Способ прогнозирования риска развития неблагоприятных сердечно-сосудистых событий у больных ишемической болезнью сердца с сахарным диабетом 2 типа, перенесших стентирование коронарных артерий
Иллюстрации
Показать всеИзобретение относится к медицине, а именно прогнозированию риска развития неблагоприятных сердечно-сосудистых событий у больных ишемической болезнью сердца (ИБС) с сахарным диабетом 2 типа (СД 2 типа), перенесших стентирование коронарных артерий. Изобретение может быть использовано в кардиологии, ангиологии, кардиохирургии, реабилитологии. Для этого непосредственно перед стентированием определяют содержание в сыворотке крови одного из маркеров воспаления - липопротеин-ассоциированной фосфолипазы А2 (Лп-ФЛА2) методом иммуноферментного анализа. При выявлении у пациентов ИБС с СД 2 типа, перенесших стентирование коронарных артерий, уровня Лп-ФЛА2 983 нг/мл и более прогнозируют риск развития неблагоприятных сердечно-сосудистых событий. Изобретение позволяет выделить приоритетную группу больных ИБС с СД 2 типа, перенесших стентирование коронарных артерий, для диспансерного наблюдения с организацией эффективных целевых мероприятий, направленных на профилактику развития неблагоприятных сердечно-сосудистых событий и предотвращение у этих пациентов высокой преждевременной смертности. 3 табл., 2 ил., 2 пр.
Реферат
Изобретение относится к медицине и может быть использовано в кардиологии, ангиологии, кардиохирургии, реабилитологии для прогнозирования риска развития неблагоприятных сердечно-сосудистых событий у больных ишемической болезнью сердца (ИБС) с сахарным диабетом 2 типа (СД 2 типа), перенесших стентирование коронарных артерий, и, следовательно, снижения риска высокой преждевременной смертности у этих пациентов с учетом уровня одного из маркеров воспаления сыворотки крови, фермента - липопротеин-ассоциированной фосфолипазы А2 (Лп-ФЛА2).
Частота возникновения сердечно-сосудистых осложнений у больных СД 2 типа в 2-3 раза выше, чем в среднем в популяции, а прогноз жизни у больных ИБС в сочетании с СД 2 типа хуже по сравнению с прогнозом у пациентов без такового.
Негативное влияние СД 2 типа на отдаленный клинический успех и результаты коронарного стентирования обусловлено более частым (на 25-30%) возникновением рестеноза и более быстрым прогрессированием атеросклероза при этом заболевании. Метаанализ результатов 6 исследований показал, что наличие СД 2 типа, по данным многофакторного анализа, увеличивало риск возникновения рестеноза в 1,3 раза [1]. Возникновение рестеноза является основной причиной отсутствия клинического эффекта через 6-12 мес. после стентирования коронарных артерий (КА), в то время как прогрессирование коронарного атеросклероза - в более поздние сроки после эндоваскулярного вмешательства.
Поскольку определение традиционных факторов риска развития неблагоприятных сердечно-сосудистых событий (инфаркт миокарда, смерть, нефатальное острое нарушение мозгового кровообращения, повторная реваскуляризация вследствие рестеноза стента или прогрессирования атеросклероза в нативных КА) недостаточно для предсказания возникновения сердечно-сосудистых осложнений [2], большой интерес вызывает изучение новых воспалительных протеинов, занимающих важное место в патогенезе возникновения нестабильности атеросклеротической бляшки.
В последнее время особое внимание уделяется липопротеинассоциированной фосфолипазе А2, играющей ключевую роль в развитии атеросклероза и являющейся маркером внутрисосудистого воспаления, может служить независимым предиктором риска развития и обострения ИБС, а также неблагоприятного прогноза после перенесенного острого инфаркта миокарда. Особенностями Лп-ФЛА2, привлекающими к ней внимание исследователей, являются специфичность в отношении сосудистого воспаления, минимальная биоизменчивость и стабильность при ишемии миокарда [3, 4]. Определение в крови уровня и активности Лп-ФЛА2 - наряду с другими маркерами воспаления потенциально может использоваться для прогнозирования риска развития неблагоприятных сердечно-сосудистых событий.
Известен способ выявления развития гиперплазии неоинтимы и рестеноза сонных артерий после ангиореконструктивных операций на них у больных с прогрессирующим церебральным атеросклерозом, сущность которого заключается в определении в сыворотке крови содержания биомаркера липопротеин-ассоциированной фосфолипазы А2 (Лп-ФЛА2) [5].
Недостатком данного способа является то, что отдаленная эффективность ангиореконструктивных операций оценивается больных при прогрессирующем атеросклерозе в периферических (сонных) артериях, а также тот факт, что предикторами неблагоприятных исходов после таких операций на сегодняшний день большинство специалистов считают наличие у пациента с ИБС сахарного диабета 2 типа, а эта тяжелая в прогностическом плане когорта пациентов не была включена в исследование.
В проанализированной патентной и научной медицинской литературе адекватного прототипа не обнаружено.
Задачей изобретения является разработка объективного высокоинформативного способа прогнозирования риска развития неблагоприятных сердечно-сосудистых событий у больных ИБС с СД 2 типа, перенесших стентирование КА.
Поставленная задача решается путем определения в сыворотке крови у больных ИБС с СД 2 типа непосредственно перед стентированием КА концентрации одного из маркеров воспаления - фермента Лп-ФЛА2 посредством иммунно-ферментного анализа. При выявлении уровня растворимого Лп-ФЛА2 983 нг/мл и более прогнозируют риск развития неблагоприятных сердечно-сосудистых событий после стентирования КА.
Новым в предлагаемом способе является то, что для прогнозирования риска развития неблагоприятных сердечно-сосудистых событий после стентирования КА у больных ИБС с СД 2 типа непосредственно перед стентированием в сыворотке крови определяют содержание фермента Лп-ФЛА2. Риск развития неблагоприятных сердечно-сосудистых событий после коронарного стентирования прогнозируют при наличии в сыворотке крови уровня Лп-ФЛА2 983 нг/мл и более.
Предложенный способ прогнозирования риска развития неблагоприятных сердечно-сосудистых событий у больных ИБС с СД 2 типа, перенесших стентирование коронарных артерий с использованием одного из маркеров воспаления, фермента - Лп-ФЛА2 основан на том, что в его основе лежит гидролиз окисленных ЛПНП, который приводит к образованию побочных провоспалительных проатерогенных продуктов - лизофосфатидилхолина (ЛФХ) и окисленных неэстерифицированных жирных кислот (НЭЖК). Лизофосфатидилхолин играет ключевую роль в атерогенезе. Он действует как хемоаттрактант для моноцитов, ухудшает эндотелиальную функцию, вызывает повреждение и гибель эндотелиальных клеток путем нарушения целостности плазматических мембран, индуцируя апоптоз в клетках гладкой мускулатуры и макрофагах. Уровень Лп-ФЛА2 повышен в атеросклеротических бляшках, кроме того, она интенсивно экспрессируется в макрофагах, находящихся в фиброзной капсуле атеромы в месте разрыва [6]. Повышение уровня ЛП-ФЛА2 не только свидетельствует об атеросклеротическим поражении коронарных артерий, но может прогнозировать риск развития сосудистых осложнений [6-13].
Имеет ряд крупных эпидемиологических исследований, в которых изучалась связь возникновения сердечно-сосудистых осложнений с уровнем ЛП-ФЛА2 [14-16]. Результаты этих исследований не вполне однозначны.
Таким образом, оценка содержания одного из маркеров воспаления, фермента - липопротеин-ассоциированной фосфолипазы А2 является ранним предиктором стратификации риска развития неблагоприятных сердечно-сосудистых событий у больных ИБС с СД 2 типа, перенесших стентирование коронарных артерий.
Техническим результатом предлагаемого изобретения является повышение точности способа.
Технический результат достигается путем определения непосредственно перед стентированием в сыворотке крови методом иммуноферментного анализа Лп-ФЛА2 и дает возможность:
- оценить персональный риск развития неблагоприятных сердечно-сосудистых событий у больных ИБС с СД 2 типа, перенесших стентирование коронарных артерий, еще на ранней стадии манифестации заболевания и назначить соответствующую патогенетическую профилактическую терапию, направленную на ингибирование процессов внутрисосудистого воспаления и прогрессирования атеросклероза;
- повысить предсказательную ценность неблагоприятного прогноза течения заболевания у больных ИБС с СД 2 типа, перенесших стентирование КА;
- определить приоритетную группу больных ИБС с СД 2 типа, перенесших стентирование КА, для диспансерного наблюдения с организацией эффективных целевых мероприятий, направленных на профилактику развития неблагоприятных сердечно-сосудистых событий и предотвращение у этих пациентов высокой преждевременной смертности.
Существенные признаки проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и не очевидные для специалиста. Идентичной совокупности признаков в проанализированной литературе не обнаружено. Предлагаемое изобретение может быть использовано в здравоохранении.
Исходя из вышеизложенного следует считать изобретение соответствующим условиям патентоспособности "Новизна", "Изобретательский уровень", "Промышленная применимость".
Изобретение будет понятно из следующего описания и приложенных к нему рисунков.
На фиг. 1 представлено определение чувствительности и специфичности при различных концентрациях в крови Лп-ФЛА2 у пациентов ИБС с СД 2 типа (ROC-анализ): изображена характерологическая кривая (ROC-кривая) чувствительности и специфичности значений плазменной концентрации Лп-ФЛА2 в риске развития неблагоприятных сердечно-сосудистых событий. По оси абсцисс отложены значения специфичности (%), по оси ординат - чувствительности (%). По данным анализа следует, что «точкой отсечения» - cut off, характеризующей прогнозирование риска развития неблагоприятных сердечно-сосудистых событий с чувствительностью данного критерия 80% при специфичности 100%, является плазменная концентрация Лп-ФЛА2 983 нг/мл.
На фиг. 2 представлено определение вероятности развития неблагоприятных сердечно-сосудистых событий в течение года наблюдения после стентирования КА в зависимости от уровня Лп-ФЛА2 (анализ по Каплану-Мейеру). По оси абсцисс отложены значения времени (мес), по оси ординат - частоты развития неблагоприятных сердечно-сосудистых событий (%). На фиг. 2А представлены результаты для 1-й группы, в которой не было зарегистрировано неблагоприятных сердечно-сосудистых событий, на фиг. 2Б - результаты для 2-й группы больных, с неблагоприятным течением заболевания и зарегистрированной комбинированной конечной точкой.
Способ осуществляется следующим образом:
Определение уровня липопротеин ассоциированной фосфолипазы А2 в сыворотке крови проводится методом иммуно-ферментного анализа (ELISA). Используется коммерческий набор фирмы Cloud-Clone Corp., (USA).
Используемый материал: сыворотка крови.
Сбор и хранение образцов: Образцам крови дают свернуться в течение двух часов при комнатной температуре или в течение ночи при 4°С, а затем центрифугируют 20 мин при приблизительно 1000 g. Анализируют немедленно или хранят аликвоты образцов при -20°С или ниже, при -80°С.
Протокол анализа:
1. Определяют необходимое для текущей постановки количество лунок, с учетом приготовленных разведений стандарта, бланка и образцов. Приготавливают 7 лунок для стандартов, 1 лунку для бланка. Вносят по 100 мкл каждого разведения стандарта, бланка и образца в соответствующие лунки. Закрывают микропланшет. Инкубируют 2 ч при 37°С.
2. Снимают крышку, удаляют жидкость из лунок, не промывают.
3. Вносят по 100 мкл рабочего раствора детектирующего реагента А в каждую лунку. Закрывают микропланшет. Инкубируют 1 час при 37°С.
4. Аспирируют раствор из лунок и внесите по 350 мкл готового буфера для промывок. На каждую лунку, с помощью сжимаемой бутыли, многоканальной пипетки, ручного диспенсера или автоматического промывочного устройства, и оставляют не менее чем на ~1-2 минуты. Удаляют жидкость из всех лунок и тщательно осушают лунки, постучав перевернутым микропланшетом по фильтровальной бумаге. Повторяют процедуру в общей сложности 3 раза. После последней промывки удаляют из лунок всю жидкость полностью аспирацией или декантированием, перевертывают микропланшет и стучат им по чистой фильтровальной бумаге.
5. Вносят по 100 мкл рабочего раствора детектирующего реагента В во все лунки. Закрывают микропланшет. Инкубируют 30 минут при 37°С.
6. Повторяют процедуру аспирации/промывки 5 раз, как описано в шаге 4.
7. Вносят по 90 мкл раствора субстрата в каждую лунку. Закрывают новой крышкой. Инкубируют 15-25 минут при 37°С (но не более 30 минут) в защищенном от света месте. При добавлении раствора субстрата цвет жидкости поменяется на голубой.
8. Вносят по 50 мкл стоп-раствора в каждую лунку. При этом цвет жидкости в лунках поменяется на желтый. Аккуратно перемешивают жидкость в лунках, постучав по краю микропланшета. Если изменение цвета не однородно, аккуратно стучат по краю микропланшета до полного перемешивания.
9. Удаляют любые капли жидкости и отпечатки пальцев с наружной стороны дна микропланшета. Затем немедленно выполняют измерения с помощью микропланшетного ридера при длине волны 450 нм.
Микропланшет, поставляемый в данном наборе, покрыт специфическими моноклональными антителами к Lp-PL-A2. Стандарты и образцы вносят в соответствующие лунки микропланшета, вместе с поликлональными антителами к Lp-PL-A2, конъюгированными с биотином. На следующем этапе в лунки вносят авидин, конъюгированный с пероксидазой хрена (HRP) и инкубируют в течение необходимого времени. Затем в лунки вносят раствор субстрата ТМВ. Изменение окрашивания в лунках, обусловленное связыванием антител, конъюгированных с биотином, и авидина, конъюгированного с ферментом, будет наблюдаться только в лунках, содержащих Lp-PL-A2. Энзиматическую реакцию останавливают добавлением серной кислоты и интенсивность развившегося окрашивания измеряют с помощью микропланшетного спектрофотометра при длине волны 450 ± 10 нм. Концентрацию Lp-PL-A2 в образцах определяют сравнением полученной оптической плотности (ОП) образцов с построенной калибровочной кривой.
Статистическая обработка результатов проводилась с использованием пакета программ STATISTIC А 10,0 (Statsoftlns, USA). Непрерывные переменные представляли в виде M±SD или Медианы, верхнего и нижнего квартилей (Me[LQ; UQ]). Для определения статистической значимости различий непрерывных величин в зависимости от параметров распределения использовался непарный t-критерий Стьюдента или U-критерий Манна-Уитни. Анализ взаимосвязей между переменными проводили на основе ранговых коэффициентов корреляции Спирмана. При исследовании взаимосвязей статистически значимыми считали отличия при р<0,05. Для оценки прогноза неблагоприятного развития сердечно-сосудистых событий применялся дискриминантный анализ. Эмпирическая зависимость вероятности развития неблагоприятных событий при увеличении значений Лп-ФЛА2 представлена функцией Каплана-Мейера.
В исследование включено 60 пациентов ИБС (47 мужчин и 13 женщин) в возрасте от 48 до 78 лет, в среднем 61 (48-74) лет с СД 2 типа, госпитализированных в стационар с целью выполнения эндоваскулярной коронарной реваскуляризации миокарда посредством стентирования. На период включения в проспективное исследование все больные ИБС с СД 2 типа находились в стадии компенсации или субкомпенсации углеводного обмена.
Непосредственно перед стентированием коронарных артерий в сыворотке крови с помощью иммуноферментного метода определяли содержание одного из маркеров воспаления сыворотки крови, фермента Лп-ФЛА2.
На каждого больного заполнялась специально разработанная клиническая карта. Все пациенты давали свое письменное информированное согласие для участия в исследовании. Состояние больных оценивали исходно и через 12 месяцев с анализом частоты комбинированной конечной точки, включавшей: смерть от сердечно-сосудистых событий, нефатальный ИМ, нефатальное острое нарушение мозгового кровообращения, повторная реваскуляризация (АКШ, стентирование коронарных артерий в связи с рестенозированием первично имплантированного стента или стенозированием нативных КА), а также комбинация конечных точек. Оценивали в динамике показатели ЭхоКГ - конечный диастолический размер (КДР), конечный систолический размер (КСР), фракция выброса ЛЖ (ФВ ЛЖ), межжелудочковая перегородка (МЖП), задняя стенка ЛЖ (ЗСЛЖ).
На момент включения в исследование все больные получали базисную терапию - иАПФ, β-адреноблокаторы, антагонисты кальция, аспирин, клопидогрел. Подавляющее большинство (92%) получали пероральную сахароснижающую терапию, включавшую бигуаниды (метформин), производные сульфонилмочевины II и III генерации (глибенкламид, гликлазид, глимепирид). Всем пациентам дополнительно назначалась гиполипидемичесие препараты: аторвастатин в дозе 10-20 мг/сутки Критериями исключения из исследования являлись: острый коронарный синдром, ИМ давность менее 6 месяцев, семейная гиперлипидемия, декомпенсированный СД, нарушение мозгового кровообращения давностью менее 6 месяцев, тяжелое нарушение функции почек и печени, острые воспалительные заболевания.
Состояние углеводного обмена оценивалось по уровню гликированного гемоглобина (HbA1c) иммунотурбодиметрическим методом. Содержание иммунореактивного инсулина (IR) определялось методом иммуноферментного анализа с использованием набора реактивов фирмы ELISA Monobind. Референсные значения для инсулина составляли 2,6-24,9 MEg/мл.
Для определения тканевой чувствительности к инсулину у пациентов ИБС с СД 2 типа рассчитывался индекс инсулинорезистентности HOMA-IR: НОМА-IR = ИРИ * глюкоза (ммоль/л)/22,5 (норма <2,27).
Липидный спектр сыворотки крови с определением содержания общего холестерина (ОХС), триглицеридов (ТГ), ХС ЛПВП, ХС ЛПНП оценивали общепринятым колориметрическим методом на анализаторе FP-90 Labsystems (Финляндия).
С целью выявления возможности ассоциации Лп-ФЛА2 с наступлением неблагоприятных сердечно-сосудистых событий пациентов ретроспективно распределили методом конвертов в 2 группы: 1-я группа (n=30) с благоприятным течением патологии, 2-я группа (n=30) с неблагоприятным течением. Через 12 месяцев проспективного наблюдения оценивали антиишемическую эффективность эндоваскулярного вмешательства, эффекты гиполипидемической терапии, эволюцию факторов риска.
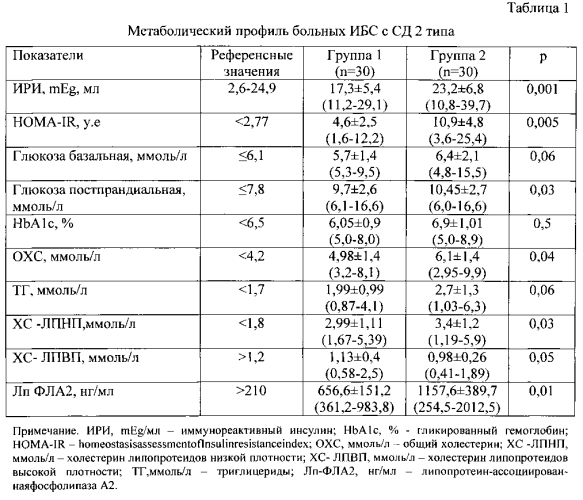
Результаты исследования метаболического профиля и уровня липопротеин-ассоциированной фосфолипазы А2 группах больных представлены в таблице 1.
В 1-й группе базальная гликемия у 24(80%) пациентов в среднем составляла 5,7 (5,3-9,5) ммоль/л. Постпрандиальная гликемия составляла 9,7±2,6 ммоль/л. Уровень гликозилированного гемоглобина (HbA1c) составлял 6,05±0,9%. Иммунореактивный инсулин (ИРИ) только в 4(13%) случаях превышал референсные значения (24,9 mEg/мл) у остальных пациентов ИРИ колебался в пределах нормальных величин 17,3±5,4 mEg/мл. Анализ липидного спектра крови выявил явное увеличение атерогенного ХС ЛПНП - 2,99 ммоль/л, в то время как антиатерогенный ХС ЛПВП (равный 1,13 ммоль/л) оказался в пределах нормальных значений. Уровень Лп-ФЛА2 (656,6 нг/мл) в три раза превышал референсные значения (табл.1).
Во 2-й группе неблагоприятному клиническому течению патологии соответствовало развитие гиперинсулинемии (>24,9 mEg/мл) у 12 (40%) пациентов, составившей 23,2 (10,8-39,7) mEg/мл. Этому соответствовало повышение индекса тканевой инсулинорезистентности (HOMA-IR) до 10,5 у.е. и постпрандиальной гликемии до 10,45 ммоль/л. Повышенный уровень HbA1c диагностировался у 14 (47%) пациентов. Атерогенная дислипидемия оказалась в этой группе более выраженной по сравнению с 1-й группой. Действительно, выявлялась (р=0,05-0,03) явная дислипидемия: общий холестерин составлял 6,1 (2,95-9,9) ммоль/л, ХС ЛПНП - 3,4 (1,19-5,9) ммоль/л, ХС ЛПВП - 0,98 (0,41-1,89) ммоль/л. Во второй группе оказался повышенным уровень Лп-ФЛА2 - 1157,6 (254,5-2012,5) нг/мл, почти в 6 раз превышая (р=0,005) референсные значения и в 2 раза концентрацию Лп-ФЛА2 в крови больных 1-й группы.
За период проспективного наблюдения, как указывалось ранее, один пациент 2-й группы умер внезапно; при этом уровень концентрации в крови Лп-ФЛА2 составил 1435 нг/мл.
В обеих группах не выявлено тесной корреляционной взаимосвязи между уровнем Лп-ФЛА2 и показателями углеводного обмена (базальной гликемией, индексом инсулинорезистентности HOMA-IR, HbA1c).
Проведенный корреляционный анализ показал, что при построении прогностической модели выявлена сравнительно слабая, но достоверная корреляция с рецидивами стенокардии (r=0,25; р=0,05), с летальным исходом (r=0,2; р=0,05) и мозговым инсультом (r=0,33; р=0,05); более выраженная корреляционная взаимосвязь прослеживалась с прогрессированием атеросклероза в нативных коронарных артериях (r=0,66; р=0,05) и рестенозом стентов после проведенной эндоваскулярной реваскуляризации (r=0,36; р=0,05).
Следовательно, прогрессирующее увеличение Лп-ФЛА2 983 нг/мл указывает на выраженность сосудистого воспаления у всех больных ИБС с СД 2 типа, перенесших эндоваскулярную коронарную реваскуляризацию. У пациентов с благоприятным течением заболевания уровень нового маркера иммунного воспаления Лп-ФЛА2 к концу наблюдения имел тенденцию к снижению, тогда как у пациентов с неблагоприятным течением, напротив, статистически значимо повышался (р<0,05).
Таким образом, предложенный способ определения прогноза заболевания иллюстрируется следующими клиническими примерами, свидетельствующими о том, что определение непосредственно перед стентированием уровня одного из маркеров воспаления сыворотки крови, фермента - Лп-ФЛА2 обеспечивает объективную оценку тяжести процесса, а содержание Лп-ФЛА2 983 нг/мл является важным прогностическим тестом развития неблагоприятных сердечно-сосудистых событий у больных ИБС с сахарным диабетом 2 типа, перенесших стентирование коронарных артерий.
ПРИМЕР 1: Пациентка Ц., 55 лет поступила в ОСН 04.02.2013 с жалобами на давящие боли за грудиной при незначительной физической нагрузке, ходьбе на 100-150 м, при подъеме на один этаж, купирующиеся нитроглицерином (до 3-4 табл./сут), иррадиирущее в левое плечо, сопровождалось одышкой смешанного характера, на повышение АД до 160/90 мм рт.ст. В 2009 г. перенесла острый инфаркт миокарда. Страдает сахарным диабетом 2 типа 4 года.
Клинико-лабораторные показатели пациента при поступлении представлены в таблице 2.
По данным коронарной ангиографии выявлен коронарный атеросклероз с поражением ПНА - стеноз 75% в пр/3. Осуществлена реваскуляризация миокарда посредством имплантации стента с антипролиферативным лекарственным покрытием (Cypher) в сосуд - ПНА.
Клинический диагноз: ИБС. Стенокардия напряжения ФК III. Атеросклероз коронарных артерий (ПНА - стеноз 75% в пр/3). Постинфарктный кардиосклероз (2009). Стентирование ПНА стентом с антипролиферативным лекарственным покрытием (Cypher) (11.02.2013). Н I (NYHA II). Фон: Гипертоническая болезнь III стадии, степень АГ 2, гиперхолестеринемия. Сахарный диабет 2 типа, гликированный гемоглобин <6,5%, достигнутый 6,7%. ХБП 2 ст. СКФ - 69 (по формуле CKD-EPI). Риск 4. Сопутствующее: Поверхностный гастрит, ремиссия. Варикозная болезнь вен нижних конечностей. Хроническая венозная недостаточность I ст.
Назначено лечение: клопидогрел 75 мг, по 1 таблетке 1 раз утром, кардиомагнил 75 мг, по 1 таблетке 1 раз в сутки, в обед, после еды, бисопролол 5 мг по 1 таблетке утром, фозиноприл 10 мг 1 т * 2 р/день, амлодипин 10 мг 1 т вечером, розувастатин 20 мг по 1 таблетке 1 раз в сутки на ночь, сиофор 850 мг 1 т вечером, диабетон MB 2 т утром.
Через 8 месяцев на фоне целевого АД развилось острое нарушение мозгового кровообращения по ишемическому типу. Показатели гемодинамики: АД 140/80 мм рт. ст., частота сердечных сокращений (ЧСС) 65/мин. ФК ХСН остался на прежнем уровне -II по NYHA. По данным Эхо-КГ: ФВ ЛЖ, толщина МЖП и ЗС ЛЖ не изменились, тенденция к увеличению КСР и КДР ЛЖ, что свидетельствует о прогрессировании ишемического ремоделирования ЛЖ.
Таким образом, у пациентки с повышенной экспрессией Лп-ФЛА2 (более 983 нг/мл) за период наблюдения зарегистрировано наступление неблагоприятного сердечно-сосудистого события - острое нарушение мозгового кровообращения.
ПРИМЕР 2: Пациент М., 51 год поступил с ОСН 27.06.2013 года с жалобами на давящие боли в области сердца при ходьбе на 150 м, купирующиеся нитроглицерином (до 1-2 табл./сут), на повышение АД до 180/100 мм рт.ст. В 2013 г. перенес острый инфаркт миокарда. Страдает сахарным диабетом 2 типа в течение 5 лет.
Клинико-лабораторные показатели пациента при поступлении представлены в таблице 3.
По данным коронарографии выявлен стеноз ПНА 75% в ср/3. Осуществлена реваскуляризация миокарда посредством имплантации стента с антипролиферативным лекарственным покрытием (Orsiro) в сосуд - ПНА.
Клинический диагноз: ИБС. Стенокардия напряжения ФК III. Атеросклероз коронарных артерий (ПНА 75% в ср/3). Постинфарктный кардиосклероз (2013 г). Стентирование ПНА стентом с антипролиферативным лекарственным покрытием Orsiro (04.07.13). НК I стадии (ФК ХСН II по NYHA). Фон: Гипертоническая болезнь III стадии, степень АГ 2, гиперхолестеринемия. Сахарный диабет 2 типа, гликированный гемоглобин<6,5%, достигнутый 6,0%. Ожирение II ст. ХБП 1 стадии. Риск развития ССО 4 (очень высокий).
Назначено лечение: клопидогрел 75 мг утром, кардиомагнил 150 мг после обеда, бисопролол 5 мг утром, лизиноприл 10 мг утром, аторвастатин 20 мг в ужин, сиофор 1000 мг вечером.
Через 12 месяцев повторно обследован в клинике. Было отмечено увеличение переносимости физической нагрузки по данным теста 6-минутной ходьбы, ангинозные боли не беспокоили, нитроглицерином не пользовался. АД 120-130/75-80 мм рт.ст., частота сердечных сокращений (ЧСС) 61/мин. ФК ХСН снизился до I по NYHA. По данным Эхо-КГ: ФВ ЛЖ возросла, отмечена тенденция к уменьшению КДР ЛЖ, толщина МЖП и ЗС ЛЖ не изменились.
По данным повторной коронарной ангиографии не было диагностировано прогрессирования атеросклероза в коронарных артериях, стент в ПНА проходим.
Таким образом, у пациента с уровнем Лп-ФЛА2 363,2 нг/мл (менее 983 нг/мл) за период наблюдения не было зарегистрировано неблагоприятных сердечно-сосудистых событий.
Результаты нашего исследования убедительно продемонстрировали, что неблагоприятное течение ИБС, выражающееся в наступлении неблагоприятных сердечно-сосудистых событий у больных СД 2 типа, перенесших стентирование коронарных артерий, обусловленное стимуляцией атерогенеза, сопровождается повышенным (более 983 нг/мл) уровнем растворимой липопротеин-ассоциированной фосфолипазы А2 и имеет прогностическое значение.
Таким образом, полученные данные о значимости содержания одного из маркеров воспаления сыворотки крови, фермента - липопротеин-ассоциированной фосфолипазы А2 в риске развития неблагоприятных сердечно-сосудистых событий у больных ИБС с СД 2 типа, перенесших стентирование коронарных артерий, характеризуется научной новизной и приоритетностью.
Предлагаемый способ применен у 60 пациентов и позволяет прогнозировать риск развития неблагоприятных сердечно-сосудистых событий, обусловленное повышенной экспрессией (более 983 нг/мл) Лп-ФЛА2 в сыворотке крови у больных ИБС с СД 2 типа, перенесших стентирование КА, что позволяет выделить приоритетную группу больных для диспансерного наблюдения с организацией эффективных целевых мероприятий, направленных на профилактику развития неблагоприятных сердечно-сосудистых событий и предотвращение у этих пациентов высокой преждевременной смертности.
СПИСОК ЛИТЕРАТУРЫ
1. Gerber Y., Dunlay S.M., Jaffe A.S. et al. Plasma lipoprotein-associated phospholipase A2 levels in heart failure: association with mortality in the community. Atherosclerosis 2009; 203:593-598.
2. Peyser P.A., Bielak L.F, Cbu J.S. et al. Heritability of coronary artery calcium quantity measured by electron beam computed tomography in asymptomatic adults. Circulation. 2002; 106:304-8.
3. Caslake MJ, Packard CJ, Suckling KE, et al. Lipoprotein-associated phospholipase A2, platelet-activating factor acetylhydrolase: a potential new risk factor for coronary artery disease. Atherosclerosis 2000; 150:413-19.
4. Iribarren C. Lipoprotein-associated phospholipase A2 and cardiovascular risk: state of the evidence and future directions. Arterioscler Thromb Vase Biol 2006; 26:5-6.
5. Суслина 3.A., Танашян M.M., Костырева M.B., Шабалина А.А., Лагода О.В., Масксюткина Л.Н. Способ выявления развития гиперплазии неоинтимы и рестеноза сонных артерий после ангиореконструктивных операций на них у больных с прогрессирующим церебральным атеросклерозом. Патент РФ 2513194 С1, опубликован 20.04.2014 г.
6. Koenig W., Twardella D., Brenner H., Rothenbacher D. Lipoprotein associated phospholipase A2 predicts future cardiovascular events in patients with coronary heart disease independently of traditional risk factors, markers of inflammation, renal function, and hemodynamic stress. Arterioscler Thromb Vase Biol 2006; 26:1586-1593.
7. Brilakis E.S., McConnell J.P., Lennon R.J. et al. Association of lipoproteinassociated phospholipase A2 levels with coronary artery disease risk factors, angiographic coronary artery disease, and major adverse events at follow-up. Eur Heart J 2005; 26:137-144.
8. Corsetti J.P., Rainwater D.L., Moss A.J. et al. High lipoprotein-associated phospholipase A2 is a risk factor for recurrent coronary events in postinfarction patients. Clin Chem 2006; 52:1331-1338.
9. Gilbert J, Raboud J, Zinman B. Meta-analysis of the effect of diabetes on restenosis rates among patients receiving coronary angioplasty stenting. Diabetes Care 2004; 27: 990-4.
10. Kardys I., Oei H.H., van der Meer I.M. et al. Lipoprotein-associated phospholipase A2 and measures of extracoronary atherosclerosis: the Rotterdam Study. Arterioscler Thromb Vase Biol 2006; 26:631-636.
11. Mockel M., Muller R., Vollert J.O. et al. Lipoprotein-associated phospholipase A2 for early risk stratification in patients with suspected acute coronary syndrome: a multi-marker approach: the North Wuerttemberg and Berlin Infarction Study-II (NOBIS-II). Clin Res Cardiol 2007; 96:604-612.
12. Sabatine M.S., Morrow D.A., O′Donoghue M. et al. Prognostic utility of lipoprotein-associated phospholipase A2 for cardiovascular outcomes in patients with stable coronary artery disease. Arterioscler Thromb Vase Biol 2007; 27:2463-2469.
13. Winkler K., Hoffmann M.M., Winkelmann B.R. et al. Lipoproteinassociated phospholipase A2 predicts 5-year cardiac mortality independently of established risk factors and adds prognostic information in patients with low and medium high-sensitivity C-reactive protein (the Ludwigshafen risk and cardiovascular health study). Clin Chem 2007; 53:1440-1447.
14. Packard C.J., O'Reilly D.S., Caslake M.J. et al. Lipoprotein-associated phospholipase A2 as an independent predictor of coronary heart disease: West of Scotland Coronary Prevention Study Group. N Engl J Med 2000; 343:1148-1155.
15. Persson M., Berglund G., Nelson J.J., Hedblad B. Lipoprotein-associated phospholipase A2 activity and mass are associated with increased incidence of ischemic stroke: a population-based cohort study from Malmo, Sweden. Atherosclerosis 2008; 200:191-198.
16. White H., Held C, Stewart R. et al. Study design and rationale for the clinical outcomes of the STABILITY Trial (STabilization of Atherosclerotic plaque By Initiation of darapLadlb TherapY) comparing darapladib versus placebo in patients with coronary heart disease. Am Heart J 2010; 160:655-661.
Способ прогнозирования риска развития неблагоприятных сердечно-сосудистых событий у больных ИБС с сахарным диабетом 2 типа, перенесших стентирование коронарных артерий, характеризующийся тем, что в сыворотке крови непосредственно перед стентированием определяют содержание фермента липопротеин-ассоциированной фосфолипазы А2 (Лп-ФЛА2) и при наличии уровня Лп-ФЛА2 983 нг/мл и более прогнозируют риск развития неблагоприятных сердечно-сосудистых событий.