Профилактика гипогликемии у пациентов с сахарным диабетом 2 типа
Иллюстрации
Показать всеНастоящая группа изобретений относится к медицине, а именно к эндокринологии, и касается профилактики гипогликемии при сахарном диабете 2 типа. Для этого вводят соединение desPro36Экзендин-4(1-39)-Lys6-NH2 (AVE0010) или его фармацевтически приемлемую соль в сочетании с препаратом сульфонилмочевины. Такое комплексное введение обеспечивает эффективную профилактику гипогликемии. 2 н. и 16 з.п. ф-лы, 10 ил., 33 табл., 1 пр.
Реферат
Предметом настоящего изобретения является способ профилактики гипогликемии при сахарном диабете 2 типа посредством ликсисенатида (desPro36Экзендин-4(1-39)-Lys6-NH2, AVE0010) в качестве дополнительной терапии к введению сульфонилмочевины.
Метформин является гипогликемическим средством группы бигуанидов, применяемым при лечении сахарного диабета 2 типа, не отвечающего на диетическую модификацию. Метформин улучшает гликемический контроль посредством улучшения чувствительности к инсулину. Метформин, как правило, принимают перорально. Однако контроль при сахарном диабете 2 типа у страдающих ожирением пациентов посредством метформина может быть недостаточным. Таким образом, этим пациентам, могут потребоваться дополнительные меры для контроля сахарного диабета 2 типа.
Гипогликемия является решающим ограничивающим фактором при гликемическом контроле диабета, как при кратковременном, так и продолжительном лечении. Несмотря на стабильные улучшения в гликемическом контроле диабета, данные популяционных исследований указывают на то, что гипогликемия продолжает оставаться основной проблемой, как у пациентов с диабетом 1 типа, так и с диабетом 2 типа (Американская ассоциация диабета, рабочая группа по гипогликемии: Defining and Reporting Hypoglycemia in Diabetes. Dibetes Care 28(5), 2005, 1245-1249).
Kendall (Diabetes Care, 2005, 28(5): 1083-1091) описывает эффекты экзендина-4 на гликемический контроль у пациентов с диабетом 2 типа, принимающих метформин и сульфонилмочевину, в 30-недельном, двойном слепом, плацебо-контролируемом исследовании. Экзендин-4 значительно снизил HbA1c у пациентов с диабетом 2 типа, неспособных достичь адекватного гликемического контроля с максимально эффективными дозами комбинированной терапии посредством метформина-сульфонилмочевины.
Ratner (Diabet. Med. 2010, 27:1024-1032) описывает дозозависимые эффекты ликсисенатида, принимаемого один или два раза в сутки, у пациентов с диабетом 2 типа, неадекватно контролируемых посредством метформина, в рандомизированном, двойном слепом, плацебо-контролируемом 13-недельном исследовании в параллельных группах.
Первый аспект настоящего изобретения касается способа профилактики гипогликемии при сахарном диабете 2 типа, содержащего введение
(a) desPro36Экзендин-4(1-39)-Lys6-NH2 или/и его фармацевтически приемлемой соли, и
(b) сульфонилмочевины или/и ее фармацевтически приемлемой соли, нуждающемуся в этом индивидууму.
Специалист знает подходящие фармацевтически приемлемые соли сульфонилмочевины.
В частности, способ является способом профилактики симптоматической гипогликемии или тяжелой симптоматической гипогликемии у пациента с сахарным диабетом 2 типа.
Более конкретно, способом по настоящему изобретению является способ профилактики гипогликемии у пациента с диабетом 2 типа, обладающего повышенным риском гипогликемии, в частности у пациента с диабетом 2 типа, перенесшего, по меньшей мере, один гипогликемический эпизод. Гипогликемический эпизод может быть симптоматическим гипогликемическим эпизодом или тяжелым симптоматическим гипогликемическим эпизодом.
В настоящем изобретении гипогликемия является состоянием, при котором пациент с сахарным диабетом 2 типа переносит концентрацию глюкозы в плазме ниже 60 мг/дл (или ниже 3,3 ммоль/л), ниже 50 мг/дл, ниже 40 мг/дл, или ниже 36 мг/дл.
В настоящем изобретении "симптоматическая гипогликемия" или "симптоматический гипогликемический эпизод" является состоянием, связанным с клиническим симптомом, который является результатом гипогликемии, при котором концентрация глюкозы в плазме составляет ниже 60 мг/дл (или ниже 3,3 ммоль/л), ниже 50 мг/дл, или ниже 40 мг/дл. Клиническими симптомами могут быть, например, потение, сердцебиение, голод, беспокойство, тревожность, усталость, раздражительность, головная боль, потеря концентрации, сонливость, психиатрические расстройства, зрительные нарушения, временные дефекты восприятия, временные двигательные дефекты, спутанность сознания, судороги и кома. В способе по настоящему изобретению можно отобрать один или несколько клинических симптомов симптоматической гипогликемии, как указано в настоящем документе. Симптоматическую гипогликемию можно связывать с быстрым выздоровлением после перорального введения углевода.
В настоящем изобретении "тяжелая симптоматическая гипогликемия" или "тяжелый симптоматический гипогликемический эпизод" является состоянием с клиническим симптомом, как указано в настоящем документе, которое вызывается гипогликемией, при которой концентрация глюкозы в плазме ниже 36 мг/дл (или ниже 2,0 ммоль/л). Тяжелую симптоматическую гипогликемию можно связывать с острым неврологическим поражением, являющимся результатом гипогликемического эпизода. При тяжелой симптоматической гипогликемии пациент может нуждаться в помощи другого человека, если, например, пациент не смог бы справиться сам/сама, вследствие острого неврологического поражения. Определение тяжелой симптоматической гипогликемии может включать все эпизоды, при которых неврологическое поражение является достаточно тяжелым, чтобы предотвратить самолечение, и которые, таким образом, предположительно подвергают пациентов риску повредить себе или другим. Острым неврологическим поражением может быть, по меньшей мере, одно выбранное из сонливости, психиатрических расстройств, зрительных нарушений, временных сенсорных дефектов, временных двигательных дефектов, спутанности сознания, судорог и комы.
Тяжелую симптоматическую гипогликемию можно связывать с быстрым восстановлением после перорального введения углевода, внутривенного введения глюкозы или/и глюкагона.
Нормогликемия может относиться к концентрации глюкозы в плазме крови от 60 мг/дл до 140 мг/дл (соответствующей от 3,3 ммоль/л до 7,8 ммоль/л).
В клиническом испытании к удивлению было обнаружено, что во время лечения пациентов с сахарным диабетом 2 типа посредством ликсисенатида в сочетании с сульфонилмочевиной с или без метформина, число гипогликемических эпизодов у индивидуальных пациентов может быть уменьшено. Сто двадцать семь (22,1%) пациентов, получавших лечение ликсисенатидом в сочетании с сульфонилмочевиной с или без метформина, имели 389 симптоматических гипогликемических эпизодов по протоколу определения в течение периода применения исследуемого препарата во время всего испытания, в то время как 51 (17,9%) пациентов, получавших плацебо (т.е. получавших лечение сульфонилмочевиной с или без метформина), как сообщалось, перенесли 230 симптоматических гипогликемических эпизодов в течение того же периода (таблица 24), указывая, что число гипогликемических эпизодов сократилось у пациентов, получавших лечение ликсисенатидом (в среднем 3,06 эпизодов у пациентов, которые, как сообщалось, перенесли гипогликемические эпизоды) по сравнению с пациентами, получавшими лечение плацебо (в среднем 4,51 эпизодов, которые, как сообщалось, перенесли гипогликемические эпизоды).
Два (0,3%) пациента, получавших лечение ликсисенатидом в сочетании с сульфонилмочевиной с или без метформина, имели тяжелые симптоматические гипогликемические эпизоды в течение периода применения исследуемого препарата в течение всего испытания, в то время как 1 (0,4%) пациент, получавший плацебо (т.е. получавший лечение сульфонилмочевиной с или без метформина), как сообщалось, перенес тяжелую симптоматическую гипогликемию в течение того же периода (таблица 25).
Эти результаты указывают на то, что сочетание ликсисенатида и сульфонилмочевины с или без метформина можно использовать для профилактики гипогликемии.
Соединения (a) и (b) можно вводить нуждающемуся в этом индивидууму в количестве, достаточном для вызывания терапевтического эффекта.
Соединение desPro36Экзендин-4(1-39)-Lys6-NH2 (AVE0010, Ликсисенатид) является производным экзендина-4. AVE0010 описан как SEQ ID NO:93 в WO 01/04156:
SEQ ID NO: 1 AVE0010 (44 AS)
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-S-K-K-K-K-K-K-NH2
SEQ ID NO: 2 Экзендин-4 (39 AS)
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-P-S-NH2
Экзендины являются группой пептидов, которые могут снижать концентрацию глюкозы в крови. Аналог экзендина AVE0010 характеризуется C-концевым усечением природной последовательности экзендина-4. AVE0010 содержит шесть C-концевых остатков лизина, не присутствующих в экзендине-4.
В контексте по настоящему изобретению AVE0010 включает их фармацевтически приемлемые соли. Специалист в данной области знает фармацевтически приемлемые соли AVE0010. Предпочтительно фармацевтически приемлемой солью AVE0010, применяемой в настоящем изобретении является ацетат.
AVE0010 (desPro36Экзендин-4(1-39)-Lys6-NH2) или/и их фармацевтически приемлемую соль можно вводить посредством подкожной инъекции. Известны подходящие приспособления для инъекции, например, так называемые "ручки", содержащие картридж, содержащий активный ингредиент и иглу для инъекции. AVE0010 или/и его фармацевтически приемлемую соль можно вводить в подходящем количестве, например, в количестве в диапазоне от 10 до 15 мкг на дозу или от 15 до 20 мкг на дозу один раз сутки (прогрессивное титрование от 10 до 15 и до 20 мкг/сутки. 20 мкг является эффективной поддерживающей дозой).
В настоящем изобретении AVE0010 или/и его фармацевтически приемлемую соль можно вводить в суточной дозе в диапазоне от 10 до 15 мкг или в диапазоне от 15 до 20 мкг один раз в сутки (прогрессивное титрование от 10 до 15 и до 20 мкг/сутки. 20 мкг является эффективной поддерживающей дозой). AVE0010 или/и его фармацевтически приемлемую соль можно вводить посредством одной инъекции в сутки.
В настоящем изобретении можно применять жидкую композицию, содержащую desPro36Экзендин-4(1-39)-Lys6-NH2 или/и его фармацевтически приемлемую соль. Специалист знает жидкие композиции AVE0010, подходящие для парентерального введения. Жидкая композиция по настоящему изобретению может обладать кислотным или физиологическим pH. Кислотный pH предпочтительно находится в диапазоне pH 1-6,8, pH 3,5-6,8, или pH 3,5-5. Физиологический pH предпочтительно находится в диапазоне pH 2,5-8,5, pH 4,0-8,5, или pH 6,0-8,5. pH может быть скорректирован посредством фармацевтически приемлемой разбавленной кислоты (как правило, HCl) или фармацевтически приемлемого разбавленного основания (как правило, NaOH). Предпочтительно pH находится в диапазоне pH 3,5-5,0.
Жидкая композиция может содержать буфер, такой как фосфат, цитрат, ацетат. Предпочтительно, он может содержать ацетатный буфер в количествах до 5 мкг/мл, до 4 мкг/мл или до 2 мкг/мл.
Жидкая композиция по настоящему изобретению может содержать подходящий консервант. Подходящий консервант можно выбирать из фенола, м-крезола, бензилового спирта и сложного эфира п-гидроксибензойной кислоты. Предпочтительным консервантом является м-крезол.
Жидкая композиция по настоящему изобретению может содержать средство придания тоничности. Подходящее средство придания тоничности можно выбирать из глицерина, лактозы, сорбита, маннита, глюкозы, NaCl, кальций или магний содержащих соединений, таких как CaCl2. Концентрация глицерина, лактозы, сорбита, маннита и глюкозы может находиться в диапазоне от 100 до 250 мМ. Концентрация NaCl может доходить до 150 мМ. Предпочтительным средством придания тоничности является глицерин.
Кроме того, жидкая композиция может содержать L-метионин от 0,5 мкг/мл до 20 мкг/мл, предпочтительно от 1 мкг/мл до 5 мкг/мл. Предпочтительно она содержит L-метионин.
В настоящем изобретении сульфонилмочевину можно вводить перорально. Специалист знает составы сульфонилмочевины, подходящие для лечения диабета 2 типа посредством перорального введения. Для перорального введения сульфонилмочевину можно формулировать в твердой лекарственной форме, такой как таблетка или пилюля.
В настоящем изобретении, desPro36Экзендин-4(1-39)-Lys6-NH2 или/и фармацевтически приемлемую соль можно вводить при дополнительной терапии при введении сульфонилмочевины.
В настоящем изобретении термины "дополнительный", "дополнительное лечение" и "дополнительная терапия" включают лечение сахарного диабета 2 типа с применением сульфонилмочевины и AVE0010. Сульфонилмочевину и AVE0010 можно вводить в пределах интервала в 24 часа. Сульфонилмочевину и AVE0010 каждый в отдельности можно вводить в однократной суточной дозировке. Сульфонилмочевину и AVE0010 можно вводить различными способами. Сульфонилмочевину можно вводить перорально, и AVE0010 можно вводить подкожно.
В настоящем изобретении сульфонилмочевину можно выбирать из глибенкламида, глибенкламида MR, гликлазида, гликлазида LM, глимепирида, глипизида, глипизида XL, гликуидона и толбутамида.
В настоящем изобретении сульфонилмочевина может быть глибенкламидом, глибенкламидом MR, гликлазидом, гликлазидом LM, глимепиридом, глипизидом, глипизидом XL, гликуидоном или толбутамидом.
Предпочтительная доза глибенкламида составляет ≤10 мг/сутки, 10-20 мг/сутки или ≥20 мг/сутки.
Предпочтительная доза глибенкламида MR составляет ≤6 мг/сутки, 6-12 мг/сутки или ≥12 мг/сутки.
Предпочтительная доза гликлазида составляет ≤160 мг/сутки, 160-320 мг/сутки или ≥320 мг/сутки.
Предпочтительная доза гликлазида LM составляет ≤60 мг/сутки, 60-120 мг/сутки или ≥120 мг/сутки.
Предпочтительная доза глимепирида составляет ≤4 мг/сутки, 4-8 мг/сутки или ≥8 мг/сутки.
Предпочтительная доза глипизида составляет ≤20 мг/сутки, 20-40 мг/сутки или ≥ 40 мг/сутки.
Предпочтительная доза глипизида XL составляет ≤ 10 мг/сутки, 10-20 мг/сутки или ≥20 мг/сутки.
Предпочтительная доза гликуидона составляет ≤60 мг/сутки, 60-90 мг/сутки или ≥90 мг/сутки.
Предпочтительная доза толбутамида составляет ≤1500 мг/сутки или ≥1500 мг/сутки.
Способ по настоящему изобретению предпочтительно представляет собой способ лечения индивидуума, страдающего от диабета 2 типа, когда диабет 2 типа неадекватно контролируется лечением сульфонилмочевиной в отдельности, например, посредством лечения в течение, по меньшей мере, 3 месяцев.
Например, лечение посредством глибенкламида в отдельности с дозой ≤10 мг/сутки, 10-20 мг/сутки или ≥20 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Например, лечение посредством глибенкламида MR в отдельности с дозой ≤6 мг/сутки, 6-12 мг/сутки или ≥12 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Например, лечение посредством гликлазида в отдельности с дозой ≤160 мг/сутки, 160-320 мг/сутки или ≥320 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Например, лечение посредством гликлазида LM в отдельности с дозой ≤60 мг/сутки, 60-120 мг/сутки или ≥120 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Например, лечение посредством глимепирида в отдельности с дозой ≤4 мг/сутки, 4-8 мг/сутки или ≥8 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Например, лечение посредством глипизида в отдельности с дозой ≤20 мг/сутки, 20-40 мг/сутки, или ≥40 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Например, лечение посредством глипизида XL в отдельности с дозой ≤10 мг/сутки, 10-20 мг/сутки или ≥20 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Например, лечение посредством гликуидона в отдельности с дозой ≤60 мг/сутки, 60-90 мг/сутки или ≥90 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Например, лечение посредством толбутамида в отдельности с дозой ≤1500 мг/сутки или ≥1500 мг/сутки может быть недостаточным для адекватного контроля диабета 2 типа.
Способ по настоящему изобретению может дополнительно содержать введение (c) метформина или/и его фармацевтически приемлемой соли.
Метформин является международным непатентованным названием 1,1-диметилбигуанида (CAS номер 657-24-9). В настоящем изобретении, термин "метформин" включает любую его фармацевтически приемлемую соль.
В настоящем изобретении метформин или/и его фармацевтически приемлемую соль можно вводить перорально. Специалист знает составы метформина, подходящие для лечения диабета 2 типа посредством перорального введения. Метформин можно вводить в дозе, по меньшей мере, 1,0 г/сутки или, по меньшей мере, 1,5 г/сутки. Для перорального введения метформин можно формулировать в твердой лекарственной форме, такой как таблетка или пилюля.
В настоящем изобретении, термины "дополнительный", "дополнительное лечение" и "дополнительная терапия" включают лечение сахарного диабета 2 типа посредством сульфонилмочевины, AVE0010 и метформина. Сульфонилмочевину, метформин и AVE0010 можно вводить в течение временного интервала в 24 часа. Сульфонилмочевину, метформин и AVE0010 каждый в отдельности можно вводить в однократной суточной дозе. Сульфонилмочевину, метформин и AVE0010 можно вводить посредством различных способов введения. Сульфонилмочевину и метформин можно вводить перорально, и AVE0010 можно вводить подкожно.
Способ по настоящему изобретению предпочтительно является способом лечения индивидуума, страдающего диабетом 2 типа, когда диабет 2 типа неадекватно контролируется лечением посредством сочетания сульфонилмочевины и метформина в отдельности, например, с дозой ≤1500 мг/сутки метформина, ≥1500 - ≤2500 мг/сутки метформина, ≥2500 - ≤3000 мг/сутки метформина, или ≥3000 мг/сутки метформина в течение, по меньшей мере, 3 месяцев. Сульфонилмочевину можно выбирать из сульфонилмочевин, как описано в настоящем документе. Доза сульфонилмочевины может быть дозой, как указано в настоящем документе.
Индивидуум, для которого предназначено лечение посредством способа по настоящему изобретению, страдающий от диабета 2 типа, может быть страдающим ожирением индивидуумом. В настоящем изобретении, страдающий ожирением индивидуум может иметь индекс массы тела, по меньшей мере, 30.
Индивидуум, для которого предназначено лечение посредством способа по настоящему изобретению, может иметь значение HbA1c, по меньшей мере, 8%, в частности, индивидуум для которого предназначено лечение посредством способа по настоящему изобретению, может иметь значение HbA1c в диапазоне от 8% до 10%.
В настоящем изобретении, индивидуум, страдающий диабетом 2 типа, который неадекватно контролируется, может иметь значение HbA1c в диапазоне от 8% до 10%.
После лечения посредством способа по настоящему изобретению или с применением комбинации по настоящему изобретению, значение HbA1c может достичь значения ниже 8%, ниже 7% или ниже 6,5%. Эти значения HbA1c можно достичь посредством лечения, по меньшей мере, в течение 3 месяцев.
Индивидуум, для которого предназначено лечение посредством способа, по настоящему изобретению может быть взрослым индивидуумом. Индивидуум может находиться в возрасте в диапазоне от 18 до 50 лет.
Другим аспектом настоящего изобретения является фармацевтическая комбинация, содержащая
(a) desPro36Экзендин-4(1-39)-Lys6-NH2 или/и его фармацевтически приемлемую соль, и
(b) сульфонилмочевину или/и ее фармацевтически приемлемую соль.
Предпочтительно, фармацевтическая комбинация по настоящему изобретению предназначена для применения в лечении сахарного диабета 2 типа.
Предпочтительно, комбинация по настоящему изобретению предназначена для применения в профилактике гипогликемии, как описано в настоящем документе, у пациентов с сахарным диабетом 2 типа.
Более предпочтительно комбинация по настоящему изобретению, предназначена для применения в профилактике гипогликемии у пациентов с диабетом 2 типа, имеющих повышенный риск гипогликемии, в частности у пациентов с диабетом 2 типа, перенесших, по меньшей мере, один гипогликемический эпизод. Гипогликемический эпизод может быть симптоматическим гипогликемическим эпизодом или тяжелым симптоматическим гипогликемическим эпизодом.
Фармацевтическую комбинацию по настоящему изобретению можно вводить, как описано в настоящем документе, в отношении способа по настоящему изобретению. Соединения (a) и (b) комбинации по настоящему изобретению можно формулировать, как описано в настоящем документе, в отношении способа по настоящему изобретению.
В фармацевтической комбинации по настоящему изобретению desPro36Экзендин-4(1-39)-Lys6-NH2 или/и его фармацевтически приемлемую соль можно получать для подкожного введения.
В фармацевтической комбинации по настоящему изобретению сульфонилмочевину или/и ее фармацевтически приемлемую соль можно получать для перорального введения.
Фармацевтическая комбинация может дополнительно содержать (c) метформин или/и его фармацевтически приемлемую соль. В фармацевтической комбинации метформин можно получать для перорального введения, как описано в настоящем документе.
В фармацевтической комбинации сульфонилмочевину можно выбирать из глибенкламида, глибенкламида MR, гликлазида, гликлазида LM, глимепирида, глипизида, глипизида XL, гликуидона и голбутамида.
Специфическая комбинация по настоящему изобретению содержит AVE0010 и глибенкламид.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010 и глибенкламид MR.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010 и гликлазид.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010 и гликлазид LM.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010 и глимепирид.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010 и глипизид.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010 и глипизид XL.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010 и гликуидон.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010 и толбутамид.
Специфическая комбинация по настоящему изобретению содержит AVE0010, глибенкламид и метформин.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010, глибенкламид MR и метформин.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010, гликлазид и метформин.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010, гликлазид LM и метформин.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010, глимепирид и метформин.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010, глипизид и метформин.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010, глипизид XL и метформин.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010, гликуидон и метформин.
Другая специфическая комбинация по настоящему изобретению содержит AVE0010, толбутамид и метформин.
Дозировки соединений в специфических комбинациях по настоящему изобретению можно выбирать, как описано в настоящем документе.
Фармацевтическую комбинацию по настоящему изобретению можно применять в профилактике гипогликемии, как описано в настоящем документе, у пациентов с сахарным диабетом 2 типа.
Фармацевтическую комбинацию по настоящему изобретению можно применять при гликемическом контроле у пациентов с сахарным диабетом 2 типа. В настоящем примере, в таблице 11 приведены результаты первичного параметра эффективности, изменение от исходного уровня до 24 недели (LOCF) в HbA1c с применением анализа ANCOVA. Предварительно заданный первичный анализ показал, что лечение с применением ликсисенатида, комбинированного с сульфонилмочевиной с или без метформина (также называемое в настоящем документе "группа, получающая лечение ликсисенатидом", "группа ликсисенатида" или "пациенты, получающие лечение ликсисенатидом") имело результатом статистически значимое снижение HbA1c от исходного уровня до 24 недели, по сравнению с группой плацебо (различие средних значений против группы плацебо = -0,74%; p-значение <0,0001). Группа плацебо получала сульфонилмочевину с или без метформина. В таблице 12 обобщается доля пациентов с ответом на лечение (HbA1c ≤6,5% или <7% на 24 неделе, соответственно). Анализ HbA1c ответов с применением CMH способа показал значимое отличие лечения против плацебо для группы, получавшей лечение ликсисенатидом (p-значение <0,0001). На 24 неделе 19,3% пациентов, получавших лечение ликсисенатидом, и 4,7% пациентов, получавших плацебо, достигли значений HbA1c ≤6,5%; 36,4% пациентов в группе ликсисенатида, и 13,5% пациентов в группе плацебо достигли значений HbA1c <7%.
В частности, фармацевтическую комбинацию по настоящему изобретению можно применять при уменьшении постпрандиальной концентрации глюкозы в плазме или/и при уменьшении концентрации глюкозы в плазме натощак. Более конкретно, фармацевтическую комбинацию по настоящему изобретению можно применять при уменьшении постпрандиальной концентрации глюкозы в плазме и при уменьшении концентрации глюкозы в плазме натощак. В таблицах 13, 14 и 17 обобщены анализы ANCOVA 2-часовой постпрандиальной концентрации глюкозы в плазме, концентрации глюкозы в плазме натощак (FPG), и ΗΟΜΑ-β, соответственно. На фигуре 4 проиллюстрировано изменение среднего значения (±SE) от исходного уровня в FPG и массы тела со временем в течение 24-недельного двойного слепого периода лечения. На фигурах 7, 8 и 10 в приложении проиллюстрированы изменения среднего значения (±SE) от исходного уровня со временем в 2-часовой постпрандиальной концентрации глюкозы в плазме, FPG, и ΗΟΜΑ-β в течение всего двойного слепого периода лечения.
Результаты оценки 2-часовой постпрандиальной концентрации глюкозы в плазме показали статистически значимое улучшение от исходного уровня до 24-недельного в группе ликсисенатида (ликсисенатид в комбинации с сульфонилмочевиной с или без метформина) сравнительно с группой плацебо (сульфонилмочевина с или без метформин) (различие средних значений против плацебо = 5,98 ммоль/л; p-значение <0,0001, таблица 13). Для FPG статистически значимым уменьшением от исходного уровня до 24 недельного в группе ликсисенатида по сравнению с группой плацебо (различие средних значений против плацебо = 0,63 ммоль/л; p-значение <0,0001, таблица 14). Лечение посредством ликсисенатида по существу снизило отклонение глюкозы от исходного уровня до 24 недели по сравнению с группой плацебо (различие средних значений = -5,57 ммоль/л, 95% CI = от -6,397 до -4,744), как представлено в таблице 19.
Фармацевтическую комбинацию по настоящему изобретению можно применять при индуцировании потери массы тела у пациентов с сахарным диабетом 2 типа или/и для профилактики увеличения массы у пациентов с сахарным диабетом 2 типа. В таблице 15 обобщены результаты анализов ANCOVA массы тела. На фигуре 5 проиллюстрировано среднее изменение (±SE) от исходного уровня FPG и массы тела со временем в течение основного 24-недельного двойного слепого периода лечения. На фигуре 9 проиллюстрирована масса тела в течение всего двойного слепого периода лечения.
Предел среднего изменения массы тела от исходного уровня на 24 неделе составлял -1,76 кг у пациентов, принимавших лечение ликсисенатидом (ликсисенатид в комбинации с сульфонилмочевиной с или без метформина), и -0,93 кг для пациентов, получавших плацебо (сульфонилмочевина с или без метформина) (различие средних значений против плацебо = -0,84 кг) со статистически значимым отличием между лечебными группами (p-значение <0,0001). Масса тела продолжала уменьшаться после 24-недельного периода лечения при обоих лечебных режимах (фигура 9). Приблизительно 14,4% пациентов, получавших лечение ликсисенатидом, и 7,2% пациентов, получавших плацебо, имели ≥5% потери массы тела от исходного уровня до 24 недели (таблица 16).
Изобретение дополнительно иллюстрируют следующие фигуры и пример.
Подписи к фигурам
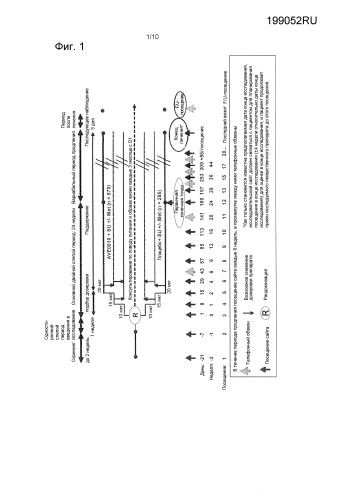
Фигура 1: План исследования. SU: сульфонилмочевина. Met: метформин.
Фигура 2: График Каплана-Мейера для прерывания лечения по любой причине - рандомизированная популяция.
Фигура 3: График среднего изменения при HbA1c (%) от исходного уровня во время посещения до 24 недели и в конечной точке - популяция mITT. LOCF = перенос вперед данных последнего наблюдения. Примечание: график включал измерения, полученные перед введением препарата неотложной терапии и через 3 суток после последней дозы инъекции препарата, применяемого в двойном слепом исследовании, во время или перед 12 посещением (24 неделя), или на 169 сутки, если 12 посещение (24 неделя) является невозможным.
Фигура 4: График среднего изменения концентрации глюкозы в плазме натощак (ммоль/л) от исходного уровня во время посещения вплоть до 24 недели и в конечной точке - популяция mITT. LOCF = перенос вперед данных последнего наблюдения. Примечание: график включал измерения, полученные перед введением препарата неотложной терапии вплоть до 1 суток после последней дозы инъекции препарата, применяемого в двойном слепом исследовании, во время или перед 12 посещением (24 неделя), или 169 сутки, если 12 посещение (24 неделя) является невозможным.
Фигура 5: График среднего изменения массы тела (кг) от исходного уровня во время посещения вплоть до 24 недели и в конечной точке - популяция mITT. LOCF = перенос вперед данных последнего наблюдения. Примечание: график включал измерения, полученные перед введением препарата неотложной терапии и вплоть до 3 суток после последней дозы инъекции препарата, применяемого в двойном слепом исследовании, во время или перед 12 посещения (24 неделя), или на 169 сутки, если 12 посещение (24 неделя) является невозможным.
Фигура 6: График среднего изменения HbA1C (%) от исходного уровня во время посещения и в конечной точке - популяция mITT. LOCF = перенос вперед данных последнего наблюдения, EOT = последнее значение в процессе лечения. Примечание: анализ исключал измерения, полученные после введения препарата неотложной терапии и/или после прекращения лечения плюс 3 суток.
Для 24 недели (LOCF) анализ включал измерения, полученные вплоть до 3 суток после последней дозы инъекции препарата, применяемого в двойном слепом исследовании, во время или перед 12 посещением (24 неделя), или на 169 сутки, если 12 посещение (24 неделя) является невозможным.
Фигура 7: График среднего изменения в 2-часовой постпрандиальной концентрации глюкозы в плазме (ммоль/л) от исходного уровня во время посещения и в конечной точке в выбранных центрах - популяция mITT. LOCF = перенос вперед данных последнего наблюдения, EOT = последнее значение в процессе лечения. Примечание: анализ исключал измерения, полученные после введения препарата неотложной терапии и/или после прекращения лечения. Для 24 недели (LOCF), анализ включал измерения, полученные вплоть до даты последней дозы инъекции препарата, применяемого в двойном слепом исследовании, во время или перед 12 посещением (24 неделя), или на 169 сутки, если 12 посещение (24 неделя) является невозможным.
Фигура 8: График среднего изменения концентрации глюкозы в плазме натощак (ммоль/л) от исходного уровня во время посещения и в конечной точке - популяция mITT. LOCF = перенос вперед данных последнего наблюдения, EOT = последнее значение в процессе лечения. Примечание: анализ исключал измерения, полученные после введения препарата неотложной терапии и/или после прекращения лечения плюс 1 сутки. Для 24 недели (LOCF), анализ включал измерения, полученные вплоть до 1 сутки после последней дозы инъекции препарата, применяемого в двойном слепом исследовании, во время или перед 12 посещением (24 неделя), или на 169 сутки, если 12 посещение (24 неделя) является невозможным.
Фигура 9: График среднего изменения массы тела (кг) от исходного уровня во время посещения и в конечной точке - популяция mITT. LOCF = перенос вперед данных последнего наблюдения, EOT = последнее значение в процессе лечения. Примечание: анализ исключал измерения, полученные после введения препарата неотложной терапии и/или после прекращения лечения плюс 3 суток. Для 24 недели (LOCF) анализ включал измерения, полученные вплоть до 3 суток после последней дозы инъекции препарата, применяемого в двойном слепом исследовании, во время или перед 12 посещением (24 неделя), или на 169 сутки, если 12 посещение (24 неделя) является невозможным.
Фигура 10: График среднего изменения ΗΟΜΑ-β от исходного уровня во время посещения и в конечной точке в выбранных центрах - популяция mITT. LOCF = перенос вперед данных последнего наблюдения, EOT = последнее значение в процессе лечения. Примечание: анализ исключал измерения, полученные после введения препарата неотложной терапии и/или после прекращения лечения. Для 24 недели (LOCF) анализ включал измерения, полученные вплоть до даты последней дозы инъекции препарата, применяемого в двойном слепом исследовании, во время или перед 12 посещения(24 неделя), или на 169 сутки, если 12 посещение (24 неделя) является невозможным.
Пример
Рандомизированное двойное слепое плацебо-контролируемое 2-режимное проводящееся в параллельных группах многонациональное исследование, оценивающее эффективность и безопасность ликсисенатида по сравнению с плацебо в качестве дополнительного лечения к сульфонилмочевине в комбинации с или без метформина у пациентов с диабетом 2 типа.
Сущность
Этот пример описывает рандомизированное двойное слепое плацебо-контролируемое 2-режимное, проводящееся в параллельных группах, многонациональное исследование, оценивающее эффективность и безопасность ликсисенатида по сравнению с плацебо в качестве дополнительного лечения к сульфонилмочевине в комбинации с или без метформина у пациентов с диабетом 2 типа. Приблизительная минимальная продолжительность исследования для пациента составляла 79 недель (вплоть до 3 недель скрининга + 24-недели основного лечения + переменное продление + 3 суток последующего наблюдения). Исследование проводили в 136 центрах в 16 странах. Первичной задачей исследования было оценить эффективность ликсисенатида для гликемического контроля по сравнению с плацебо в отношении падения HbA1c (абсолютное изменение) в течение 24-недельного периода.
Всего 859 пациентов были рандомизированы в одну из двух лечебных групп (573 в группе ликсисенатида и 286 в группе плацебо). Всех рандомизированных пациентов подвергали лечению в рамках исследования. Демографические и исходные характеристики были, главным образом, сходными в лечебных группах. Одиннадцать пациентов (9 пациентов на ликсисенатиде и 2 пациента на плацебо) были исключены из популяции mITT из-за анализа эффективности, ввиду отсутствия данных об эффективности после исходного уровня. Во время всего периода лечения в рамках исследования 259 (30,2%) пациентов досрочно прекратили лечение в рамках исследования. Проценты пациентов, которые прекратили лечение, были сходными в лечебных группах (30,9% для группы ликсисенатида и 28,7% для группы плацебо). Для группы ликсисенатида основной причиной прерывания лечения были "нежелательные явления" (12,4% против 8,0% для группы плацебо), за ними следовали "другие причины" (11,7% против 9,1% для группы плацебо).
Изменения среднего значения, определенные методом наименьших квадратов, от исходного уровня до 24 недели в HbA1c составляли -0,85% для группы ликсисенатида и -0,10% для группы плацебо (различие средних значений против плацебо = -0,74%; p-значение <0,0001). Всего 198 пациентов (36,4%) в группе ликсисенатида имели HbA1c <7% на 24 неделе по сравнению с 37 пациентами (13,5%) в группе плацебо, и 105 (19,3%) пациентов, получавших лечение ликсисенатидом, имели HbA1c ≤6,5% по сравнению с 13 (4,7%) пациентами, получавшими плацебо. Анализ на ответ HbA1c (HbA1c ≤6,5 или <7% на 24 неделе) с применением критерия Кохрана-Мантеля-Хензеля (CMH) также продемонстрировал значимое отличие лечения против плацебо для группы ликсисенатида на 24 неделе (p-значение <0,0001).
Кроме того, лечение посредством ликсисенатида улучшало постпрандиальный гликемический контроль, как показано результатами для 2-часовой постпрандиальной оценки содержания глюкозы в плазме (PPG) и для отклонения содержания глюкозы. Статистически значимое улучшение PPG было продемонстрировано в группе ликсисенатида по сравнению с группой плацебо с различием средних значений, определенных методом наименьших квадратов, -5,98 ммоль/л (p-значение <0,0001). Кроме того, лечение посредством ликсисенатида продемонстрировало статистически значимое снижение уровня глюкозы в плазме натощак (различие средних значений, определенных методом наименьших квадратов, -0,63 ммоль/л; p-значение <0,0001) и массы тела (различие средних значений, определенных методом наименьших квадратов, -0,84 кг; p-значение <0,0001) по сравнению с группой плацебо. Для функции