Метил 5-(арилкарбамоил)-1-(бензил и фенил)-4-циннамоил-1н-пиразол-3-карбоксилаты, проявляющие анальгетическую активность, и способ их получения
Иллюстрации
Показать всеИзобретение относится к новым индивидуальным соединениям класса пиразолов. Описываются метил 5-(арилкарбамоил)-1-(бензил и фенил)-4-циннамоил-1H-пиразол-3-карбоксилаты (IIIa-е) имеющие формулу, приведенную ниже, и способ их получения. Технический результат - получение новых соединений, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии как обладающие анальгетической активностью. 3 н. и 2 з.п. ф-лы, 1 табл., 3 пр.
Реферат
Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса пиразолов и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии.
Известны структурные аналоги заявленных соединений, получаемые рециклизацией 4,5-диароил-1H-пиррол-2,3-дионов под действием монозамещенных гидразинов в абсолютном хлороформе при комнатной температуре в течение 15-20 минут с последующим кипячением в этаноле в течение 20-30 минут образуются N-ариламиды 2-(1-(бензил и фенил)-5-арил-3-ароил-1H-пиразол-4-ил)-2-оксоуксусной кислоты (Силайчев П.С., Кудреватых Н.В., Масливец А.Н. // ЖОрХ. 2010. Т. 46, вып. 10. С. 1540-1543):
К недостаткам данного способа относится невозможность получения метил 5-(арилкарбамоил)-1-(бензил и фенил)-4-циннамоил-1H-пиразол-3-карбоксилатов.
Задачей изобретения является разработка простого способа синтеза не описанных в литературе метил 5-(арилкарбамоил)-1-(бензил и фенил)-4-циннамоил-1H-пиразол-3-карбоксилатов.
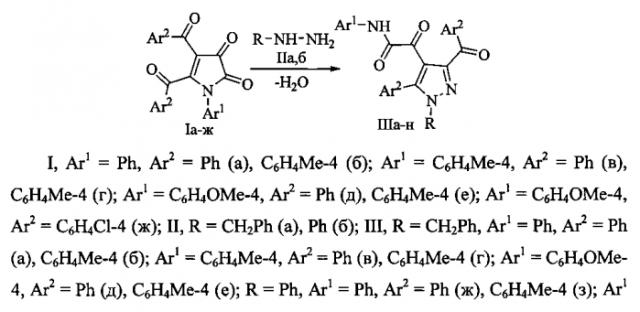
Поставленная задача осуществляется путем взаимодействия метил 1-арил-3-циннамоил-4,5-диоксо-4,5-дигидро-1H-пиррол-2-карбоксилатов (Силайчев П.С., Филимонов В.О., Слепухин П.А., Масливец А.Н. // ЖОрХ. 2012. Т. 48. С. 563-567) (Ia-в) с бензилгидразином (IIa) и фенилгидразином (IIб) в среде инертного полярного апротонного растворителя - 1,4-диоксана по схеме:
Процесс ведут путем выдерживания раствора реагентов в среде абсолютного 1,4-диоксана при температуре 100-102°С в течение 20-30 минут.
Из патентной и технической литературы не были выявлены способы получения метил 5-(арилкарбамоил)-1-(бензил и фенил)-4-циннамоил-1H-пиразол-3-карбоксилатов, имеющие сходные признаки с заявляемым способом, а именно, не использовались исходные продукты, растворители, в которых проходит реакция, и интервал температур, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. Метил 1-бензил-5-(фенилкарбамоил)-4-циннамоил-1H-пиразол-3-кабоксилат (IIIa).
К раствору 1.0 ммоль соединения (Ia) в 20 мл абсолютного 1,4-диоксана добавляли раствор 1 ммоль бензилгидразина (IIa) в 5 мл абсолютного 1,4-диоксана, кипятили 30 минут, растворитель отгоняли, остаток перекристаллизовывали из этанола. Выход 83%, т.пл. 168-170°С (этанол). Соединение (IIIa) C28H23N3O4.
Найдено, %: С 72.22; Η 4.95; N 9.00.
Вычислено, %: С 72.25; Η 4.98; N 9.03.
Соединение (IIIa) - бесцветное кристаллическое вещество, легкорастворимое в ДМФА и ДМСО, труднорастворимое в обычных органических растворителях, нерастворимое в алканах и воде.
В ИК спектре соединения (IIIa), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний амидной ΝΗ группы при 3253 см-1, метоксикарбонильной группы при 1733 см-1, амидной карбонильной группы при 1675 см-1, кетонной карбонильной группы и двойной связи циннамоильного заместителя при 1648 и 1620 см-1, а также полоса «амид II» при 1562 см-1.
В спектре ПМР соединения (IIIa), записанном в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют синглет протонов метоксикарбонильного заместителя при 3.80 м.д., синглет метиленовой группы бензильного заместителя при 5.56 м.д., дублеты протонов двойной связи циннамоильного заместителя при 7.26 и 7.53 м.д. с константами спин-спинового взаимодействия характерной для транс-замещенных алкенов и синглет протона амидной группы ΝΗ при 10.87 м.д.
Пример 2. Метил 1-фенил-5-(фенилкарбамоил)-4-циннамоил-1H-пиразол-3-карбоксилат (IIIб).
К раствору 1.0 ммоль соединения (Ia) в 20 мл абсолютного 1,4-диоксана добавляли раствор 1 ммоль фенилгидразина (IIб) в 5 мл абсолютного 1,4-диоксана, кипятили 30 минут, растворитель отгоняли, остаток перекристаллизовывали из этанола. Выход 80%, т.пл. 209-210°C (этанол). Соединение (IIIб) C27H21N3O4.
Найдено, %: С 71.80; Η 4.66; N 9.27.
Вычислено, %: С 71.83; Η 4.69; N 9.31.
Соединение (IIIб) - бесцветное кристаллическое вещество, легкорастворимое в ДМФА и ДМСО, труднорастворимое в обычных органических растворителях, не растворимое в алканах и воде.
В ИК спектре соединения (IIIб), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний амидной ΝΗ группы при 3281 см-1, метоксикарбонильной группы при 1728 см-1, амидной карбонильной группы при 1684 см-1, кетонной карбонильной группы и двойной связи циннамоильного заместителя при 1649 и 1621 см-1, а также полоса «амид II» при 1558 см-1.
В спектре ПМР соединения (IIIб), записанном в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют синглет протонов метоксикарбонильного заместителя при 3.86 м.д., дублеты протонов двойной связи циннамоильного заместителя при 7.29 и 7.61 м.д. с константами спин-спинового взаимодействия характерной для Аираис-замещенных алкенов и синглет протона амидной группы ΝΗ при 10.95 м.д.
Соединения (IIIв-е) синтезировали аналогично.
Предлагаемый способ прост в осуществлении, одностадиен и позволяет получить не описанные в литературе метил 5-(арилкарбамоил)-1-(бензил и фенил)-4-циннамоил-1H-пиразол-3-карбоксилаты (IIIa-е) с хорошими выходами, которые найдут применение в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств.
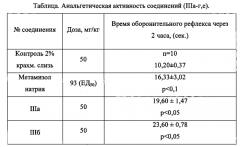
Пример 5. Фармакологическое исследование метил 5-(арилкарбамоил)-1-(бензил и фенил)-4-циннамоил-1H-пиразол-3-карбоксилатов (IIIa-г, е), на наличие анальгетической активности.
Оценку анальгетических свойств соединений (IIIa-г, е) изучали на беспородных мышах массой 18-22 грамм методом термического раздражения «горячая пластинка» по Эдди и Леймбах (Eddy N.B., Leimbarh D.J. Pharmacol and Exper. Gher. 1953., 385-393). В качестве препарата сравнения использовали метамизол натрия.
Проведенные исследования показали (см. табл.), что соединения (IIIa-г, е) обладают выраженной анальгетической активностью на уровне или превышающей таковую у препарата сравнения. Данные о фармакологической активности аналогов заявляемых соединений в доступной литературе отсутствуют.
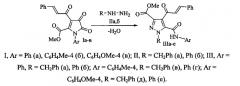
1. Метил 5-(арилкарбамоил)-1-(бензил или фенил)-4-циннамоил-1H-пиразол-3-карбоксилаты формулы где III, Ar=Ph, R=CH2Ph (a), Ph (б); Ar=С6Н4Ме-4, R=CH2Ph (в), Ph(г); Ar=C6H4OMe-4, R=CH2Ph (д), Ph (е).
2. Метил 5-(арилкарбамоил)-1-(бензил или фенил)-4-циннамоил-1H-пиразол-3-карбоксилаты формулы где III, Ar=Ph, R=CH2Ph (a), Ph (б); Ar=С6Н4Ме-4, R=CH2Ph (в), Ph(г); Ar=C6H4OMe-4, R=CH2Ph (д), Ph (е), обладающие анальгетической активностью.
3. Способ получения метил 5-(арилкарбамоил)-1-(бензил или фенил)-4-циннамоил-1H-пиразол-3-карбоксилатов формулы где III, Ar=Ph, R=CH2Ph (a), Ph (б); Ar=С6Н4Ме-4, R=CH2Ph (в), Ph(г); Ar=C6H4OMe-4, R=CH2Ph (д), Ph (е),отличающийся тем, что метил 1-арил-3-циннамоил-4,5-диоксо-4,5-дигидро-1H-пиррол-2-карбоксилаты (Ia-в) формулы где I, Ar=Ph (а), С6Н4Ме-4 (б); Ar=С6Н4ОМе-4 (в),подвергают взаимодействию с бензилгидразином (IIа) или фенилгидразином (IIб) в среде инертного полярного апротонного растворителя-1,4-диоксана, при температуре 100-102°C в течение 20-30 минут.
4. Способ по п. 3, отличающийся тем, что процесс ведут при температуре 100-102°C - температура кипения 1,4-диоксана.
5. Способ по одному из пп. 3 или 4, отличающийся тем, что в качестве растворителя используют абсолютный 1,4-диоксан.