Клетки, производные от кардиальной ткани
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описан способ получения клеток, производных от кардиальной ткани человека, которые не экспрессируют теломеразу и Isl-1 и экспрессируют CD117. Также описаны композиции, включающие очищенную популяцию клеток, полученных таких способом, которые используются для восстановления поврежденного миокарда при помощи человеческих клеток кардиального происхождения. Предложенная группа изобретений может быть использована в медицине. 5 н. и 14 з.п. ф-лы, 39 ил., 30 табл., 20 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В рамках настоящего изобретения испрашивается приоритет заявки с серийным номером 61/224446 от 09 июля 2009 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям для восстановления поврежденного миокарда при помощи человеческих клеток, производных от кардиальной ткани. Более конкретно, настоящее изобретение относится к способам и композициям для восстановления поврежденного миокарда при помощи экспандированных человеческих клеток, производных от кардиальной ткани, которые не экспрессируют теломеразу.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Острый инфаркт миокарда (ОИМ) - основная причина смерти в США. ОИМ возникает в результате внезапной и продолжительной недостаточности притока крови к отдельным участкам сердца, обычно обусловленной сужением коронарной артерии. Без достаточного снабжения кровью начинается ишемия ткани, что приводит к отмиранию миоцитов и васкулярных структур. Участок некротической ткани называется очагом инфаркта и впоследствии замещается рубцовой тканью. Оставшиеся кардиомиоциты неспособны восстановить некротическую ткань, и функция сердца со временем ухудшается. Такое ухудшение может выражаться в потере функциональности сердечной мускулатуры, связанной с ремоделированием поврежденного миокарда.
В основе некоторых видов лечения острого инфаркта миокарда лежит тромболизис или, как вариант, ангиопластика, позволяющая открыть закупоренный сосуд и восстановить приток крови к очагу инфаркта. Такие способы лечения обеспечивают эффективное сокращение размера зоны инфаркта и улучшение систолической функции сердца, но не позволяют обратить потерю функциональности сердечной мышцы, связанную с ремоделированием поврежденного миокарда. Другие способы лечения, например, с использованием ингибиторов ангиотезин-превращающего фермента (иАПФ) и бета-блокаторов, способны улучшить общую функциональность и выживаемость. Однако терапевтический эффект от использования этих препаратов помогает повысить выживаемость у пациентов в состоянии после ОИМ менее чем на 5%.
Другим перспективным способом лечения острого инфаркта миокарда является клеточная трансплантация. Например, Orlic et al. (Nature 410: 701-705 (2001)) сообщает о введении Lin- c-kit+ клеток костного мозга в поврежденный миокард. Orlic et al сообщают: «Наши исследования показывают, что локально доставляемые клетки костного мозга способны заново образовывать миокард, улучшая исход заболевания коронарных артерий».
В другом примере Nygren et al. (Nature Medicine 10: 494-501 (2004)) сообщают: «Мы показали, что не фракционированные клетки костного мозга и очищенная популяция гемопоэтических стволовых клеток и клеток-предшественников успешно пересаживаются в миокард, пораженный в результате инфаркта. Вживление носит транзиторный, но гемопоэтический характер. В отличие от этого кардиомиоциты, производные от клеток костного мозга, редко встречались за пределами миокарда, пораженного в результате инфаркта, и возникали исключительно путем слияния клеток».
Однако механизм, благодаря которому происходит лечение ОИМ при помощи клеток костного мозга остается неясным. Например, Murry et al. (Nature 428: 664-668 (2004)) сообщает: «Мы использовали репортерные трансгены, экспрессированные как кардиомиоцитом, так и убиквитарно, чтобы проследить поведение гемопоэтических стволовых клеток после 145 трансплантаций в здоровые и пораженные ткани сердца взрослых мышей. Трансдифференцирование в кардиомиоцитах при использовании этих генетических методик, позволяющих проследить дальнейшее развитие клеток и сердец с вживленными стволовыми клетками, не выявлено, а сердца с вживленными стволовыми клетками не показали выраженного увеличения кардиомиоцитов по сравнению с сердцами, в которые вживлялось плацебо. Эти результаты показывают, что гемопоэтические стволовые клетки не способны быстро приобрести кардиальный фенотип, и ставят под вопрос клинические исследования по восстановлению миокарда после инфаркта».
В другом примере Werner et al. (Nature Clinical Practice Cardiovascular Medicine 5: 78-79 (2008)) сообщает: «Все еще существует ряд вопросов, требующих ответов в отношении наиболее эффективной субпопуляции клеток-предшественников, лучшего способа наращивания клеток-предшественников, основополагающих механизмов действия, а также долгосрочной безопасности и эффективности способа. Более того, несколько попыток использования клеток костного мозга для лечения пациентов с ОИМ привели к отрицательным результатам, возможно, вследствие временной вариативности введения клеток костного мозга после ОИМ, различий в применяемых способах получения клеток-предшественников или обоих факторов».
В другом примере Balsam et al. (Nature 428: 668-673 (2004)) сообщают: «Наши данные позволяют предположить, что даже в микросреде пораженного сердца клетки костного мозга, обогащенные c-kit, клетки костного мозга Lin- c-kit+ и гемопоэтические стволовые клетки c-kit+ Thy1.1lo Lin- Sca-1+ долгосрочного восстановления повторяют традиционный для гемопоэтических клеток путь развития».
Другим возможным источником клеток являются эмбриональные стволовые клетки. Например, Gold et al. (WO 2005090558) описывает способы получения клеток, дифференцированных в кардиомиоциты, из эмбриональных стволовых клеток для использования в регенеративной медицине.
В другом примере Gold and Hassanipour (WO 2007002136) описывают способы дифференциации полипотентных стволовых клеток приматов в клетки, способные дифференцировать в кардиомиоциты.
Другим возможным источником клеток являются кардиальные клетки-предшественники. Кардиальные клетки-предшественники были выявлены в сердце человека и крысы. Кардиальные клетки-предшественники имеют самовосстанавливающуюся и мультипотентную природу, обуславливающую возможность дифференцирования по любой линии.
Например, в заявке на патент США № US 20040126879 A1 описано использование кардиальных стволовых клеток CD31+, CD38+ и c-kit- для лечения поврежденного миокарда.
В другом примере Oh et al. (PNAS 100: 12313-12318 (2003)) описывают существование в сердце взрослого человека кардиальных клеток-предшественников, экспрессирующих Sca-1, CD31 и CD38, и не способных экспрессировать CD4, CD8, B220, Gr-1, Mac-1, TER119, c-kit, Flk-1, e-Cadherin, фактор фон Виллебранда, CD45 и CD34.
В другом примере в заявке на патент США № US 20080241111 A1 описан способ выделения клеток, производных от кардиальной ткани млекопитающего. Выделение осуществляется в несколько стадий: (i) ферментная обработка фрагмента кардиальной ткани млекопитающего для приготовления клеточной суспензии, (ii) выделение группы клеток, производных от кардиальной ткани, из указанной клеточной суспензии методом градиента плотности и (iii) суспензионное культивирование полученной группы клеток, производных от кардиальной ткани, в питательной среде, содержащей фактор роста фибробластов и эпидермальный фактор роста, а затем селекция и выделение клеток, образующих рабочую сферу.
В другом примере в заявке на патент США № US 20080213231 A1 описана группа плюрипотентных стволовых клеток, состоящая из плюрипотентных стволовых клеток, производных от ткани скелетной мускулатуры человека или мыши, плюрипотентные стволовые клетки c-met-отриц., Pax-7-отриц., Myf-5-отриц., MyoD-отриц., Myogenin-отриц., M-cadherin-отриц., CD105-полож., CD90-полож., c-kit-отриц., и CD45-отриц., плюрипотентные стволовые клетки CD34-отриц., в случае если они являются производными стволовых клеток человека, CD34-полож., в случае если они являются производными стволовых клеток мыши, и группа плюрипотентных стволовых клеток, полученная путем пролиферации одной клетки.
В другом примере Laugwitz et al. (Nature 433: 647-653 (2005) описывают кардиальные клетки-предшественники isl1-1+ в постнатальном миокарде крысы, мыши и человека.
В другом примере Messina at al. (Circulation Research 95: 911-921, (2004)) описывают «изолирование недифференцированных клеток, растущих в виде самосклеивающихся кластеров (которые мы назвали «кардиосферами») из субкультур постнатального атриального или вентрикулярного биоптата человека и мышиных сердец. Эти клетки имеют клональное происхождение, экспрессируют антигены/маркеры стволовых и эндотелиальных клеток-предшественников и очевидно обладают свойствами взрослых кардиальных стволовых клеток». Messina at al сообщают: «Заново развивающиеся человеческие и мышиные кардиосферы обнаруживают экспрессию маркеров эндотелиальных (KDR (человека)/flk-1 [мыши], CD-31) и стволовых клеток (CD-34, c-kit, sca-1)».
В другом примере Smith et al. (Circulation 115(7): 896-908 (2007) сообщают: «Из образцов чрескожной эндомиокардиальной биопсии получена первичная культура в виде многоклеточных кластеров, известных как кардиосферы, которые высеваются для выращивания стволовых клеток, полученных из кардиосферы (CDC)».
В другом примере в заявке на патент США № US 20070020758 описан способ изолирования, экспансирования и сохранения кардиальных стволовых клеток из биоптатов ткани человека или животного для клеточной трансплантации и функционального восстановления миокарда и других органов.
В другом примере Beltrami et al. (Cell 114(6): 763-776 (2003)) описывают «существование клеток Lin− c-kitPOS, обладающих свойствами кардиальных стволовых клеток. Они имеют клональное происхождение, являются самовосстанавливающимися и мультипотентными, и, соответственно, могут дифференцироваться в миоциты, гладкомышечные и эндотелиальные клетки».
В другом примере в международной патентной заявке № WO 2008054819 описаны кардиоваскулярные стволовые клетки, положительные по маркерам isl1+/Nkx 2.5+/flk1+, и кардиоваскулярные стволовые клетки, которые могут дифференцироваться по линии эндотелиальных, кардиальных или гладкомышечных клеток.
В другом примере в международной патентной заявке № WO 2008109839 A1 описывается расширенная популяция стволовых клеток, включающая полипептид CXCR4 и полипептид FIk-I, при этом указанные стволовые клетки способны дифференцировать в клетки, экспрессирующие Mef2C, GATA-4, миокардин и Nkx2.5.
В другом примере в международной патентной заявке № 2008081457A2 описывается способ изолирования кардиальных стволовых клеток. Способ включает обработку ткани, содержащей кардиальные стволовые клетки, составом, содержащим диспазу Il, в условиях, пригодных для индуцирования диссоциации клеток, в результате чего происходит изолирование кардиальных стволовых клеток.
В другом примере в международной патентной заявке № 2008058273 A2 описывается способ получения клеток из миоцитов (MDC), подобных стволовым клеткам млекопитающего, из атриальной или вентрикулярной ткани сердца. Способ включает следующие стадии: изолирование клеток из атриальной или вентрикулярной ткани сердца для получения клеточной суспензии; культивирование клеток в среде, содержащей митоген, с получением композиции, содержащей MDC.
В другом примере в международной патентной заявке № 2008054819 A2 описывается способ изолирования кардиоваскулярных стволовых клеток. Способ включает обработку популяции клеток агентами, реактивными к Islet1, Nkx2.5 и flk1, и отделение реактивно-положительных клеток от реактивно-отрицательных клеток.
В другом примере в заявке на патент США № US 20070212423 A1 описывается способ изолирования c-kit-/c-met- клетки-предшественника кардиомиоцита мышечного происхождения, включающий выделение клеток с диаметром менее 40 мкм из суспензии мышечных клеток, культивирование клеток в тканевой культурной среде на твердом субстрате, изолирование клеток в суспензии в среде, таким образом изолируя c-kit-/c-met- клетки-предшественника кардиомиоцита мышечного происхождения.
В другом примере в заявке на патент США № US 20050058633 описана изолированная c-kit-/c-met-клетка-предшественник кардиомиоцита млекопитающего мышечного происхождения.
В другом примере в международной патентной заявке № WO 2004019767 описана изолированная кардиомиоцитная стволовая клетка млекопитающего, имеющая фенотип c-kitneg/CD31+/CD38+ и экспрессирующая обратную транскриптазу теломеразы.
В другом примере в международной патентной заявке № WO 2008083962 A1 описаны клетки-предшественники кардиомиоцитов (CMPC), характеризующиеся наличием эпитопа, подобного Sca-1 или Sca-1, и CD31 на клеточной поверхности.
В другом примере в заявке на патент США № 20080213230 A1 описан способ подготовки изолированной популяции клеток, обогащенной стволовыми клетками или клетками-предшественниками. Способ включает: (a) культивирование образца ткани, (b) получение клеток, мигрирующих поверх склеенных фибробластов в процессе указанного культивирования, (c) клонирование одной или нескольких клеток, полученных по п.(b) для создания одной или нескольких клоногенных популяций, (d) идентификация одной или нескольких клоногенных популяций, имеющих желаемый фенотип, (e) изолирование стволовых клеток или клеток-предшественников из одной или нескольких клоногенных популяций, идентифицированных по п.(d), путем сортировки клеток с использованием одной или нескольких клеточных поверхностей или внутренних маркеров стволовых клеток или клеток-предшественников и (f) культивирование изолированных стволовых клеток или клеток-предшественников в контролируемой среде, в которой отсутствуют питающие клетки, для получения в результате изолированной популяции клеток, обогащенной стволовыми клетками или клетками-предшественниками.
При этом одним из факторов, препятствующих использованию кардиальных клеток-предшественников, является отсутствие эффективного способа изолирования и экспандирования клеток. Таким образом, по-прежнему существует потребность в эффективном изолировании и экспансии кардиальных клеток-предшественников с целью оценки их эффективности при лечении повреждений миокарда.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам изолирования и экспандирования клеток, производных от кардиальной ткани человека. Клетки, изолированные и экспандированные в соответствии со способами, составляющими предмет настоящего изобретения, не экспрессируют теломеразу и могут использоваться для лечения или восстановления поврежденного миокарда.
Настоящее изобретение относится к очищенной популяции клеток, производных от кардиальной ткани человека, не экспрессирующих теломеразу.
Настоящее изобретение относится к способу получения клеток, производных от кардиальной ткани человека, включающему следующие стадии:
a. получение сердечной ткани;
b. диссоциация сердечной ткани;
c. обработка ферментами сердечной ткани с целью высвобождения клеток;
d. удаление кардиомиоцитов из числа высвободившихся клеток; и
e. культивирование оставшихся клеток.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения или восстановления поврежденного миокарда у пациента. Способ включает следующие стадии:
a. получение популяции клеток, производных от кардиальной ткани человека, не экспрессирующих теломеразу; и
b. введение популяции клеток, производных от кардиальной ткани человека, пациенту в количестве, достаточном для лечения или восстановления поврежденного миокарда.
В одном из вариантов осуществления изобретения клетки, производные от кардиальной ткани человека, используемые для лечения пациента, были заморожены.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
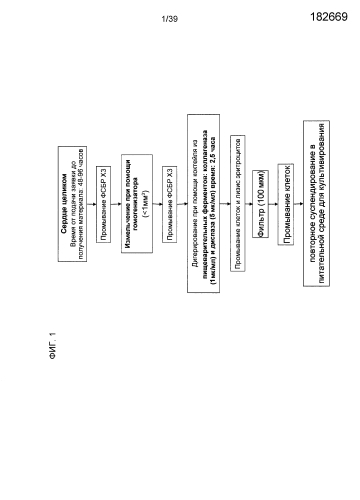
На фиг.1 в виде схемы представлена процедура изолирования клеток, составляющих предмет настоящего изобретения. Процесс получения клеточных популяций подробно описан в примере 1.
На фиг.2 в виде схемы представлен процесс изолирования клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения. Процесс получения первичных популяций клеток подробно описан в примере 1.
На фиг.3 в виде схемы представлен альтернативный способ изолирования клеток, производных от кардиальной ткани человека, составляющих предмет настоящего изобретения.
На фиг.4 показана морфология клеток, производных от кардиальной ткани человека (hCTC's), составляющих предмет настоящего изобретения. Все изображения представлены в 100X увеличении, если не указано иное. Панель a: изображение клеточной суспензии, полученной из предварительного посева клеток, полученных после первоначальной ферментации. Черная стрелка указывает на рефрактильные не прилипающие клетки S. Панель b: черная стрелка указывает на рефрактильные кластеры клеток S. Белая стрелка указывает на прилипающие клетки, полученные из первичного посева (изображения представлены в 200-кратном увеличении). На панели c показаны клетки A2, полученные из повторного посева клеточных культур S. На панели d показаны повторно высеянные рефрактильные клетки S в клеточной культуре A2.
На фиг.5 показано влияние густоты посева на потенциал роста клеток hCTC. Ось x отражает количество дней в культуре после посева клеток hCTC (A1) и hCTC (S) из замороженных пробирок. Ось y отражает аккумулятивную общую дупликацию клеток hCTC (A3).
На фиг.6 показано влияние сниженного уровня кислорода на потенциал роста клеток hCTC (A3).
На фиг.7 показан потенциал роста клеток (rCTC (A2)), производных от кардиальной ткани крысы rCTCA2. Ось x отражает количество дней в культуре после повторного посева клеток rCTC (S) из замороженных пробирок. Ось y отражает аккумулятивную общую дупликацию клеток rCTC (A2).
На фиг.8 показаны восстановление и жизнеспособность клеток hCTC (A3) после замораживания и имитации доставки при помощи потенциального устройства введения (представляющего собой иглу калибра 30). Количество восстановившихся жизнеспособных клеток обозначено слева на оси y. Жизнеспособность клеток указана справа на оси y. Закрашенные ромбы используются для обозначения жизнеспособности клетки. Квадраты без заливки обозначают клеточное восстановление. Подробности описаны в примере 6.
На фиг.9 показаны восстановление и жизнеспособность клеток rCTC (A2) после замораживания и имитации доставки при помощи потенциального устройства введения (представляющего собой иглу калибра 30). Количество восстановившихся жизнеспособных клеток обозначено слева на оси y. Жизнеспособность клеток указана справа на оси y. Закрашенные квадраты используются для обозначения восстановления клеток перед помещением в иглу. Закрашенные треугольники используются для обозначения жизнеспособности клеток перед помещением в иглу. Квадраты без заливки используются для обозначения жизнеспособности клеток после введения при помощи иглы. Треугольники без заливки используются для обозначения восстановления клеток после введения при помощи иглы. Подробности описаны в примере 6.
На фиг.10 на основании данных проточной цитометрии показана экспрессия маркера клеточной поверхности hCTC (A3). На каждой гистограмме пунктирной линией отмечен контроль изотипа антител. Сплошной линией обозначено окрашивание антигена. Антигены показаны на выделенных панелях. Ось x отражает интенсивность свечения фикоэритрина (PE) по логарифмической шкале. Ось y отражает количество клеток.
На фиг.11 приведены результаты сравнения экспрессии маркера клеточной поверхности клеток hCTC (A3) (верхняя панель) и взрослых дермальных фибробластов человека - NHDF (номер по каталогу CC-2511, Lonza, нижние панели). На каждой гистограмме ось x отражает интенсивность свечения фикоэритрина (PE) по логарифмической шкале. Ось y отражает количество клеток. Пунктирной линией показан контроль изотипа антител. Сплошной линией обозначено окрашивание антигена. Позитивная популяция селектирована на основании 1% позитивной популяции по контролю изотипа. Индивидуальные маркеры указаны на каждой гистограмме.
На фиг.12 на основании данных проточной цитометрии показана экспрессия маркера клеточной поверхности rCTC (A2). Пунктирной линией отмечен контроль изотипа. Сплошной линией обозначено окрашивание антигена CD31 (левая панель) и CD90 (правая панель).
На фиг.13 показана экспрессия кардиоспецифических генов в клетках hCTC (A3), что установлено путем количественной полимеразной цепной реакции в реальном времени (qRT-PCR). Подробное описание приведено в примере 8. Ось y отражает процентное отношение GAPDH и подразделяется на нижнюю и верхнюю шкалы. Нижняя шкала ранжируется в пределах от 0 до 0,01%, а верхняя шкала ранжируется в пределах от 0,05% до 0,15%. Значения аббревиатур: ТЦМ - тяжелая цепь миозина, кардиальный ФТ - фактор транскрипции, НЧДФ - неонатальный человеческий дермальный фибробласт, ч-сердце - сердце человека. Данные представлены в виде среднего значения ± стандартное отклонение (n=3).
На фиг.14 показана повышенная экспрессия мышиной специфической тяжелой цепи миозина (ТЦМ) в совместной культуре мышиных клеток (mCTC (A2)), производных от кардиальной ткани (А2), с крысиными неонатальными кардиомиоцитами (номер по каталогу R357-6W, Cell Application, Остин, Техас). Уровень экспрессии гена мышиной ТЦМ представлен в виде процентного содержания мышиного GAPDH в каждом образце. Ось y отражает процентное содержание мышиного GAPDH. Значения аббревиатур: mCTC - клетки mCTC (A2), выращенные в дифференцирующей среде, как описано в примере 9, КМ - кардиомиоциты, mCTC+CM-mCTC, культивированные совместно с крысиными кардиомиоцитами КМ в дифференцирующей среде. Данные представлены в виде среднего значения ± стандартное отклонение (n=3).
На фиг.15 показана кривая роста свиных клеток (pCTC (A3)), производных от кардиальной ткани (А3), культивированных по способу, описанному в примере 10. Ось x отражает время культивации после посева. Ось y отражает общее совокупное количество дупликаций в популяции.
На фиг.16 на основании данных проточной цитометрии показана экспрессия маркера клеточной поверхности pCTC (A3). Пунктирной линией показан контроль изотипа антител. Сплошной линией обозначено окрашивание антигена CD90 (верхняя левая панель), CD105 (верхняя правая панель), маркер свиных эндотелиальных клеток (нижняя левая панель), CD16 (нижняя средняя панель), CD45 (нижняя правая панель).
На фиг.17 в динамике показано кардиальное ремоделирование, следующее за острым инфарктом миокарда. Динамическое изображение воспроизведено из исследования Pfeffer M. in Atlas of heart failure (Colucci W, editor, 1999).
На фиг.18 показано влияние введения клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения, на фракцию укорочения (ФУ) у животных, у которых имел место острый инфаркт миокарда, что установлено путем эхокардиографии. Фракция укорочения представляет собой процентное изменение (ФУ%) в систолу и диастолу в каждом сердечном цикле и отражает общую функцию сердца. Данные, отражающие фракцию укорочения, записаны индивидуально у каждого животного на 5 (Д5) или 28 день (Д28) после индукции ОИМ. Животным были введены клетки rCTC (A2) или hCTC (A3), дозировка указана на шкале x.
На фиг.19 показано влияние клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения, на оценку регионарного движения стенки (ОРДС) у животных, у которых был вызван острый инфаркт миокарда, что установлено путем эхокардиографии. Каждая панель, отделенная вертикальной сплошной линией, представляет собой экспериментальную ветвь в исследовании. 5Д и 28Д соответствуют периодам 5 дней и 28 дней после возбуждения ОИМ, соответственно. ОРДС выполнялась на 5Д (исходное состояние) и 28Д (контроль при последующем наблюдении). Животным были введены клетки rCTC (A2) или hCTC (A3), дозировка указана на шкале x.
На фиг.20 показано влияние клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения, на конечный диастолический размер левого желудочка (КДРЛЖ) у животных, у которых был вызван острый инфаркт миокарда. КДРЛЖ - измерение размера левого желудочка в конце диастолы. Измерение КДРЛЖ проводилось на 5 (5Д) и 28 день (28Д) после вызывания инфаркта миокарда. Представленные данные отражают относительное изменение [(28Д-5Д)/5Д] каждого отдельного животного. Животным были введены клетки rCTC (A2) или hCTC (A3), дозировка указана на шкале x.
На фиг.21 представлен статистический анализ на основе сравнения относительного изменения КДРЛЖ в каждой экспериментальной группе. При выполнении однофакторного дисперсионного анализа (ANOVA) данных использовался F-критерий. Группа 1: носитель; группа 2: клетки rCTC (A2) 1×106 клетки (целевая доза); группа 3: клетки hCTC (A3) 1×104 клетки (целевая доза); группа 4: клетки hCTC (A3) 1×105 клетки (целевая доза); группа 5: клетки hCTC (A3) 1×106 клетки (целевая доза).
На фиг.22 показано влияние введения человеческих клеток, производных от кардиальной ткани, на конечный систолический размер левого желудочка (КСРЛЖ). КСРЛЖ - измерение размера желудочка в конце систолы каждого сердечного цикла. Каждая панель, отделенная вертикальной сплошной линией, представляет собой экспериментальную ветвь в исследовании. Измерение КСРЛЖ проводилось на 5 (5Д) и 28 день (28Д) после вызывания инфаркта миокарда. Данные, представленные в записях, относятся к одному животному в каждый момент времени. Животным были введены клетки rCTC (A2) или hCTC (A3), дозировка указана на шкале x.
На фиг.23 отражена функция сердца на 5 и 28 день после инфаркта и введения человеческих клеток, производных от кардиальной ткани; у каждого отдельного животного измерялись четыре параметра (ФУ, ОРДС, КСРЛЖ, КДРЛЖ). Каждая черная точка отражает сердечную функцию каждого отдельно взятого животного в момент времени, обозначенный на оси X. Черная сплошная линия отражает тренд изменений в период с 5Д по 28Д, отмеченных у каждого отдельно взятого животного. Каждая панель отражает один параметр, измеренный путем эхокардиографии.
На фиг.24 представлена корреляция между фракцией укорочения и дозировкой клеток, производных от кардиальной ткани. Ось Y отражает абсолютное изменение на 28 день, начиная с 5 дня после инфаркта и введения клеток (28Д-5Д). На оси X показана дозировка hCTC (A3) по линейной шкале. Данные представлены в виде среднего значения ± стандартное отклонение (n=35).
На фиг.25 представлена корреляция между КДРЛЖ и дозировкой клеток, производных от кардиальной ткани, составляющих предмет настоящего изобретения. Ось Y отражает абсолютное изменение на 28 день, начиная с 5 дня после инфаркта и введения клеток (28Д-5Д). На оси X показана дозировка hCTC (A3) по линейной шкале. Данные представлены в виде среднего значения ± стандартное отклонение (n=35).
На фиг.26 показана ретенция клеток hCTC (A3), введенных в сердце животного, перенесшего инфаркт миокарда. Ретенция оценивалась по уровню экспрессии бета-микроглобулина, отмеченному в крысиных сердцах. На панели a показана ретенция клеток hCTC (A3) в течение 4 недели после введения в дозировке, показанной на оси. На панели b показана динамика ретенции клеток hCTC (A3), где на оси x показано количество дней после введения клеток в пораженные инфарктом миокарда сердца крыс, а на оси y показано процентное отношение целевой дозировки. На панели c показана ретенция клеток hCTC (A3) в динамике по времени на основании зарегистрированного среднего значения процентного содержания клеток, при этом количество человеческих клеток, зарегистрированных непосредственно после введения, принимается за 100%. На оси x показано количество дней после введения клеток в пораженные инфарктом миокарда сердца крыс.
На фиг.27 представлена корреляция между ретенцией hCTC (A3) и профилактикой ремоделирования у крыс с инфарктом миокарда. На левой панели представлен корреляционный график. На оси x показано количество клеток на логарифмической шкале; ось y отражает изменения ремоделирования (дельта КДРЛЖ, 28Д-5Д). Количество клеток у каждого животного через 4 недели после введения и соответствующая дельта-функция КДРЛЖ отражены на графике. На правой панели приведен статистический анализ линейной регрессии.
На фиг.28 показана локализация человеческого антигена ядерного матрикса (NuMA) в миокарде крыс, которые получали лечение клетками hCTC (A3) (целевая доза - 1×106 клеток). На левой панели показано позитивное окрашивание человеческого NuMA, наблюдаемого в миокарде при целевой дозе 1×106 hCTC при 400-кратном увеличении. На правой панели показано окрашивание в среде лекарства у контрольного животного.
На фиг.29 показана локализация человеческого антигена NuMA у другого животного, получавшего целевую дозу 1×106 hCTC (A3) клеток. На верхней левой панели показано увеличенное изображение (100-кратное увеличение), где видны два кластера NuMA-положительных клеток. На верхней правой панели представлено изображение с сильным увеличением (400-кратное увеличение) кластеров NuMA-положительных клеток. На нижней левой панели представлено изображение с сильным увеличением NuMA-положительных клеточных кластеров. На нижней правой панели представлено изображение с сильным увеличением ядер NuMA-положительных клеток с миоцитоподобной морфологией.
На фиг.30 показано окрашивание контрольных антител для NuMA, присутствующих в миокарде человека и крысы. На двух изображениях сверху показано NuMA-позитивное окрашивание (левая панель) с высокой ядерной специфичностью (отсутствие окрашивания в изотипном контроле, правая панель) в сердце человека. На двух изображениях снизу показан контроль крысиных сердец, демонстрирующих специфичность NuMA-антител к человеческим клеткам.
На фиг.31 представлена оценка миокардиальной гипертрофии в группах, получавших hCTC (A3) или носитель. Целевая доза обозначена на оси y. Животные, получавшие клетки hCTC (A3), получали целевую дозу 1×104, 1×105 или 1×106 клетки. Область, закрашенная светло-серым цветом, отражает пропорцию не гипертрофированных участков в сердце в целом. Область, закрашенная темно-серым цветом, отражает пропорцию гипертрофированных участков в сердце в целом.
На фиг.32 приводится оценка размера зоны инфаркта. На левой панели показан относительный размер зоны инфаркта (процентное отношение площади зоны инфаркта к общей площади левого желудочка), на правой панели показана абсолютная площадь зоны инфаркта. Каждое животное обозначено черной точкой. Средний размер зоны инфаркта в группе обозначен сплошной черной линией.
На фиг.33 показано окрашивание плотности капилляров в группах, получавших в качестве лечения клетки hCTC (A3) или носитель. Животные, получавшие клетки hCTC (A3), получали целевую дозу 1×104, 1×105 или 1×106 клетки. На панели a показана плотность капилляров в краевой зоне инфаркта миокарда, что установлено при помощи окрашивания изолектином-B4. На панели b показана плотность капилляров в краевой зоне, что установлено при помощи окрашивания CD31.
На фиг.34 показана плотность миоцитов за пределами зоны инфаркта. На панели a показаны типичные примеры H&E окрашивания миокарда животных из группы, получавшей в качестве лечения носитель (левая панель), и животных, получавших 1×105 клетки hCTC (A3) (правая панель). На панели b показана плотность миоцитов, наблюдаемая в областях сердца за пределами зоны инфаркта, выраженная в количестве миоцитов на мм2. Данные представлены в виде среднего значения ± стандартное отклонение (n=6). На панели c показаны пролиферирующие миоциты, наблюдаемые в результате двойного окрашивания Ki-67 и тяжелой цепи миозина. Данные представлены в виде среднего значения ± стандартное отклонение (n=6).
На фиг.35 показаны дифференциально экспрессированные гены в миокарде крыс в ответ на лечение клетками hCTC (A3) во всех целевых дозах.
На фиг.36 в количественном выражении отражено влияние введения клеток hCTC и hMSC на кардиальную ткань у крыс, перенесших острый инфаркт миокарда. На панели a показано отношение площади зоны инфаркта к площади здоровой ткани на свободной стенке левого желудочка. На панели b показано ранжирование дилатации, наблюдаемой в сердцах животных во всех группах. На панели c показан жизнеспособный миокард.
На фиг.37 показано влияние введения клеток hCTC (A3) и человеческих мезенхимальных стволовых клеток (номер по каталогу PT-2501, Lonza, Уолкерсвиль, Мерилэнд) на кардиальную ткань у крыс, перенесших острый инфаркт миокарда. Для каждого животного приводятся два разреза, расположенных рядом друг с другом: один выполнен по средней линии между сосочковой мышцей и предсердиями, а второй выполнен со стороны сосочковой мышцы. Две колонки слева принадлежат испытуемым животным из группы, получавшей в качестве лечения носитель. Две колонки в центре относятся к группе, получавшей hMSC (целевая доза 1×106). Две колонки справа относятся к группе, получавшей клетки hCTC (A3) (целевая доза 1×105).
На фиг.38 показано влияние введения клеток hCTC (A3) на сердечную функцию у крыс, перенесших острый инфаркт миокарда, на 28 день после инфаркта и введения клеток. При помощи эхокардиографии измерены три параметра (ФУ, КСРЛВ, КДРЛЖ). Показано относительное изменение по сравнению с исходным состоянием (7 день после инфаркта и введения клеток) на 28 день после введения клеток и инфаркта. Представлены три партии клеток hCTC (A3) от разных доноров, человеческие фибробласты и клетки pCTC (A3).
На фиг.39 показано влияние введения клеток hCTC (A3) на сердечную функцию у крыс, перенесших острый инфаркт миокарда, на 84 день после инфаркта и введения клеток. При помощи эхокардиографии измерены три параметра (ФУ, КСРЛВ, КДРЛЖ). Показано относительное изменение по сравнению с исходным состоянием (7 день после инфаркта и введения клеток) на 84 день после введения клеток и инфаркта. В исследовании были использованы человеческие дермальные фибробласты и три различных партии клеток hCTC (A3) от разных доноров.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не для ограничения изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
ОПРЕДЕЛЕНИЯ
В рамках настоящего документа термин «поврежденный миокард» относится к клеткам миокарда, подвергшимся ишемии. Ишемия может быть вызвана инфарктом миокарда или другим сердечнососудистым заболеванием или сопутствующими заболеваниями.
Термин «острый инфаркт миокарда» в рамках настоящего документа относится к патологическому состоянию, более известному как «сердечный приступ», при котором нарушается приток крови к одному из участков сердца, вызывая гибель клеток сердца. Как правило, это является следствием окклюзии (закупорки) коронарной артерии в результате обрыва легко уязвимой атеросклеротической бляшки, которая представляет собой нестойкое скопление жиров (например, холестерола) и белых клеток крови (в особенности макрофагов) на стенке артерии. Возникающие в результате ишемия (ограничение притока крови) и нехватка кислорода без лечения в течение достаточно продолжительного периода могут привести к повреждению и (или) отмиранию мышечной ткани сердца (миокарда).
Термин «популяция hCTC (S)» или «hCTC (S)» в рамках настоящего документа относится к не прилипающей популяции человеческих клеток, производных от кардиальной ткани, полученной из первоначальной культуры клеток после диссоциации человеческой кардиальной ткани, ее ферментной обработки и фильтрации в соответствии со способами, составляющими предмет настоящего изобретения.
Термин «популяция hCTC (A1)» или «клетки hCTC (A1)» в рамках настоящего документа относится к прилипающей популяции человеческих клеток, производных от кардиальной ткани, полученной из первоначальной культуры клеток после диссоциации человеческой кардиальной ткани, ее ферментной обработки и фильтрации в соответствии со способами, составляющими предмет настоящего изобретения.
Термин «популяция hCTC (A2)» или «клетки hCTC (A2)» в рамках настоящего документа относится к популяции прилипающих клеток, полученной in vitro из культуры клеток hCTC (S).
Термин «популяция hCTC (A3)» или «клетки hCTC (A3)» в рамках настоящего документа относится к популяции прилипающих клеток, полученных in vitro из смешанной культуры клеток hCTC (S) и hCTC (A1).
Способы получения клеток, составляющих предмет настоящего изобретения
Настоящее изобретение относится к способу получения клеток, производных от кардиальной ткани человека, которые не экспрессируют теломеразу. Способ включает следующие стадии:
a. получение сердечной ткани;
b. диссоциацию сердечной ткани;
c. обработка ферментами сердечной ткани с целью высвобождения клеток;
d. удаление кардиомиоцитов из числа высвободившихся клеток; и
e. культивирование оставшихся клеток.
Сердечная ткань может быть диссоциирована вручную. В альтернативном варианте осуществления сердечная ткань может быть диссоцииро