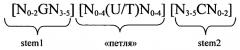Нуклеиновая кислота, содержащая или кодирующая гистоновую структуру типа "стебель-петля" и поли(а)-последовательность или сигнал полиаденилирования, для повышения экспрессии кодируемого белка
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Описана кодирующая нуклеотидная последовательность, прежде всего матричная РНК (мРНК), которая содержит или кодирует гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования. Последовательность применяется для повышения уровня экспрессии кодируемого белка. Также описано ее применение для приготовления фармацевтической композиции, прежде всего вакцины, предназначенной для применения при лечении опухолевых и раковых заболеваний, сердечно-сосудистых заболеваний, инфекционных болезней, аутоиммунных или генетических заболеваний или в генной терапии. Дополнительно описан способ транскрипции in vitro, способы in vitro для повышения уровня экспрессии белка с использованием нуклеиновой кислоты, которая содержит или кодирует гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования, и способ ex vivo и in vivo. 3 н. и 11 з.п.ф-лы, 23 ил., 15 табл., 11 пр.
Реферат
Настоящее изобретение относится к кодирующей нуклеотидной последовательности, прежде всего матричной РНК (мРНК), которая содержит или кодирует гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования, и к ее применению для повышения экспрессии кодируемого белка. В изобретении предложено также ее применение для приготовления фармацевтической композиции, прежде всего вакцины предназначенной, например, для применения при лечении опухолей и раковых заболеваний, сердечно-сосудистых заболеваний, инфекционных болезней, аутоиммунных заболеваний или генетических заболеваний, или, например, в генной терапии. Настоящее изобретение относится также к способу транскрипции in vitro, способам in vitro повышения уровня экспрессии белка с помощью нуклеиновой кислоты, которая содержит или кодирует гистоновую структуру типа «стебель-петля» и поли(A)-последовательность или сигнал полиаденилирования, и способу ex vivo и in vivo.
Помимо сердечно-сосудистых заболеваний и инфекционных болезней, опухоли и раковые заболевания представляют собой одну из наиболее часто встречающихся причин смерти в современном обществе, и в большинстве случаев их лечение и последующие меры реабилитации являются весьма дорогостоящими. Лечение опухолей и раковых заболеваний в значительной степени зависит, например, от типа имеющейся опухоли, возраста, распределения раковых клеток в организме пациента, подлежащего лечению, и т.д. Противораковую терапию в настоящее время, как правило, осуществляют с применением лучевой терапии или химиотерапии в дополнение к инвазивным операциям. Однако указанные традиционные терапии, как правило, оказывают экстраординарное стрессовое воздействие на иммунную систему, и в некоторых случаях их можно применять лишь в ограниченной степени. Кроме того, большинство этих традиционных терапий предусматривают длинные интервалы между отдельными обработками для того, чтобы дать возможность восстановиться иммунной системе.
Поэтому в последние годы было проведено изучение стратегий применения вспомогательного лечения в дополнение к указанным «традиционным методам лечения» для того, чтобы избегать или по меньшей мере снижать воздействие таких терапий на иммунную систему. Один из таких путей вспомогательного лечения включает, в частности, подходы на основе генной терапии или генетическую вакцинацию, что, как уже установлено, представляет собой весьма перспективный путь лечения или подкрепления указанных традиционных терапий.
Генная терапия и генетическая вакцинация представляют собой методы молекулярной медицины, которые уже разрешены для лечения и предупреждения заболеваний и которые, как правило, оказывают выраженное воздействие при применении в повседневной медицинской практике, в частности, при лечении упомянутых выше заболеваний. Генную терапию можно применять также в других областях медицины, например, при генетических заболеваниях, к которым относятся (наследственные) заболевания, обусловленные дефектом определенного гена, и они наследуются согласно законам Менделя. Наиболее хорошо известными примерами указанных генетических заболеваний являются среди прочего муковисцидоз (фиброзно-кистозная дегенерация) и серповидноклеточная анемия. Оба метода, т.е. генная терапия и генетическая вакцинация, основаны на интродукции нуклеиновых кислот в клетки или ткани пациента и последующем процессинге информации, кодируемой нуклеиновой кислотой, которая интродуцирована в клетки или ткани, что приводит к (белковой) экспрессии требуемых полипептидов.
Для осуществления геннотерапевтических подходов, как правило, применяют ДНК, хотя из современных разработок известно также применение РНК. Важно отметить, что во всех указанных геннотерапевтических подходах мРНК функционирует как мессенджер информации о последовательности кодируемого белка вне зависимости от того, применяют ли ДНК, вирусную РНК или мРНК.
В целом, РНК считается нестабильной молекулой: РНКазы распространены повсеместно и, как известно, их трудно инактивировать. Кроме того, РНК также являются химически более лабильными, чем ДНК. Таким образом, представляется неожиданным, что находящаяся в «нефункциональном состоянии» мРНК в эукариотической клетке отличается относительной стабильностью, и требуются специфические сигналы для усиления расщепления индивидуальных мРНК. Основной причиной этого явления, вероятно, может быть то, что расщепление мРНК в клетках катализируется практически исключительно экзонуклеазами. Однако концы эукариотической мРНК защищены от действия этих ферментов специфическими концевыми структурами и ассоциированными с ними белками: кэпом m7GpppN на 5′-конце и, как правило, poly(A)-последовательностью на 3′-конце. Таким образом, удаление указанных двух концевых модификаций оказывает влияние на ограничение скорости расщепления мРНК. Хотя стабилизирующий элемент охарактеризован в 3′ UTR мРНК альфа-глобина, последовательности РНК, влияющие на метаболизм эукариотической мРНК, как правило, действуют в качестве усилителя расщепления, как правило, посредством усиления деаденилирования (см. обзор у Meyer S., C. Temme и др., Crit Rev Biochem Mol Biol 39(4), 2004, cc.197-216.).
Как указано выше, 5′-концы эукариотических мРНК, как правило, пост-транскрипционно модифицированы таким образом, что они несут метилированную кэп-структуру, например, m7GpppN. Помимо ее участия с сплайсинге, стабилизации и транспорте РНК, кэп-структура в значительной степени усиливает рекрутмент рибосомальной 40S-субъединицы к 5′-концу мРНК в процессе инициации трансляции. Для последней функции требуется распознавание кэп-структуры эукариотическим комплексом фактора инициации eIF4F. Поли(A)-последовательность дополнительно стимулирует трансляцию путем повышенного рекрутмента 40S-субъединицы к мРНК, явление, для которого требуется вмешательство поли(A)-связывающего белка (РАВР). РАВР, в свою очередь, как установлено в последние годы, взаимодействует физически с eIF4G, являясь частью связанного с кэпом комплекса eIF4F. Это представляет собой предполагаемую модель замкнутой петли инициации трансляции на кэпированных полиаденилированных мРНК (Michel Y.M., D. Poncet и др., J Biol Chem 275(41), 2001, cc.32268-32276.).
Практически все эукариотические с мРНК несут на своем конце поли(A)-последовательность, добавление которой к их 3′-концу осуществляется с помощью повсеместно действующего механизма расщепления/полиаденилирования. Присутствие последовательности поли(A) на 3′-конце является одной из наиболее характерных особенностей эукариотических мРНК. После расщепления большинство пре-мРНК, за исключением зависящих от репликации транскриптов гистонов, приобретает полиаденилированный «хвост». В этом контексте процессинг 3′-конца представляет собой процесс ядерной котранскрипции, который усиливает транспорт мРНК из ядра в цитоплазму и влияет на стабильность и трансляцию мРНК. Образование указанного 3′-конца происходит в результате двухстадийной реакции, связанной с механизмом расщепления/полиаденилирования, и зависит от присутствия последовательностей двух элементов в мРНК-предшественниках (пре-мРНК); а именно высококонсервативного гексануклеотида AAUAAA (сигнал полиаденилирования) и расположенной в прямом направлении от него богатой G/U последовательности. На первой стадии происходит расщепление пре-мРНК между двумя указанными элементами. На второй стадии, тесно связанной с первой стадией, вновь образовавшийся 3′-конец удлиняется путем добавления поли(A)-последовательности, состоящей из 200-250 аденилатов, которые оказывают последующее влияние на все аспекты метаболизма мРНК, включая экспорт, стабильность и трансляцию мРНК (Dominski Z. и W.F. Marzluff. Gene 396(2), 2007, cc.373-390).
Единственным известным исключением из этого правила являются зависимые от репликации гистоновые мРНК, на конце которых присутствует характерная для гистонов структура типа «стебель-петля» вместо поли(A)-последовательности. Примеры последовательностей гистоновых структур типа «стебель-петля» описаны у Lopez с соавторами. (Davila Lopez М. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10, doi: 10.1261/rna.782308).
За структурами типа «стебель-петля» в гистоновых пре-мРНК, как правило, располагается богатая пуринами последовательность, известная как расположенный в прямом направлении гистоновый элемент (HDE). Указанные пре-мРНК процессируются в ядре путем одного эндонуклеолитического расщепления примерно на расстоянии 5 нуклеотидов в прямом направлении относительно структуры «стебель-петля», катализируемого мяРНП (малые ядерные нуклеопротеины) U7, посредством спаривания оснований мяРНК U7 с HDE.
В результате необходимости упаковки вновь синтезированной ДНК в хроматин, синтез гистонов регулируется в зависимости от клеточного цикла. Повышенный синтез белков гистонов в процессе S-фазы достигается путем активации транскрипции генов гистонов, а также пост-транскрипционным регулированием уровней гистоновой мРНК. Можно продемонстрировать, что гистоновая структура типа «стебель-петля» важна для всех пост-транскрипционных стадий регуляции экспрессии гистонов. Для эффективного процессинга необходим экспорт мРНК в цитоплазму, включение в полирибосомы и регуляция стабильности мРНК.
В указанном выше контексте был идентифицирован белок с молекулярной массой 32 кДа, ассоциированный с гистоновой структурой типа «стебель-петля» на 3-конце гистоновых транскриптов как в ядре, так и в цитоплазме. Уровень экспрессии указанного связывающего структуру типа «стебель-петля» белка (SLBP) регулируется клеточным циклом и является наиболее высоким во время S-фазы, когда уровни гистоновой мРНК повышены. SLBP необходим для эффективного 3′-концевого процессинга гистоновой пре-мРНК с помощью мяРНП U7. После завершения процессинга SLBP остается ассоциированным со структурой типа «стебель-петля» на конце зрелых гистоновных мРНК и стимулирует их трансляцию в гистоновые белки в цитоплазме (Dominski Z. и W.F. Marzluff, Gene 396(2), 2007, cc.373-390). Важно отметить, что РНК-связывающий домен SLBP является консервативным у многоклеточных и простейших организмов (Davila Lopez M. и Samuelsson Т., RNA, изд-во New York, N.Y., 14(1), 2008, cc.1-10. doi: 10.1261/rna.782308), и удалось продемонстрировать, что его связывание с последовательностью гистоновой структуры типа «стебель-петля» зависит от структуры типа «стебель-петля» и что минимальный сайт связывания включает по меньшей мере 3 нуклеотида, расположенных в 5′-направлении, и 2 нуклеотида, расположенных в 3′-направлении относительно структуры типа «стебель-петля» (Pandey N.В. и др., Molecular and Cellular Biology, 14(3), 1994, cc.1709-1720 и Williams A.S. и Marzluff W.F., Nucleic Acids Research, 23(4), 1995, cc.654-662.).
Хотя гистоновые гены классифицируют либо как «зависимые от репликации», которые обеспечивают получение мРНК, несущей на конце гистоновую структуру типа «стебель-петля», либо как «замещенного типа», которые обеспечивают получение мРНК, несущей вместо этого поли(A)-«хвост», в некоторых очень редких случаях в естественных условиях встречаются мРНК, которые содержат и гистоновую структуру типа «стебель-петля», и поли(A)- или олиго(A)-последовательность на их 3′-конце. Sanchez с соавторами оценили воздействие встречающихся в естественных условиях олиго(A)-«хвостов», присоединенных к 3′-концу гистоновой структуры типа «стебель-петля» гистоновой мРНК, в процессе оогенеза Xenopus с использованием люциферазы в качестве репортерного белка и установили, что олиго(A)-«хвост» представляет собой активный компонент механизма репрессии трансляции, приводящий к «молчанию» гистоновой мРНК в процессе оогенеза, и что его удаление является компонентом механизма, который активирует трансляцию гистоновых мРНК (Sanchez R. и W.F. Marzluff, Mol Cell Biol 24(6), 2004, cc.2513-2525).
Кроме того, было проведено изучение требований к регуляции зависимых от репликации гистонов на уровне процессинга пре-мРНК и стабильности мРНК с использованием искусственных конструкций, кодирующих маркерный белок альфа-глобин, с учетом преимущества, которое дает факт, что ген глобина содержит интроны в отличие от не содержащих интроны генов гистонов. Для этой цели создавали конструкции, в которых за кодирующей последовательностью альфа-глобина находился сигнал гистоновой структуры типа «стебель-петля» (за гистоновой конструкцией типа «стебель-петля» по ходу транскрипции находился элемент гистона) и сигнал полиаденилирования (Whitelaw Е. и др., Nucleic Acids Research, 14(17), 1986, cc.7059-7070; Pandey N.В. и Marzluff W.F., Molecular and Cellular Biology, 7(12), 1987, cc.4557-4559; Pandey N.В. и др., Nucleic Acids Research, 18(11), 1990, cc.3161-3170).
С использованием другого подхода Lüscher с соавторами изучали зависящую от клеточного цикла регуляцию рекомбинантного гена гистона H4. Создавали конструкции, в которых за кодирующей последовательностью H4 находился сигнал гистоновой структуры типа «стебель-петля» и сигнал полиаденилирования, два участвующих в процессинге сигнала, случайным образом разделенные кодирующей последовательностью галактокиназы (Lüscher B. и др., Proc. Natl. Acad. Sci. USA, 82(13), 1985, cc.4389-4393).
Кроме того, Stauber с соавторами идентифицировали минимальную последовательность, требуемую для обеспечения зависящей от клеточного цикла регуляции уровней мРНК гистона H4. Для этих исследований использовали конструкции, содержащие кодирующую последовательность маркера для селекции, представлявшего собой ксантин: гуанинфосфорибозилтрансферазу (GPT), расположенную перед сигналом гистоновой структуры типа «стебель-петля», за которым находился сигнал полиаденилирования (Stauber C. и др., ЕМВО J, 5(12), 1986, cc.3297-3303).
Изучение процессинга гистоновой пре-мРНК позволило Wagner с соавторами идентифицировать факторы, необходимые для расщепления гистоновой пре-мРНК, с использованием репортерной конструкции, помещая EGFP между сигналом гистоновой конструкции типа «стебель-петля» и сигналом полиаденилирования, в результате чего экспрессия EGFP имела место только в случае нарушения процессинга гистоновой пре-мРНК (Wagner Е.J. и др., Mol Cell 28(4), 2007, cc.692-699).
Следует отметить, что для трансляции полиаденилированной мРНК, как правило, требуется, чтобы 3′-поли(A)-последовательность находилась в непосредственной близости от 5′-концевого кэпа. Это опосредуется белок-белковым взаимодействием между поли(A)-связывающим белком и эукариотическим фактором инициации eIF4G. Касательно зависимых от репликации гистоновых мРНК обнаружен аналогичный механизм. В этом контексте Gallie с соавторами продемонстрировали, что гистоновая конструкция типа «стебель-петля» функционально сходна с последовательностью поли(A) в том плане, что она повышает эффективность трансляции и дополнительно зависит от 5′-кэпа для обеспечения эффективного уровня трансляции. Эти авторы продемонстрировали, что гистоновая конструкция типа «стебель-петля» является достаточным и необходимым фактором повышения трансляции репортерной мРНК в трансфектированных клетках яичника китайского хомячка, но для оптимальной функциональной активности должна находиться на 3′-конце. Таким образом, аналогично поли(A)-«хвосту» других мРНК 3′-конец указанных гистоновых мРНК, вероятно, имеет решающее значение для трансляции in vivo и является функциональным аналогом поли(A)-«хвоста» (Gallic D.R., Lewis N.J. и Marzluff W.F., Nucleic Acids Research, 24(10), 1996, cc.1954-1962).
Кроме того, можно продемонстрировать, что SLBP связывается с цитоплазматической гистоновой мРНК и требуется для ее трансляции. Даже с учетом того, что SLBP не взаимодействует непосредственно с eIF4G, домен, необходимый для трансляции гистоновой мРНК, взаимодействует с недавно идентифицированным белком SLIP1. На следующей стадии SLIP1 взаимодействует с eIF4G и обеспечивает циркуляризацию гистоновой мРНК и поддерживает эффективную трансляцию гистоновой мРНК с помощью механизма, сходного с трансляцией полиаденилированных мРНК.
Как указано выше, в подходах генной терапии, как правило, используют ДНК для переноса кодирующей информации в клетку, в которой она затем транскрибируется в мРНК, которая несет встречающиеся в естественных условиях мРНК, прежде всего структуру 5′-кэпа и 3′-поли(A)-последовательность, для гарантии экспрессии кодируемого терапевтического белка.
Однако во многих случаях системы экспрессии, основанные на интродукции указанных нуклеиновых кислот в клетки или ткань пациента, и последующей экспрессии требуемых полипептидов, кодируемых этими нуклеиновыми кислотам, не обеспечивают желаемый или даже необходимый уровень экспрессии, позволяющи эффективную терапию, вне зависимости от того, применяют ли ДНК или РНК.
Как известно из существующего уровня техники, предпринимались различные попытки повысить выход экспрессии кодируемого белка, в частности, путем применения улучшенных систем экспрессии in vitro и/или in vivo. Методы повышения уровня экспрессии, которые описаны в целом и известны из существующего уровня техники, как правило, основаны на применении экспрессионных векторов или кассет, содержащих специфические промоторы и соответствующие регуляторные элементы. Поскольку указанные экспрессионные векторы или кассеты, как правило, ограничены конкретными клеточными системами, эти экспрессионные системы требуется адаптировать для применения в других клеточных системах. Затем указанными адаптированными экспрессионными векторами или кассетами, как правило, трансфектируют клетки и, как правило, обрабатывают в зависимости от конкретной клеточной линии. Таким образом, предпочтение отдается прежде всего тем молекулам нуклеиновых кислот, которые могут обеспечивать экспрессию кодируемых белков в клетке-мишени системами, присущими клетке, вне зависимости от промоторов и регуляторных элементов, которые являются специфичными для конкретных типов клеток. В этом контексте можно различать элементы, стабилизирующие мРНК, и элементы, которые повышают эффективность трансляции мРНК.
мРНК, имеющие оптимизированную кодирующую последовательность, и пригодные в целом для указанной цели, описаны в заявке WO 02/098443 (фирма CureVac GmbH). Например, в WO 02/098443 описаны мРНК, стабилизированные в обычной форме и оптимизированные для трансляции их кодирующих областей. В WO 02/098443 описан также метод выявления модификаций последовательности. В WO 02/098443 описаны также возможности замены нуклеотидов аденина и урацила в последовательностях мРНК с целью повышения содержания гуанина/цитозина (G/C) в последовательностях. Согласно WO 02/098443 указанные замены и адаптации, направленные на повышение содержания G/C, можно применять в генной терапии, а также в генетических вакцинах при лечение рака или инфекционных болезней. В этом контексте в WO 02/098443 в целом предложены последовательности, представляющие собой базовые последовательности для таких модификаций, при этом модифицированная мРНК кодирует по меньшей мере один биологически активный пептид или полипептид, который, например, не транслируется вообще в организме пациента, подлежащего лечению, либо транслируется несоответствующим образом, либо с дефектами. Альтернативно этому, в WO 02/098443 предложены мРНК, кодирующие антигены, например, опухолевые антигены или вирусные антигены, в качестве базовой последовательности для указанных модификаций.
В качестве другого подхода к повышению уровня экспрессии кодируемого белка в заявке WO 2007/036366 описано положительное влияние длинных поли(A)-последовательностей (прежде всего, превышающих по длине 120 пар оснований) и комбинации по меньшей мере двух 3′-нетранслируемых областей гена бета-глобина на стабильность и трансляционную активность мРНК.
Однако даже с учетом того, во всех последних приведенных в качестве прототипов документах уже предпринята попытка создать обладающие высокой эффективностью инструменты для геннотерапевтических подходов и дополнительно повысить стабильность и трансляционную активность мРНК, все еще сохраняется проблема, связанная с более низкой, как правило, стабильностью вариантов, основанных на использовании РНК, по сравнению с вакцинами на основе ДНК и геннотерапевтическими подходами на основе ДНК. Таким образом, в данной области все еще сохраняется потребность в улучшенных инструментах, применяемых для генной терапии и генетической вакцинации или в качестве вспомогательной терапии при осуществлении общепринятых методов лечения, указанных выше, которые позволяют улучшить обеспечение кодируемыми белками in vivo, например, посредством дополнительного повышения стабильности и/или трансляционной активности мРНК, предпочтительно для генной терапии.
Таким образом, в основу настоящего изобретения была положена задача разработать дополнительные и/или альтернативные способы повышения уровня экспрессии кодируемого белка, предпочтительно посредством стабилизации мРНК и/или повышения трансляционной эффективности указанной мРНК в отношении таких нуклеиновых кислот, для которых из существующего уровня техники известна возможность применения в терапии (например, генной терапии и генетической вакцинации).
Указанная задача решается с помощью объекта изобретения, представленного в прилагаемой формуле изобретения. В частности, задача, положенная в основу настоящего изобретения, решается с помощью предлагаемой в изобретении нуклеотидной последовательности, представляющей собой первый вариант осуществления изобретения, которая содержит или кодирует
а) кодирующую область, которая предпочтительно кодирует пептид или белок;
б) по меньшей мере одну гистоновую структуру типа «стебель-петля» и
в) необязательно поли(A)-последовательность или сигнал полиаденилирования,
которая предпочтительно предназначена для повышения уровня экспрессии кодируемого белка, где кодируемый белок предпочтительно не представляет собой ни гистоновый белок, ни репортерный белок (например, люциферазу, GFP, EGFP, β-галактозидазу, прежде всего EGFP) и ни маркерный белок или белок для селекции (например, альфа-глобин, галактокиназу и ксантин: гуанинфосфорибозилтрансферазу (GPT)).
В этом контексте согласно первому варианту осуществления настоящего изобретения предлагаемую в изобретении нуклеиновую кислоту получают по меньшей мере частично путем синтеза ДНК или РНК, или она представляет собой выделенную нуклеиновую кислоту.
В основу настоящего изобретения положен неожиданно установленный при создании изобретения факт, что комбинация поли(A)-последовательности или сигнала полиаденилирования и по меньшей мере одной гистоновой структуры типа «стебель-петля», даже хотя они представляют собой различные по своей природе механизмы, обладает синергетическим действием, поскольку указанная комбинация приводит к повышению уровня экспрессии белка до уровня, многократно превышающего тот, который достигается при индивидуальном применении любого из указанных элементов. Установлено, что синергетическое действие комбинации поли(A) и по меньшей мере одной гистоновой структуры типа «стебель-петля» не зависит от порядка расположения поли(A) и гистоновой структуры типа «стебель-петля» и не зависит от длины поли(A)-последовательности.
Таким образом, наиболее предпочтительной является предлагаемая в изобретении молекула нуклеиновой кислоты, которая содержит или кодирует а) кодирующую область, которая предпочтительно кодирует пептид или белок; б) по меньшей мере одну гистоновую структуру типа «стебель-петля» и в) последовательность поли(A) или последовательность полиаденилирования; предпочтительно предназначенная для повышения уровня экспрессии кодируемого белка, где кодируемый белок предпочтительно не представляет собой ни гистоновый белок, ни репортерный белок (например, люциферазу, GFP, EGFP, β-галактозидазу, прежде всего EGFP) и/или ни маркерный белок или белок для селекции (например, альфа-глобин, галактокиназу и ксантин: гуанинфосфорибозилтрансферазу (GPT)))
Согласно дополнительному альтернативному аспекту первого варианта осуществления настоящего изобретения предлагаемая в изобретении нуклеиновая кислота не содержит расположенный в прямом направлении гистоновый элемент (HDE).
В этом контексте наиболее предпочтительной является предлагаемая в изобретении нуклеиновая кислота, которая содержит или кодирует в направлении 5′→3′:
а) кодирующую область, предпочтительно кодирующую пептид или белок,
б) по меньшей мере одну гистоновую структуру типа «стебель-петля», необязательно без расположенного в прямом направлении гистонового элемента в 3′-области относительно гистоновой структуры типа «стебель-петля»,
в) поли(A)-последовательность или сигнал полиаденилирования.
Понятие «расположенный в прямом направлении гистоновый элемент (HDE)» относится к богатому пуринами состоящему примерно из 15-20 нуклеотидов полинуклеотидному сегменту, расположенному в 3′-направлении относительно встречающихся в естественных условиях структур типа «стебель-петля», который представляет собой сайт связывания для мяРНК U7, участвующей в процессинге гистоновой пре-мРНК в зрелую гистоновую мРНК. Например, у морских ежей HDE представляет собой CAAGAAAGA (Dominski Z. и W.F. Marzluff, Gene 396(2), 2007, cc.373-390).
Кроме того, согласно первому варианту осуществления настоящего изобретения предлагаемая в изобретении нуклеиновая кислота предпочтительно не содержит интрон.
Согласно другому наиболее предпочтительному варианту осуществления настоящего изобретения предлагаемая в изобретении нуклеотидная последовательность, представляющая собой первый вариант осуществления настоящего изобретения, содержит или кодирует в направлении 5′→3′:
а) кодирующую область, предпочтительно кодирующую пептид или белок;
б) поли(A)-последовательность; и
в) по меньшей мере одну гистоновую структуру типа «стебель-петля».
Предлагаемая в изобретении нуклеотидная последовательность, представляющая собой первый вариант осуществления настоящего изобретения, содержит любую приемлемую нуклеиновую кислоту, выбранную например, из любой (одноцепочечной или двухцепочечной) ДНК, включая предпочтительно (но, не ограничиваясь только ими), например, геномную ДНК, одноцепочечные молекулы ДНК, двухцепочечные молекулы ДНК, или ее можно выбирать, например, из любой из ПНК (пептидная нуклеиновая кислота), или ее можно выбирать, например, из любой (одноцепочечной или двухцепочечной) РНК, предпочтительно матричной РНК (мРНК) и т.д. Предлагаемая в изобретении молекула нуклеиновой кислоты может содержать также вирусную РНК (вРНК). Однако предлагаемая в изобретении нуклеотидная последовательность может не представлять собой вирусную РНК или может не содержать вирусную РНК. Более конкретно, предлагаемая в изобретении нуклеотидная последовательность может не содержать элементы вирусной последовательности, например, вирусные энхансеры или вирусные промоторы (например, не содержит инактивированные элементы вирусного промотора или вирусной последовательности, более конкретно, не инактивированные с помощью основанных на замене стратегий), или другие элементы вирусной последовательности или вирусные или ретровирусные нуклеотидные последовательности. Более конкретно, предлагаемая в изобретении нуклеотидная последовательность может не представлять собой ретровирусный или вирусный вектор или модифицированный ретровирусный или вирусный вектор.
В любом случае предлагаемая в изобретении нуклеотидная последовательность может содержать энхансерную и/или промоторную последовательность, которая может быть модифицирована или не модифицирована или которая может быть активирована или не активирована, или может не содержать указанные последовательности. Энхансер и/или промотор могут экспрессироваться или не экспрессироваться в растениях и/или могут экспрессироваться или не экспрессироваться в эукариотических организмах, и/или могут экспрессироваться или не экспрессироваться в прокариотических организмах. Предлагаемая в изобретении молекула нуклеиновой кислоты может содержать последовательность, кодирующую (обладающий способностью к автономному сплайсингу) рибозим, или не содержать указанную последовательность.
Предпочтительно предлагаемая в изобретении молекула нуклеиновой кислоты представляет собой РНК.
Согласно конкретным аспектам первого варианта осуществления настоящего изобретения предлагаемая в изобретении нуклеиновая кислота представляет собой нуклеотидную последовательность, которая входит в состав нуклеиновой кислоты, пригодной для транскрипции in vitro, прежде всего в соответствующем векторе для транскрипции in vitro (например, в плазмиде или линейной нуклеотидной последовательности, которая содержит специфические промоторы для транскрипции in vitro, такие как промоторы T3, T7 или Sp6).
Согласно другим наиболее предпочтительным аспектам первого варианта осуществления настоящего изобретения предлагаемая в изобретении нуклеиновая кислота входит в состав нуклеиновой кислоты, пригодной для транскрипции и/или трансляции в экспрессионной системе (например, в экспрессионном векторе или плазмиде), прежде всего в прокариотической (например, бактериальной типа Е. coli) или эукариотической (например, в клетках млекопитающего, таких как CHO-клетки, клетках дрожжей или клетках насекомых или в целых организмах, таких как растения или животные) экспрессионной системе.
Понятие «экспрессионная система» относится к системе (клеточная культура или целые организмы), которая пригодна для производства пептидов, белков или РНК, прежде всего мРНК.
Предлагаемая в изобретении нуклеотидная последовательность, представляющая собой первый вариант осуществления настоящего изобретения, содержит или кодирует по меньшей мере одну гистоновую структуру типа «стебель-петля». В контексте настоящего изобретения указанную гистоновую структуру типа «стебель-петля», как правило, выводят из генов гистонов, и она содержит внутримолекулярные спаривающиеся основания двух соседних полностью или частично обратно комплементарных последовательностей, которые образуют таким образом конструкцию типа «стебель-петля». Конструкция типа «стебель-петля» может находиться в одноцепочечной ДНК или, что является наиболее распространенным, в РНК. Эту структуру называют также «шпилькой» или «шпилечной петлей», и она, как правило, состоит из стебля и (концевой) петли в непрерывной последовательности, при этом «стебель» образован двумя соседними полностью или частично обратно комплементарными последовательностями, которые разделены короткой последовательностью типа спейсера, образуя петлю структуры типа «стебель-петля». Две соседние полностью или частично обратно комплементарные последовательности можно обозначать, например, как элементы stem1 и stem2 структуры типа «стебель-петля». Структура типа «стебель-петля»» образуется в том случае, когда эти две соседние полностью или частично обратно комплементарные последовательности, например, элементы stem1 и stem2 структуры типа «стебель-петля», образуют пары оснований друг с другом, что приводит к созданию двухцепочечной нуклеотидной последовательности, содержащей неспаренную петлю в концевой области, которая состоит из короткой последовательности, локализованной между элементами stem1 и stem2 структуры типа «стебель-петля» на непрерывной последовательности. Таким образом, неспаренная петля, как правило, представляет собой область нуклеиновой кислоты, которая не обладает способностью к спариванию оснований с любым из указанных элементов структуры типа «стебель-петля». Образовавшаяся имеющая форму «леденца на палочке» структура представляет собой основной конструктивный элемент многих вторичных структур РНК. Таким образом, образование структуры типа «стебель-петля» зависит от стабильности образовавшихся областей «стебля» и «петли», при этом первой предпосылкой является, как правило, присутствие последовательности, которая может обладать способностью к обратной укладке на самой себе с формированием спаренной двойной цепи. Стабильность спаренных элементов структуры типа «стебель-петля» определяется длиной, количеством мисмэтчей или выпуклостей, которые она содержит (небольшое количество мисмэтчей, как правило, является допустимым, прежде всего в случае длинной двойной цепи) и составом оснований спаренной области. В контексте настоящего изобретения оптимальная длина петли составляет 3-10 оснований, более предпочтительно 3-8, 3-7, 3-6 или еще более предпочтительно 4-5 оснований и наиболее предпочтительно 4 основания.
Согласно настоящему изобретению последовательность гистоновой структуры типа «стебель-петля», которая представляет собой компонент (б) по п.1 формулы изобретения, можно получать не из мышинного гистонового белка. Более конкретно, последовательность гистоновой структуры типа «стебель-петля» можно получать не из мышиного гена гистона H2A614. Кроме того, нуклеиновая кислота, предлагаемая в изобретении, может не содержать ни мышиной последовательности гистоновой структуры типа «стебель-петля», ни мышиного гена гистона H2A614. Кроме того, предлагаемая в изобретении нуклеотидная последовательность может не содержать сигнал процессинга структуры типа «стебель-петля», более конкретно сигнал процессинга мышиного гистона и наиболее конкретно может не содержать сигнал процессинга структуры типа «стебель-петля» H2kA614. Кроме того, предлагаемая в изобретении молекула нуклеиновой кислоты может содержать по меньшей мере один ген гистона млекопитающих. Однако по меньшей мере один ген гистона млекопитающих может не иметь последовательность, представленную в SEQ ID NO: 7 в WO 01/12824.
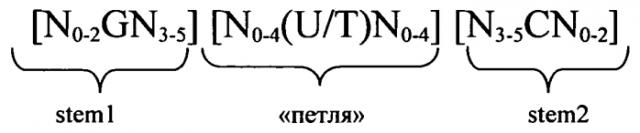
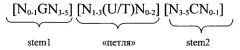
Согласно одному из предпочтительных аспектов первого варианта осуществления изобретения предлагаемая в изобретении нуклеотидная последовательность содержит или кодирует по меньшей мере одну последовательность гистоновой структуры типа «стебель-петля», предпочтительно соответствующую по меньшей мере одной из следующих формул (I) или (II):
формула (I) (последовательность структуры типа «стебель-петля» без пограничных элементов «стебля»):
формула (II) (последовательность структуры типа «стебель-петля» с пограничными элементами):
в которых:
пограничные элементы stem1 или stem2 N1-6 обозначают непрерывную последовательность, состоящую из 1 -6, предпочтительно 2-6, более предпочтительно 2-5, еще более предпочтительно 3-5, наиболее предпочтительно 4-5 или 5 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, Т, G и C или их нуклеотидного аналога;
stem1 [N0-2GN3-5] обозначает последовательность, обратно комплементарную или частично обратно комплементарную элементу stem2, и представляет собой непрерывную последовательность, состоящую из 5-7 нуклеотидов;
в которой N0-2 обозначает непрерывную последовательность, состоящую из 0-2, предпочтительно 0-1, более предпочтительно 1 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, T, G и C или его нуклеотидного аналога;
в которой N3-5 обозначает непрерывную последовательность, состоящую из 3-5, предпочтительно 4-5, более предпочтительно 4 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, T, G и C или его нуклеотидного аналога, и в которой G обозначает гуанозин или его аналог и необязательно может быть заменен на цитидин или его аналог при условии, что комплементарный ему нуклеотид цитидин в stem2 заменен на гуанозин;
последовательность «петли» [N0-4(U/T)N0-4] локализована между элементами stem1 и stem2 и обозначает непрерывную последовательность, состоящую из 3-5 нуклеотидов, более предпочтительно 4 нуклеотидов;
в которой N0-4 каждый независимо друг от друга обозначает непрерывную последовательность, состоящую из 0-4, предпочтительно 1-3, более предпочтительно 1-2 N, где N каждый независимо друг от друга выбран из нуклеотида, выбранного из A, U, T, G и C или его нуклеотидного аналога; и
в которой U/T обозначает уридин или необязательно тимидин;
stem2 [N3-5CN0-2] обозначает последовательность, обратно комплементарную или частично обратно комплементарную элементу stem1, и представляет собой непрерывную последовательность, состоящую из 5-7 нуклеотидов;
в которой N3-5 обозначает непрерывную последовательность, состоящую из 3-5, предпочтительно 4-5, более предпочтительно 4 N, где N каждый независимо д