Ингибиторы faah периферически-ограниченного действия
Иллюстрации
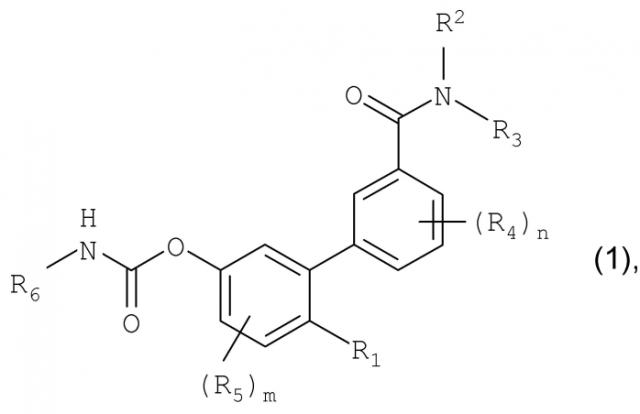
Показать всеИзобретение относится к соединению формулы (1), где R1 выбирают из группы, состоящей из гидроксигруппы и ее физиологически гидролизуемых сложных эфиров и -NR8R9, где R8 и R9 независимо выбирают из группы, состоящей из водорода и незамещенного (С1-С3)алкила; R2 и R3 независимо выбирают из группы, состоящей из водорода или незамещенного (С1-С3)алкила; каждый из R4 независимо выбирают из группы, состоящей из галогена и незамещенного (С1-С3)алкила, а n представляет собой целое число от 0 до 4; каждый из R5 независимо выбирают из группы, состоящей из галогена и незамещенного (С1-С3)алкила, a m представляет собой целое число от 0 до 3; R6 представляет собой незамещенный циклогексил или циклогексил, замещенный (С1-С6)алкилом, галогеном или трифторметилом; и его фармацевтически приемлемые соли. Соединения предназначены для изготовления фармацевтической композиции или лекарственного средства для ингибирования FAAH у нуждающегося в этом млекопитающего, где млекопитающее нуждается в лечении боли, воспалительного расстройства или нуждается в лечении для ускоренного заживления ран. Соединения также предназначены для повышения периферического уровня анандамида, олеоилэтаноламида (OEA), палмитилэтаноламида (PEA) или стеароилэтаноламида (SEA) у нуждающегося в этом млекопитающего. Технический результат - ингибиторы FAAH периферически-ограниченного действия. 8 н. и 20 з.п. ф-лы, 2 табл., 29 ил.
(1)
Реферат
Перекрестные ссылки на родственные заявки
Для настоящего изобретения испрашивается приоритет по Предварительной Заявке США No. 61/368500 от 28 июля 2010 года, содержание которой в полном объеме и для всех целей включено в настоящее описание посредством ссылки.
Это изобретение было создано при поддержке правительства США по грантам No. DA012413, DA012447 и АА017538, полученным национальным Институтом Здравоохранения США. Правительство США обладает определенными правами на настоящее изобретение.
Уровень техники
Периферические каннабиноидные рецепторы осуществляют мощный ингибирующий контроль над возникновением болевых ощущений, однако конкретный эндогенный каннабиноидный сигнал, который обычно запускает этот внутренний анальгетический механизм, все еще неизвестен. Чтобы ответить на этот вопрос, авторы изобретения разработали периферический ингибитор гидролазы амидов жирных кислот (FAAH), фермента, ответственного за деградацию эндоканнабиноида анандамида. Соединение под названием URB937 подавляет активность FAAH и повышает уровень анандамида за пределами центральной нервной системы (ЦНС). Несмотря на неспособность URB937 попасть в мозг и спинной мозг, это соединение ослабляет поведенческую реакцию, характерную для постоянной боли, в моделях воспаления и поражения периферических нервов на грызунах, а также подавляет вызванную вредоносным стимулом нейронную активацию в областях спинного мозга, вовлеченных в обработку болевого сигнала. Блокада CB1-рецептора нивелирует эти эффекты. Эти результаты позволяют предположить, что анандамид-опосредованная передача сигналов на периферических CB1-рецепторах контролирует передачу информации о боли в ЦНС. Неспособные проникать в мозг ингибиторы FAAH, усиливающие данный механизм, представляют собой новый способ терапии боли.
Анандамид, природный амид арахидоновой кислоты и этаноламина, обладает всеми ключевыми свойствами эндогенного каннабиноидного вещества (Devane, W.A. et al. Science, 258, 1946-1949 (1992)): он высвобождается стимулированными нейронами при необходимости (Di Marzo, V. et al., Nature, 372, 686-691 (1994); Giuffrida, A. et al., Nat. Neurosci., 2, 358-363 (1999)); он активирует каннабиноидные рецепторы с высокой аффинностью (Devane, W.A. et al. Science, 258, 1946-1949 (1992)) и он быстро выводится посредством двухстадийного процесса, состоящего из транспорта, опосредуемого переносчиком, и последующего внутриклеточного гидролиза (Di Marzo, V. et al., Nature, 372, 686-691 (1994); Beltramo, M. et al., FEBS Lett, 403, 263-267 (1997)). Гидролиз анандамида катализируется ферментом гидролазой амидов жирных кислот (FAAH), мембранно-связанной сериновой гидролазой (Cravatt, B.F. et al., Nature, 384, 83-87 (1996); Patricelli, M.P. et al., Biochemistry, 38, 9804-9812 (1999)) (WO 98/20119) (Патент США No. 6271015), которая также расщепляет другие биоактивные жирные этаноламиды, такие как олеоилэтаноламид (цис-9-октадеценамид)) (Rodriguez de Fonseca, F. et al. Nature, 414, 209-212 (2001)) и палмитоилэтаноламид (Calignano, A. et al., Nature, 394, 277-281 (1998)). Мутантные мыши, не имеющие гена, кодирующего FAAH, не могут метаболизировать анандамид (Cravatt, B.F. et al., Proc. Natl. Acad. Sci. U.S.A., 98, 9371-9376 (2001)) и, несмотря на фертильность и общую нормальность, демонстрируют признаки повышенной активности анандамида на каннабиноидных рецепторах, такие как пониженная чувствительность к боли (Cravatt, B.F. et al., Proc. Natl. Acad. Sci. U.S.A., 98, 9371-9376 (2001)). Это позволяет предположить возможность того, что лекарственные средства, нацеленные на FAAH, могут усиливать местное действие анандамида, и при этом, возможно, позволяют избежать множества зачастую нежелательных эффектов, сопровождающих использование Δ9-ТНС и других антагонистов каннабиноидов прямого действия (Hall, W., et al., Lancet, 352, 1611-1616 (1998); Chaperon, F., et al., Crit. Rev. Neurobiol, 13, 243-281 (1999)).
Ощущение боли может эффективно контролироваться нейромедиаторами, которые функционируют внутри ЦНС. Эта модуляция была хорошо охарактеризована в заднем роге спинного мозга, где обрабатываются импульсы, переносимые ноцицептивными (болечувствительными) волокнами перед тем, как они передаются в мозг. В дополнение к этим основным механизмам, может осуществляться внутренний контроль передачи боли на концах афферентного нервного волокна вне ЦНС.Один из известных примеров периферической регуляции представлен эндогенными опиоидами, которые высвобождаются из активированных иммунных клеток во время воспаления и ингибируют инициацию боли путем взаимодействия с опиоидными рецепторами, локализованными на чувствительных нервных окончаниях1,2.
Предполагается, что эндоканнабиноидные медиаторы могут выполнять функцию, аналогичную функции опиоидов, так как фармакологическая активация периферических каннабиноидных рецепторов CB1 и CB2 ингибирует связанную с болью поведенческую реакцию3-7, в то время как генетическое нарушение экспрессии рецептора CB1 в первичных ноцицептивных нейронах обостряет такую реакцию8. Кроме того, есть данные, из которых следует, что клинические состояния, ассоциированные с невропатической болью или воспалением, такой как комплексный регионарный болевой синдром и артрит, могут сопровождаться периферическими повышениями уровня эндоканнабиноида анандамида9,10. Полагают, что другой важный эндоканнабиноид-лиганд, 2-арахидоноилглицерин (2-AG), также вовлечен в ноцицептивную передачу сигналов вне ЦНС8,11.
Огромное внимание уделяется роли анандамида в болевых ощущениях. Методы лечения боли посредством введения анандамида и палмитоиланандамида раскрыты в публикации патентной заявки США No.: 20020173550. Методы лечения боли путем введения ингибиторов FAAH раскрыты в публикациях патентных заявок США No. 20040127518 и 20030134894. Способы лечения боли путем введения ингибиторов транспорта анандамида раскрыты в публикации патентной заявки США No. 20030149082.
Хотя эти сведения намекают на то, что эндоканнабиноидная система выполняет важную функцию в периферической регуляции ноцицепции, они не дают однозначного представления о природе эндогенного лиганда или лигандов, вовлеченных в данную функцию. При этом устранение этого пробела является необходимым для получения представления о внутренних механизмах, которые контролируют возникновение боли на молекулярном уровне, а также для обнаружения новых обезболивающих средств, лишенных основных побочных эффектов. В настоящем исследовании для более подробного изучения функций периферического анандамида и раскрытия его возможной роли в контроле появления болевых сигналов авторами был идентифицирован и охарактеризован не проникающий в мозг ингибитор фермента деградации анандамида, FAAH12. Особо важной при разработке терапевтического применения ингибиторов FAAH является их способность модулировать действие эндогенных каннабиноидных систем внутри ЦНС, вызывающих нежелательные психотропные или седативные эффекты.
Настоящее изобретение направлено на решение этих и других потребностей, для чего предлагаются ингибиторы FAAH периферически-ограниченного действия, а также способ их применения для лечения разнообразных состояний, включающих боль и/или воспаление.
Раскрытие изобретения
В первом аспекте изобретения описываются соединения и фармацевтические композиции, имеющие следующую формулу:
,
в которой R1 выбирают из группы, состоящей из гидроксигруппы и ее физиологически гидролизуемых сложных эфиров, -SH, -o-карбоксамидо, -OC(O)R7, -О-CO-NR8R9 и -NR8R9, где R7 представляет собой замещенный или незамещенный гидрокарбил, a R8 и R9 независимо выбирают из группы, состоящей из водорода и (C1-C3)алкила; R2 и R3 независимо выбирают из группы, состоящей из водорода и гидрокарбила; каждый R4 независимо выбирают из группы, состоящей из галогена и гидрокарбила, а n представляет собой целое число от 0 до 4; каждый R5 независимо выбирают из группы, состоящей из галогена или гидрокарбила, a m представляет собой целое число от 0 до 3; и R6 представляет собой замещенный или незамещенный циклогексил; а также их фармацевтически приемлемые соли. В предпочтительных воплощениях распределение этих соединений в реципиенте ограничено периферическими областями.
Во втором аспекте изобретения описываются фармацевтические композиции, включающие терапевтически эффективное количество соединений по изобретению. Композиции могут быть включены в состав, предназначенный для введения любым подходящим образом, включая пероральный и парентеральный пути введения. Кроме того, композиции могут иметь вид единичной лекарственной дозировки.
В третьем аспекте изобретения описывается способ лечения пациента, нуждающегося в ингибиторе FAAH периферически-ограниченного действия (например, соединении-ингибиторе FAAH по изобретению). В предпочтительных воплощениях пациентом является человек. В некоторых воплощениях необходимость связана с лечением боли, воспаления или иммунного расстройства у пациента. В некоторых воплощениях боль может быть ноцицептивной, воспалительной или невропатической болью. В предпочтительном варианте соединение-ингибир FAAH периферически-ограниченного действия представляет собой соединение по изобретению.
В четвертом аспекте изобретения описывается способ повышения периферической активности эндогенно вырабатываемого (т.е. эндоканнабиноида, такого как анандамид, N-арахидоноил допамин) или поступающего извне каннабиноидного амида жирной кислоты у пациента путем введения соединения по изобретению. В предпочтительном варианте амидом жирной кислоты является анандамин, N-арахидоноил допамин, олеоилэтаноламид, стеароилэтаноламид или палмитоилэтаноламид. В случае, когда этаноламид жирной кислоты поступает извне, он может вводиться пациенту перед, после или одновременно с введением соединения по изобретению. В некоторых воплощениях пациент нуждается в лечении боли, воспаления или иммунного расстройства. В предпочтительных воплощениях боль может быть ноцицептивной, воспалительной или невропатической болью.
В пятом аспекте изобретения описываются способы скрининга соединений на предмет их способности к вытеснению из мозга транспортной системой белка устойчивости к раку молочной железы (BCRP). Структуры, аналогичные URB937, и соединения по изобретению могут служить в качестве субстратов для BCRP. Соответственно, в некоторых воплощениях в изобретении описываются способы анализа аналога URB937 и/или соединений по изобретению на основе их способности транспортироваться транспортной системой BCRP in vitro.
Краткое описание чертежей
Фиг.1 URB937 представляет собой ингибитор FAAH периферически-ограниченного действия, (a) Активность FAAH в печени (закрашенные круги) и в мозге (закрашенные квадраты) через 1 ч после введения различных доз URB937 (0,03-100 мг-кг-1, подкожно) у мышей Swiss, (b) Распределение URB937 в печени (закрашенные круги), в мозге (закрашенные квадраты) и в сыворотке (вставка) после однократной инъекции мышам (1 мг-кг-1, внутрибрюшинно). (с) Зависимость ингибирования активности FAAH в печени (закрашенные круги) или в мозге (закрашенные квадраты) от времени после введения URB937 (1 мг-кг-1, внутрибрюшинно). (d) Воздействие URB937 (1 мг-кг-1, внутрибрюшинно, закрашенные столбцы) или пустого носителя (незакрашенные столбцы) на уровень анандамида и пальмитоилэтаноламида (PEA) в печени, в переднем мозге и в гипоталамусе мышей Swiss, (e) Воздействие URB937 на уровень анандамида и PEA в печени мышей С57 В1/6 дикого типа (+/+) и FAAH-дефицитных мышей (-/-). (f) Отсутствие влияния URB937 (1 мг-кг-1, внутрибрюшинно, закрашенные столбцы) на уровень 2-арахидоноилглицерина (2-AG) в мышах Swiss. Результаты выражены как среднее значение±стандартная погрешность среднего; n=3; *P<0,05; ***P<0,001 по сравнению с пустым носителем.
Фиг.2 URB937 ингибирует поведенческие реакции на вредоносные химические вещества у мышей и крыс, (a-d) Болевое поведение мышей, индуцированное уксусной кислотой (НАс). (a) Болевое поведение (количество эпизодов скорчивания) оценивали через 1 ч после введения пустого носителя (V), URB937 (URB, 1 мг-кг-1, внутрибрюшинно) или индометацина (IDM, 1 мг-кг-1, внутрибрюшинно). Также показан эффект от пустого носителя и URB937, вводимых без уксусной кислоты. (b) Статистическая корреляция между антиноцицепцией и ингибированием активности FAAH в печени, вызванным URB937 (1 мг-кг-1, внутрибрюшинно). (с) Влияние URB937 (1 мг-кг-1, внутрибрюшинно) на скорчивания, индуцированные уксусной кислотой у мышей дикого типа C57B 1/6 (+/+) и у FAAH-дефицитных мышей (-/-). (d) Антагонист CB1 римонабант (Rim, 1 мг-кг-1, подкожно), в отличие от антагониста CB2 АМ630 (1 мг-кг-1, подкожно), нивелирует антиноцицептивное действие URB937. Результаты выражены в виде средних значений±стандартная погрешность среднего; n=5-17. *P<0,05 по сравнению с пустым носителем; **P<0,01 по сравнению с пустым носителем; и ***P<0,001 по сравнению с пустым носителем; ##P<0,01 по сравнению с URB937; ###P<0,001 по сравнению с URB937. (e-g) Болевое поведение крыс, индуцированное формалином, (e) URB937 (1 мг-кг-1, внутрибрюшинно) демонстрировал зависимое от времени изменение суммарного болевого индекса по отношению к пустому носителю, римонабанту (2 мг-кг-1, внутрибрюшинно) или комбинации URB937 и римонабанта (F14,22=1.86, P=0.039). Формалин инъецировали в момент времени=0. (f) URB937 (1 мг-кг-1, внутрибрюшинно) уменьшал площадь под кривой (AUC) болевого поведения во время полного цикла реакции на формалин (F3,22=3.32, P=0.039). (g) Антиноцицептивный эффект URB937 был ограничен Фазой 2 реакции на формалин (10-60 мин; F1,3=3.05, P=0,050), тогда как достоверных изменений болевого поведения во время Фазы 1 (0-10 мин) не наблюдалось (F1,3=2.22, P=0.115). Результаты выражены в виде средних значений±стандартная погрешность среднего; n=5-7. *P<0,05, все группы по сравнению с URB937; #P<0,05, URB937 или URB937 вместе с римонабантом по сравнению с пустым носителем.
Фиг.3 URB937 подавляет индуцированную формалином экспрессию белка Fos в поясничной области (L4) спинного мозга крыс, (a-c) Репрезентативные срезы, демонстрирующие индуцированные формалином Fos-положительные клетки в поясничных сегментах после инъекции (a) пустого носителя; (b) URB937 (1 мг-кг-1, внутрибрюшинно); или (c) URB937 вместе с римонабантом (2 мг-кг-1, внутрибрюшинно). Калибровочная шкала, 1 мм. (d) Количественный анализ влияния пустого носителя (незакрашенные столбцы), URB937 (закрашенные столбцы), римонабанта, и URB937 вместе с римонабантом на количество Fos-положительных клеток в поверхностном слое заднего рога (пластинка I, II), nucleus proprius (пластинка III, IV), в шейной области заднего рога (пластинка V, VI), и в переднем роге. Данные о поведении тех же объектов исследования представлены на Фиг.2. Результаты выражены в виде средних значений±стандартная погрешность среднего; n=5-7. *P<0,05, все группы по сравнению с URB937; #P<0,05, URB937 вместе с римонабантом, или римонабант отдельно по сравнению с URB937; &P<0,05, пустой носитель, римонабант по сравнению с URB937.
Фиг.4 URB937 ослабляет болевую поведенческую реакцию, вызванную периферическим воспалением у мышей. Влияние URB937 (1 мг-кг-1, внутрибрюшинно), вводимого отдельно или в комбинации с римонабантом (R, 1 мг-кг-1, внутрибрюшинно) или АМ630 (AM, 1 мг-кг-1, внутрибрюшинно), на (a) индуцированную каррагенаном механическую гипералгезию; (b) термическую гипералгезию; (с) механическую аллодинию; и (d) отек лапы. Механическую и термическую гипералгезию измеряли сразу перед инъекцией каррагенана (0 ч) или через 4 ч и 24 ч после инъекции. Механическую аллодинию измеряли в момент Очи через 24 ч после каррагенана. Результаты выражены в виде средних значений±стандартная погрешность среднего; n=6. *p<0,05 по сравнению с пустым носителем; **P<0,01 по сравнению с пустым носителем; ***P<0,001 по сравнению с пустым носителем; #P<0,05 по сравнению с URB937; ###P<0,01 по сравнению с URB937.
Фиг.5 URB937 подавляет болевую поведенческую реакцию, вызванную периферическим невральным поражением у мышей, (a-c) Влияние однократного введения носителя (заштрихованные столбцы) или URB937 (закрашенные столбцы; 1 мг-кг-1, внутрибрюшинно) на (a) механическую гипералгезию, (b) термическую гипералгезию и (c) механическую аллодинию, индуцированную перевязыванием седалищного нерва, (d-f) Влияние повторных инъекций URB937 (1 мг-кг-1, внутрибрюшинно, один раз ежедневно в течение 4 следующих друг за другом дней) на (d) механическую гипералгезию, (е) термическую гипералгезию и (f) механическую аллодинию. BL - исходный уровень (измеренный перед перевязыванием); IL - ипсилатеральная лапа (с перевязкой); CL - контралатеральная лапа (без перевязки). Результаты выражены в виде средних значений±стандартная погрешность среднего; n=6. ***P<0,001 по сравнению с исходным уровнем; #P<0,05 по сравнению с пустым носителем; ##P<0,01 по сравнению с пустым носителем; ###P<0,001 по сравнению с пустым носителем.
Фиг.6 Влияние URB937 (1 мг-кг-1, внутрибрюшинно) на уровень анандамида и палмитоилэтаноламида (PEA) в тканях мышей Swiss. Незакрашенные столбцы - пустой носитель; закрашенные столбцы - URB937. Результаты выражены в виде средних значений±стандартная погрешность среднего; n=4-6.*, P<0,05, **, P<0,01, ***, P<0,001 по сравнению с пустым носителем;
Фиг.7 Внутриподошвенная инъекция каррагенана не влияет на механическую (a) и термическую гипералгезию (b) или механическую аллодинию (c) в контралатеральных (без инъекции) лапах мышей Swiss. Римонабант (R, 1 мг-кг-1, внутрибрюшинно) и АМ630 (1 мг-кг-1, внутрибрюшинно) не имели эффекта. Результаты выражены в виде средних значений±стандартная погрешность среднего.
Подробное описание изобретения
После возникновения боли периферические каннабиноидные рецепторы оказывают мощный ингибирующий контроль, однако эндогенный каннабиноидный сигнал, который обычно запускает этот внутренний анальгетический механизм, все еще неизвестен. Авторы настоящего изобретения разработали периферический ингибитор гидролазы амидов жирных кислот (FAAH), фермента, ответственного за деградацию эндоканнабиноида анандамида. Соединение URB937 подавляет активность FAAH и повышает уровень анандамида за пределами центральной нервной системы (ЦНС). Несмотря на удивительную относительную неспособность проникать в мозг и в спинной мозг (соединение кроме того удивительно чувствительно к системе транспорта, опосредующей вытеснение из мозга), URB937 ослабляет поведенческую реакцию, характерную для постоянной боли в моделях воспаления и поражения периферических нервов на грызунах, а также подавляет вызванную вредоносным стимулом нейронную активацию в областях спинного мозга, вовлеченных в обработку болевого сигнала. Блокада CBi-рецептора предотвращает эти эффекты. Эти результаты позволяют предположить, что анандамид-опосредованная передача сигналов на периферических CB1-рецепторах контролирует передачу информации о боли в ЦНС. Относительно неспособные проникнуть в мозг ингибиторы FAAH, усиливающие данный механизм, представляют собой новый способ терапии боли.
Ощущение боли может эффективно контролироваться нейромедиаторами внутри ЦНС. Эта модуляция была хорошо изучена в заднем роге спинного мозга, где импульсы, переносимые ноцицептивными (болечувствительными) волокнами, обрабатываются перед тем, как они передаются в мозг. Дополнительно к этим основным механизмам, внутренний контроль передачи боли может осуществляться на концах афферентных нервных волокон вне ЦНС. Одним из известных примеров периферической регуляции являются эндогенные опиоиды, которые высвобождаются из активированных иммунных клеток во время воспаления и ингибируют инициацию боли путем взаимодействия с опиоидными рецепторами, локализованными на чувствительных нервных окончаниях1,2.
Соединение URB937 представляет собой мощный ингибитор FAAH, который практически не проникает в ЦНС и, таким образом, в основном препятствует деактивации анандамида только в периферических тканях. Несмотря на ограниченный спектр действия URB937 оказывает значительное антиноцицептивное влияние в моделях острой и постоянной боли на грызунах, которое нивелируется блокадой каннабиноидного рецептора CB1. Из этих наблюдений можно предположить, что ингибирование периферической активности FAAH усиливает эндогенный анальгетический механизм, регулирующий передачу возникающих ноцицептивных входных сигналов в спинной мозг и в мозг. Этот механизм, вероятно, опосредован анандамидом или другим эндогенным каннабиноидным амидом жирной кислоты.
Не желая связывать себя какой-либо теорией, авторы предполагают, что периферическая передача сигналов с помощью анандамида служит в качестве диффузной паракринной системы, которая модулирует интенсивность болевых стимулов по мере их нарастания в поврежденных тканях. Две линии рассуждений подтверждают эту мысль. Во-первых, сигналы, вызываемые воспалением и невральным поражением, могут запускать локальное высвобождение анадамида. Например, деполяризация мембраны и активация каналов TRPV-1 стимулируют выработку анандамида в культурах сенсорных нейронов25, в то время как активация провоспалительного рецептора, Toll-подобного рецептора 4, вызывает аналогичный эффект в макрофагах26. Эти сигналы, а также, возможно, другие, которые еще не идентифицированы, могут вносить вклад в повышение уровня периферического анандамида, обнаруженное в животных моделях поражения спинного нерва и воспаления8,11, а также при болезненных состояниях человека, таких как комплексный регионарный болевой синдром9 и артрит10. Во-вторых, хотя рецепторы CBi особенно широко представлены в мозге, они также повсеместно распространены в тканях и органах млекопитающих. Более конкретно, они экспрессируются в крупных первичных сенсорных нейронах и транспортируются в периферические нервные окончания27,28, где их присутствие может быть как необходимым для поддержания обычных болевых порогов8, и так и достаточным для того, чтобы оказывать значительный ноцицептивный эффект'. Рецепторы CB1 на болечувствительных окончаниях могут опосредовать анальгетическое действие местно вырабатываемого анандамида и могут также быть вовлечены в противовоспалительную активность этого липидного медиатора через его ингибирующее влияние на высвобождение возбуждающих нейропептидов29. Тем не менее, разумно предполагать, что другие каннабиноидные и каннабиноид-подобные рецепторы также прямо или косвенно вносят свой вклад в передачу сигналов анандамида в ответ на поражение. Двумя вероятными кандидатами являются рецепторы CB2, которые могут активироваться или с помощью анандамида, или с помощью 2-AG30, а также рецепторы, активируемые пероксисомными пролифераторами α-типа, которые активируются с помощью PEA и других медиаторов, имеющих липидное происхождение7,20,21. Эти рецепторы и их эндогенные лиганды присутствуют в периферических сенсорных нейронах и иммунных клетках, и вовлечены в модуляцию ноцицепции и воспаления21,31,32.
Мутантные мыши, в которых FAAH селективно делетирован во всех клетках, кроме нервных, и сохранен в периферических и центральных нейронах, демонстрируют поразительный фенотип, в котором нормальная ноцицептивная передача сопровождается уменьшением чувствительности к провоспалительным триггерам33. Возможное объяснение этого открытия, которое согласуется с настоящими результатами, заключается в том, что активность сигналов анадамида в периферических ноцицепторах регулируется FAAH, локализованным на самих ноцицепторах, а не на других соседних клетках, отличных от нервных. Это согласуется с тем наблюдением, что периферическая аксотомия индуцирует экспрессию FAAH в крупных сенсорных нейронах, реакцию, которая, как ожидается, расширяет совместную локализацию FAAH и рецепторов C B 1 34 .
Агонисты опиоидных рецепторов прямого действия оказывают значительное анальгетическое воздействие в животных и человеческих экспериментальных моделях боли2,35. Авторы настоящего изобретения показали, что достижение значительной аналгезии возможно также путем усиления активности механизма на основе анандамида, вовлеченного в сохранение ноцицептивного гомеостаза. Эти факты дают новый взгляд на внутренний контроль боли и могут использоваться в терапевтических целях для разработки эффективных анальгетиков, лишенных основных побочных эффектов.
Определения
Следует отметить, что использованные в данном описании и в последующей формуле изобретения существительные в единственном числе включают также и множественное число, если в контексте явно не указано иное.
«FAAH» служит для обозначения гидролазы амидов жирных кислот млекопитающих и включает человеческую, крысиную и мышиную форму этого фермента, однако не огранивается только ими. Патент США No. 6,271,015 раскрывает выделенные и очищенные формы FAAH. В ряде воплощений IC50 FAAH рассматриваемых соединений определяют по ингибированию крысиной формы фермента в физиологически приемлемых условиях. Гидролазы амидов жирных кислот (FAAH) (Deutsch, D.G., et al., Prostaglandins Leukot. Essent. Fatty Acid, 66, 201-210 (2002)) - это ферменты, ответственные за деградацию липидных эталонамидов (Fowler, С.J., et al., Biochem. Pharmacol. 62, 517-526 (2001); Patricelli, M.P., et al. Vitam. Horm., 62, 663-674 (2001)), например анандамида (AEA, 1, Фиг.1), (Devane, W.A., et al., Science 258, 1946-1949 (1992)) олеоилэтаноламида (Rodriguez de Fonseca, F., et al. Nature (London) 414, 209-212 (2001); Fu, J., et al., Nature (London) 425, 90-93 (2003)) и палмитоилэтаноламида (Calignano, A., et al. Nature (London) 394, 277-281 (1998); Lambert, D.M., et al., Curr. Med. Chem. 9, 663-674 (2002)), биохимического процесса, который наряду с селективным транспортом в клетки в случае AEA (Di Marzo, V., Nature (London) 372, 686-691 (1994); Beltrama, M., et al., Science 277, 1094-1097 (1997); Piomelli, D., et al., Proc. Natl. Acad. Sci. U.S.A. (2002)), приводит к прекращению клеточных эффектов данных физиологически активных веществ. Вследствие различных важных физиологических ролей этаноламидов жирных кислот классы низкомолекулярных соединений, которые способны блокировать гидролазу FAAH или гидролазы FAAH, но не связываются с другими ферментами, участвующими в метаболизме эндоканнабиноидов, например с моноглицерид-липазой (MGL) (Dinh, Т.Р., et al., Proc. Natl. Acad. Sci. U.S.A. 99, 10819-10824 (2002)), или с каннабиноидными рецепторами, могут быть полезны как в качестве фармакологических средств, так и в качестве прототипов для разработки новых лекарственных средств (Piomelli, D., et al. Trends Pharmacol. Sci. 21, 218-224 (2000); Bisogno, Т., et al., Curr. Pharm. Des. 8, 533-547 (2002); Yarnell, A., Chem. Eng. News 80(49), 32 (2002); Smith, A., Nat. Rev. Drug Discov. 2, 92 (2003); Wendeler, M., et al. Angew. Chem. Int. Ed. 42, 2938-2941 (2003)).
Термин «фармацевтически приемлемый носитель» охватывает все стандартные фармацевтические носители, буферы и наполнители, включая фосфатно-солевой буферный раствор, воду и эмульсии (такие как масло-вода или вода-масло), а также различные типы увлажняющих агентов и/или адъювантов. Подходящие фармацевтические носители и их составы описаны в «Remington's Pharmaceutical Sciences» (Mack Publishing Co., Easton, 19th ed. 1995). Предпочтительные фармацевтические носители зависят от предполагаемого способа введения активного агента. Типичные способы введения описаны ниже.
Термин «эффективное количество» обозначает дозировку, достаточную для получения искомого результата в отношении выявленного расстройства, состояния или психического состояния. Искомый результат может включать субъективное или объективное улучшение у реципиента такой дозировки. В отношении боли улучшение может представлять собой уменьшение признаков или симптомов боли.
Термины «лечение», «терапия» и им подобные включают, в частности, способы и операции, осуществляемые для достижения полезных изменений в состоянии здоровья реципиента. Изменения могут быть или субъективными или объективными и могут относиться к таким характеристикам, как симптомы или признаки заболевания, расстройства или состояния, которое необходимо лечить. Например, если пациент замечает уменьшение боли, то было проведено успешное лечение. Например, если наблюдается уменьшение отека, то было проведено полезное лечение воспаления. Аналогичным образом, если врач замечает объективные изменения, такие как улучшенный диапазон движения, то лечение боли или воспаления, которые ухудшали это движение, оказалось полезным. Предотвращение ухудшения состояния реципиента также охватывается этим термином.
Терапевтическая польза включает любой из ряда субъективных или объективных факторов, выявляющих благотворную реакцию или улучшение состояния, которое необходимо лечить, как обсуждается в настоящем документе.
«Фармацевтически приемлемый» или «терапевтически приемлемый» относится к веществу, которое не препятствует эффективности или биологической активности активных ингредиентов и которое не токсично по отношению к хозяину в используемых количествах, причем хозяева могут быть людьми или животными, которым вводится это вещество.
«Терапевтически эффективное количество» обозначает количество активного агента, достаточное для получения искомого биологического или клинического результата. Этот результат может представлять собой ослабление признаков, симптомов или причин заболевания или может быть другим целевым изменением биологической системы. Термин «терапевтически эффективное количество» используется в настоящем изобретении для обозначения любого количества состава, которое вызывает существенное улучшение заболевания, расстройства или состояния при введении объекту. Это количество будет меняться в зависимости от состояния, которое необходимо лечить, стадии прогрессии состояния, а также типа и концентрации применяемого состава. Подходящие количества в любом случае будут очевидны специалистам в данной области техники или их можно определить с помощью стандартного эксперимента.
«Профилактическое лечение» представляет собой лечение пациента, не имеющего явных признаков неврологического или психологического расстройства или состояния или же имеющего только ранние или слабые признаки такого расстройства или состояния, где лечение вводят с целью уменьшения риска развития патологии или ухудшения расстройства или состояния. Соединения по изобретению могут применяться в качестве профилактического лечения для предотвращения ненужных или нежелательных страхов или панических атак или для уменьшения уровня страхов на тот случай, если произойдет ухудшение состояния.
При использовании в данном документе термин «пациент» или «объект» включает любое подвергающееся лечению животное, включая, без ограничения перечисленным, млекопитающих (например, крыс, мышей, кошек, собак), в том числе человека.
При использовании в настоящем изобретении термин «гидрокарбил» означает (C1-С8) углеводородный остаток, который является (C1-С8)алкильным остатком, (C1-C8)алкенильным, (C3-С8)циклоалкильным, (C3-С8)циклоалкельным, (C1-С8)гетероалкильным, (C3-C8)гетероалкенильным, (C3-С8)гетероциклоалкильным, или (C3-C8)гетероциклоалкенильным остатком. В предпочтительном варианте гидрокарбил в каждом случае представляет собой замещенный или незамещенный (C1-C6), (С1-C3) или (C1-С2)гидрокарбил и более предпочтительно незамещенный (С1-C3)алкил. В еще более предпочтительном варианте гидрокарбил в каждом случае представляет собой метил или этил, или трифторметил. Термин «гидрокарбил» также включает группы, содержащие до 1, 2, или 3 атомов гидрокарбильных групп, как они описаны выше, замещенных гетероатомом при условии, что гетероатомы гидрокарбила не располагаются смежно друг с другом и гидрокарбил не присоединен к оставшемуся соединению с помощью гетероатома.
В настоящем изобретении термин «алкил», сам по себе или в виде части другого заместителя, означает, если явно не указано иное, прямую или разветвленную цепь насыщенного углеводородного остатка, содержащего указанное число углеродных атомов (т.е. (C1-C6) означает от одного до шести атомов углерода). Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, н-пентил, н-гексил, н-гептил, н-октил, и так далее.
В настоящем изобретении термин «алкокси» означает алкильный остаток, присоединенный к остальной молекуле через атом кислорода алкокси-группы. Соответственно, примеры алкоксигрупп включают, в частности, метокси, этокси, пропокси и так далее.
Термин «алкенил» берет свое название от соответствующей алкильной группы, но отличается от нее наличием одной или нескольких двойных связей. Аналогично, «алкинильные» группы названы вслед за соответствующими алкильными группами, но отличаются наличием одной или нескольких тройных связей. Неограниченные примеры таких ненасыщенных алкенильных и алкинильных групп включают винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил, а также высшие гомологи и изомеры.
В настоящем изобретении термин «гетероалкил» берет свое название от соответствующей алкильной группы, но отличается тем, что содержит один, два или три гетероатома, независимо выбранных из N, O, и S и замещающих атом углерода алкильной группы. Гетероатомы азота и серы необязательно окислены, а атомы азота необязательно кватернизированы. Гетероалкильная группа присоединена к остатку молекулы через атом углерода гетероалкильной группы, а гетероатомы гетероалкила не располагаются смежно с другими гетероатомами.
Термин «гетероалкенил» берет свое название от соответствующей алкенильной группы, но отличается тем, что имеет 1, 2, или 3 гетероатома, замещающих атом углерода алкенильной группы. Гетероатомы азота и серы необязательно окислены, а атомы азота необязательно кватернизированы. Гетероатом может образовывать двойную связь с углеродным атомом. Гетероалкенильная группа присоединена к остатку молекулы через атом углерода алкила, а гетероатомы алкила не располагаются смежно с другими гетероатомами.
В настоящем изобретении термин «циклоалкил» означает насыщенный моноциклический углеводородный радикал, включающий от около 3 до около 8 атомов углерода, а более предпочтительно - 3-6 атомов углерода. Термин «циклоалкенил» означает моноциклический неароматический углеводородный радикал, включающий от около 5 до около 6 атомов углерода и имеющий по меньшей мере одну двойную связь. Типичные циклоалкильные группы и циклоалкенильные группы включают циклопропил, циклобутил, циклопнтил, циклогексил, циклогексенил, циклогепта-1,3-диенил и так далее.
В настоящем изобретении термин «гетероциклоалкил» означает насыщенный или частично насыщенный углеводородный остаток, включающий от около 3 до около 8 атомов углерода, а более предпочтительно - 3-6 атомов углерода, в которых 1, 2 или 3 из атомов углерода независимо замещены гетероатомом, выбранным из O, N, или S. Атомы азота и серы необязательно окислены, а атом(ы) азота необязательно кватернизированы. Окисленная сера может находиться в форме тио-, сульфинил- или сульфонилгрупп. Термин «гетероциклоалкенил» означает гетероциклоалкильную группу, имеющую по меньшей мере одну двойную связь. Гетероциклоалкильная или гетероциклоалкенильная группа присоединена к остатку молекулы через атом углерода гетероциклоалкильной или гетероциклоалкенильной группы, соответственно; и гетероатомы гетероциклоалкила или гетероциклоалкенила не располагаются смежно с другими гетероатомами гетероциклоалкила или гетероциклоалкенила.
В настоящем изобретении подразумевается, что термин «гетероатом» включает кислород (O), азот (N) и серу (S)).
В настоящем изобретении термин «галоген» или «гало» означает иод (I), бром (Br), хлор (Cl) и/или фтор (F).
Вышеописанный гидрокарбильцый, алкильный, алкенильный, циклоалкильный, циклоалкенильный, гетероалкильный, гетероалкенильный, циклогетероалкильный и циклогетероалкенильный остатки могут быть замещены одним, двумя или тремя заместителями, независимо выбранными из незамещенного (C1-С6) или (С1-C3)алкила, незамещенной (C1-C6) или (С1-C3)алкоксигруппы, незамещенной аминогруппы, незамещенной (C1-С6) или (C1-С3) алкиламиногруппы, ди-(незамещенный (C1-C6) или (C1-C3)алкил)аминогруппы, гидроксигруппы, галогена, незамещенной карбоксамидогруппы, незамещенной (C1-C6) или (С1-C