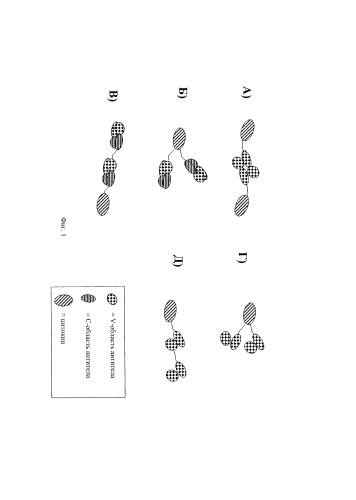
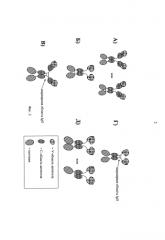
Иммуноконъюгаты направленного действия
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и иммунологии. Описаны иммуноконъюгат для доставки эффекторного фрагмента, который влияет на клеточную активность. Иммуноконъюгат содержит один одноцепочечный эффекторный фрагмент и два антигенсвязывающих фрагментов, представляющих собой молекулу Fab. Также описаны молекулы нуклеиновых кислот, кодирующие иммуноконъюгаты, векторы и клетки-хозяева, которые содержат молекулы нуклеиновых кислот, способы получения иммуноконъюгатов, предлагаемых в изобретении, и способы применения указанных иммуноконъюгатов для лечения болезни. 4 н. и 129 з.п. ф-лы, 53 ил., 23 табл., 28 пр.
Реферат
Предпосылки создания изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к антигенспецифическим иммуноконъюгатам, предназначенным для избирательного переноса обладающих эффекторной функцией фрагментов (эффекторных фрагментов), которые оказывают влияние на клеточную активность. Кроме того, настоящее изобретение относится к молекулам нуклеиновых кислот, кодирующим указанные иммуноконъюгаты, и векторам и клеткам-хозяевам, которые содержат указанные молекулы нуклеиновых кислот. Изобретение относится также к способам получения иммуноконъюгатов, предлагаемых в изобретении, и способам применения указанных конъюгатов для лечения заболевания.
Известный уровень техники
В различных клинических ситуациях часто требуется деструкция индивидуальной клетки или конкретного типа клеток. Например, основной задачей при терапии рака является специфическое разрушение опухолевых клеток с сохранением при этом в интактном и неповрежденном состоянии здоровых клеток и тканей. С выживаемостью и/или гибелью клеток связано множество путей трансдукции сигналов в клетке. Таким образом, для оказания влияния на поддержание клетки или ее деструкцию можно применять непосредственное введение связанного с указанным путем фактора, который участвует в обеспечении выживаемости или гибели клеток.
Цитокины представляют собой молекулы, обеспечивающие передачу клеточных сигналов, которые принимают участие в регуляции иммунной системы. При применении в терапии рака цитокины могут действовать в качестве иммуномодуляторов, которые обладают противоопухолевой активностью и которые могут повышать иммуногенность некоторых типов опухолей. Однако быстрый клиренс из крови и отсутствие специфичности для опухоли обусловливают необходимость системного введения высоких доз цитокинов для достижения достаточной для активации иммунного ответа или противоопухолевого действия концентрации цитокина в области локализации опухоли. Такие высокие уровни обладающих системным действием цитокинов могут приводить к проявлению серьезной токсичности и нежелательных реакций.
Одним из путей введения in vivo фактора пути трансдукции сигнала, такого как цитокин, в конкретную область (например, опухоль или микроокружение опухоли) является конъюгация фактора с иммуноглобулином, специфическим для указанной области. Осуществляемые ранее стратегии, целью которых было введение факторов путей трансдукции сигналов, таких как цитокины, в конкретную область in vivo, предусматривали применение тяжелых цепей иммуноглобулинов, конъюгированных с различными цитокинами, такими как лимфотоксин, фактор некроза опухоли-α (TNF-α), интерлейкин-2 (IL-2) и колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF). Тяжелые цепи иммуноглобулинов либо конъюгировали с цитокином химически, либо конъюгат иммуноглобулин-цитокин экспрессировали в виде слитого белка (см. Nakamwa К. и Kubo A., Cancer Supplement 80, 1997, cc.2650-2655; Jun L-и др., Chin. Med. J. 113, 2000, cc.151-153 (2000) и Becker J.C. и др., Proc. Natl. Acad. Sci. USA 93, 1996, cc.7826-7831). Исследователи обнаружили, что они не только обладали способностью обеспечивать направленный перенос цитокинов к специфическим областями in vivo, но и обладали преимуществом, связанным с тем, что моноклональные антитела имели более продолжительное время полужизни в сыворотке, чем большая часть других белков. Из-за системной токсичности, ассоциированной с высокими дозами определенных неконъюгированных цитокинов, а именно IL-2, возможность применения слитого белка иммуноглобулин-цитокин в более низких дозах, обеспечивающих максимальное повышение иммуностимулирующее действие при поддержании системных побочных действий на минимальном уровне, позволила исследователям высказать предположение о том, что иммуноконъюгаты иммуноглобулин-цитокин являются оптимальными терапевтическими средствами. Однако одним из основных ограничений клинического применения иммуноглобулинов в качестве обеспечивающих введение агентов является их неудовлетворительное поглощение и плохое распределение в опухолях, что обусловлено, прежде всего, крупным размером молекулы иммуноглобулина (см. Xiang J. и др., Immunol. Cell Biol. 72, 1994, cc.275-285). Кроме того, высказано предположение о том, что иммуноконъюгаты иммуноглобулин-цитокин могут активировать комплемент и взаимодействовать с Fc-рецепторами. Это присущее иммуноглобулину свойство рассматривалось как нежелательное, поскольку мишенью терапевтических иммуноконъюгатов могут быть клетки, экспрессирующие Fc-рецепторы, а не целевые несущие антиген клетки.
Один из подходов, позволяющих преодолевать эти проблемы, состоит в применении сконструированных фрагментов иммуноглобулина. В многочисленных исследованиях подробно описаны характеристики иммуноконъюгатов, представляющих собой фрагмент иммуноглобулина-цитокин (см. Savage Р. и др., Br.J.Cancer 67, 1993, cc.304-310; Harvill E.T. и Morrison S.L., Immunotechnol. 1, 1995, cc.95-105 и Yang J. и др., Mol. Immunol. 32, 1995, cc.873-881). В целом, известны две общепринятые конструкции слитых белков, представляющих собой фрагмент иммуноглобулина-цитокин, такие как F(аb')2-цитокин, экспрессия которого происходит в клетках млекопитающих, и scFv-цитокин экспрессия которого происходи в клетках Escherichia coli (см., Xiang J., Hum. Antibodies 9, 1999, cc.23-36). У большинства типов таких иммуноконъюгатов сохраняются, как способность связываться с опухолью, так и функциональная активность цитокина. Опубликованные в последние годы исследования продемонстрировали, что эти слитые белки обладают способностью обеспечивать in vivo направленный перенос цитокинов к опухолям, которые экспрессируют ассоциированный с опухолью антиген, и ингибировать как первичные, так и метастатические опухоли при оценке на созданной на иммунокомпетентных животных модели.
Примерами иммунокоъюгатов, включающих фрагмент иммуноглобулина-цитокин, являются иммуноконъюгат scFv-IL-2, описанный в публикации РСТ WO 2001/062298 А2; иммуноконъюгат, включающий фрагмент тяжелой цепи иммуноглобулина-GM-CSF, который описан в US 565050; иммуноконъюгат, описанный в РСТ-публикации WO 2006/119897 А2, в котором первая субъединица (scFv) конъюгата scFv-IL-12 соединена только дисульфидным(ими) мостиком(ами) с второй субъединицей (IL-12), и иммуноконъюгат, описанный в РСТ-публикации WO 99/29732 А2, в котором первая субъединица (фрагмент тяжелой цепи Ig) конъюгата фрагмент тяжелой цепи Ig-IL-12 соединена только дисульфидным(ими) мостиком(ами) с второй субъединицей (IL-12). Хотя эти иммуноконъюгаты второго поколения обладают некоторыми улучшенными свойствами по сравнению с иммуноконъюгатами первого поколения, которые содержат иммуноглобулин-цитокин, требуется разработка более специфических и даже более безопасных терапевтических агентов, обладающих более высокой эффективностью в отношении опухолевых клеток и пониженным количеством случаев возникновения и серьезностью побочных действий, свойственных этим продуктам (например, токсичность, деструкция неопухолевых клеток и т.д.). Кроме того, требуется идентифицировать пути дальнейшей стабилизации иммуноконъюгатов с сохранением приемлемых уровней терапевтической активности.
В настоящем изобретении предложены иммуноконъюгаты, обладающие повышенной эффективностью, высокой специфичностью действия, пониженной токсичностью и улучшенной стабильностью в крови по сравнению с известными иммуноконъюгатами.
Краткое изложение сущности изобретения
Одним из объектов настоящего изобретения являются иммуноконъюгаты, обладающие повышенной эффективностью, высокой специфичностью действия, пониженной токсичностью и улучшенной стабильностью по сравнению с известными иммуноконъюгатами. Иммуноконъюгаты, предлагаемые в настоящем изобретении, можно применять для избирательного введения эффекторных фрагментов в область-мишень. Согласно другому варианту осуществления изобретения иммуноконъюгат обеспечивает введение цитокина в область-мишень, при этом цитокин может обладать локализованным биологическим действием, таким как локальный воспалительный ответ, стимуляция роста и активации Т-клеток и/или активация В- и/или NK-клеток.
Одним из объектов настоящего изобретения является иммуноконъюгат, который содержит по меньшей мере первый эффекторный фрагмент и по меньшей мере первый и второй антигенсвязывающие фрагменты, независимо друг от друга выбранные из группы, включающей Fv и Fab, при этом первый эффекторный фрагмент связан с помощью амино- или карбоксиконцевой пептидной связи с первым антигенсвязывающим фрагментом, а второй антигенсвязывающий фрагмент связан с помощью амино- или карбоксиконцевой пептидной связи либо с I) первым эффекторным фрагментом, либо с II) первым антигенсвязывающим фрагментом.
Следующим объектом настоящего изобретения является иммуноконъюгат, который содержит по меньшей мере первый одноцепочечный эффекторный фрагмент, сцепленный на его аминоконцевой аминокислоте с одной или несколькими scFv-молекулами, и в котором первый одноцепочечный эффекторный фрагмент сцеплен на его карбоксиконцевых аминокислотах с одной или несколькими scFv-молекулами.
Другим объектом настоящего изобретения является иммуноконъюгат, который содержит по меньшей мере первый одноцепочечный эффекторный фрагмент и первый и второй антигенсвязывающие фрагменты, в котором первый и второй антигенсвязывающие фрагменты содержат scFv-молекулу, сцепленную на ее карбоксиконцевой кислоте с константной областью, которая содержит константную область иммуноглобулина, независимо выбранную из группы, включающей: СН1 IgG, Скаппа IgG и СН4 IgE, и первый антигенсвязывающий фрагмент сцеплен на карбоксиконцевой аминокислоте его константной области с аминоконцевой аминокислотой одного из эффекторных фрагментов, и первый и второй антигенсвязывающие фрагменты ковалентно связаны через по меньшей мере один дисульфидный мостик.
Следующим объектом настоящего изобретения является иммуноконъюгат, который содержит по меньшей мере первый одноцепочечный эффекторный фрагмент и первый и второй антигенсвязывающие фрагменты, в котором и первый и второй антигенсвязывающие фрагменты содержат scFv-молекулу, сцепленную на ее карбоксиконцевой аминокислоте с СН3-доменом IgG1, и в котором первый антигенсвязывающий фрагмент сцеплен на его карбоксиконцевой аминокислоте с аминоконцевой аминокислотой одного из эффекторных фрагментов, и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через по меньшей мере один дисульфидный мостик.
Другим объектом настоящего изобретения является иммуноконъюгат, который содержит первый и второй одноцепочечные эффекторные фрагменты и первый и второй антигенсвязывающие фрагменты, в котором каждый из антигенсвязывающих фрагментов содержит Fab-молекулу, сцепленную на карбоксиконцевой аминокислоте ее тяжелой или легкой цепи с СН3-доменом IgG1, и в котором каждый из СН3-доменов IgG1 сцеплен на его карбоксиконцевой аминокислоте с аминоконцевой аминокислотой одного из эффекторных фрагментов, и в котором первый и второй антигенсвязывающие фрагменты ковалентно связаны через по меньшей мере один дисульфидный мостик.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 95. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 104. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 105. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 106. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 107. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 96. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность SEQ ID NO: 96 и полипептидную последовательность, выбранную из группы, включающей SEQ ID NO: 95 и 104-107. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептид, последовательность которого идентична по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности, выбранной из группы, включающей SEQ ID NO: 95, 96 и 104-107.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 108. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 108. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 117. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 117. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 118. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 118. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 119. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 119. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 120. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 120. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 109. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 109.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит вариабельную область тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 13, либо последовательности SEQ ID NO: 15. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 9, либо последовательности SEQ ID NO: 11. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 13, либо последовательности SEQ ID NO: 15, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 9, либо последовательности SEQ ID NO: 11.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 14, либо последовательности SEQ ID NO: 16. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 14, либо SEQ ID NO: 16. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 10, либо последовательности SEQ ID NO: 12. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 10, либо SEQ ID NO: 12.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 99. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 100, либо последовательности SEQ ID NO: 215. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 101, либо последовательности SEQ ID NO: 235. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 100, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 101. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 215, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 235.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 112. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 112. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо SEQ ID NO: 113, либо SEQ ID NO: 216. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 113, либо SEQ ID NO: 216. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо SEQ ID NO; 114, либо SEQ ID NO: 236. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью либо SEQ ID NO: 114, либо SEQ ID NO: 236.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 7, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID N0:195, SEQ ID NO: 199, SEQ ID NO: 203 и SEQ ID NO: 207. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 177,SEQ ID NO: 181, SEQ ID NO:185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201 и SEQ ID NO: 205. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 7, SEQ ID NO: 179, SEQ ID NO: 183, SEQ ID NO: 187, SEQ ID NO: 191, SEQ ID NO:195, SEQ ID NO: 199, SEQ ID NO: 203 и SEQ ID NO: 207, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 177. SEQ ID NO: 181, SEQ ID NO:185, SEQ ID NO: 189, SEQ ID NO: 193, SEQ ID NO: 197, SEQ ID NO: 201 и SEQ ID NO: 205.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 8, SEQ ID NO: 180, SEQ ID NO: 184, SEQ ID NO: 188, SEQ ID NO: 192, SEQ ID NO: 196, SEQ ID NO: 200, SEQ ID NO: 204 и SEQ ID NO: 208. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 8, SEQ ID NO: 180, SEQ ID NO: 184, SEQ ID NO: 188, SEQ ID NO: 192, SEQ ID NO: 196, SEQ ID NO: 200, SEQ ID NO: 204 и SEQ ID NO: 208. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 178, SEQ ID NO: 182, SEQ ID NO: 186, SEQ ID NO: 190, SEQ ID NO: 194, SEQ ID NO: 198, SEQ ID NO: 202 и SEQ ID NO: 206. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 178, SEQ ID NO: 182, SEQ ID NO: 186, SEQ ID NO: 190, SEQ ID NO: 194, SEQ ID NO: 198, SEQ ID NO: 202 и SEQ ID NO: 206.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 239, SEQ ID NO: 241 и SEQ ID NO: 243. Согласно другому варианту осуществления изобретения конъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 245, SEQ ID NO: 247 и SEQ ID NO: 249. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 239, SEQ ID NO: 241 и SEQ ID NO: 243, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 245, SEQ ID NO: 247 и SEQ ID NO: 249.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 240, SEQ ID NO: 242 и SEQ ID NO: 244. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 240, SEQ ID NO: 242 и SEQ ID NO: 244. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 246, SEQ ID NO: 248 и SEQ ID NO: 250. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 246, SEQ ID NO: 248 и SEQ ID NO: 250.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей; SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139, SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171 и SEQ ID NO: 175. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 23, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169 и SEQ ID NO: 173. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 21, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 43, SEQ ID NO: 47, SEQ ID NO: 51, SEQ ID NO: 69, SEQ ID NO: 73, SEQ ID NO: 77, SEQ ID NO: 81, SEQ ID NO: 85, SEQ ID NO: 89, SEQ ID NO: 93, SEQ ID NO: 123, SEQ ID NO: 127, SEQ ID NO: 131, SEQ ID NO: 135, SEQ ID NO: 139, SEQ ID NO: 143, SEQ ID NO: 147, SEQ ID NO: 151, SEQ ID NO: 155, SEQ ID NO: 159, SEQ ID NO: 163, SEQ ID NO: 167, SEQ ID NO: 171 и SEQ ID NO: 175, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 23, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 67, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 79, SEQ ID NO: 83, SEQ ID NO: 87, SEQ ID NO: 91, SEQ ID NO: 121, SEQ ID NO: 125, SEQ ID NO: 129, SEQ ID NO: 133, SEQ ID NO: 137, SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 149, SEQ ID NO: 153, SEQ ID NO: 157, SEQ ID NO: 161, SEQ ID NO: 165, SEQ ID NO: 169 и SEQ ID NO:173.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 22, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 44, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 70, SEQ ID NO: 74, SEQ ID NO: 78, SEQ ID NO: 82, SEQ ID NO: 86, SEQ ID NO: 90, SEQ ID NO: 94, SEQ ID NO: 124, SEQ ID NO: 128, SEQ ID NO: 132, SEQ ID NO: 136, SEQ ID NO: 140, SEQ ID NO: 144, SEQ ID NO: 148, SEQ ID NO: 152, SEQ ID NO: 156, SEQ ID NO: 160, SEQ ID NO: 164, SEQ ID NO: 168, SEQ ID NO: 172 и SEQ ID NO: 176. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей: SEQ ID NO: 22, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 44, SEQ ID NO: 48, SEQ ID NO: 52, SEQ ID NO: 70, SEQ ID NO: 74, SEQ ID NO: 78, SEQ ID NO: 82, SEQ ID NO: 86, SEQ ID NO: 90, SEQ ID NO: 94, SEQ ID NO: 124, SEQ ID NO: 128, SEQ ID NO: 132, SEQ ID NO: 136, SEQ ID NO: 140, SEQ ID NO: 144, SEQ ID NO: 148, SEQ ID NO: 152, SEQ ID NO: 156, SEQ ID NO: 160, SEQ ID NO: 164, SEQ ID NO: 168, SEQ ID NO: 172 и SEQ ID NO: 176. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей: SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 24, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 50, SEQ ID NO: 68, SEQ ID NO: 72, SEQ ID NO: 76, SEQ ID NO: 80, SEQ ID NO: 84, SEQ ID NO: 88, SEQ ID NO: 92, SEQ ID NO: 122, SEQ ID NO: 126, SEQ ID NO: 130, SEQ ID NO: 134, SEQ ID NO: 138, SEQ ID NO: 142, SEQ ID NO: 146, SEQ ID NO: 150, SEQ ID NO: 154, SEQ ID NO: 158, SEQ ID NO: 162, SEQ ID NO: 166, SEQ ID NO: 170 и SEQ ID NO: 174. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей: SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 24, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 42, SEQ ID NO: 46, SEQ ID NO: 50, SEQ ID NO: 68, SEQ ID NO: 72, SEQ ID NO: 76, SEQ ID NO: 80, SEQ ID NO: 84, SEQ ID NO: 88, SEQ ID NO: 92, SEQ ID NO: 122, SEQ ID NO: 126, SEQ ID NO: 130, SEQ ID NO: 134, SEQ ID NO: 138, SEQ ID NO: 142, SEQ ID NO: 146, SEQ ID NO: 150, SEQ ID NO: 154, SEQ ID NO: 158, SEQ ID NO: 162, SEQ ID NO: 166, SEQ ID NO: 170 и SEQ ID NO: 174.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 209, SEQ ID NO: 211, SEQ ID NO: 213, SEQ ID NO: 217, SEQ ID NO: 219, SEQ ID NO: 221, SEQ ID NO: 223, SEQ ID NO: 225 и SEQ ID NO: 227. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 229, SEQ ID NO: 231, SEQ ID NO: 233 и SEQ ID NO: 237. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 211, SEQ ID NO: 219 и SEQ ID NO: 221, полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 231. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 209, SEQ ID NO: 223, SEQ ID NO: 225 и SEQ ID NO: 227, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 229. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 213, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 233. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 217, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности SEQ ID NO: 237.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 210, SEQ ID NO: 212, SEQ ID NO: 214, SEQ ID NO: 218, SEQ ID NO: 220, SEQ ID NO: 222, SEQ ID NO: 224, SEQ ID NO: 226 и SEQ ID NO: 228. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 210, SEQ ID NO: 212, SEQ ID NO: 214, SEQ ID NO: 218, SEQ ID NO: 220, SEQ ID NO: 222, SEQ ID NO: 224, SEQ ID NO: 226 и SEQ ID NO: 228. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична последовательности, выбранной из группы, включающей SEQ ID NO: 230, SEQ ID NO: 232, SEQ ID NO: 234 и SEQ ID NO: 238. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая кодируется полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 230, SEQ ID NO: 232, SEQ ID NO: 234 и SEQ ID NO: 238.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 257, либо последовательности SEQ ID NO: 261. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 259, либо последовательности SEQ ID NO: 271. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 257, либо последовательности SEQ ID NO: 261, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 259, либо последовательности SEQ ID NO: 271.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 258, либо последовательности SEQ ID NO: 262. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области тяжелой цепи, которая кодируется полинуклеотидной последовательностью SEQ ID NO: 258 или SEQ ID NO: 262. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 260, либо последовательности SEQ ID NO: 272. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит последовательность вариабельной области легкой цепи, которая кодируется полинуклеотидной последовательностью SEQ ID NO: 260 или SEQ ID NO: 272.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 251, либо последовательности SEQ ID NO: 255. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 253, либо последовательности SEQ ID NO: 265. Согласно следующему варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 251, либо последовательности SEQ ID NO: 255, и полипептидную последовательность, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична либо последовательности SEQ ID NO: 253, либо последовательности SEQ ID NO: 265.
Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%. 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 252, либо последовательности SEQ ID NO: 256. Согласно другому варианту осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью SEQ ID NO: 252 или SEQ ID NO: 256. Согласно одному из вариантов осуществления изобретения иммуноконъюгат содержит полипептидную последовательность, кодируемую полинуклеотидной последовательностью, которая по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична либо последовательности SEQ ID NO: 254,