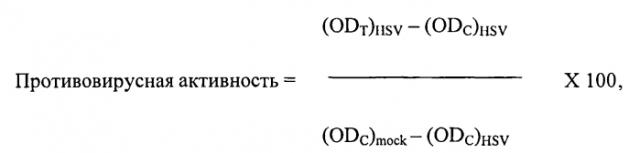
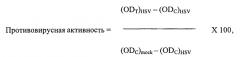
Противовирусная композиция
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к средству для предупреждения или лечения вирусной инфекции, вызванной вирусом простого герпеса (HSV). Выделенный экстракт из ствола (ствола с корой), коры, ветки или ствола без коры растения Ficus arnottiana, полученный определенным способом, для предупреждения или лечения вирусной инфекции, вызванной вирусом простого герпеса (HSV). Композиция, содержащая терапевтически эффективное количество экстракта ствола (ствола с корой), коры, ветки или ствола без коры растения Ficus arnottiana и фармацевтически приемлемый носитель, для предупреждения или лечения вирусной инфекции, вызванной вирусом простого герпеса (HSV). Способ получения композиции. Способ лечения у субъекта вирусной инфекции, вызванной вирусом простого герпеса (HSV), включающий этап, на котором субъекту вводят композицию. Применение композиции для предупреждения или лечения вирусной инфекции, вызванной вирусом простого герпеса (HSV). Применение выделенного экстракта и фармацевтически приемлемого носителя с целью получения лекарственного препарата для предупреждения или лечения вирусной инфекции, вызванной вирусом простого герпеса (HSV). Вышеописанные средства эффективны для предупреждения или лечения вирусной инфекции, вызванной вирусом простого герпеса (HSV). 6 н. и 18 з.п. ф-лы, 10 ил., 4 табл., 18 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к композиции, содержащей экстракт растения Ficus arnottiana, обладающего противовирусной активностью. Настоящее изобретение также относится к способу получения композиции. Настоящее изобретение дополнительно относится к композиции для применения в лечении вирусных инфекций, особенно вызванных вирусом простого герпеса (HSV).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Вирусы являются этиологической причиной многих заболеваний, угрожающих жизни или ухудшающих качество жизни человека. Особое беспокойство вызывают вирусы герпеса, такие как вирус простого герпеса 1 типа (HSV-1), вирус простого герпеса типа 2 (HSV-2), цитомегаловирус (CMV), вирус Эпштейна-Барр (EBV), вирус опоясывающего лишая (VZV) и вирусы герпеса человека 6, 7 и 8 типов (HHV-6, HHV-7 и HHV-8) и т.п.
Простой герпес - это вирусное заболевание, вызванное вирусами простого герпеса (HSV). HSV-1 часто ассоциируется с герпетическим поражением кожи лица, которое известно как герпес губ или простой герпес. Инфекция, вызываемая HSV-1, обычно возникает в слизистой оболочке орофарингеальной зоны, где вирус начинает колонизировать ганглий тройничного нерва и персистирует в нем в латентном состоянии. HSV-2 чаще ассоциируется с генитальным герпесом. HSV-2 обычно передается половым путем и бывает в анусе, прямой кишке, верхнем отделе пищеварительного тракта, а также в области половых органов с диссеминацией в область крестцовых ганглиев. В зависимости от зон контакта оба вируса могут, наоборот, инфицировать слизистую оболочку полости рта или половых органов. Эти вирусы могут проникать в центральную нервную систему, где они реплицируются, и вызывать латентную инфекцию в ганглиях задних корешков.
Заболевания, вызванные HSV, могут становиться угрожающими для жизни пациентов с ослабленным иммунитетом, особенно пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ). После первичного инфицирования HSV сохраняется в организме хозяина в течение всей жизни последнего, поэтому инфекция, вызываемая HSV, рассматривается как пожизненная инфекция (The Journal of Infectious Diseases, 2002, 186, S71-S77).
Несколько противовирусных препаратов, которые применяются для лечения герпеса, включают ацикловир, валацикловир, фамцикловир и пенцикловир. Из числа перечисленных противовирусных средств для лечения вирусных инфекций, вызванных HSV-1 и HSV-2, используется ацикловир.
Растение Ficus arnottiana, которое широко распространено в Индии и на Шри-Ланке, представляет собой лиственное дерево средних размеров без воздушных корней. Растение применяют для лечения заболеваний кожи, воспалений, диареи, диабета, чувства жжения, лепры, чесотки и ран в соответствии с традиционной системой медицины Аюрведа (Natural Product Radiance, 2009, 8 (5), 478-482).
По-прежнему существует необходимость в эффективных композициях и способах профилактики и лечения вирусных инфекций, особенно герпетических инфекций. Частота и степень тяжести герпетических инфекций увеличились из-за увеличения числа пациентов с ослабленным иммунитетом, причиной чего являются агрессивные схемы химиотерапии, растущая частота трансплантации органов и увеличение частоты инфицирования ВИЧ.
Насколько нам известно, на сегодняшний день отсутствует информация о каком-либо лекарственном препарате для лечения вирусных инфекций, содержащем экстракт растения Ficus arnottiana.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 представлена хроматограмма образца 23 из примера 4, проанализированного с помощью ВЭЖХ. На хроматограмме представлены два пика биоактивных маркеров (ВМ), а именно ВМ-1 и ВМ-2.
На фигуре 2 представлена хроматограмма состава IB из примера 6, проанализированного с помощью ВЭЖХ. На хроматограмме представлены два пика биоактивных маркеров (ВМ), а именно ВМ-1 и ВМ-2.
На фигуре 3 показана ингибирующая активность образца 23 из примера 4 по отношению к HSV-1 до инфицирования по сравнению с ингибирующей активностью ацикловира.
На фигуре 4 показана ингибирующая активность образца 23 из примера 4 по отношению к HSV-2 до инфицирования по сравнению с ингибирующей активностью ацикловира.
На фигуре 5 показан ингибирующий эффект образца 23 из примера 4 в отношении адсорбции HSV-1 по сравнению с ингибирующим эффектом ацикловира.
На фигуре 6 показан ингибирующий эффект образца 23 из примера 4 в отношении адсорбции HSV-2 по сравнению с ингибирующим эффектом ацикловира.
На фигуре 7 показана ингибирующая активность образца 23 из примера 4 в отношении проникновения HSV-1 по сравнению с ингибирующей активностью ацикловира.
На фигуре 8 показана ингибирующая активность образца 23 из примера 4 в отношении проникновения HSV-2 по сравнению с ингибирующей активностью ацикловира.
На фигуре 9 показан вирулицидный эффект образца 23 из примера 4 по отношению к HSV-1 по сравнению с вирулицидным эффектом ацикловира.
На фигуре 10 показан вирулицидный эффект образца 23 из примера 4 по отношению к HSV-2 по сравнению с вирулицидным эффектом ацикловира.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем.
Настоящее изобретение также относится к способу получения экстракта растения Ficus arnottiana и композиции, содержащей выделенный экстракт в качестве активного ингредиента.
Настоящее изобретение также относится к противовирусной активности композиции.
В одном из аспектов настоящего изобретения противовирусная активность композиции представляет собой активность против HSV. В одном из аспектов настоящее изобретение относится к композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana и фармацевтически приемлемый носитель, для применения в предупреждении и лечении вирусной инфекции, вызванной вирусом простого герпеса (HSV).
Настоящее изобретение дополнительно относится к способу лечения у субъекта вирусной инфекции, вызванной вирусом простого герпеса (HSV), который включает введение субъекту композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем.
Настоящее изобретение также относится к композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana и фармацевтически приемлемый носитель, для применения в предупреждении вирусной инфекции вместе с использованием презервативов или других барьерных средств контрацепции.
Настоящее изобретение включает композицию, содержащую терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем, для применения в предупреждении и лечении вирусных инфекций, вызванных вирусом простого герпеса (HSV).
Настоящее изобретение также включает применение выделенного экстракта растения Ficus arnottiana с целью производства лекарственного препарата для лечения вирусной инфекции, вызванной вирусом простого герпеса (HSV).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Прежде чем перейти к подробному описанию настоящего изобретения, следует понимать, что данное изобретение не ограничивается конкретными вариантами осуществления. Также следует понимать, что использованная в данном документе терминология применяется только для описания конкретных вариантов осуществления и не рассматривается как ограничивающая.
Использованные в описании и формуле изобретения формы единственного числа охватывают также ссылки на множественное число, если в контексте четко не указано другое.
Если не указано другое, все используемые в данном документе технические и научные термины имеют то же значение, которое обычно понимает средний специалист той области, к которой относится настоящее изобретение.
Используемые в данном документе термины "лечение", "лечить" или "обработка" включают превентивное (профилактическое) и паллиативное лечение.
Термин "Ficus arnottiana" также включает синонимы, такие как "Ficus populifolia", "Urostigma arnottianum" или "Urostigma cordifolium ".
Упоминаемые в данном документе "экстракт" или "выделенный экстракт" означают смесь соединений, которые присутствуют в растении, или фракции, полученные из растения Ficus arnottiana. Такие соединения или фракции получают путем экстракции из измельченного целого растения или частей растения Ficus arnottiana, например ствола (ствола с корой), ствола без коры, коры и веток с применением соответствующих растворителей, при этом за этапом экстракции необязательно может следовать дополнительное обогащение. Термины "экстракт" и "выделенный экстракт" могут использоваться взаимозаменяемо.
Упоминаемые в данном документе "противовирусные лекарственные средства" относятся к классу терапевтических средств, применяемых, в частности, для лечения вирусных инфекций, особенно вызванных вирусами простого герпеса, такими как вирус простого герпеса 1 типа (HSV-1), вирус простого герпеса 2 типа (HSV-2), цитомегаловирус (CMV), вирус Эпштейна-Барр (EBV), вирус опоясывающего лишая (VZV) и вирусы герпеса человека 6, 7 и 8 типов (HHV-6, HHV-7 и HHV-8) и т.п.
Упоминаемая в данном документе "композиция" относится к растительной композиции или фармацевтической композиции, содержащей терапевтически эффективное количество экстракта или выделенного экстракта растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем. Необходимо отметить, что термин "композиция" следует интерпретировать в широком смысле и он включает любую композицию, предназначенную для достижения терапевтического эффекта, имеющуюся в продаже либо как фармацевтический препарат, например, с маркировкой для назначенного указания к применению, либо имеющуюся в продаже как препарат, отпускаемый без рецепта, либо имеющуюся в продаже как растительный лекарственный препарат.
Используемый в данном документе термин "терапевтически эффективное количество" означает количество экстракта растения Ficus arnottiana, которое дает желаемый терапевтический ответ, такой как облегчение, лечение и/или предупреждение вирусной инфекции или симптомов поражения кожи, свищей, герпеса губ, волдырей, наростов, припухлостей, узелков, папул, сыпи и язв, связанных с вирусной инфекцией или вызванных вирусной инфекцией, особенно вызванных HSV-1 или HSV-2.
Под "фармацевтически приемлемым" подразумевается, что носитель, разбавитель, наполнители и/или соль должны быть совместимы с другими ингредиентами, входящими в состав, и не быть вредными для пациента, их получающего.
Используемый в данном документе термин "фармацевтически приемлемый носитель" означает нетоксичное, инертное твердое, полутвердое вещество, разбавитель, такой как вода, инкапсулирующий материал или вспомогательное вещество любого типа для лекарственного состава. Некоторые неограничивающие примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, представляют собой сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал, целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы, солод, желатин, тальк, кроме того другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезивные средства; средства покрытия, подсластители, вкусовые и ароматизирующие средства; консерванты, такие как фенолип, метилпарабен, бутилпарабен и пропилпарабен; антиоксиданты; масла или воски, такие как пчелиный воск, карнаубский воск, твердый воск, желтый воск и цетиловые сложные эфиры; эмульгаторы, такие как моностеарат глицерина; петролатумы, например парафин, ланолиновые спирты, белый вазелин, желтый вазелин, спирты шерстяного жира, нефтяной вазелин и нефтяной воск; гликоли, такие как пропиленгликоль, метилгликоль и метилэтиленгликоль; карбомеры, такие как карбопол 974Р; полиоксиэтиленовые алкиловые эфиры, такие как цетостериловый спирт; пластификаторы, такие как триэтаноламин; растворители и гидрофильные желатинирующие средства также могут присутствовать в композиции согласно решению разработчика рецептуры.
Используемый в данном документе термин "биологически активный маркер" относится к биологически активным химическим соединениям, которые присутствуют в экстракте целого растения или частей растения Ficus arnottiana, таких как ствол (ствол с корой), ствол без коры, кора и ветки. Биологически активные маркеры, выделенные из экстракта ствола растения Ficus arnottiana, проявляют противовирусную активность.
Используемый в данном документе термин "субъект" относится к животному, в частности к млекопитающему, более конкретно к человеку. Используемый в данном документе термин "млекопитающее" относится к теплокровным позвоночным животных класса млекопитающих, включая людей, которые отличаются наличием волосяного покрова на коже и наличием у особей женского пола молочных желез, у которых образуется молоко, для вскармливания потомства. Термин "млекопитающие" включает таких животных как кот, собака, кролик, медведь, лиса, волк, обезьяна, олень, мышь, свинья, а также включает человека.
Растение Ficus arnottiana является широко распространенным видом в Индии и на Шри-Ланке. В различных местах штата Махараштра, Индия, и вблизи этого региона, в Белгауме, Колхапуре, Гоа, собирали целые растения этого вида или части растений, такие как ствол, ствол без коры, кора и ветки. Свежесобранные растения или части растений высушивали. Для определения таксономических характеристик во время цветения и плодоношения собирали образцы гербария и хранили в гербарии под ведомством компании Piramal Healthcare Limited (ранее Piramal Life Sciences Limited), Горегаон, Мумбаи, Индия. На основании морфологических признаков гербарные образцы были отнесены к Ficus arnottiana. Полученные и использованные в данном изобретении экстракты не ограничиваются теми, которые были получены из растений Ficus arnottiana, выращенных в Махараштре, Индия; экстракт может быть получен из любого растения Ficus arnottiana, выращенного в других регионах.
Настоящее изобретение относится к выделенному экстракту из целого растения или одной или нескольких частей растения Ficus arnottiana, полученному путем перемешивания измельченного целого растения или одной или нескольких частей растения с растворителем с последующим концентрированием полученного экстракта и необязательным обогащением экстракта путем разделения растворителем. Части растений, которые могут быть использованы, включают ствол с корой, ствол без коры, кору, листья, ветки, корни, цветки, соцветия, семена и плоды. Предпочтительно, чтобы для применения выбирались такие части растения, как ствол (ствол с корой), ствол без коры, кора и ветки.
Настоящее изобретение дополнительно относится к композиции, содержащей терапевтически эффективное количество выделенного экстракта целого растения или одной или нескольких частей растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем.
Настоящее изобретение также относится к способу получения экстракта растения Ficus arnottiana и композиции, содержащей экстракт в качестве активного ингредиента.
Способ получения композиции включает следующие этапы, на которых:
(а) получают экстракт из измельченного целого растения или одной или нескольких частей растения Ficus arnottiana путем перемешивания с растворителем в соотношении от 1:8 до 1:10 вес/объем в течение 3-12 часов при 30-50°C;
(b) концентрируют экстракт, полученный на этапе (а);
(c) необязательно высушивают экстракт, полученный на этапе (b), под высоким вакуумом (0,01-5 мм рт.ст.);
(d) необязательно обогащают экстракт, полученный на этапе (b) или на этапе (с), путем разделения растворителем и
(e) смешивают экстракт, полученный на этапе (b), этапе (с) или этапе (d), с фармацевтически приемлемым носителем с получением композиции.
В одном из аспектов настоящего изобретения экстракт, полученный на этапе (b), этапе (с) или этапе (d), можно применять без фармацевтически приемлемого носителя.
В другом аспекте настоящего изобретения части растения выбирают из ствола, коры, ствола без коры и веток.
В одном из вариантов осуществления композиция настоящего изобретения содержит экстракт ствола растения Ficus arnottiana. Соответственно, представлен способ получения композиции, содержащей экстракт со ствола растения Ficus arnottiana, который включает следующие этапы, на которых:
(a) получают экстракт из ствола растения Ficus arnottiana путем перемешивания с растворителем в соотношении от 1:8 до 1:10 вес/объем в течение 3-12 часов при 30-50°C;
(b) концентрируют экстракт, полученный на этапе (а);
(c) необязательно высушивают экстракт, полученный на этапе (b), под высоким вакуумом (0,01-5 мм рт.ст.);
(d) необязательно обогащают экстракт, полученный на этапе (b) или этапе (с), путем разделения растворителем и
(е) смешивают экстракт, полученный на этапе (b), этапе (с) или этапе (d), с фармацевтически приемлемым носителем и составляют в терапевтические лекарственные формы.
В одном из аспектов настоящего изобретения экстракт, полученный на этапе (b), этапе (с) или этапе (d), может применяться без фармацевтически приемлемого носителя.
Целое растение или одну или несколько частей растения Ficus arnottiana можно измельчать, при этом целое растение или одну или несколько частей растения Ficus arnottiana можно грубо измельчать, или измельчать в порошок, или измельчать до структуры другого типа.
В одном из вариантов осуществления настоящего изобретения растворитель для экстракции измельченного целого растения или одной или нескольких частей растения Ficus arnottiana выбирают из метанола, этанола, н-пропанола, изопропанола, н-бутанола, ацетона, этилацетата, дихлорметана, воды или их смесей, предпочтительно смеси метанола и воды.
В одном из вариантов осуществления настоящего изобретения экстракт в растворителе перед концентрированием фильтруют.
В одном из вариантов осуществления настоящего изобретения концентрирование экстракта в растворителе осуществляют с применением одного или нескольких способов, выбранных из: (i) перегонки при пониженном давлении (150-600 мм рт.ст.) при 30-50°C; (ii) лиофилизации и (iii) высушивания распылением, с получением экстракта.
В одном из вариантов осуществления настоящего изобретения растворители для обогащения экстракта посредством разделения растворителем выбирают из воды, петролейного эфира, дихлорметана, хлороформа, этилацетата, метанола, ацетона, ацетонитрила, н-пропанола, изопропанола и бутанола или их смесей.
В одном из аспектов настоящего изобретения из экстракта целого растения или одной или нескольких частей растения Ficus arnottiana выделяют один или несколько биологически активных маркеров.
В одном из вариантов осуществления настоящего изобретения в экстракте растения Ficus arnottiana идентифицируют два биологически активных маркера. Биологически активные маркеры выделяют из экстракта и конкретно идентифицируют как флоризин и 5,7,4'-тригидроксифлавон.
В другом варианте осуществления настоящего изобретения из композиции, содержащей экстракт растения Ficus arnottiana, выделяют два биологически активных маркера. Биологически активные маркеры идентифицируют как флоризин и 5,7,4'-тригидроксифлавон.
Соответственно, в одном аспекте настоящее изобретение относится к композиции, содержащей терапевтически эффективное количество экстракта растения Ficus arnottiana, содержащего один или несколько биологически активных маркеров, для применения в предупреждении и лечении вирусной инфекции, вызванной вирусом простого герпеса (HSV).
В одном из вариантов осуществления содержащимся в экстракте биологически активным маркером является флоризин и 5,7,4'-тригидроксифлавон или их смесь.
В одном из вариантов осуществления настоящее изобретение относится к биологически активному маркеру(-ам), выделенному из экстракта растения Ficus arnottiana для применения в лечении вирусной инфекции, вызванной вирусом простого герпеса (HSV), где HSV может быть HSV-1 или HSV-2 и где биологически активный маркер выбирают из флоризина, или 5,7,4'-тригидроксифлавона, или их смесей.
Настоящее изобретение дополнительно относится к способу лечения у субъекта вирусной инфекции, вызванной вирусом простого герпеса (HSV), который включает введение субъекту композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana.
Настоящее изобретение, кроме того, дополнительно относится к способу лечения у субъекта вирусной инфекции, вызванной HSV, где HSV представляет собой HSV-1; при этом способ включает введение субъекту композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana.
Настоящее изобретение также относится к способу лечения у субъекта вирусной инфекции, вызванной HSV, где HSV представляет собой HSV-2; при этом способ включает введение субъекту композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana.
Настоящее изобретение также относится к композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем, для применения в предупреждении и лечении вирусной инфекции, вызванной HSV.
Настоящее изобретение дополнительно относится к композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем, для применения в предупреждении и лечении вирусной инфекции, вызванной HSV, где HSV представляет собой HSV-1.
Настоящее изобретение, кроме того, дополнительно относится к композиции, содержащей терапевтически эффективное количество выделенного экстракта растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем, для применения в предупреждении и лечении вирусной инфекции, вызванной HSV, где HSV представляет собой HSV-2.
Настоящее изобретение также относится к применению терапевтически эффективного количества выделенного экстракта растения Ficus arnottiana в комбинации с фармацевтически приемлемым носителем с целью производства лекарственного препарата для лечения вирусной инфекции.
В одном из аспектов настоящего изобретения субъектом, подлежащим лечению, или субъектом, на которого направлено применение, является млекопитающее, в частности человек, у которого диагностировали инфекцию, вызванную вирусом. Конкретнее, млекопитающим, подлежащим лечению, является человек, у которого диагностировали инфекцию, вызванную HSV.
В другом аспекте настоящего изобретения субъектом, подлежащим лечению, является млекопитающее, в частности человек, у которого диагностировали инфицирование вирусом иммунодефицита человека (ВИЧ) и которому композицию вводят для профилактики коинфицирования HSV-1.
В еще одном аспекте настоящего изобретения субъектом, подлежащим лечению, является млекопитающее, в частности человек, у которого диагностировали инфицирование вирусом иммунодефицита человека (ВИЧ) и которому композицию вводят для профилактики коинфицирования HSV-2.
В дополнительном аспекте настоящего изобретения млекопитающим, подлежащим лечению, является человек, которому композицию вводят для профилактики инфекции, передающейся половым путем (STI).
В другом аспекте настоящего изобретения субъектом, подлежащим лечению, является млекопитающее, в частности человек, у которого диагностировали рецидивирующие инфекции, вызванные HSV.
Настоящее изобретение также предусматривает применение композиции настоящего изобретения в комбинации с другими противовирусными лекарственными средствами, такими как ацикловир, фамцикловир, ганцикловир, имуновир, индинавир или озельтамивир.
В одном из аспектов настоящего изобретения способ лечения вирусной инфекции включает введение вышеописанной композиции с помощью известных способов введения, которые помимо прочего включают нижеследующие.
Композиция может быть введена перорально, например, в виде пилюль, таблеток, таблеток, покрытых оболочкой, капсул, гранул, растворов, эликсиров или сиропа.
В соответствии с настоящим изобретением композиция, составленная для перорального применения (пероральные составы), содержит от приблизительно 5% до приблизительно 99% по весу экстракта растения Ficus arnottiana. Пероральные составы получают путем тщательного смешивания экстракта растения Ficus arnottiana с обычной основой, такой как сахара, крахмалы или смазывающие вещества.
Композиция может применяться для местного или трансдермального применения. Местные композиции настоящего изобретения включают составы, подходящие для местного или трансдермального применения на коже, подходящие для нанесения на слизистые оболочки или введения совместно с презервативом или другим барьерным средством контрацепции. Композиции могут быть составлены в большое разнообразие типов продуктов, которые включают без ограничения лосьоны, крема, гели, палочки, пластыри, вагинальные суппозитории или пессарии, спреи или мази.
В соответствии с настоящим изобретением композиция, составленная для местного или трансдермального применения, содержит от приблизительно 5% до приблизительно 99%, предпочтительно от 5 до 50% по весу экстракта растения Ficus arnottiana. Состав для местного или трансдермального применения получают путем смешивания экстракта растения Ficus arnottiana с обычной основой, такой как масла, воски или гликоли.
Экстракт растения Ficus arnottiana содержится в композиции настоящего изобретения в таком количестве, которое является эффективным для достижения желаемого терапевтического ответа у конкретного пациента, не проявляя при этом токсичности по отношению к пациенту и не вызывая у него тяжелых побочных эффектов. Эффективное количество будет зависеть от множества факторов, включающих активность экстракта, использованного в настоящем изобретении, способ введения, время применения, скорость экскреции конкретной используемой композиции, длительность лечения, возраст, пол, вес, состояние, общее состояние здоровья и прошлую историю болезни пациента, подлежащего лечению, и подобные факторы, хорошо известные в области медицины.
Эффективность экстракта растения Ficus arnottiana устанавливали с помощью биологических анализов, которые подробно описаны в нижеследующих примерах. Эти примеры приведены в данном документе только с целью пояснения и не должны ограничивать объем настоящего изобретения.
Примеры
[Примечание: вода, используемая в протоколах экспериментов, является деминерализованной водой.]
Пример 1
Получение экстракта Ficus arnottiana с применением смеси дихлорметана (DCM) и метанола (1:1)
Свежесобранные стволы Ficus arnottiana высушивали с использованием осушителя и измельчали в порошок. Грубо измельченный материал (150 г) вымачивали в 1500 мл смеси DCM:метанол (1:1) при постоянном помешивании в течение 3 часов в круглодонной колбе, которую помещали на водяную баню, поддерживаемую при температуре 40°C±5°C. Экстракт фильтровали, а остаток вымачивали в 1500 мл смеси DCM:метанол (1:1) в течение 3 часов при 40°C±5°C и фильтровали. Экстракты соединяли и концентрировали с использованием роторного испарителя при 45°C в условиях линейного вакуума (приблизительно 500 мм рт.ст.) с получением 5,0 г первичного экстракта (обозначено как образец 1).
Экстракты из других частей растения, таких как кора ствола, ствол без коры и ветка, получали с использованием смеси DCM:метанол (1:1), следуя тому же способу, который применяли касательно ствола. Выходы экстрактов следующие:
(i) 2,5 г экстракта получили из 50 г коры (обозначено как образец 2);
(ii) 2,0 г экстракта получили из 50 г ствола без коры (обозначено как образец 3);
(iii) 16,3 г экстракта получили из 300 г ветки (обозначено как образец 4).
Пример 2
Обогащение образца 1, образца 2, образца 3 и образца 4 из примера 1
Этап 1. Образец 1 (1 г) суспендировали в 30 мл смеси вода:метанол (9:1) при комнатной температуре (25°C±5°C), обрабатывали ультразвуком для растворения и разделяли последовательно 3 раза с применением 30 мл петролейного эфира (60°C-80°C). Слой петролейного эфира концентрировали на роторном испарителе в условиях линейного вакуума с получением 0,5 г фракции петролейного эфира (обозначено как образец 5).
Этап 2. Водный фильтрат, полученный на этапе 1, разделяли последовательно 3 раза с помощью 30 мл хлороформа. Слой хлороформа концентрировали на роторном испарителе в условиях линейного вакуума с получением 0,10 г фракции хлороформа (обозначено как образец 6).
Этап 3. Водный слой, полученный на этапе 2, затем разделяли последовательно 3 раза с помощью 30 мл этилацетата. Слой этилацетата концентрировали на роторном испарителе в условиях линейного вакуума с получением 0,07 г фракции этилацетата (обозначено как образец 7).
Этап 4. Водный слой, полученный на этапе 3, затем концентрировали на роторном испарителе в условиях линейного вакуума для удаления остаточных органических растворителей и лиофилизировали с получением 0,24 г водной фракции (обозначено как образец 8).
Обогащение экстрактов других частей растения, таких как кора ствола, ствол без коры и ветки, осуществляли тем же способом, что и для экстракта ствола. Выходы экстрактов следующие:
(i) 1 г образца 2 обогащали с получением 0,06 г фракции петролейного эфира (обозначено как образец 9); 0,16 г фракции хлороформа (обозначено как образец 10); 0,07 г фракции этилацетата (обозначено как образец 11) и 0,24 г водной фракции (обозначено как образец 12);
(ii) 1 г образца 3 обогащали с получением 0,21 г фракции петролейного эфира (обозначено как образец 13); 0,19 г фракции хлороформа (обозначено как образец 14); 0,29 г фракции этилацетата (обозначено как образец 15) и 0,28 г водной фракции (обозначено как образец 16);
(iii) 1 г образца 4 обогащали с получением 0,64 г фракции петролейного эфира (обозначено как образец 17); 0,15 г фракции хлороформа (обозначено как образец 18); 0,03 г фракции этилацетата (обозначено как образец 19) и 0,08 г водной фракции (обозначено как образец 20).
Пример 3
Получение метанольного экстракта растения Ficus arnottiana
Свежесобранный ствол Ficus arnottiana высушивали и измельчали в порошок. Грубо измельченный материал (50 г) вымачивали в 500 мл метанола при перемешивании в течение 3 часов в круглодонной колбе, которую помещали на водяную баню, поддерживаемую при температуре 40°C±5°C. Экстракт фильтровали, а остаток вымачивали в 500 мл метанола в течение 3 часов при 40°C±5°C и фильтровали. Экстракты соединяли и концентрировали с применением роторного испарителя в условиях линейного вакуума с получением 2,06 г экстракта (обозначено как образец 21).
Мстанольный экстракт из веток растения Ficus arnottiana получали, следуя тому же способу, который применяли касательно ствола. Из 50 г веток получили 3,95 г экстракта (обозначено как образец 22).
Пример 4
Получение метанольного:водного (1:1) экстракта растения Ficus arnottiana
Свежесобранный ствол Ficus arnottiana высушивали и измельчали в порошок. Грубо измельченный материал (100 г) вымачивали в 1 л смеси метанол:вода (1:1) при постоянном помешивании в течение 3 часов в кругл одонной колбе, которую помещали на водяную баню, поддерживаемую при температуре 40°C±5°C. Экстракт фильтровали, а остаток вымачивали в 800 мл смеси метанол:вода (1:1) в течение 3 часов при 40°C±5°C и фильтровали. Экстракты соединяли и концентрировали с применением роторного испарителя в условиях линейного вакуума и лиофилизировали с получением 5,67 г метанол-водного экстракта (обозначено как образец 23).
Метанол-водный экстракт веток растения Ficus arnottiana получали, следуя тому же способу, который применяли касательно ствола. Из 50 г веток получили 4,03 г экстракта (обозначено как образец 24).
Пример 5
Получение водного экстракта растения Ficus arnottiana
Свежесобранный ствол Ficus arnottiana высушивали и измельчали в порошок. Грубо измельченный материал (50 г) вымачивали в 500 мл воды при постоянном помешивании в течение 3 часов в круглодонной колбе, которую помещали на водяную баню, поддерживаемую при температуре 45°C±5°C. Экстракт фильтровали и лиофилизировали с получением 1,04 г экстракта (обозначено как образец 25).
Водный экстракт ветки растения Ficus arnottiana получали, следуя тому же способу, который применяли касательно ствола. Из 50 г ветки получили 1,11 г экстракта (обозначено как образец 26).
Пример 6
Получение состава
Общий способ получения крема
Необходимое количество метилпарабена и пропилпарабена при слабом нагревании растворяли в пропиленгликоле и воде (см. таблицу 1) в подходящем сосуде из стекла/нержавеющей стали. В сосуд добавляли образец 23 из примера 4 и растворяли/диспергировали с применением механической мешалки. Температуру поддерживали на уровне от 60°C до 75°C. В этот раствор при постоянном перемешивании добавляли глицерилмоностеарат и пропиленгликоль. Расплавляли пчелиный воск, белый мягкий парафин и глицерилмоностеарат и добавляли в вышеуказанный сосуд при постоянном перемешивании. Температуру медленно понижали до комнатной температуры.
| Таблица 1 | ||||
| состав IA, состав IB и состав IC | ||||
| № | Ингредиенты | Состав IA | Состав IB | Состав IC |
| % вес./вес. | % вес./вес. | % вес./вес. | ||
| 1 | Образец 23 из примера 4 | 10 | 20 | 30 |
| 2 | Пчелиный воск | 2 | 2 | 2 |
| 3 | Белый мягкий парафин | 76,8 | 61,8 | 46,8 |
| 4 | Глицерилмоностеарат | 3 | 3 | 3 |
| 5 | Пропиленгликоль | 3 | 3 | 3 |
| 6 | Метилпарабен | 0,18 | 0,18 | 0,18 |
| 7 | Пропилпарабен | 0,02 | 0,02 | 0,02 |
| 8 | Вода | 5 | 10 | 15 |
| Всего | 100 | 100 | 100 |
Пример 7
Аналитический анализ
Часть А: оценка образца 23 из примера 4
Растворяли 100 мг образца 23 из примера 4 в 1 мл смеси метанол:вода (1:1); обрабатывали 1 мл 0,04 М KMnO4 и оставляли на 15 минут при комнатной температуре. Смесь разбавляли разбавителем [метанол:вода (1:1)], фильтровали через фильтр из поливинилиденфторида (PVDF) с диаметром пор 0,45 мкм и анализировали фильтрат с помощью ВЭЖХ.
Условия аналитической ВЭЖХ:
Колонка: Unisphere aqua С 18, 150×4,6 мм, 3 мкм
Подвижная фаза А: 0,1% трифторуксусная кислота
Подвижная фаза В: ацетонитрил
Градиент: время (минуты)/% А: 0/90, 25/60, 30/20, 35/20, 36/90, 40/90
Время прогона: 40 минут
Концентрация: 10 мг/мл
Разбавитель: метанол:вода (1:1)
Длина волны: 270 нм
Результат
На фигуре 1 изображена аналитическая хроматограмма образца 23 из примера 4. На хроматограмме проиллюстрированы пики двух биологически активных маркеров, обозначенных как ВМ 1 (биологически активный маркер 1) и ВМ 2 (биологически активный маркер 2), при времени удерживания 14,3 и 21,8, соответственно. Биологически активные маркеры проявляли противовирусную активность. ВМ 1 и ВМ 2 выделяли и очищали, как описано в части С.
Часть В: оценка состава IB из примера 6
Растворяли 1 г состава IB из примера 6 в 15 мл смеси метанол:вода (1:1) и нагревали при 60°C в течение 20 минут. Полученный в результате раствор разводили разбавителем до объема 20 мл, фильтровали через фильтр из поливинилиденфторида (PVDF) с диаметром пор 0,45 мкм и анализировали фильтрат с помощью ВЭЖХ.
Условия аналитической ВЭЖХ:
Колонка: Unisphere aqua С 18, 150×4,6 мм, 3 мкм
Подвижная фаза А: 0,1% трифторуксусная кислота
Подвижная фаза В: ацетонитрил
Градиент: время (минуты)/% А: 0/90, 25/60, 30/20, 35/20, 36/90, 40/90
Время прогона: 40 минут
Концентрация: 50 мг/мл
Разбавитель: метанол:вода (1:1)
Длина волны: 270 нм
Результат
На фигуре 2 изображена аналитическая хроматограмма состава IB из примера 6. На хроматограмме проиллюстрированы пики двух биологически активных маркеров, обозначенных как ВМ 1 и ВМ 2, при времени удерживания 14,3 и 21,8, соответственно. Биологически активные маркеры проявляли противовирусную активность. ВМ 1 и ВМ 2 выделяли и очищали, как описано в части С.
Часть С: выделение биологически активных маркеров
В 1,6 л метанола растворяли 85,0 г образца 23 из примера 4, обрабатывали ультразвуком в течение 10 минут и оставляли отстаиваться на 30 минут. Надосадочную жидкость сливали и фильтровали с получением фильтрата №1. Нерастворимую часть промывали 200 мл метанола. Надосадочную жидкость фильтровали с получением фильтрата №2. Фильтраты №1 и №2 объединяли и высушивали на роторном испарителе с получением 26,18 г образца. Полученный в