Способ моделирования травматического остеомиелита
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и может быть использовано для моделирования травматического остеомиелита трубчатых костей. Способ включает предварительную сенсибилизацию крыс путем трехкратного внутрибрюшинного введения ослабленной нагреванием при 60°С в течение 30 минут культуры слабовирулентного золотистого стафилококка. Причем через каждые 3 дня сенсибилизацию проводят с постепенным увеличением дозы от 1 до 3 млн бактериальных тел. Далее, через три дня после окончания сенсибилизации, в стерильных условиях под наркозом производят разрез мягких тканей. Через дистальный метафиз бедренной кости толстой иглой формируют отверстие в костно-мозговом канале, в которое вводят активный стафилококк в дозе 6 млн бактериальных тел в 0,1 г 30% раствора желатина. После этого мягкие ткани ушивают кетгутом, рану обрабатывают. Способ обеспечивает получение физиологически точной модели различных стадий послеоперационного травматического остеомиелита при снижении летальности испытуемых животных. 3 ил., 2 табл..
Реферат
Изобретение относится к области медицины и может быть использовано для моделирования острого и хронического травматического остеомиелита.
В современном представлении о патогенезе остеомиелита остаются нерешенные задачи. Невозможность их решения клиническим путем актуализирует поиск модели остеомиелита, которая соответствует закономерностям возникновения и обеспечивает возможность изучения механизма его развития.
Известен способ моделирования остемиелита, предполагающий использование крольчат [1, 2]. Для развития заболевания проводят первоначальную сенсибилизацию организма с последующим депонированием микробов в костно-мозговую полость помощью вязких веществ (ланолина или желатина) [3].
Указанная модель вполне эффективна и приемлема для изучения патогенеза заболевания, но требует значительных материальных затрат и не всегда целесообразна для проведения скрининговых исследований.
Для испытания новых лекарственных средств для лечения заболевания необходимо наличие эффективной и легко реализуемой модели, включающей различные стадии развития остеомиелита. Представляется целесообразным усовершенствование указанной модели остеомиелита с применением крыс, что значительно удешевит эксперимент и сделает более доступным возможность его применения.
Известен способ моделирования развития остеомиелита на крысах [4]. Он заключается в следующем. В костно-мозговой канал большеберцовой кости вводят полую трубку с глухим концом. Производят поперечный дефект кости. Одновременно выполняют сквозное отверстие в стенке трубки. Инфицирующий материал вводят дробно через свободный конец трубки, находящийся вне раны. Введение инфицирующего материала осуществляют в место дефекта кости. Однако у данной модели имеется ряд недостатков:
- модель не предполагает предварительной сенсибилизации организма, в связи с этим возможен большой процент не заболевших животных, что требует повторного инфицирования;
- игла постоянно находится в костно-мозговом канале, дополнительно травматизирует животных и доставляет неудобство в их жизнедеятельности, что не согласуется с «Правилами лабораторной практики в Российской Федерации (GLP) (утв. Приказом Министерства здравоохранения Российской Федерации от 19.06.2003 N 267);
- диаметр большеберцовой кости красы довольно мал, что затрудняет введение инъекционной иглы в костно-мозговой канал;
- введение стафилококка осуществляется без использования вязких веществ, поэтому в ряде случаев наблюдается тяжелое течение заболевания с генерализацией инфекции и гибель животных.
Новый технический результат - получение более физиологически точной модели различных стадий травматического остеомиелита, соответствующей диагнозу, расширение области применения модели и снижение летальности испытуемых животных.
Для достижения нового технического результата в способе моделирования травматического остеомиелита, включающем формирование дефекта костной ткани большеберцовой кости у экспериментального животного с последующим введением в место дефекта инфицирующего материала, предварительно крыс сенсибилизируют путем трехкратного внутрибрюшинного введения ослабленной нагреванием при 60°С в течение 30 мин культуры слабовирулентного золотистого стафилококка, причем через каждые 3 дня сенсибилизацию проводят с постепенным увеличением дозы от 1 до 3 млн бактериальных тел, далее, через три дня после окончания сенсибилизации, в стерильных условиях, под наркозом производят разрез мягких тканей, через дистальный метафиз бедренной кости толстой иглой формируют отверстие в костно-мозговом канале, куда вводят активный стафилококк в дозе 6 млн бактериальных тел в 0,1 г 30%-ного раствора желатина, после этого мягкие ткани ушивают кетгутом, рану обрабатывают.
Способ осуществляют следующим образом. У экспериментального животного формируют дефект костной ткани большеберцовой кости с последующим введением в место дефекта инфицирующего материала, при этом предварительно крыс сенсибилизируют путем трехкратного внутрибрюшинного введения ослабленной нагреванием при 60°С в течение 30 мин культуры слабовирулентного золотистого стафилококка, причем через каждые 3 дня сенсибилизацию проводят с постепенным увеличением дозы от 1 до 3 млн бактериальных тел, далее, через три дня после окончания сенсибилизации, в стерильных условиях, под наркозом производят разрез мягких тканей, через дистальный метафиз бедренной кости толстой иглой формируют отверстие в костно-мозговом канале, куда вводят активный стафилококк в дозе 6 млн бактериальных тел в 0,1 г 30%-ного раствора желатина, после этого мягкие ткани ушивают кетгутом, рану обрабатывают и появление на 10-й день таких признаков изменений лейкоцитарной формулы крови, наличии таких клинических проявлений, как боль при пальпации коленного сустава, увеличение коленного сустава в 2-3 раза по сравнению со здоровой конечностью, наличие гнойного отделяемого из раны, регистрация при проведении сцинтиграфии ускоренного и повышенного поступления препарата в артерии на стороне поражения, также определение участков гиперфиксации индикатора в мягкотканую и костную фазы исследования, подтверждает формирование модели острой стадии травматического остеомиелита, а при появлении к 21 дню признаков снижения общего количества миелокариоцитов, мегакариоцитов, моноцитов и лимфоцитов в костном мозге, изменении лейкоэритробластического отношения клеток костного мозга в сторону уменьшения клеток миелоидного ряда, элементов подтверждающих гнойная инфильтрация костного мозга подтверждает создание модели хронической стадии травматического остеомиелита
Предлагаемый способ основан на анализе результатов экспериментальных исследований. Эксперименты выполняли на 20 белых нелинейных крысах-самцах массой 200-250 г. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище. При проведении экспериментов руководствовались «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР от 12.08.1977 г., №755).
Крыс распределяли на две группы: интактные (группа-1) и животные с экспериментальным остеомиелитом (группа-2). Предварительно крыс группы-2 сенсибилизировали путем внутрибрюшинного введения ослабленной нагреванием (60°С, 30 мин) культуры слабовирулентного золотистого стафилококка через каждые 3 дня. Сенсибилизацию проводили с постепенным увеличением дозы (1 млн, 2 млн и 3 млн бактериальных тел). Микробную взвесь готовили по стандарту мутности ГНИИСК им. Л.А. Тарасевича.
Через три дня после окончания сенсибилизации в стерильных условиях, под наркозом (Золетил, 10 мг/кг в/м) в дистальный метафиз правой бедренной кости вводили дозу активного стафилококка (6 млн. бактериальных тел в 0,1 г 30%-ного раствора желатина). Для чего производили разрез мягких тканей, толстой иглой формировали отверстие в костномозговой канал и, с помощью шприца вводили инфицирующий материал. Затем мягкие ткани ушивали кетгутом. Рану обрабатывали раствором бриллиантового зеленого.
Со следующего дня после проведения операции начинали наблюдение клинических проявлений. Фиксировали показатели общего состояния животных (вялость, малоподвижность, ректально определяли температуру тела) и местные проявления (отек мягких тканей конечности, локальную гипертермию, щадящее положение конечности, наличие свищей, абсцессов). Маркерами развития воспаления служили данные анализов крови, результаты исследования костного мозга, сцинтиграфии и гистологического исследования.
Анализ крови проводили на 7 сутки после операции на автоматическом гематологическом анализаторе для ветеринарии РСЕ 90 Vet (США, High Technology). На 21 сутки эксперимента после эвтаназии СО2-асфиксией левую бедренную кость забирали для количественного определения клеток костного мозга, правую бедренную кость помещали в раствор формалина для последующего гистологического исследования. Костный мозг для подсчета миелограмм брали из грудины, мазки фиксировали в метиловом спирте в течение 5 мин и окрашивали азур II - эозином, приготовленном по Нохту. Для определения общего количества миелокариоцитов (ОКМ), костный мозг из канала левой бедренной кости вымывали 1 мл 5% раствора уксусной кислоты и ресуспендировали. Дополнительное разведение проводили с помощью лейкоцитарного меланжера (конечное разведение в 20000 раз). Вычисление ОКМ проводили с помощью камеры Горяева [5].
Трехфазная сцинтиграфия с 99mТс-технефор (ООО «Диамед», Россия, 18,5 МБк) выполнена на 10 сутки эксперимента на однофотонном эмиссионном компьютерном томографе Philips BrightView (США). Исследование включало в себя радионуклидную ангиографию, мягкотканую фазу (blood-pool) и костную фазу исследования (остеосцинтиграфию).
Для гистологического исследования кость декальцинировали по Грипу [6], обезвоживали в спиртах восходящей концентрации и заливали в парафин. Депарафинированные срезы толщиной 7 мкм окрашивали гематоксилином и эозином.
Результаты экспериментальных исследований статистически обрабатывали в программе Statistica 10.
К 6-7-му дню после проведения операции температура тела заболевших животных повысилась до 38,5°С, но к 20-му дню произошло снижение этого показателя до 36,9°С. На 2-й день у крыс группы-2 наблюдали малоподвижность, щадящее положение конечности, которые сохранялись на протяжении всего эксперимента. К 10 дню у всех крыс группы-2 появилась боль при пальпации, увеличение коленного сустава в 2-3 раза по сравнению со здоровой конечностью, гнойное отделяемое из раны. К 15 суткам у трех животных группы-2 образовались абсцессы в области правой бедренной кости. К 21 суткам животные стали более подвижны, уменьшились боль при пальпации и отек коленного сустава.
На развитие острого воспалительного процесса указывало достоверное увеличение в крови животных группы-2 количества лейкоцитов, нейтрофильных гранулоцитов и моноцитов на 7 сутки заболевания (табл. 1). Количество лимфоцитов достоверно снижалось по сравнению с интактными.
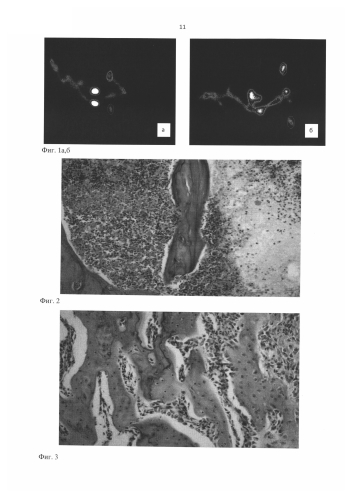
В результате сцинтиграфии на 10 сутки в группе здоровых крыс определялось одновременное поступление индикатора в магистральные сосуды задних конечностей, отсутствие участков гиперфиксации препарата в мягкотканную и костные фазы исследования. Во второй группе регистрировалось ускоренное и повышенное поступление препарата в артерии на стороне поражения, также определялись участки гиперфиксации индикатора в мягкотканую и костную фазы исследования (средняя разница счета по сравнению с симметричным участком 115±5% и 121±10% соответственно), что расценивалось нами как проявление острой стадии остеомиелита (Фиг. 1).
ОКМ в костном мозге заболевших крыс значительно снижалось в сравнении с интактными. В результате развития заболевания был нарушен преимущественно миелоидный росток, на что указывает уменьшение индекса созревания нейтрофилов (ИСН) заболевших в сравнении со здоровыми животными (табл. 2). При этом индекс созревания эритрокариоцитов (ИСЭ) животных обеих групп значительно не отличался. Вследствие этого лейкоэритробластическое отношение (ЛЭО) клеток костного мозга животных группы-2 смещалось в сторону значительного уменьшения клеток миелоидного ряда в сравнении с группой-1. Кроме того, в костном мозге заболевших животных снижалось количество мегакариоцитов на 73%, моноцитов на 61% и лимфоцитов на 51% в сравнении с контролем.
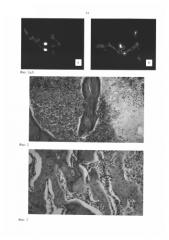
При морфологическом исследовании в диафизе бедренной кости отмечалась гнойная инфильтрация костного мозга. Происходил некроз и аутолиз костных перекладин, кортикального слоя кости, стенок каналов остеонов. Резорбция кости сопровождалась появлением в ней мелких дефектов, заполненных гноем, которые сливались в более крупные фокусы, содержащие секвестры (Фиг. 2). Одновременно с воспалительно-некротическими изменениями в костной ткани происходили репаративные процессы. По периферии остеомиелитического очага отмечалось образование грануляционной ткани, содержащей большое количество фибробластов и остеобластов. Участки некроза замещались молодой костной тканью (Фиг. 3). Полученные результаты характеризовали классическую картину хронического остеомиелита.
Источники информации
1. Стрелков Н.С. Моделирование гнойного остеомиелита в эксперименте: Труды Ижевского мед. ин-та. - 1995. - Т. 33. Ч. 3 - С. 114-115.
2. Переслыцких П.Ф. Экспериментально-теоретические аспекты патогенеза гематогенного остеомиелита. - Иркутск, 1993. - 145 с.
3. Масликов В.М. Сравнительная оценка методов хирургического лечения острого гематогенного остемиелита у детей: автореф. … к.м.н., М., 1979.
4. Матузов С.А., Бусоедов А.В., Котляров В.Н., Сизоненко В.А. Способ моделирования травматического остеомиелита, патент №2129735 от 27.04.1999.
5. Руководство к практическим занятиям по гематологи: учеб.пособие / Новицкий В.В., Уразова О.И. - Томск: Изд-во Томского университета, 2007. - 230 с.
6. Пирс Э. Гистохимия. М.: изд-во иностранной литературы, 1962, 690 с.
Таблица 1. Результаты анализов крови опытных животных
Таблица 2. Миелограмма костного мозга опытных животных
Фиг. 1. Сцинтиграфия крысы на 20 сутки после моделирования остеомиелита. Повышенная концентрация радиофармацевтического препарата в мягкотканую фазу (а) и костную фазу (б) исследования в зоне поражения правой бедренной кости.
Фиг. 2. Бедренная кость крысы на 21 сутки после моделирования остеомиелита. Некроз и резорбция костной балки в зоне гнойного воспаления. Окраска гематоксилином и эозином. Ув. 100 х.
Фиг. 3. Бедренная кость крысы на 21 сутки после моделирования остеомиелита. Грануляционная ткань с большим количеством остеобластов. Участки остеогенеза. Окраска гематоксилином и эозином. Ув. 100 х.
Способ моделирования травматического остеомиелита, включающий формирование дефекта костной ткани большеберцовой кости у экспериментального животного с последующим введением в место дефекта инфицирующего материала, отличающийся тем, что предварительно крыс сенсибилизируют путем трехкратного внутрибрюшинного введения ослабленной нагреванием при 60°С в течение 30 минут культуры слабовирулентного золотистого стафилококка, причем через каждые 3 дня сенсибилизацию проводят с постепенным увеличением дозы от 1 до 3 млн бактериальных тел, далее, через три дня после окончания сенсибилизации, в стерильных условиях, под наркозом производят разрез мягких тканей, через дистальный метафиз бедренной кости толстой иглой формируют отверстие в костно-мозговом канале, куда вводят активный стафилококк в дозе 6 млн бактериальных тел в 0,1 г 30%-ного раствора желатина, после этого мягкие ткани ушивают кетгутом, рану обрабатывают.