Моноклональное антитело сс3-4 к конформационному эпитопу с3 человека, штамм гибридной днк мыши рккк(п)764д - продуцент моноклонального антитела сс3-4
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Предложено моноклональное антитело, способное специфически связываться с молекулой С3 комплемента человека с экспонированной тиоэфирной связью, и штамм гибридомы мыши РККК(П)764Д. Антитело по настоящему изобретению блокирует альтернативный путь активации комплемента и может найти дальнейшее применение в создании антител, пригодных для клинического применения. 2 н. и 2 з.п. ф-лы, 5 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к области биотехнологии, в частности к антителам, связывающим компонент С3 комплемента человека и блокирующим альтернативный путь активации комплемента.
Система комплемента играет важную роль в иммунной защите организма, в частности, при аутоиммунных заболеваниях и заболеваниях, связанных с воспалением тканей. Список заболеваний, связанных с активацией комплемента, включает такие аутоиммунные заболевания, как ревматоидный артрит, системная красная волчанка, васкулиты, рассеянный склероз и др. [Ballanti. Immunol Res 56(2-3):477-91 (2013)], а также повреждения тканей после ишемии и реперфузии, хронический легочный дистресссиндром, тиреоидит, сахарный диабет, ряд глазных заболеваний и многие другие заболевания [Walport. N Engl J Med 3441058-1066 (2001)]. Система включает более 30 белков, выполняющих регуляторные и иные функции. Так, повышенные концентрации его компонентов С3а, С5а, C5b-9, циркулирующих в крови и других жидкостях организма в условиях острого или хронического воспаления, вызывает и поддерживает активацию нейтрофилов, моноцитов, тромбоцитов, клеток эндотелия сосудов.
Система комплемента активируется тремя различными путями: классическим, альтернативным и лектиновым. [https://ru.wikipedia.org/wiki/ Система комплемента; Pyz et al., Ann Med 38, 242-251 (2006)]. Классический путь активируется комплексами антиген-антитело, лектиновый - узнаванием углеводных компонентов лектинами, альтернативный - связыванием СЗ с распознаваемыми мотивами на поверхности патогена.
Все три пути активации приводят к протеолитическому расщеплению С3 с образованием фрагментов C3b и С3а, при этом в молекулах С3 и C3b экспонируется сложный тиоэфир, нуклеофильная атака которого приводит к ковалентному связыванию C3b с антигеном (обычно - с поверхностными структурами микробной клетки). Дальнейшее расщепление связанного C3b специфическими протеиназами приводит к образованию фрагментов C3b, С3с и C3dg, которые, наряду с C3b и С3а, распознаются различными рецепторами фагоцитов. Расположенный на поверхности микробных клеток C3b связывает фактор В комплемента, в результате чего фактор В становится субстратом для сериновой протеиназы - фактора D. В результате протеолиза фактором D фактор В распадается на фрагменты Ва и Bb. Bb также является активной протеазой, которая остается связанной с C3b на поверхности микробной клетки. Комплекс C3bBb является С3-конвертазой, атакующей С3, концентрация которого в сыворотке крови человека составляет 1,2 мг/мл. В результате количество C3b еще более увеличивается, поскольку одна молекула С3-конвертазы нарабатывает около 1000 молекул C3b, ковалентно связанных с микробной клеткой и опсонизирующих ее для последующего фагоцитоза. Кроме того, С3 конвертаза, присоединяя дополнительно молекулу C3b, становится С5 конвертазой, (C3b)2Bb, расщепляющей С5 на С5а и C5b. Анафилотоксины С5а и С3а являются активаторами нейтрофилов воспалительных фагоцитов и хемоаттрактантами, притягивающими тучные клетки к очагу заражения, что приводит к локальному выделению гистамина, вазодилятации, накоплению в очаге воспаления фагоцитирующих клеток и к другим воспалительным эффектам. Дальнейшие каскадные реакции в системе комплемента приводят также к образованию мембраноатакующего комплекса, образующего поры в мембранах микробных клеток.
Активация комплемента по альтернативному пути включает в себя так называемую петлю усиления, которая, с участием факторов В, D и Р (про-пердина) усиливает протеолиз С3 по принципу положительной обратной связи, что в ряде случаев приводит к негативным последствиям для организма больного. Одним из возможных механизмов ингибирования образования активной С3-конвертазы и последующего блокирования альтернативного пути активации комплемента является связывание или блокирование активации С3 в организме больного, например, с помощью химерных или гуманизированных антител.
В частности, известно, что все последовательные превращения С3 и его дочерних компонентов, происходящие в процессе активации альтернативного пути комплемента, сопровождаются конформационными перестройками молекул, что приводит к появлению новых антигенных детерминант, так называемых неоантигенов. Были получены моноклональные антитела к некоторым неоантигенам, способные подавлять активацию альтернативного пути комплемента, в частности, мышиные, химерные и гуманизированные антитела к С3 и C3b и их функциональные фрагменты (WO 2004031240, WO 2013152024, RU 2473563, ЕА 2011101593, WO 2006012621), которые избирательно подавляют альтернативный путь активации комплемента. Однако ни одно из заявленных ранее химерных и гуманизированных антител до сих пор не применяется в медицинской практике в связи с недостаточной эффективностью технологии их получения.
Наиболее близкими по технической сущности к заявляемому изобретению являются антитела против C3b, Fab-фрагмент которых ингибирует альтернативный каскад комплемента с IC50 около 100 нМ, содержит последовательности CDR тяжелой (SEQ ID NO: 1-4) и/или легкой (SEQ ID NO:5-8) цепей антитела S77 и/или представляет собой антитело S77 или его фрагмент [RU 2473563, 2011].
Вместе с тем данные антитела имеют ограниченную область применения, в частности не блокируют активность сложного тиоэфира С3. Кроме того, технология их получения недостаточно эффективна.
Технической задачей, решаемой авторами, являлось расширение спектра антител к компоненту С3 человека, способных к ингибированию его биологической активности, в частности, созданию антител, которые способны специфично связываться с антигенной детерминантой на молекуле С3 с экспонированной тиоэфирной связью, которая появляется в составе С3 конвертазы альтернативного пути и в биологически активной молекуле гидролизованного С3 компонента комплемента человека, и не связываться с нативной молекулой С3 компонента человека.
Технический результат достигается созданием группы изобретений, включающих в себя моноклональные антитела СС3-4, которые специфично и с высокой аффинностью связываются с молекулой С3 компонента комплемента человека с экспонированной тиоэфирной связью и блокируют альтернативный путь активации комплемента, и мышиной гибридомы sCC3-4, продуцирующей данное моноклональное антитело.
Технология получения гибридомы включала в себя иммунизацию животных антигеном, представляющим собой сыворотку крови человека, активированную по альтернативному пути, использование данного модифицированного антигена для иммунизации животных с последующим отбором клонов, продуцирующих антитела, связывающих С3 компонент комплемента человека с экспонированной тиоэфирной связью и не связывающих нативный С3, и очисткой полученного антитела.
Полученное мышиное моноклональное антитело узнает конформационный эпитоп (неоантиген), который обычно отсутствует в молекуле С3 и появляется при его активации по альтернативному пути. Моноклональное антитело СС3-4 по настоящему изобретению не связывается с нативным С3, у которой тиоэфирная связь находится внутри молекулы, изолированная от ее поверхности петлей, образованной α-цепью фрагмента молекулы и не блокирует активацию комплемента по классическому пути.
Перечень чертежей и иного иллюстративного материала.
На фиг. 1 показаны результаты электрофореза в полиакриламидном геле мышиного моноклонального антитела СС3-4 (4-20% полиакриламидный гель):
а - невосстанавливающие условия;
б - маркеры молекулярных весов (кД);
в - восстанавливающие условия.
На фиг. 2 демонстрируется блокирование МАТ СС3-4 активации альтернативного пути активации комплемента. Показано подавление АПК МАТ СС3-4 при различных соотношениях антитело:антиген.
На фиг. 3 показано влияние МАТ СС3-4 на активность С3-конвертазы. Продемонстрирована остановка активации комплемента по альтернативному пути во времени различными агентами.
На фиг. 4 продемонстрировано уточнение эпитопной специфичности МАТ СС3-4. Показаны результаты электрофореза в ПААГ 4-20% С3 сыворотки крови человека и продуктов его активации с последующим иммуноблотом с поликлональными антителами кролика к C3d человека.
На фиг. 5 показано определение константы связывания МАТ СС3-4 с С3, обработанным гидразингидратом, с помощью зависимости Скэтчарда.
Список приводимых последовательностей
Seq ID NO: 1 Последовательность нуклеотидов, кодирующая вариабельную область тяжелой цепи моноклонального антитела СС3-4
Seq ID NO: 2 Последовательность нуклеотидов, кодирующая вариабельную область легкой цепи антитела СС3-4
Seq ID NO: 3 Последовательность аминокислот вариабельной области тяжелой цепи моноклонального антитела СС3-4
Seq ID NO: 4 Последовательность аминокислот вариабельной области легкой цепи моноклонального антитела СС3-4
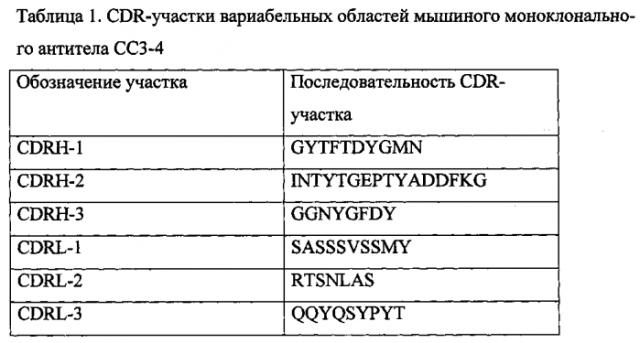
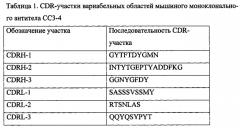
Seq ID NO: 5 Последовательность аминокислот участка CDRH-1 моноклонального антитела СС3-4
Seq ID NO: 6 Последовательность аминокислот участка CDRH-2 моноклонального антитела СС3-4
Seq ID NO: 7 Последовательность аминокислот участка CDRH-3 моноклонального антитела СС3-4
Seq ID NO: 8 Последовательность аминокислот участка CDRL-1 моноклонального антитела СС3-4
Seq ID NO: 9 Последовательность аминокислот участка CDRL-2 моноклонального антитела СС3-4
Seq ID NO: 10 Последовательность аминокислот участка CDRL-3 моноклонального антитела СС3-4
Полученный штамм гибридных культивируемых клеток животных (гибридом) - продуцент моноклонального антитела СС3-4 к неоантигену активированной формы компонента С3 комплемента человека (авторское наименование штамма: SCC3-4) характеризовался следующими свойствами.
1. Родословная штамма (родительские клетки гибридомы - миелома мышей SP2/0 и спленоциты мыши линии BALB/C; антиген - гидрозиноли-зованный С3 компонент комлпемента человека; слияние проведено с помощью полиэтиленгликоля с последующим клонированием продуцента методом лимитирующих разбавлений).
2. Число пассажей к моменту паспортизации и депонирования - 20.
3. Стандартные условия выращивания (культивирование при температуре 37°С, питательная среда RPMI 1640 с 10% фетальной сыворотки крупного рогатого скота).
4. Культуральные свойства (тип роста - суспензионный, культивирование роллерное или стационарное, кратность рассева 1:5, время субкультивирования 3-4 дня, посевная доза 50 тыс.кл./мл).
5. Характеристика культивирования гибридомы в организме животного (гибридома культивируется в перитонеальной полости сингенных мышей (BALB/C), доза клеток при перевивке 2-3·106 кл./мышь, метод сенсибилизации животного - предварительное введение 0,2 мл пристана, время образования асцита или отбора сыворотки 12-16 суток, перевиваемость - не более 10 пассажей).
6. Данные по видовой принадлежности - сингенные мыши BALB/C.
7. Маркерные признаки и методы их оценки: культура продуцирует иммуноглобулины IgG1 типа, специфически связывающие С3 компонент комлемента человека.
8. Контроль контаминации бактериями, грибами, микоплазмами и вирусами (нет)
9. Характеристика полезного вещества, продуцируемого штаммом (культура продуцирует иммуноглобулины IgG1 типа, специфически связывающие С3 компонент комлемента человека).
10. Характеристика биосинтеза полезных продуктов, выход продукта в среду, уровень активности - при культивировании гибридома секретирует за время субкультивирования моноклональное антитело в количестве 5-10·105 мкг/мл среды. Контроль продуктивности осуществляется с помощью твердофазного иммуноферментного анализа. Стабильность продуцирования антител сохраняется на протяжении 15 пассажей в культуре и 10 пассажей на животных.
11. Способ криоконсервирования - криоконсервирование проводится при -70°С, длительное хранение культуры осуществляется при -70°С в холодильнике или при -196°С в жидком азоте, отогрев проводится с помощью быстрого переноса ампулы с культурой на водяную баню с температурой 37°С. Среда для криоконсервирования - 90% фетальной сыворотки крупного рогатого скота и 10% диметилсульфоксида.
12. Другие особенности штамма - гибридома вызывает образование солидных, асцитных или смешанных опухолей при прививке в перионатальную полость мышам линии BALB/C в дозе 2-3·106 кл./мышь.
Гибридома депонирована в коллекцию под №РККК(П)764Д
Сущность и промышленная применимость изобретения поясняются следующими примерами.
Пример 1. Получение антигенов для иммунизации и скрининга гибридом, иммунизация мышей и отбор гибридомы sCC3-4.
1.1. Получение антигенов
Для иммунизации использовали сыворотку крови человека, активированную по альтернативному пути. Для этого 450 мкл сыворотки смешивали с 50 мкл 20 мМ Hepes буфера рН 7,4, содержащего 150 мМ NaCl, 100 мМ ЭГТА, 50 мМ MgCl2 и 10 мг/мл зимозана. Полученную смесь инкубировали при постоянном перемешивании в течение 60 минут при температуре 37°С. По концентрации образуемого С3а судили об эффективности активации, конверсия С3 составляла не менее 55-60%. Полученный препарат аликвотировали и хранили при -80°С.
Для определения специфичности моноклональных антител использовали С3 компонент комплемента человека, обработанный гидразин-гидратом, который эффективно разрывает тиоэфирную связь. С3 компонент комплемента был получен из сыворотки здоровых доноров иммуноаффинной хроматографией с помощью моноклональных антител СС3а-1 к компоненту С3 комплемента человека в физиологических условиях. К 20 мл сыворотки человека (ЧНС) добавляли 1 мл 1М ε-аминокапроновой кислоты (6-AKK) и 1 мл 0,5М ЕДТА. Приготовленную таким образом сыворотку наносили на колонку 2,6×30 см МАТ СС3а-1-Сефарозы, уравновешенную 0,02М Na-фосфатным буфером, содержащим 0,3M NaCl, 0,05М 6-AKK и 0,02М ЕДТА, рН 7,4. Сыворотку пропускали со скоростью 15 мл/час, после чего колонку отмывали с той же скоростью 200 мл уравновешивающего буфера. Далее проводили дополнительную промывку колонки с той же скоростью 180 мл того же буфера и собирали фракцию гемолитически активного С3. Раствор С3 после диализа против 0,005М трис-HCl буфера рН-7,8 концентрировали ионообменной хроматографией на колонке 1,6×5 см ДЕАЕ-Сефацеля, уравновешенной буфером для диализа. Элюцию С3 проводили линейным градиентом NaCL 0-0.5М со скоростью 90 мл/час. Фракцию, содержащую гемолитическую активность С3, аликвотировали и хранили при -80°С. По результатам электрофореза в ПААГе данная фракция содержала белок с молекулярным весом 190 кД, который в восстанавливающих условиях распадался на две полипептидные цепи 115 и 75 кД, что соответствует компоненту С3 комплемента человека.
Для получения гидрозинализированного антигена в образец, содержащий 1 мг/мл С3, вносили нейтрализованный до рН-7,8 гидразингидрат до конечной концентрации 0,1М и инкубировали 1 час в термостате 37°С при постоянном перемешивании, затем диализовали против 0,02М фосфатного буфера, аликвотировали и хранили при -80°С.
1.2. Иммунизация мышей и скрининг гибридомы
Мышей линии Balb/c иммунизировали полученным, как описано в п.п. 1.1 препаратом сыворотки в полном адъюванте Фрейнда в концентрации 10 мкг/мышь в апоневроз задних конечностей. На 28 день мышам повторно внутривенно вводили антиген в дозе 50 мкг/мышь. Еще через 4 дня проводили выделение клеток селезенки и их слияние с клетками миеломы SP2/0 по стандартной процедуре (Shivanand Pandey. Hybridoma Technology For Production Of Monoclonal Antibodies // International Journal of Pharmaceutical Sciences Review and Research. - Volume 1, Issue 2, March - April 2010; Article 017) Через 12-14 суток проводили клонирование и определение специфичности секретируемых клонами моноклональных антител по подавлению продукции С3а и С5а в тесте активации комплемента по альтернативному пути, отбирая нейтрализующие клоны. Для этого к 50 мкл отобранной культуральной среды добавляли 50 мкл сыворотки крови человека, предварительно в 20 раз разбавленной 20 мМ буфером HEPES (рН 7,2-7,4), содержащим 150 мМ NaCl, 10 мМ ЭГТА, 5 мМ MgCl2, 1 мг/мл БСА (Буфер АПК) и 10 мкл суспензии зимозана (1 мг/мл), приготовленной в буфере АПК. Плату инкубировали 1 час при 37°С, после чего вносили в ячейки по 10 мкл раствора, содержащего 0,2 М ЭДТА, 1 мМ PMSF. Степень подавления активации комплемента определяли по содержанию анафилатоксинов С3а и С5а в пробах после инкубации. Концентрации С3а и С5а определяли иммуноферментным анализом, используя стандартизованные тест-системы.
Для отбора клонов, связывающих С3 компонент комплемента человека с экспонированной тиоэфирной связью и не распознающих нативный С3, культуральнуто среду клонов, подавляющих альтернативную активацию комплемента, дополнительно скринировали, для чего в ячейки платы с сорбированными поликлональными антителами к иммуноглобулинам мыши вносили по 100 мкл промывочного буфера, содержащего 20 мМ фосфатного буфера и 0,05% Tween-20 и 50 мкл культуральной среды. Через 1 час инкубации на шейкере при 37°С ячейки отмывали промывочном буфером и вносили по 100 мкл промывочного буфера, содержащего 1 мг/мл БСА и 100 нг/мл или гидразинализированного или нативного С3. Через час инкубации в ячейки вносили по 100 мкл раствора коньюгата антител кролика к С3 человека с пероксидазой. Клоны, которые связываются только с гидразинализированным С3, отбирали для дальнейшей работы.
В результате был отобран клон sCC3-4, продуцирующий мышиное моноклональное антитело СС3-4, связывающее С3 компонент комплемента с экспонированной тиоэфирной связью и не связывающее нативный С3 компонент комплемента человека.
В результате последующего внутрибрюшинного размножения, криоконсервирования и контроля чистоты клеток был получен штамм гибридомы sCC3-4, продуцент моноклонального антитела СС3-4.
Пример 2. Исследование свойств моноклонального антитела СС3-4 2.1. Очистка МАТ СС3-4
Антитело СС3-4 выделяли из асцитной жидкости мышей линии Balb/c внутрибрюшинно привитой гибридомой sCC3-4 с помощью аффинной хроматографии на сорбенте Сефароза-С3.
2.2. Изучение молекулярных свойств антитела СС3-4.
По результатам электрофореза в 4-20% полиакриламидном геле с ДДС натрия молекулярный вес антитела СС3-4 в невосстанавливающих условиях соответствует ожидаемому для нативного IgG мыши (170 кДа), в востанавливающих условиях антитело диссоциирует на тяжелую (55 кДа) и легкую (29 кДа) цепи (фиг. 1). Изотип антитела СС3-4, установленный с помощью набора «Mouse monoclonal antibody isotyping reagents» производства фирмы «SIG-МА» - IgG1. Препараты очищенного антитела СС3-4 использовали для изучения его биологических свойств.
2.2. Исследование биологических свойств моноклонального антитела СС3-4.
2.2.1. Изучение блокирования моноклональным антителом (МАТ) СС3-4 альтернативного пути активации комплемента (АПК). Активацию комплемента по альтернативному пути (АПК) проводили в 20 мМ буфере HEPES (рН 7,2-7,4), содержащем 150 мМ NaCl, 10 мМ ЭГТА, 5 мМ MgCl2, 1 мг/мл БСА (Буфер АПК) путем инкубации сыворотки с активатором АПК зимозаном в в 96-луночном планшете для ИФА. В ряды ячеек планшета вносили по 80 мкл специфических анти-С3 антител (Анти-С3 МАТ) или неспецифических моноклональных антител (МАТ) (положительный контроль) и 20 мкл сыворотки крови здоровых доноров, содержащей 1М ε-аминокапроновой кислоты. Пробу инкубировали при 37°С при постоянном перемешивании в течение 10 мин, после чего в ячейки вносили по 10 мкл суспензии зимозана (с концентрацией 10 мг/мл), приготовленной в Буфере АПК. Для отрицательного контроля вместо зимозана вносили буфер АПК. Плату инкубировали 1 час при температуре 37°С при постоянном перемешивании на шейкере. Активацию комплемента останавливали внесением в ячейки 10 мкл раствора, содержащего 0,2 М ЭДТА, 1 мМ PMSF. Концентрации антител в инкубационных пробах варьировали от эквимолярного значения по отношению к концентрации антигена С3, которую предварительно определяли в сывороточных пробах с помощью ИФА, в сторону понижения. Установленные отношения молярных концентраций Анти-С3 МАТ: СЗ в экспериментальных пробах составили 1:1, 1:2, 1:4, 1:8, 1:16. Степень активации комплемента определяли по содержанию анафилатоксинов С3а и С5а в пробах после инкубации. Степень спонтанной активации комплемента учитывали, измеряя концентрации С3а и С5а в пробах, содержащих 90 мкл Буфера А и 20 мкл сыворотки после инкубации при тех же условиях. Концентрации С3а и С5а определяли иммуноферментным анализом, используя стандартизованные тест системы.
О нейтрализующей (блокирующей) способности судили по изменению уровней анафилактосинов С3 и С5 в сывороточных пробах в зависимости от концентрации антител.
Для количественных расчетов полагали, что 100%-ной активации комплемента и его компонентов С3 и С5 соответствуют концентрации С3а и С5а, измеряемые в пробах, содержащих неспецифические МАТ, т.е. в отсутствие потенциальных ингибиторов. Подавление АПК выражали в процентах ингибирования (ПИ) и рассчитывали для каждого анафилатоксина отдельно по формуле: ПИ(С5а/С3а)=((А-С)-(В-С))/(А-С))×100%, где:
А - концентрация анафилатоксина, мкг/мл, в образце, не содержащем неспецифические МАТ.
В - концентрация анафилатоксина в данном образце, мкг/мл.
С - концентрация анафилатоксинов, мкг/мл, получаемая за счет спонтанной активации.
Результаты, представленные на фиг. 2, показывают, что 100%-ное подавление АПК, оцененное по уровням продукции обоих анафилатоксинов, достигается при молярном отношении МАТ СС3-4:С3, равном 1:8. Поскольку ингибирование достигается при соотношении АТ/АГ меньше единицы, то становится очевидным, что для достижения эффективного ингибирования достаточно нейтрализовать лишь часть молекул С3. Этот факт позволил предположить, что антитела нейтрализуют долю молекул С3, участвующих на стадии инициации АПК.
2.2.2. Изучение блокирования моноклональным антителом (МАТ) СС3-4 классического пути активации комплемента (КПК).
Для проверки способности МАТ СС3-4 блокировать активацию комплемента по классическому пути был проведен гемолитический тест. Для активации КПК использовались сенсибилизированные эритроциты барана. Для приготовления сенсибилизированных эритроцитов барана 300 мкл эритроцитарной массы, содержащей 3*109 эритроцитов, трижды отмывали эритроциты в вероналовом солевом буфере, содержащем 0,1% желатина, 2,5 мМ MgCl2, 0,75 мМ CaCl2 (Буфер КПК). Осадок эритроцитов после отмывки ресуспензировали в 3 мл Буфера КПК и добавили 3 мл этого же буфера, содержащего реактив «Комплемент» (лиофилизат сыворотки морской свинки, иммунизированной эритроцитами барана), разведенный в 200 раз. Инкубировали суспензию 30 мин при 37 градусах при постоянном перемешивании. По окончании инкубации сесибилизированные эритроциты трижды отмывали центрифугированием в Буфере КПК. Осадок эритроцитов развели в 14 мл Буфере КПК.
В крутлодонную плату для иммунологических работ внесли в каждую ячейку по 50 мкл пулированной сыворотки человека, разведенной в 10 раз в Буфере КПК и 50 мкл растворов МАТ СС3-4 и анти-С5 МАТ в качестве контроля с концентрациями 500 мкг/мл, 200 мкг/мл, 100 мкг/мл, 50 мкг/мл в Буфере КПК, содержащем 1 мг/мл БСА. После предварительной инкубации 5 минут внесли в ячейки по 100 мкл суспензии эритроцитов. Инкубировали плату 60 мин при постоянном перемешивании при 37°С. По окончании активации эритроциты осадили центрифугированием, супернатанты перенесли в плоскодонные чистые платы для измерения ОД при 415 нм. МАТ СС3-4 не проявили способности блокировать КПК.
2.2.3. Исследование влияния МАТ СС3-4 на активность С3-конвертазы альтернативного пути.
Так как С3-конвертазы альтернативного пути: жидкофазная, твердофазная и так называемая С3-конвертаза петли усиления - являются Mg-зависимыми, внесение в сыворотку ЭДТА приводит к остановке альтернативной активации комплемента. Для изучения влияния МАТ СС3-4 на все названные выше С3-конвертазы, в ячейки 96-луночной платы для анализа вносили по 80 мкл буфера HEPES (рН 7,2-7,4), содержащего 150 мМ NaCl, 1 мг/мл БСА, 10 мМ ЭГТА, 5 мМ MgCl2, 20 мкл сыворотки крови человека, содержащей 1М ε-аминокапроновой кислоты и 10 мкл суспензии зимозана в буфере для АПК с концентрацией 10 мг/мл и инкубировали при 37°С и при постоянном перемешивании на шейкере в течение 1 часа. Через разные промежутки времени в ячейки вносили по 10 мкл раствора, содержащего 0,2 М ЭДТА, 1 мМ PMSF или 10 мкл МАТ СС3-4 в концентрации 1 мг/мл. По истечении часа степень активации определяли по содержанию анафилатоксина С3а в образцах, которое определяли иммуноферментным анализом. Кривые инактивации альтернативного пути комплемента, представленные на фиг.3, идентичны, что указывает на инактивацию МАТ СС3-4 С3-конвертазы альтернативного пути.
2.2.3. Уточнение участка связывания МАТ СС3-4.
По предварительным данным специфичность МАТ СС3-4 нельзя выявить в вестернблоте, так как неодетерминанта СС3-4 является конформационной и при обработке SDS денатурирует. Для того чтобы определить, с какой областью С3 взаимодействуют МАТ СС3-4, С3 и его фрагменты, связывающиеся с СС3-4, были выделены из активированной зимозаном сыворотки крови человека с помощью аффинной хроматографии на сорбенте сефароза-СС3-4. Полученный материал анализировали в вестернблоте в неденатурирующих условиях. Для идентификации фрагментов использовали поликлональные кроличьи антитела к C3d и С3с (Behring Diagnostics GmbH, Германия)
Из результатов, прдставленных на фиг.4 следует, что минимальным по размеру фрагментом С3, связывающимся с СС3-4, является фрагмент с молекулярной массой приблизительно 39 кДа, который открывается антителами к С3с и не открывается антителами к C3d, что соответствует а 2 фрагменту С3с.
2.2.4. Изучение аффинности МАТ СС3-4 к С3, обработанному гидразингидратом
Для определения аффинности МАТ СС3-4 к антигену использовали метод ИФА с анализом результатов связывания по методу Скэтчарда (Варфоломеев С.Д., Гуревич К.Г. // Биокинетика: Практический курс. М., 1999. С. 352), основанному на исследовании зависимости отношения равновесной концентрации комплекса антиген-антитело к концентра-ции свободного антигена от концентрации комплекса. В качестве антигена использовали С3 человека, обработанный гидразингидратом и отделенный от нативной формы С3 обращеннофазной хроматографией.
Зависимость Скэтчарда представлена на рис. 5, из которой было вычислено значение константы диссоциации KD=2,92×10-10М (что соответствует константе связывания Ксв=(3,42±0,10)×10-9М).
Пример 3. Синтез и секвенирование кДНК, кодирующих вариабельные части легкой и тяжелой цепей моноклонального антитела СС3-4.
Из клеток гибридомы СС3-4 выделяли РНК, на матрице которой с помощью наборов синтетических праймеров (Immunogenetics Information System http://www.imgt.org) были амплифицированы фрагменты ДНК, кодирующие вариабельные области тяжелой (VH) и легкой (VL) цепей антитела. Полученные фрагменты ДНК были клонированы в вектор pALTA (Евроген) и сиквенированы с внешних праймеров (М13). Последовательности фрагментов ДНК, кодирующих VH и VL, представлены на SEQ ID No: 1 и SEQ ID No: 2, вычисленные аминокислотные последовательности VH и VL представлены на SEQ ID No 3 и SEQ ID No 4. Анализ последовательностей аминокислот вариабельных областей тяжелой и легкой цепей моноклонального антитела СС3-4 производили по Кэботу (Kabat Е.А., Wu Т.Т., Perry Н., Gottesman К. and Foeller С. (1991) Sequences of Proteins of Immuno-logical Interest, Fifth Edition. NIH Publication No. 91-3242), что позволило выделить участки CDR, определяющие комплементарность антитела антигену (табл. 1).
Сравнение последовательностей участков CDR с последовательностями известных антител к компонентам С3 и C3b комплемента человека показал отсутствие гомологии с аналогичными участками известных антител.
Моноклональное антитело СС3-4 по настоящему изобретению может служить основой для конструирования химерных и гуманизированных антител, пригодных для создания лекарственных препаратов, блокирующих альтернативный путь активации системы комплемента. Предлагаемый штамм позволяет получать антитело с высоким выходом целевого продукта.
1. Моноклональное антитело, способное специфически связываться с молекулой С3 комплемента человека с экспонированной тиоэфирной связью и содержащее гипервариабельные участки тяжелой цепи с последовательностями SEQ ID NO: 5-7 и гипервариабельные участки легкой цепи с последовательностями SEQ ID NO: 8-10.
2. Моноклональное антитело, способное специфически связываться с молекулой С3 комплемента человека с экспонированной тиоэфирной связью, по п. 1, имеющее последовательность вариабельной области тяжелой цепи по SEQ ID NO: 3 и последовательность вариабельной области легкой цепи по SEQ ID NO: 4.
3. Моноклональное антитело, способное специфически связываться с молекулой С3 комплемента человека с экспонированной тиоэфирной связью, по п. 2, кодируемое ДНК, содержащей последовательности нуклеотидов по SEQ ID NO: 1 и SEQ ID NO: 2.
4. Штамм гибридомы мыши, депонированный в коллекции РККК под номером РККК(П)764Д и продуцирующий антитело по п. 1.