Вакцина гриппозная инактивированная расщепленная и способ ее получения
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается способа получения средства, предназначенного для лечения гриппа, включающего заражение куриных эмбрионов вирусом гриппа, инкубацию эмбрионов, охлаждение эмбрионов, сбор вируссодержащей аллантоисной жидкости (ВАЖ), обработку ВАЖ с целью дезагрегации и последующей инактивации, микрофильтрацию ВАЖ, ультрафильтрацию ВАЖ и очистку вирусного концентрата. Группа изобретений также касается средства, предназначенного для лечения гриппа, которое получено указанным способом. Группа изобретений обеспечивает получение вакцины, антигенная активность которой превышает таковую вакцины “Ваксигрипп”. 2 н.п. ф-лы, 3 ил., 8 пр., 6 табл.
Реферат
Вакцина гриппозная инактивированная расщепленная и способ ее получения (далее - изобретение) относится к иммунологии, медицине, фармакологии, и касается производства инактивированных гриппозных вакцин, которые могут быть использованы для вакцинации населения России против гриппа.
В настоящее время для вакцинации против гриппа используется 2 типа вакцин: инактивированные вакцины и «живые» вакцины. В свою очередь инактивированные вакцины подразделяются на цельновирионные, расщепленные, субъединичные и виросомальные. Значительную часть на мировом рынке инактивированных вакцин занимают расщепленные вакцины. Это обусловлено тем, что эти вакцины обладают высокой иммуногенностью, как и цельновирионные вакцины, однако их реактогенность существенно ниже цельновирионных вакцин. Субъединичные вакцины обладают очень низкой реактогенностью, однако их иммуногенность уступает иммуногенности расщепленных гриппозных вакцин.
В настоящее время известно несколько средств, предназначенных для лечения гриппа и соответственно способов производства этих средств.
В патенте РФ №2283139, дата опубликования 10.09.2006 г описывается средство и способ получения расщепленных антигенов. В описании технологического процесса для разрушения очищенных вирионов используется детергент β-октилглюкозид и окончательная очистка антигенов осуществляется методом хроматографии на носителе Сефадекс-50 фирмы «GE» (Швеция). Инактивация вирусной активности проводится на стадии разведения вирусного концентрата методом облучения ультрафиолетом. Согласно этому способу очистка вирионов осуществляется последовательной комбинацией метода сорбции - элюции на формализированных куриных эритроцитов и метода хроматографической очистки. Однако используемая технология очистки вирионов не позволяет воспроизводить параметры очистки из-за нестандартности куриных эритроцитов, а также описанный метод хроматографии не всегда эффективен для очистки вируссодержащей аллантоисной жидкости (ВАЖ) с большим содержанием разрушенных клеток. Носитель Сефадекс-50, используемый на стадии окончательной очистки антигена не эффективен для разделения гриппозных антигенов и овальбумина, вследствие не оптимального предела отсечения самого носителя. Инактивация с использованием ультрафиолетового облучения не всегда позволяют получить воспроизводимый результат, так как в случае высоко агрегированных вирусных концентратов не все вирусные частицы подвергаются действию облучения. Соответственно средство обладает повышенным риском реактогенности у вакцинированных людей, а также опасностью остаточной инфекционности в готовой лекарственной форме вакцины.
В патенте РФ №2535153, дата опубликования 10.12.2014 описывается средство и способ получения высокоочищенного вирусного концентрата с использованием методов обработки вируссодержащей аллантоисной жидкости (ВАЖ) полиэлектролитом ПЭГ 6000 для снижения процесса агрегации с последующей микрофильтрацией на 2 каскадах картриджей (диаметр пор 10 мкм и 1 мкм), ультрафильтрацией на кассетах с порогом отсечения 300 КилоДальтон и окончательной очисткой вируса в градиенте плотности сахарозы. Для дальнейшего производства инактивированных гриппозных вакцин из концентратов, полученных данным способом необходимо проводить инактивацию вирусной активности с использованием метода ультрафиолетового облучения, как и в предыдущем способе, что существенно снижает его привлекательность. В качестве электролита в данном изобретении используется раствор полиэтиленгликоля-6000 в достаточно высокой концентрации. Это вещество является безвредным и применяется в медицинской промышленности, однако его стоимость достаточно высока, и с учетом тех количеств, которые используются для обработки ВАЖ в данном изобретении, применение этого реагента существенно увеличивает себестоимость. Кроме того, на основании этого патента можно получить только очищенный вирусный концентрат, а не лекарственную форму вакцины против гриппа. Для получения лекарственной формы вакцины необходим дополнительный блок технологии разрушения, выделения, и очистки вирусных антигенов. При этом получаемое средство обладает опасностью остаточной инфекционности в готовой лекарственной форме вакцины.
Согласно рекомендациям ВОЗ инактивацию вирусной активности при производстве инактивированных гриппозных вакцин предпочтительно проводить на ранних стадиях технологического процесса, в частности при обработке ВАЖ. Для этих целей используют различные дезактивационные реагенты, и, прежде всего, раствор β-пропиолактона. Согласно данным литературы обработка этим реагентом не приводит к нарушению иммунохимической структуры антигенов гриппа. Соответственно, при этой обработке не меняется набор протективных эпитопов (иммунокомпетентность) в составе поверхностных антигенов (гемагглютинин, нейроминидаза). Кроме того, не нарушаются функциональные свойства гемагглютинина, а именно осуществлять фузию с плазматической мембраной клетки. В свою очередь, путь процессинга антигена гемагглютинина в антиген-представляющей клетке иммунной системы человека соответствует таковому для натурального вируса гриппа, и таким образом позволяет индуцировать клеточный иммунитет при вакцинации препаратом, полученным с использованием β-пропиолактона в качестве инактиватора. (A. Huckrade, 2012). Таким образом, использование β-пропиолактона для инактивации ВАЖ позволяет получать дезактивированный материал на ранних стадиях производства, что резко снижает объем жидких отходов, подлежащих инактивации. Кроме того, полученный таким образом антиген гемагглютинин обладает более высоким протективным потенциалом, чем аналогичные антигены, полученные с использованием формалина или ультрафиолетового облучения. Следует также отметить, что на стадии обработки ВАЖ при правильном подборе компонентов β-пропиолактон гарантированно осуществляет инактивацию вирусной активности в течении нескольких часов, тогда как использование ультрафиолетового облучения на стадии разбавленного ОВК не всегда приводит к 100% инактивации. В настоящее время за рубежом β-пропиолактон уже используется при производстве гриппозных вакцин, однако в России до настоящего времени не было апробированной технологии по применению этого реагента для производства отечественных препаратов против гриппа.
Наиболее близкими к предлагаемому изобретению являются средства и способы описанные в патентах РФ №2493872, дата опубликования 27.09.2013 г; и РФ №2523614 (Вакцина против гриппа и способ ее получения), дата опубликования 20.07.2014, которые мы считаем прототипами предлагаемого изобретения.
Первый прототип (патент РФ №2493872) описывает средство и способ очистки вирусов гриппа с использованием микрофильтрации и ультрафильтрации (без использования формализированных куриных эритроцитов). Для микрофильтрации используются картриджи с очень маленьким диаметром пор (0,45+0,22 мкм). Ультрафильтрация проводится на кассетах с пределом отсечения 300-500 КилоДальтон. Очищенный таким образом вирус далее дополнительно очищается методом ультрацентрифугирования в градиенте плотности сахарозы. В данном патенте не описывается способ инактивации вируса гриппа, однако из текста описания изобретения следует, что процесс инактивации будет проводиться уже после стадии получения очищенного вирусного концентрата. Следует отметить, что использование в процессе микрофильтрации картриджей с диаметром пор 0,45+0,22 мкм как правило приводит к быстрому засорению этих картриджей при очистке ВАЖ, так как в результате размножения вирусов и разрушения клеток куриных эмбрионов в ВАЖ присутствует большое количество дебрисных культур различных размеров. Таким образом, из-за неоптимального размера пор срок эксплуатации вышеуказанных картриджей очень незначителен. Кроме того, если засорение картриджей происходит в производственном процессе очистки ВАЖ, то их замена - приводит к нарушению условий стерильности технологического процесса, и создает большие проблемы с логистикой. Поэтому, в мировой литературе описанные картриджи с более крупными размерами пор для микрофильтрации ВАЖ. В частности, в патенте РФ №2535153 описано применение каскада картриджей 10 мкм и 1 мкм, которые позволяют очищать от дебриса значительные объемы ВАЖ.
Второй прототип (патент РФ №2523614) описывает средство и способ получения расщепленной вакцины против вируса гриппа с использованием методов осветления (центрифугирования), микрофильтрации, концентрирования, расщепления концентрата вируса гриппа с последующей ультрафильтрацией полученного вирусного лизата. Особенностью данного патента является использование нейтральных или основных аминокислот, а также натрия хлорида в концентрации 0,3-2,0 Моля в качестве стабилизаторов. В данном патенте не указывается на какой стадии и каким способом производится инактивация вирусной активности. В описании к этому патенту указывается, что для расщепления очищенных вирионов используются различные детергенты (катионные, анионные, и неионные). Однако далеко не все детегенты позволяют выделять антигены гемагглютинина и нейроминидазы с полным сохранением их иммунокомпетентности. В частности, наиболее известный и доступный анионный детергент N-лаурилсаркозинат Na у некоторых серотипов вируса гриппа вызывает деструкцию гемагглютинина и резко снижает его антигенную и иммуногенную активность. Другой известный неионный детергент Тритон Х-100 является очень мягким для разрушения вирусов гриппа реагентом, однако он очень плохо отделяется от выделенных антигенов в процессе их очистки. Поэтому выбор оптимального детергента для разрушения вируса является основной частью технологии производства современных гриппозных инактивированных вакцин. Кроме того, в данном патенте описаны способы стабилизации выделенных антигенов с использованием различных аминокислот в конечных концентрациях до 0,5 М, или же детергентом твином 80 до конечной концентрации до 0,2%. Однако известно, что некоторые аминокислоты являются биологически активными веществами и в высоких концентрациях (до 0,5 М) могут быть реактогенными при массовой вакцинации людей. Кроме того, эти реагенты в случае применения на различных стадиях технологического цикла могут существенно увеличить себестоимость технологии. В отношении детергента твин-80 следует отметить, что по данным литературы, этот детергент используется как стабилизатор только в концентрации 1%, и нет оснований предполагать, что это вещество в концентрации 0,2% будет эффективным стабилизатором как в процессе расщепления и очистки антигенов, так и в составе конечной лекарственной формы. Соответственно полученное лекарственное средство обладает опасностью остаточной инфекционности в готовой лекарственной форме вакцины, а также опасностью проявления повышенной реактогенности при вакцинации людей.
В результате многолетних экспериментов проведенных авторами этого изобретения, было установлено, что наиболее оптимальными подходами для получения инактивированной расщепленной вакцины является использование дезинфектанта β-пропиолактона для инактивации вирусной активности на стадии обработки ВАЖ; для предотвращения агрегации вирионов в процессе очистки наиболее оптимальным представляется использование хлористого натрия в конечной концентрации 0,22 М; для хроматографической очистки выделенных антигенов наиболее эффективно использование носителя Bio-bad 40/100/sec, фирмы Bio works (Швеция) и стабилизацию полученных моновакцин, а также стабилизацию тривалентной лекарственной формы вакцины следует проводить с использованием детергента Тритон Х-100 до конечной концентрации 100-300 мкг/мл. Вышеизложенные подходы легли в основу данного изобретения.
Задача, на решение которой направлено настоящее изобретение, заключается в разработке новой технологии для производства российской инактивированной расщепленной вакцины, которая позволит производить в нашей стране вакцину с мировым уровнем качества.
Технический результат предлагаемого изобретения заключается в разработке промышленного способа получения расщепленной вакцины и средства на ее основе, которую можно будет использовать для массовой вакцинации населения России. Поэтому получаемый результат отличается от вышеизложенных прототипов степенью очистки выделенных антигенов, более высоким уровнем их иммунокомпетентности а также более высокой эффективностью представленной технологии
Объектом изобретения является способ получения расщепленной вакцины и средство на его основе, включающий в себя заражение куриных эмбрионов вирусом гриппа, инкубацию зараженных эмбрионов, охлаждение инкубированных эмбрионов, сбор ВАЖ, обработку ВАЖ с целью дезагрегации и инактивации, микрофильтрацию ВАЖ на 2 каскадах картриджей, ультрафильтрацию ВАЖ и очистку вирусного концентрата в градиенте плотности сахарозы. Расщепление очищенного инактивированного вирусного концентрата проводится детергентом бета-октил-глюкозидом, удаление недоразрушенных вирионов и значительной части комплексов рибонуклеопротеидов с мембранным белком проводится методом ультрацентрифугирования, окончательная очистка выделенных антигенов проводится на хроматографическом носителе, и в полученную моновакцину добавляется стабилизатор.
Отличие предлагаемого способа от прототипа заключается в том, что инактивацию вирусной активности мы проводим на стадии обработки ВАЖ с использованием дезинфектанта бета-пропиолактона, дезагрегацию вирусов при обработке ВАЖ проводим хлористым натрием в конечной концентрации 0,22 Моля, финальную очистку антигенов проводим на хроматографическом носителе WorkBeads 40/100/sec фирмы Bio Works (Швеция), а стабилизацию моновакцины, а также тривалентной лекарственной формы проводим с использованием детергента Тритон Х-100 в концентрации 100-300 мкг/мл.
Заявляемый способ получения состоит из нескольких технологических этапов:
1 этап заключается в получении ВАЖ, и состоит из нескольких стадий: получение куриных эмбрионов, их дезинфекцию, предварительную инкубацию, заражение рабочим раствором посевного вируса, инкубация зараженных эмбрионов, охлаждение после инкубации, сбор ВАЖ и очистка ВАЖ.
1.1. Получение куриных эмбрионов (КЭ)
Яйцо инкубационное поступает на участок инкубации в соответствии с договором поставки. После проведения входного контроля яйцо, оплодотворенное закладывают в инкубатор, или предварительно прогретый до 37,5°С. Проводят инкубацию в течение 10-11 дней при температуре (37,9±0,2)°С и относительной влажности (54±2)%.
На 10-й день полученные куриные эмбрионы (КЭ) выгружают из инкубатора и проводят контроль жизнеспособности КЭ с помощью специального прибора-овоскопа. Куриные эмбрионы по 36 штук в пластиковых лотках помещают в телеги транспортные стеллажные (ТТС), загружают в транспортное средство и передаю на стадию 1.2.
1.2 Дезинфекция КЭ
Общее время (с выгрузки ТТС до аэрозольной камеры) - около 30 мин. Перед дезинфекцией проводят подготовку аэрозольной камеры: прогревают до температуры 32°С. За один раз в камеру загружают не более 18 телег с КЭ. Дезинфекцию КЭ проводят методом распыления дезинфицирующего раствора 1% раствор дезинфектанта Оксония Актив, производство фирмы «Ecolab», Италия. Распыление осуществляется с помощью 2-х генераторов «холодного тумана». Дезинфицированные КЭ выгружают в термальную камеру для дополнительного инкубирования КЭ.
1.3. Предварительная инкубация
Полученные КЭ, со стадии 1.2, дополнительно инкубируют следующим образом: КЭ помещают в термальную камеру при температуре (37,5±0,5)°С и относительной влажности (55±5)%, и выдерживают не менее 12 ч.
1.4 Заражение КЭ
Процесс заражения КЭ, проводится в асептических условиях. Емкость с рабочим раствором посевного вируса подсоединяется через фильтрующий элемент Medisart к линии заражения (инокулятору), производства фирмы Rame-Hart, США.
Для дезинфекции используют 70% этиловый спирт. Этим дезинфектантом проводят обработку скорлупы КЭ и игл во время процесса заражения. На инокуляторе устанавливают платы заражения (иглы с пробойниками, стерилизованные в автоклаве при температуре (126±2)°С и давлении пара (1,5±0,2) кгс/см2 в течение (30+2) мин.), устанавливают давление сжатого воздуха (35±5) кПа, после чего происходит проверка/настройка дозы. Производительность автоматической линии заражения - 30000 КЭ в час. Тележки с КЭ из термальной камеры выкатывают к машине инокулятора для предстоящего заражения. В начале работы пластиковые лотки с КЭ устанавливают на конвейер машины. Далее пластиковые лотки передвигаются по конвейеру, проходя дезинфекцию 70% этиловым спиртом, а после чего происходит заражение. В каждый КЭ вводят по (0,20±0,02) мл рабочего разведения посевного вируса. Контроль объема дозы вводимого вируса осуществляют каждые 30-40 мин. Иглы плат заражения автоматически проходят дезинфекцию 70% этиловым спиртом после каждого прокола скорлупы КЭ. После выхода лотков с зараженными КЭ проводится их визуальный выборочный контроль. Проконтролированные КЭ передают на стадию 1.5.
1.5 Инкубация зараженных КЭ
Куриные эмбрионы, зараженные вирусом гриппа, инкубируют в технологическом режиме (температура, относительная влажность) в соответствии с режимами, указанными в паспортах на штамм. Для вирусов гриппа типа А продолжительность инкубации, как правило, составляет от 36 до 46 ч, а для вирусов типа В - от 50 до 62 ч и при относительной влажности от 55 до 65%. После инкубирования зараженные КЭ передают на стадию 1.6.
1.6 Охлаждение КЭ после инкубации
Охлаждение КЭ осуществляется в холодильной камере в течение от 12 до 20 ч при температурном режиме (4±2)°С. После охлаждения КЭ осуществляют сбор ВАЖ на стадии 1.7.
1.7 Сбор ВАЖ
Сбор ВАЖ осуществляется с помощью автоматической линии для сбора аллантоисной жидкости (харвестер) производства фирмы «Rame-Hart», США. На этой линии в автоматическом режиме осуществляют декапитацию КЭ, их визуальную отбраковку (погибшие КЭ, инкубационный брак, бой) и сбор ВАЖ в асептических условиях. Собранную ВАЖ с помощью перистальтических насосов «Watson-Marlow» 720 S перекачивают в реактор вместимостью 800 литров. Перед началом сбора ВАЖ реактор охлаждают с использованием воды и охлаждающего устройства до конечной температуры в реакторе (6±2)°С.
1.8 Обработка ВАЖ
По окончании сбора ВАЖ включают мешалку со скоростью 40 об/мин, с помощью перистальтического насоса «Watson-Marlow» модель 720 S добавляют стерильный раствор 2,5 М NaCl до конечной концентрации 0,22 М. Перешивают содержимое реактора в течение (30±2) мин при температуре (6±2)°С. Далее в этот же реактор добавляют β-пропиолактон до конечной концентрации 0,1% для инактивации вируса и содержимое еще раз перемешивают в течении 1-2 часов при температуре (6±2)°С. После перемешивания мешалку отключают и содержимое реактора инкубируют в течение (16±2) ч при температуре (6±2)°С.
2 этап заключается в очистки ВАЖ методами микро- и ультрафильтрацией и очистке полученного концентрата ВАЖ методом ультрацентрифугирования в градиенте плотности сахарозы.
2.1 Очистка и концентрирование ВАЖ микро- и ультрафильтрацией
Работу проводят на совмещенной установке микро- и ультрафильтрации с соблюдением правил асептики в зоне ламинарного потока. После обработки и инактивации ВАЖ из реактора с помощью перистальтического насоса «Watson-Marlow» модель 720 S, подают на установку микрофильтрации и пропускают через 2 каскада глубинных фильтров с диаметрами пор 5 мкм и 1 мкм соответственно в стерильную емкость вместимостью 16-20 л. Полученную в результате микрофильтрации осветленную ВАЖ с помощью перистальтического насоса «Watson-Marlow», модель 720 S, подают на установку ультрафильтрации с кассетными модулями Pellicon 2 Biomax-300 с пределом отсечения 300 кДа, для концентрирования ВАЖ. Концентрируют осветленную ВАЖ в 10-15 раз. Допустимое значение давления на в процессе ультрафильтрации не должно превышать 0,5 бар. Процесс микрофильтрации и процесс ультрафильтрации проводят при комнатной температуре. Полученный концентрат в объеме 20-40 литров передают на следующую стадию очистки.
2.2 Очистка и концентрирование вируса гриппа в градиенте плотности сахарозы
В ротор ультрацентрифуги К2, производства фирмы «Альфа-Вассерман» (США) загружают стерильный фосфатный буферный раствор, рН=7,2 (ФБР) и 60% раствор сахарозы при температуре (4±2)°С. После разгона ротора до (34000±1000) об/мин в ротор с помощью перистальтического насоса «Watson-Marlow» модель 520 S со скоростью (10±1) л/мин подают концентрат ВАЖ со стадии 2.1. По окончании прохождения всего объема концентрированной ВАЖ в ротор центрифуги подают ФБР и проводят центрифугирование в течение (2,0±0,5) ч. Весь процесс проводят при температуре охлаждения ротора (4±2)°С. После окончания центрифугирования ультрацентрифугу останавливают и производят разгрузку полученных фракций инактивированного вирусного концентрата (ВК) в стерильном боксе. Далее собирают 20 фракций содержащегося в роторе градиента плотности сахарозы: первые две фракции, объемом по 200 мл, последующие - по 100 мл. Из каждого флакона отбирают пробу объемом 5 мл для контроля гемагглютинирующей активности и % содержания сахарозы. После взятия пробы каждый флакон закрывают силиконовой пробкой и помещают в холодильник на хранение при температуре (5+3)°С до 3 суток.
Для дальнейшей обработки используются фракции инактивированного ВК, обладающие титром ГА не менее 1:8000 и содержащие (35-48)% сахарозы, которые хранят в фармацевтическом морозильнике при температуре от -10 до -20°С в течении не более 3 месяцев.
3 этап включает в себя расщепление инактивированных вирусных концентратов, микро- и ультрафильтрацию полученного лизата, осаждение недоразрушенных вирионов методом ультрацентрифугирования, концентрирование супернатанта, хроматографическая очистка и стерилизующая фильтрация моновакцины.
3.1 Расщепление инактивированного вирусного концентрата
Фракции инактивированного вирусного концентрата со стадии 2.2 в необходимом количестве за 15-18 ч до работы помещают для размораживания в холодильную камеру при температуре (5±3)°С. Выбранные фракции ВК объединяют в стерильной бутыли вместимостью 16 л, с соблюдением правил асептики. Расщепление инактивированного ВК проводят с использованием детергента Октилглюкозид. Количество добавляемого детергента рассчитывают по содержанию белка в вирусном концентрате.
Определение оптимального соотношения детергент/белок проводят для каждого серотипа отдельно при смене производственного штамма или смене партии детергента. Определение осуществляется следующим образом: в полипропиленовые пробирки, объемом 2 мл помещают 1 мл исследуемого объединенного инактивированного ВК, разбавленный до концентрации белка (1±0,2) мг/мл ФБР.
В 4 пробирки с раствором разбавленного ВК добавляют по 0,5 мл концентрированного раствора октилглюкозида таким образом, чтобы в смеси содержалось 5 мг детергента, 7 мг детергента, 10 мг детергента и 15 мг детергента (соотношение 5:1, 7:1, 10:1, 15:1). Растворы тщательно перемешивают, и инкубируют 30 минут при комнатной температуре. В 5-ю пробирку вместо детергента добавляют ФБР. После инкубации во всех пробах (включая контрольную без детергента) определяют содержание гемагглютинина. Выбирается минимальное соотношение, при котором количество определенного гемагглютинина было максимальным.
Рассчитанную навеску детергента растворяют в ФБР и добавляют полученный раствор β-октилглюкозида в стеклянную бутыль с вместимостью 10-16 л с объединенным инактивированном ВК Затем в горловину бутыли вставляют верхнеприводную электрическую мешалку и проводят расщепление ВК при скорости вращения мешалки (130±10) об/мин в течение (1,0±0,2) ч. Полученный лизат передают на следующую стадию очистки.
3.2 Микро- и ультрафильтрация полученного лизата
Лизат фильтруют через установку микрофильтрации с картриджами с размером пор 10 мкм. Остатки материала вытесняют ФБР. Профильтрованный лизат подают на ультрафильтрационную установку с кассетами с пределом отсечения 30 кДа. Проводят технологической процесс (концентрирование материала) при давлении (0,7±0,1) МПа. Конечный объем концентрированного лизата - 5 л.
3.3 Осаждение недоразрушенных вирионов
Недоразрушенные вирионы из вирусного лизата осаждают методом ультрацентрифугирования на оборудовании фирмы «Thermo Fisher Scientific» модель Sorvall Lynx 6000.
С помощью перистальтического насоса «Watson Marlow» модель 720 N в ротор центрифуги закачивают 5 л ФБР режиме протока жидкости со скоростью (15±1) л/час. Далее этим же насосом подают в ротор концентрированный лизат со стадии 3.2. и разгоняют ротор до скорости 18000 об/мин. Скорость пропускания материала через ротор - (5±1) л/час, после чего вытесняют материал 5 литрами ФБР. Супернатант и ФБР после вытеснения материала объединяют в 16 литровой бутыли и передают на следующую стадию очистки.
3.4 Ультрафильтрация супернатанта
Ультрафильтрацию супернатанта (концентрирование материала) проводят на установке ультрафильтрации, как это указано в п. 3.2. Концентрирование супернатанта проводят до конечного объема 2,0 л. Полученный продукт переносят в стерильную стеклянную емкость и передают на стадию 3.5 хроматографической очистки.
3.5. Хроматографическая очистка сконцентрированного супернатанта
Для очистки сконцентрированного супернатанта используют хроматографический носитель для эксклюзивной хроматографии (гельфильтрации) «WorkBeads» 40/100, производство фирмы «Bio-Works», Швеция (информация о носителе представлена на сайте компании производителя: . раздел: Life scienses).
Гельфильтрацию проводят на производственной колонке из стекла аксиального сжатия (BPG 200/950, 30 л). На колонку объемом 15 л носителя с помощью перистальтического насоса наносят сконцентрированный супернатант в объеме 2 л. Хроматографию ведут со скоростью 10 л/ч буфером ФБР и с применением ультрафиолетового детектора К-200 производства фирмы «Knaur», Германия. Регистрацию данных детектора проводят на персональном компьютере с системой МультиХром. Пик очищенного материала начинает выходить после вытеснения свободного объема, при этом процесс сопровождается резким повышением оптической плотности на 280 нм. Сбор материала останавливают после падения оптической плотности до 30-40 единиц и выхода хроматограммы на фазу плато. Объем концентрата после прохождения через колонку увеличивается на 20-30%.
Полученный материал передают на стадию 3.6.
3.6. Стерилизующая фильтрация моновакцины
Очищенный от детергента материал со стадии 3.5 передают на стерилизующую фильтрацию.
В заранее подготовленный к работе реактор объемом 50 л заливают очищенный супернатант, добавляют ФБР до содержания суммарного белка 400-500 мкг/мл; 1% раствор мертиолята в количестве, обеспечивающем его конечную концентрацию 100 мкг/мл. Далее перемешивают со скоростью 200-220 об/мин в течение 15-20 мин при комнатной температуре.
Далее сведенную моновакцину фильтруют через одноразовый фильтрующий элемент типа «Sartobran» 0,2 мкм, площадь фильтрации 0,2 м2 или через капсулу со схожими техническими характеристиками в одноразовый стерильный пластиковый контейнер типа Flexboy (фирма Sartorius, Германия) вместимостью 20 л.
Полученную стерильную моновакцину транспортируют в фармацевтические холодильники и хранят при температуре (5±3)°С не более 6 месяцев. Проводят контроли полученной вакцины по показателям: специфическая активность, содержание белка, подлинность, содержание овальбумина, содержание бактериальных эндотоксинов, стерильность.
Этап 4 - включает в себя сведение компонентов вакцины, стерилизующая фильтрация вакцины, розлив препарата в ампулы, маркировку и упаковку.
4.1 Сведение компонентов вакцины
Процесс включает в себя сведение моновакцин 3-х типов вирусов гриппа A(H1N1), A(H3N2) и В, с 1% раствором детергента Тритон Х-100, 1% раствором мертиолята и ФБР в реакторе вместимостью 200 л.
Полуфабрикаты моновакцины трех различных штаммов вируса гриппа: типа A(H1N1), типа A(H3N2) и типа В, прошедшие все контроли, из стерильных одноразовых контейнеров в асептических условиях загружают в реактор.
Далее в реактор добавляют расчетные количества ФБР, 1% раствора мертиолята до конечной концентрации (85-115) мкг/мл, и 1% раствора детергента Тритона Х-100 до конечной концентрации 100-300 мкг/мл. Содержимое реактора перемешивают в течение 15 мин. Процесс сведения лекарственной формы проводят при комнатной температуре. Далее проводят стерилизующую фильтрацию перемешанного раствора.
4.2 Стерилизующая фильтрация лекарственной формы вакцины
Шланг, монтированный на выходном штуцере реактора в асептических условиях подсоединяют к штуцеру на входе фильтровального элемента. Другой стерильный шланг одним концом подсоединяют к штуцеру на выходе фильтровального элемента, а другим - соединяют с входным портом стерильного пластикового мешка объемом 200 л. Фильтруют через одноразовый фильтрующий элемент типа Sartobran 0,2 мкм, площадь фильтрации 0,45 м2. Из заполненного стерильного мешка в асептических условиях отбирают пробу для анализа специфической активности, содержания белка, содержание мертиолята. На каркас с контейнером, содержащим полуфабрикат вакцины, наклеивают этикетку с указанием наименования вакцины, № серии, и даты фильтрации. Контейнер с полуфабрикатом тривакцины транспортируют в цех «Готовые лекарственные формы». Хранение контейнера с полуфабрикатом лекарственной формы препарата проводится в холодильной камере при температуре от 2 до 8°С не более 14 суток. После прохождения контролей контейнер со стерильным полуфабрикатом передается для розлива в ампулы.
4.3 Розлив препарата в ампулы
Розлив препарата осуществляют на машине для заполнения и запайки ампул RSF производства фирмы CO.RI.M.A., Италия. Одноразовый контейнер с препаратом в асептических условиях соединяют через нижний порт к системе дозаторов. Устанавливают заданную дозу. Систему заполняют раствором препарата и прокачивают для удаления пузырей воздуха.
Разливают препарат в ампулы вместимостью 1,0 мл типа ИП-1 В 1 или аналогичные. Контроль стерильности процесса розлива проводят в начале и в конце розлива.
Все ампулы с препаратом контролируют на герметичность и передают на просмотр в помещение, которое защищено от прямых солнечных лучей. Контроль вакцины на механические включения проводится инспекционной машиной А-30, производства фирмы «Brevetti», Италия.
Затем препарат передают на склад карантинного хранения отделения фасовки и хранят при температуре от 2 до 8°С.
Со склада карантинного хранения отбираются ампулы с готовой лекарственной формой препарата и проводится контроля качества согласно документации. Основные контроли включают в себя визуальный контроль, определение содержания белка методом Лоури, определение специфической активности методом ОРИД, определение содержания овальбумина и эндотоксинов, определение содержания Тритона Х-100, изучение антигенной активности, стерильность.
4.4 Маркировка и упаковка
Серии ампул с готовой лекарственной формой прошедшие все контроли поступают со склада карантинного хранения в цех фасовки. Перед началом работы маркировочную машину. настраивают, набивают клише, на котором указывают: торговое название препарата, номер серии, дату выпуска, объем препарата в мл, количество доз, срок годности.
Отмаркированные ампулы укладывают в коробки или пачки из картона для потребительской тары (ГОСТ 7933-89, или ТУ ОП 5453-010-04766354-2005, или импортного). На коробку или пачку наклеивают этикетку в соответствии с нормативной документацией.
Групповая и транспортная упаковка по ГОСТ 17768-90.
Упакованную вакцину помещают в холодильную камеру склада готовой продукции и хранят при температуре от 2 до 8°С
Возможность осуществления описанного изобретения может быть продемонстрировано следующими ниже представленными примерами:
Пример 1. Получение моновакцины серотипа H3N2.
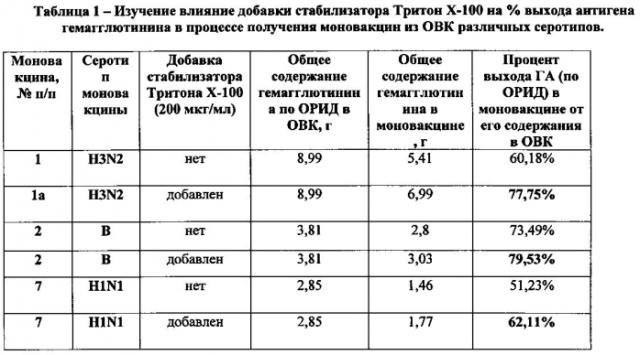
Для заражения КЭ в качестве рабочего раствора был выбран 10 пассажный уровень реассортантного вируса A/Switzerland/9715293/2013/H3N2 содержащей инфекционный титр 103,3 ИД в 0,2 мл. Реассортантный штамм для производства инактивированных гриппозных вакцин был получен от ВОЗ. КЭ после 11 суток инкубации в количестве 56366 шт после дезинфекции и предварительной инкубации были инфицированы вышеуказанной дозой рабочего раствора посевного вируса. Инкубация после заражения проводилась при температуре 35°С и относительной влажности 60% в течении 43-46 ч. Охлаждение после инкубации проводилось в холодной камере при температуре (4±1)°С в течении 12-18 часов. После охлаждения в течении 6 часов была собрана ВАЖ в объеме 370 л. В реактор с собранной ВАЖ было добавлено 37 л 2,5 М раствора NaCl, с последующим перемешиванием, после чего добавили 0,37 л β-пропиолактона. Инактивация проходила при температуре (4±2)°С в течении 14 часов. На следующей стадии очистки и концентрирования было получено 40 л концентрата ВАЖ, которые были переданы для очистки в градиенте плотности сахарозы методом ультрацентрифугирования. Из градиента были отобраны 600 мл (6 фракций) с оптимальной концентрацией сахарозы и титром РГА. В этом объеме объединенного вирусного концентрата (ОВК) содержалось 14,21 г белка (определение по методу Бредфорда) и 6,12 г ГА (определенного по методу ОРИД). Все количество ОВК (600 мл) было использовано для приготовления одной серии моновакцины. Для проведения разрушения этого ОВК было использовано 200 г детергента октилглюкозида, производства фирмы Ferac Berlin, Германия. В лизате определилось 6,12 г ГА (по методу ОРИД). Объем лизата после микрофильтрации составил 20 л. После чего профильтрованный лизат был сконцентрирован до объема 5 л при помощи метода ультрафильтрации с применением кассет с пределом отсечения 30 кДа. Далее этот объем был очищен от недоразрушенных вирионов методом ультрацентрифугирования в течении 120 минут при скорости протока 5 л/ч при температуре +8°С. Супернатант был сконцентрирован с использованием тех те кассет до объема 2 л, хроматография проводилась при комнатной температуре, с использованием колонки с 16 л носителя. По оптической плотности был собран пик в зоне «свободного» объема, в нем был определен белок по методу Бредфорда после чего буфером ФБР материал был разведен до конечной концентрации по белку до 400 мкг/мл, был добавлен детергент Тритон Х-100 до конечной концентрации 200 мкг/мл, смесь тщательно перемешали, в течении 20 мин, и профильтровали через стерильные картриджи 0,22 мкм в стерильный пластиковый контейнер. Полученную моновакцину переносим в фармацевтический холодильник и храним при температуре (5±3)°С в течении не более 3 месяцев. Из контейнера со стерильной моновакциной отбираются пробы для проведения технологических контролей. Было определено, что из 6,12 г гемагглютинина, обнаруженного в ОВК, в полученной моновакцине определяется 5,41 г гемагглютинина. Таким образом, эффективность технологии по выходу гемагглютинина составляет 88,8%.
Был проведен сравнительный анализ полипептидного состава ОВК серотипа H3N2 и полученной моновакцины. Результаты представлены в приложении 1.
Из представленных результатов следует, что в препарате моновакцины присутствуют тримеры гемагглютинина, нерасщепленный гемагглютинин, тяжелая цепь гемагглютинина, следовые количества белка нуклеокапсида и легкая цепь гемагглютинина. В исходном вирусном концентрате, из которого была произведена эта моновакцина присутствуют также полипептид M1 (мембранный белок) и существенные количества белка нуклеокапсида. Это свидетельствует, что полученный препарат моновакцины является расщепленным препаратом и не содержит вирусных частиц.
Пример 2. Получение моновакцины серотипа В.
Для получения ОВК были проведены такие же процедуры, как и в примере 1. Отличия состояли в следующем: для заражения применяли 9 пассажный уровень производственного штамма вируса B/Phuket/3073/2013; для заражения использовали 56774 шт. КЭ при температуре 33°С и относительной влажности 60% в течении 60-63 часов. После инкубации и охлаждения при тех же параметрах было собрано 440 л ВАЖ, которые были сконцентрированы по 20 л в 2 бутыли. После ультрацентрифугирования в градиенте плотности сахарозы были отобраны 600 мл препарата, содержащего 11,36 г общего белка (опред