Антитела против а2 тенасцина с и способы их применения
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии и биотехнологии. Предложены антитела к А2 домену тенасцина-С (TNC A2), а также выделенный полинуклеотид, вектор экспрессии, клетка-хозяин и способы получения антитела по изобретению. Кроме того, рассмотрена фармацевтическая композиция и применение антитела по изобретению для изготовления или производства лекарственного средства, в том числе применяемого для лечения заболевания, характеризующегося экспрессией TNC А2 или для индукции цитолиза опухолевой клетки или стромальной опухолевой клетки. Данное изобретение может найти дальнейшее применение в терапии и диагностике различных заболеваний, связанных с TNC А2. 11 н. и 25 з.п. ф-лы, 8 ил., 8 табл., 11пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антителам, специфичным к А2 домену тенасцина-С (TNC А2). Кроме того, изобретение относится к полинуклеотидам, кодирующим такие антитела, а также векторам и клетам-хозяевам, содержащим такие полинуклеотиды. Изобретение также относится к способам получения антител и способам их применения в лечении заболеваний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Тенасцин С и антитела к Тенасцину С
Тенасцины представляют собой высоко консервативное семейство крупных мультимерных гликопротеинов внеклеточного матрикса (ЕСМ), которое обнаруживается у позвоночных. У млекопитающих было идентифицировано 4 паралога тенасцина, получившие обозначения тенасцин-С, тенасцин-R, тенасцин-Х и тенасцин-W. Белки семейства тенасцинов имеют общую первичную структуру, содержащую N-концевые гептадные повторы, подобные эпидермальному фактору роста (EGF) повторы, повторы фибронектиновых доменов III типа и С-концевой фибриноген-подобный глобулярный домен. Через N-концевой олигомеризующий домен отдельные субъединицы объединяются в тримеры или даже гексамеры, как в случае тенасцина-С.
У млекопитающих мономеры тенасцина-С как правило имеют 14,5 EGF-подобных повторов и 8 повторов фибронектиновых доменов III типа, характерные для всех изоформ тенасцина-С. Однако, до 9 дополнительных повторов фибронектиновых доменов III типа (домены от А1 до D) могут независимо друг от друга как входить в состав, так и исключаться в процессе альтерантивного сплайсинга, образуя большое количество изоформ тенасцина-С (см., например, Hsia and Schwarzbauer, J Biol Chem 280, 26641-26644 (2005)).
Тенасцин-С транзиторно экспрессируется в ходе развития эмбриона, но практически отсутствует в тканях взрослого организма. Тем не менее, он вновь появляется в тканях, претерпевающих процесс ремоделирования, в том числе при некоторых патологических состояниях, таких как заживление ран, воспаление и рак (см. обзор Chiquet-Ehrismann & Chiquet, J Pathol 200, 488-499 (2003)).
Важное значение имеет высокий уровень экспрессии тенасцина-С в большинстве злокачественных солидных новообразований, включая новообразования мозга, молочных желез, толстого кишечника, легких, кожи и других органов (см. обзор Orend and Chiquet-Ehrismann, Cancer Letters 244, 143-163 (2006)), где он может экспрессироваться в трансформированных эпителиальных клетках, а также в стромальных клетках в микроокружения опухоли (Yoshida et al., J Pathol 182, 421-428 (1997), Hanamura et al., Int J Cancer 73, 10-15 (1997)). В частности, "крупные изоформы" тенасцина-С, содержащие образованные путем альтернативного сплайсинга домены от А1 до D, экспрессируются в инвазивных карциномах, будучи при этом практически недетектируемыми в здоровых тканях взрослого организма (Borsi et al., Int J Cancer 52, 688-692 (1992), Carnemolla et al., EurJ Biochem 205, 561-567 (1992)).
Такой профиль экспрессии делает тенасцин-С, и в частности его домены, образованные путем альтернативного сплайсинга, антигенами привлекательными для приложений, ориентированных на опухоли, и соответственно был разработан ряд антител к нескольким доменам белка (см., например, Brack et al., Clin Cancer Res 12, 3200-3208 (2006) или ЕР 1 817 345, в которых описаны антитела к А1 домену тенасцина-С; Silacci et al., Prot Eng Des Sel 19, 471-478 (2006), или ЕР 1 173 766, в котором описаны антитела к С домену тенасцина-С; публикацию Wang et al., Hybridoma 29, 13-16 (2010), в которой описано антитело к D домену тенасцина-С; или публикацию Balza et al., FEBS 332, 39-43 (1993), в которой описаны несколько антител к различным доменам тенасцина человека).
Недавно было описано антитело, распознающее специфичный эпитоп А2 домена тенасцина-С человека (WO 2009/089998).
Гликозилирование антител
Олигосахаридный компонент может оказывать существенное влияние на свойства, определяющие эффективность применяемого в терапевтических целях гликопротеина, включая физическую стабильность, устойчивость к действию протез, взаимодействие с иммунной системой, фармакокинетику и специфическую биологическую активность. Данные свойства могут зависеть не только от присутствия или отсутствия, но также от специфической структуры олигосахаридов. Можно вывести некоторые закономерности между структурой олигосахаридов и функциями гликопротеинов. Например, олигосахариды определенной структуры обеспечивают быстрый клиренс гликопротеинов из кровотока за счет взаимодействия с определенными белками, связывающими углеводы, тогда как другие могут связываться антителами и запускать нежелательные иммунные реакции (Jenkins et al., Nature Biotechnol 14, 975-81 (1996)).
Антитела типа IgGI, наиболее часто применяемые в иммунотерапии онкологических заболеваний, представляют собой гликопротеины, имеющие консервативный сайт N-связанного гликозилирования по Asn 297 в каждом СН2 домене. Два сложных двухантенных олигосахарида, присоединенные к Asn 297, располагаются между двумя СН2 доменами, образуя многочисленные контакты с полипептидным остовом и их присутствие имеет принципиальное значение для способности антитела проявлять эффекторные функции, такие как антитело-зависимая клеточная цитотоксичность (ADCC) (Lifely et al., Glycobiology 5, 813-822 (1995); Jefferis et al., Immunol Rev 163, 59-76 (1998); Wright and Morrison, Trends Biotechnol 15, 26-32 (1997)). Исследования в области белковой инженерии показали, что FcyR взаимодействует с нижним шарнирным участком СН2 домена IgG (Lund et al., J. Immunol. 157:4963-69 (1996)). Однако для связывания FcyR также требуется наличие олигосахаридов в участке СН2 (Lund et al., J. Immunol. 157:4963-69 (1996); Wright and Morrison, Trends Biotech. 15:26-31 (1997)), что позволяет предположить, что как олигосахарид, так и полипептид могут непосредственно участвовать в формировании сайта взаимодействия или что олигосахарид необходим для поддержания активной конформации СН2 полипептида. Модификация олигосахаридной структуры таким образом может рассматриваться как способ повышения аффинности взаимодействия между IgGI и FcyR и повышения ADCC активности IgGI.
Один из способов значительно повысить эффективность моноклональных антител - это усиление их естественных клеточно-опосредованных эффекторных функций путем модификации их олигосахаридного компонента, согласно публикации Umana et al., Nat Biotechnol 17, 176-180 (1999) и патенту США No.6,602,684 (WO 99/54342), описание которых включено сюда во всей полноте путем ссылок. Umana et al. показали, что повышенная экспрессия β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансферазы, катализирующей образование разветвленных олигосахаридов, в клетках яичнников китайского хомячка (СНО) существенно повышает in vitro ADCC активность антител, продуцируемых этими клетками. Повышенная экспрессия GnTIII в продуцирующих клеточных линиях позволяет получить антитела, обогащенные разветвленными олигосахаридами, которые кроме этого, как правило, являются нефукозилированными и относятся к гибридному типу. Если кроме GnTIII, в продуцирующих клеточных линиях повышена экспрессия маннозидазы II (ManII), это позволяет получить антитела, обогащенные сложными нефукозилированными разветвленными олигосахаридами (Ferrara et al., Biotechn Bioeng 93, 851-861 (2006)). Оба типа антител обладают повышенной ADCC, по сравнению с антителами, в которых гликаны не подвергались модификации, но только антитела, в которых большинство N-гликанов относятся к сложным, способны индуцировать значительную комплемент-зависимую цитотоксичность (Ferrara et al., Biotechn Bioeng 93, 851-861 (2006)). Изменения в составе углеводного компонента при Asn 297 или его удаление также влияют на связывание Fc-домена антитела с рецептором Fcγ (FcγR) и компонентом C1q комплемента, что имеет важное значение для ADCC и CDC, соответственно (Umana et al., Nat Biotechnol 17, 176-180 (1999); Davies et al., Biotechnol Bioeng 74, 288-294 (2001); Mimura et al., J Biol Chem 276, 45539-45547 (2001); Radaev et al., J Biol Chem 276, 16478-16483 (2001); Shields et al., J Biol Chem 276, 6591-6604 (2001); Shields et al., J Biol Chem 277, 26733-26740 (2002); Simmons et al., J Immunol Methods 263, 133-147 (2002)).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены антитела, специфично связывающие А2 домен тенасцина-С, обладающие высокой аффинностью и/или усиленной эффекторной функцией.
В одном аспекте изобретения описано антитело, специфично связывающее TNC А2, и содержащее по меньшей мере один (т.е. один, два, три, четыре, пять или шесть) участков, определяющих комплементарность (CDRs), представленных в SEQ ID NOs 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45 и 47. В одном воплощении антитело содержит три определяющих комплементарность участка тяжелой цепи CDRs (т.е. HCDR1, HCDR2 и HCDR3) и/или три определяющих комплементарность участка легкой цепи CDRs (т.е. LCDR1, LCDR2 и LCDR3), выбранных из SEQ ID NOs 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45 и 47. В более конкретном воплощении антитело содержит вариабельный участок тяжелой цепи антитела и/или вариабельный участок легкой цепи антитела, в частности, вариабельные участки легкой, и тяжелой цепей, выбранные из последовательностей вариабельных участков тяжелой и легкой цепей, представленных в SEQ ID NOs 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89 и 91. В одном воплощении антитело содержит Fc фрагмент, в частности Fc фрагмент IgG. В следующем воплощении антитело представляет собой полноразмерное антитело, в частности, антитело класса IgG. В другом воплощении антитело содержит константный участок человеческого антитела. В одном воплощении антитело представляет собой человеческое антитело. В одном воплощении антитело модифицируют с использованием гликоинженерии для получения модифицированных олигосахаридов в Fc фрагменте. В одном воплощении антитело имеет повышенное содержание нефукозилированных и/или разветвленных олигосахаридов в Fc фрагменте по сравнению с антителом, не модифицированным с использованием гликоинженерии. В следующем воплощении антитело имеет повышенную эффекторную функцию и/или повышенную аффинность связывания Fc рецепторов. В конкретном воплощении повышенная эффекторная функция представляет собой повышенную антитело-зависимую клеточную цитотоксичность (ADCC). В следующем воплощении антитело связывает TNC A2 человека с константой диссоциации Ко менее чем приблизительно 1 мкМ, предпочтительно менее чем приблизительно 100 нМ, наиболее предпочтительно менее чем приблизительно 1 нМ. В одном воплощении антитело представляет собой антитело, подвергнутое аффинному созреванию. В одном воплощении антитело связывается с TNC A2 в тканях человека.
В других аспектах изобретение также относится к полипептидам, полинуклеотидам, клеткам-хозяевам и векторам экспрессии, касающимся антител. В следующем аспекте изобретение относится к способам получения антител. В следующем аспекте изобретение направлено на способы применения антител, в частности, лечение заболеваний, характеризующихся экспрессией TNC A2, таких как онкологические заболевания.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
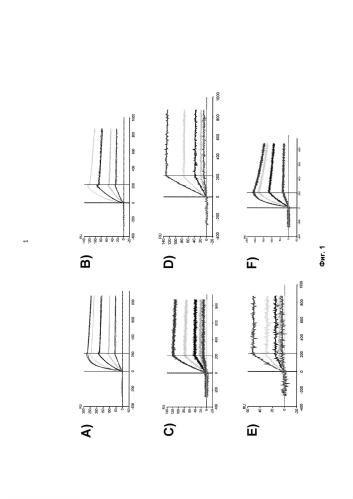
На Фигуре 1 представлены результаты анализа кинетики связывания Fab фрагментов против TNC A2, подвергнутых аффинному созреванию, и TNC A2 человека (hu) с помощью метода поверхностного плазменного резонанса (SPR). Представлены обработанные данные кинетики связывания для клона 2В10_С3В6 (а), клона 2В10_6А12 (б), клона 2В10_С3А6 (в), клона 2B10_07D8 (D), клона 2B10_01F7 (Е) и клона 2В10_6Н10 (F). Сглаженные линии отображают глобальную аппроксимацию данных с использованием модели взаимодействия в соотношении 1:1.
На Фигуре 2 (а) показаны результаты анализа кинетики связывания Fab фрагментов клона 2В10 против TNC A2 с TNC A2 человека, мыши и яванского макака с помощью метода SPR. На панели (б) показаны результаты анализа кинетики связывания IgG человека клона 2В10 против TNC A2 с TNC A2 человека, мыши и яванского макака с помощью метода SPR, согласно описанию в Примере 7.
На Фигуре 3 (а) показаны результаты иммуногистохимического анализа нормальной (верхние панели) и опухолевой (нижние панели) ткани матки человека при увеличении 100Х (левые панели) и 400Х (средние панели), при взаимодействии с вариабельными участками 2В10 в составе Fab фрагмента, сшитого с FLAG фрагментом (SHD2B10-FLAG). Правые панели: контроль, увеличение 100Х. На Фигуре 3 (b) показан уровень экспрессии TNC A2 в образцах различных тканей человека, выраженный в % от общей площади окрашиваемой поверхности при взаимодействии с вариабельными участками 2В10 в составе Fab фрагмента, сшитого с FLAG фрагментом (SHD2B10-FLAG). Образцы различных тканей человека от здоровых лиц и онкологических больных были окрашены SHD2B10-FLAG Fab фрагментом согласно описанию в Примере 8.
На Фигуре 4, А-N, показаны результаты иммуногистохимического окрашивания тканей человека при увеличении 100Х (левые панели) и 400Х (средние панели) с применением IgG мыши SHD2B10, согласно описанию в Примере 8. Окрашивание с помощью изотипического контрольного антитела показано при увеличении 100Х (правые панели). Верхние панели: нормальная ткань, нижние панели: опухолевая ткань. (А) мозг, (В) молочная железа, (С) толстый кишечник, (D) почки, (Е) печень, (F) легкие, (G) яичники, (Н) поджелудочная железа, (I) предстательная железа, (J) скелетные мышцы, (К) кожа, (L) тонкий кишечник, (М) желудок, (N) матка.
На Фигуре 5 показано связывание IgG человека, полученного на основе 2В10, с TNC A2, экспрессируемым клетками глиобластомы U87MG, по результатам проточной цитофлуориметрии (см. Пример 9). Показана средняя интенсивность флуоресценции клеток, обработанных различными концентрациями IgG 2В10 в сравнении с необработанными клетками и клетками, окрашенными только вторичным атителом (отрицательный контроль).
На Фигуре 6 показаны очистка и анализ человеческих IgG 2В10 дикого типа. А) Этап очистки с помощью аффинной хроматографии с протеином А. В) Этап очистки с помощью эксклюзионной хроматографии. С) Анализ с помощью электрофореза в полиакриламидном геле. Ход эксперимента описан в Примере 1.
На Фигуре 7 показаны очистка и анализ модифицированного с использованием гликоинженерии человеческого IgG 2B10. А) Этап очистки с помощью аффинной хроматографии с протеином А. В) Этап очистки с помощью эксклюзионной хроматографии. С) Анализ с помощью электрофореза в полиакриламидном геле. D) Анализ с помощью эксклюзионной хроматографии. Ход эксперимента описан в Примере 1.
На Фигуре 8 показано связывание антитела 2B10 против TNC A2 в виде дикого типа (wt) и в модифицированной с использованием гликоинженерии (де) версии с TNC A2 на клетках U87MG.
СВЕДЕНИЯ. ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Определения
"Акцепторные каркасные участки человека" в целях данного описания представляют собой каркасные участки, содержащие аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасные участки вариабельного домена тяжелой цепи (VH), полученные на основе каркасных участков иммуноглобулина человека или консенсусных каркасных участков человека, определение которым приведено ниже. Акцепторные каркасные последовательности, "полученные на основе" каркасной последовательности иммуноглобулина человека или консенсусных каркасных участков человека, могут содержать ту же аминокислотную последовательность или могут иметь измененную аминокислотную последовательность. В некоторых воплощениях число аминокислотных замен равно 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых воплощениях акцепторная последовательность каркасных участков VL идентична последовательности каркасных участков VL иммуноглобулина человека или консенсусной последовательности каркасных участков человека.
"Аффинность" обозначает суммарную силу всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). Если не указано иначе, термин "аффинность связывания" согласно использованию здесь обозначает собственную аффинность связывания, которая отражает взаимодействие между членами связывающей пары (например, антителом и антигеном) в соотношении 1:1. Аффинность молекулы X к своему партнеру Y может в общем виде быть представлена константой диссоциации (KD), которая представляет собой соотношение констант скоростей диссоциации и ассоциации (koff и kon, соответственно). Таким образом, равные аффинности могут характеризоваться различными константами скоростей реакции, при условии что соотношение констант скоростей остается неизменным. Аффинность может быть измерена общепринятыми способами известными в данной области техники, включая описанные здесь. Определенные иллюстративные и приведенные в качестве примеров воплощения для измерения аффинности связывания описаны ниже.
Антитело "подвергнутое аффинному созреванию" обозначает антитело с одной или несколькими модификациями (например, с мутациями аминокислот) в одном или нескольких гипервариабельных участках (HVRs) (например, CDRs), по сравнению с материнским антителом, не имеющим таких модификаций, такие модификации приводят к повышению аффинности антитела к антигену. Как правило, антитело, подвергнутое аффинному созреванию, связывается с теми же эпитопами, что и родительское антитело.
Термины "антитело к TNC А2" и "антитело, связывающее А2 домен Тенасцина-С" обозначают антитело, способное связывать TNC A2 с достаточной аффинностью таким образом, что антитело может применяться в качестве диагностического и/или терапевтического агента для нацеленного воздействия на TNC А2. В одном воплощении степень связывания антитела к TNC A2 с неродственным TNC A2 белком составляет менее 10% от связывания антитела с TNC A2, измеренного, например, с помощью радиоиммуннологического анализа (RIA). В некоторых воплощениях антитело, которое связывает TNC A2 имеет константу диссоциации (KD)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, и 0,01 нМ, или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых воплощениях антитело к TNC A2 связывает эпитоп TNC A2, который является консервативным у TNC A2 различных биологических видов.
Термин "антитело" здесь используется в широком смысле и включает антитела с различной структурой, включая моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, при условии, что они проявляют желаемую антиген-связывающую активность, но не ограничивается ими. Термин также включает фрагменты антител, имеющие Fc фрагмент и гибридные белки, содержащие участок, эквивалентный Fc фрагменту иммуноглобулина.
"Фрагмент антитела" обозначает молекулу, отличную от интактного антитела, содержащую часть интактного антитела, связывающего антиген, с которым связывается интактное антитело. Примеры фрагментов антитела включают Fv, Fab, Fab', Fab'-SH, F(ab')2, молекулы одноцепочечных антител (например, scFv), диатела и мультиспецифичные антитела, образованные из фрагментов антител, но не ограничиваются ими.
"Антитело, связывающееся с тем же эпитопом", что и референсное антитело, обозначает антитело, блокирующее связывание референсного антитела с его антигеном в тестах конкурентного связывания на 50% или более, и наоборот, референсное антитело блокирует связывание антитела с его антигеном в тестах конкурентного связывания на 50% или более. Примеры тестов конкурентного связывания приводятся ниже.
Термин "антиген-связывающий домен" обозначает часть антиген-связывающей молекулы, содержащую область, которая специфично связывает и является комплементарной к целому антигену или его части. В случаях, когда антиген имеет большие размеры, антиген-связывающая молекула может связывать только отдельную часть антигена, которая называется эпитопом. Антиген-связывающий домен может быть образован, например, одним или несколькими вариабельными доменами антитела (также называемыми вариабельными участками антитела). Предпочтительно, антиген-связывающий домен содержит вариабельный участок легкой цепи антитела (VL) и вариабельный участок тяжелой цепи антитела (VH).
Термин "химерное" антитело обозначает антитело, в котором часть тяжелой и/или легкой цепи получена из конкретных источников или биологических видов, тогда как оставшаяся часть тяжелой и/или легкой цепи получена из другого источника или биологического вида. Для химерных антител, например, компоненты не связывающие антиген могут быть получены у большого количества биологических видов, включая приматов, таких как шимпанзе и человек. Гуманизированные антитела являются наиболее предпочтительной формой химерных антител.
"Класс" антитела обозначает тип константного домена или константного участка его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, обозначаются α, δ, ε, γ и µ, соответственно.
Термин "цитотоксичный агент" здесь используется для обозначения вещества, ингибирующего или предотвращающего осуществление клеточной функции и/или вызывающего гибель или разрушение клетки. Цитотоксичные агенты включают радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные препараты (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); агенты, ингибирующие рост; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или энзиматически активные токсины бактериального, грибкового, растительного или животного происхождения, включая фрагменты и/или их варианты; и различные противоопухолевые или противораковые агенты, описанные ниже, но не ограничиваются ими.
"Эффекторные функции" относятся к формам биологической активности, связанным с Fc фрагментом антитела, различающимся у антител различных изотипов. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимую цитотоксичность (CDC); связывание Fc рецептора; антитело-зависимую клеточную цитотоксичность (ADCC); фагоцитоз; секрецию цитокинов; опосредованный иммунными комплексами захват антигена антиген-презентирующими клетками; снижение экспрессии рецепторов клеточной поверхности (например, В-клеточных рецепторов); и В-клеточную активацию.
"Эффективное количество" агента, например, фармацевтического препарата, обозначает количество, эффективное для достижения желаемого терапевтического или профилактического результата в необходимых дозировках и в течение необходимого периода времени.
Термин "Fc фрагмент" здесь используется для обозначения С-концевого участка тяжелой цепи иммуноглобулина, содержащего по меньшей мере часть константного участка. Термин включает нативную последовательность Fc фрагментов и вариантов Fc фрагментов. В одном воплощении Fc фрагмент тяжелой цепи IgG человека простирается от Cys226 или от Рго230 до карбокси-конца тяжелой цепи. Однако, С-концевой лизин (Lys447) Fc фрагмента может присутствовать или отсутствовать. Если не указано иначе, нумерация аминокислотных остатков в Fc фрагменте или в константном участке производится в соответствии с системой нумерации EU, также носящей название «EU index», согласно описанию Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
"Участок, эквивалентный Fc фрагменту иммуноглобулина" включает естественным образом возникающие аллельные варианты Fc фрагмента иммуноглобулина, а также варианты, имеющие модификации, приводящие к появлению замен, вставок, или делеций, существенно не понижающих способность иммуноглобулина опосредовать эффекторные функции (такие как антитело-зависимая клеточная цитотоксичность). Например, одна или более аминокислот могут быть удалены из N-конца или С-конца Fc фрагмента иммуноглобулина без существенной потери биологической функции. Такие варианты могут быть отобраны согласно общим правилам, известным в данной области техники, с тем, чтобы их влияние на активность было минимальным (см., например, Bowie, J. U. et al., Science 247:1306-10 (1990)).
"Каркасные участки" или "FR" обозначают остатки вариабельного домена, отличные от остатков гипервариабельного участка (HVR) (или CDR). FR вариабельного домена, как правило, состоит из 4 FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR, в составе VH (или VL), как правило, появляются в следующей последовательности: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины "полноразмерное антитело", "интактное антитело" и "полное антитело" здесь используются взаимозаменяемо и обозначают антитело, имеющее структуру в значительной степени схожую со структурой нативного антитела или имеющее тяжелые цепи, содержащие Fc фрагмент, как описано здесь.
Термины "клетка-хозяин", "линия клеток-хозяев" и "культура клеток-хозяев" используются взаимозаменяемо и обозначают клетки, в которые была внедрена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают "трансформанты" и "трансформированные клетки", включающие первично трансформированные клетки и их потомков, независимо от числа пассажей. Потомство может быть не полностью идентично родительской клетке по содержанию нуклеиновой кислоты, но может содержать мутации. Сюда также включаются мутантные потомки, имеющие такие же функции или биологическую активность при скрининге или отборе, как и исходные трансформированные клетки. В одном воплощении клетки-хозяева подвергают генетической модификации для получения антитела с модифицированными олигосахаридами. В некоторых воплощениях клетки-хозяева подвергали дальнейшей модификаци для повышения уровней экспрессии одного или нескольких полипептидов, обладающих активностью β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII). Клетки-хозяева включают культивируемые клетки, например, культивируемые клетки млекопитающих, такие как клетки СНО, клетки ВНК, клетки NSO, клетки SP2/0, клетки миеломы YO, клетки миеломы мыши Р3Х63, клетки PER, клетки PER.C6 или клетки гибридомы, клетки дрожжей, клетки насекомых и клетки растений, если перечислить только некоторые из них, а также клетки организма трансгенного животного, трансгенного растения или культивируемых растительных или животных тканей.
"Человеческое антитело" представляет собой антитело, обладающее аминокислотной последовательностью, соответствующей последовательности антитела, продуцируемого в организме или в клетках человека или полученное из источника, не относящегося к человеку, но задействующего репертуар антител человека или иные последовательности, кодирующие антитела человека. Данное определение антитела человека в частности исключает гуманизированные антитела, содержащие антиген-связывающие остатки, не являющиеся человеческими.
"Консенсусные каркасные участки человека" это каркасные участки, представляющие наиболее часто встречающиеся аминокислотные остатки в наборе последовательностей каркасных участков VL или VH иммуноглобулинов человека. Как правило, последовательности VL или VH иммуноглобулинов человека выбирают из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу согласно описанию Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols.1-3. В одном воплощении, подгруппой для VL является подгруппа каппа I, согласно Kabat et al., см выше. В одном воплощении, подгруппой для VH является подгруппа III, согласно Kabat et al., см выше.
"Гуманизированное" антитело обозначает химерное антитело, содержащее аминокислотные остатки гипервариабельных участков, не являющихся человеческими и аминокислотные остатки каркасных участков человека. В определенных воплощениях гуманизированное антитело содержит по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные участки (например, CDRs) соответствуют участкам антитела, не являющимся человеческими, и все или по существу все каркасные участки соответствуют участкам человеческого антитела. Гуманизированное антитело может содержать по меньшей мере часть константного участка антитела, полученного из антитела человека. "Гуманизированная форма" антитела, например, антитела не являющегося человеческим, обозначает антитело, прошедшее гуманизацию.
Термин "гипервариабельный участок" или "HVR", используемый здесь, обозначает каждый из участков вариабельного домена антитела, имеющих гипервариабельную последовательность и/или формирующих петли определенной структуры ("гипервариабельные петли"). Как правило, нативные состоящие из четырех цепей антитела имеют 6 HVRs; три в VH (Н1, Н2, Н3), и три в VL (L1, L2, L3). Как правило, HVRs содержат аминокислотные остатки гипервариабельных петель и/или "участков определяющих комплементаность" (CDRs), последние характеризуются наибольшей вариабельностью последовательности и/или задействованы в распознавании антигена. За исключением CDR1 в VH, CDRs как правило содержат аминокислотные остатки, формирующие гипервариабельные петли. Гипервариабельные участки (HVRs) также обозначаются участками, определяющими комплементарность (CDRs), и эти термины здесь используются взаимозаменяемо для обозначения частей вариабельного участка, формирующих антиген-связывающие участки. Эти конкретные участки были описаны в публикациях Kabat et al., U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983) и Chothia et al., J. Mol. Biol. 196:901-917 (1987), и при сравнении друг с другом данные определения включают перекрывающиеся группы аминокислотных остатков. Тем не менее, использование любого из определений для обозначения CDR антитела или его вариантов находится в рамках термина согласно использованию в настоящем документе. Соответствующие аминокислотные участки, содержащие CDRs, согласно любой из вышеупомянутых ссылок, представлены ниже в Таблице 1 для сравнения. Точные номера аминокислотных остатков, содержащих конкретные CDR, могут варьировать в зависимости от последовательности и размера CDR. Специалисты в данной области могут стандартным способом определить, какие аминокислотные остатки содержат конкретный CDR по указанной аминокислотной последовательности вариабельного участка антитела.
| Таблица 1. | |||
| Определения CDR1 | |||
| CDR | Kabat | Chothia | AbM2 |
| VH CDR1 | 31-35 | 26-32 | 26-35 |
| VH CDR2 | 50-65 | 52-58 | 50-58 |
| VH CDR3 | 95-102 | 95-102 | 95-102 |
| VL CDR1 | 24-34 | 26-32 | 24-34 |
| VL CDR2 | 50-56 | 50-52 | 50-56 |
| VL CDR3 | 89-97 | 91-96 | 89-97 |
| 1Нумерация всех определений CDR в Таблице 1 соответствует системе нумерации, разработанной Кабат и др. (см. ниже). 2"AbM" с прописной буквой "b" согласно использованию в Таблице 1 обозначают CDRs в соответствии с программой моделирования антител "AbM" Oxford Molecular. |
Kabat et al. также разработали систему нумерации для последовательностей вариабельных участков, которую можно применить для любого антитела. Любой специалист в данной области может однозначно "пронумеровать по системе Кабат" любую последовательность вариабельного участка, не основываясь на каких-либо экспериментальных данных помимо имеющихся для самой последовательности. Согласно использованию здесь, "нумерация согласно Кабат" относится к системе нумерации, разработанной Кабат и др., U.S. Dept. of Health and Human Services, "Sequence of Proteins of Immunological Interest" (1983). Если не указано иначе, ссылки на номера позиций конкретных аминокислотных остатков в вариабельном участке антитела указаны в соответствии с системой нумерации согласно Кабат.
CDRs также включают "остатки, определяющие специфичность" или "SDRs," которые представляют собой остатки, контактирующие с антигеном. SDRs находятся в составе участков CDRs, обозначаемых «укороченными CDRs», или а-CDRs (от англ. abbreviated-CDRs). Как правило, только от одной пятой до одной трети остатков в заданном CDR принимают участие в связывании антигена. Определяющие специфичность аминокислотные остатки в конкретном CDR могут быть идентифицированы, например, путем компьютерного моделирования межатомных контактов в трехмерной модели и определения вариабельности последовательности в положении заданного аминокислотного остатка в соответствии с методами, описанными Padlan et al., FASEB J. 9(1):133-139 (1995). Приведенные в качестве примера a-CDRs (a-CDR-U, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-Н3) образованы аминокислотными остатками в положениях 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35 В в Н1, 50-58 в Н2 и 95-102 в Н3 (см. Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008).) Если не указано иначе, HVR остатки и иные остатки вариабельного домена (например, остатки каркасного участка) здесь пронумерованы в соответствии с Kabat et al., см. выше.
"Конъюгат антитела" представляет собой антитело, конъюгированное с цитотоксическим агентом.
"Индивид" или "субъект" является млекопитающим. Млекопитающие включают одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и не относящихся к человеку приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс), но не ограничиваются ими. В определенных воплощениях индивидом или субъектом является человек.
"Выделенное" антитело обозначает антитело, изолированное от компонентов его естественного окружения. В некоторых воплощениях антитело очищено до степени чистоты более чем 95% или 99% согласно определению, например, электрофоретическими (например, электрофорезом в полиакриламидном геле, изоэлектрическим фокусированием (IEF), капиллярным электрофорезом) или хроматографическими (например, ионообменной или обратнофазной ВЭЖХ) способами. Для обзора способов оценки чистоты антител см., например, Flatman et al., J. Chromatogr. В 848:79-87 (2007).
"Выделенный" полинуклеотид обозначает молекулу полинуклеотида, изолированную от компонентов его естественного окружения. Выделенный полинуклеотид включает молекулу полинуклеотида, содержащуюся в клетках, как правило содержащих молекулу полинуклеотида, при этом молекула полинуклеотида находится внехромосомно или в участке хромосомы, отличном от естественного положения на хромосоме.
"Выделенный полинуклеотид, кодирующий антитело к TNC A2" обозначает одну или несколько полинуклеотидных молекул, кодирующих тяжелые и легкие цепи антитела (или их фрагменты), включая такую(ие) полинуклеотидную(ые) молекулу(ы) в одном векторе или в разных векторах, при этом такая(ие) полинуклеотидная(ые) молекула(ы) находится в одном или нескольких местоположениях в клетке-хозяине.
Термин "моноклональное антитело" здесь используется для обозначения антитела, полученного из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны и/или связывают один эпитоп, за исключением возможных вариантов антител, например, содержащих мутации, которые возникают естественным путем или в ходе получения препарата моноклонального антитела, при этом подобные варианты, как правило, присутствуют в минорных количествах. В противоположность препаратам поликлональных антител, обычно содержащим различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против единственной детерминанты или антигена. Таким образом, определение "моноклональное" указывает на характер антитела, полученного из по существу гомогенной популяции антител, и не должно рассматриваться как необходимость получения антитела определенным способом. Например, моноклональные антитела, предназначенные для применения в соответствии с настоящим изобретением, могут быть произведены с помощью различных технологий, включая гибридомную технологию, технологию рекомбинантной ДНК, технологию фагового дисплея и технологии с использованием трансгенных животных, имеющих все локусы человеческих иммуноглобулинов или их часть, но не ограничиваясь ими; данные способы и другие приведенные в качестве примера способы производства моноклональных антител здесь описаны.
"Голое антитело" обозначает антитело, не конъюгированное с гетерологичным компонентом (например, цитотоксичным компонентом) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтической композиции.
"Нативные антитела" обозначают молекулы иммуноглобулинов, возникающие естественным образом и имеющим различные структуры. Например, нативные антитела класса IgG являются гетеротетрамерными гликопротеинами весом приблизительно 150000 дальтон, состоящими из двух идентичных легких цепей и двух идентичных тяжелых