Индолил или индолинилгидроксаматные соединения, их содержащая фармацевтическая композиция (варианты) и способ лечения рака (варианты) с их помощью
Иллюстрации
Показать всеИзобретение относится к соединениям формулы (I), где R1 представляет собой SO2Ra, в котором Ra представляет собой необязательно замещенный арил или гетероарил, R2 выбирают из Н, алкила, NHC(O)-CH=CH-C(O)NRcRd, и C(O)NRcRd, где Rc и Rd независимо друг от друга выбирают из Н и гидроксигруппы, и каждая из групп R3, R4, R5 и R6 независимо друг от друга выбрана из Н, алкила, CH=CH-C(O)NRcRd, NHC(O)-CH=CH-C(O)NRcRd и C(O)NRcRd, где Rc и Rd независимо друг от друга выбирают из Н и гидроксигруппы. Соединения проявляют ингибирующую активность в отношении гистондеацетилазы (ГДАЦ), и фармацевтическим композициям, содержащим указанные соединения. Соединения могут использоваться для лечения рака. 7 н. и 9 з.п. ф-лы, 2 табл., 30 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины и фармакологии, а именно, к новым индолил или индолинилгидроксаматным соединениям, проявляющим ингибирующую активность в отношении гистондеацетилазы (ГДАЦ), к фармацевтическим композициям их содержащим и к способам лечения рака с помощью указанных соединений.
Уровень техники
Деацетилазы гистонов (ГДАЦ) представляют собой класс ферментов, которые регулируют ацетилирование гистонов и, тем самым, регулируют экспрессию генов. Известно, что ингибиторы ГДАЦ вызывают прекращение роста клеток, дифференцировку и апоптоз в опухолевых клетках. Поэтому они привлекают огромное внимание в качестве сильнодействующих противораковых веществ. См., например, Lu et al., J. Med. Chem. 2005, 48, 5530-5535; Kulp et al., Clin. Cancer Res. 2006, 12, 5199-5206; и Ryan et al., J. Clin. Oncol. 2005, 23, 3912-3922.
Раскрытие изобретения
Данное изобретение основано на неожиданном открытие того, что некоторые индолил- или индолинилгидроксаматные соединения являются ингибиторами ГДАЦ и обладают сильной противораковой активностью. Таким образом, данное изобретение относится к индолил- или индолинилгидроксаматным соединениям и использованию их при лечении рака.
В одном аспекте отличительной особенностью данного изобретения является индолил- или индолинилгидроксамтное соединения с формулой (I):
В данной формуле - представляет собой одинарная или двойная связь; n равно 0, 1 или 2; R1 - представляет собой Н, алкил, необязательно замещенный арильной или гетероарильной группой, алкенил, алкинил, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, C(O)Ra или SO2Ra, в котором Ra - представляет собой Н, алкил, алкенил, алкинил, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил; а каждая из групп R2, R3, R4, R5 и R6 независимо друг от друга представляет собой Н, алкил, алкенил, алкинил, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, галоген, цианогруппу, нитрогруппу, ORb, SRb, S(O)Rb, CH=CH-C(O)Rb, CH=CH-C(O)NRcRd, NHC(O)-CH=CH-C(O)Rb, NHC(O)-CH=CH-C(O)NRcRd, SO2NRcRd, ОС(O)Rb, С(O)Rb, С(O)ORb, C(O)NRcRd, NRcRd, NHC(O)Rb, NHC(O)NRcRd или NHC(S)Rc, в котором каждая из групп Rb, Rc и Rd независимо друг от друга представляют собой Н, гидроксигруппу, алкоксигруппу, арилоксигруппу, алкил, алкенил, алкинил, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклоалкил или гетероциклоалкенил; а когда R1 представляет собой SO2Ra, то, по меньшей мере, одна из групп R2, R3, R5 и R6 - это CH=CH-C(O)NRcRd, NHC(O)-СН=СН-С(O)Rb или NHC(O)-СН=СН-C(O)NRcRd или R4 - это СН=СН-С(O)Rb, CH=CH-C(O)NRcRd, NHC(O)-CH=CH-C(O)Rb или NHC(O)-CH=CH-C(O)NRcRd, а когда R1 представляет собой арил, то R4 - это CH=CH-C(O)NHRc.
Один подкласс вышеописанных индолил- или индолинилгидроксаматных соединений включает соединения, в которых R4 - это СН=СН-С(O)Rb, СН=СН-C(O)NRcRd, NHC(O)-CH=CH-C(O)Rb или NHC(O)-CH=CH-C(O)NRcRd. В этих соединениях R4 может представлять собой С(O)NHOH, СН=СН-С(O)ОН, CH=CH-C(O)NHOH, NHC(O)-CH=CH-C(O)OH или NHC(O)-CH=CH-C(O)NHOH; R1 может представлять собой SO2Ra, при этом Ra - это арил или гетероарил (например, фенил, необязательнозамещенный галогенидной, гидроксильной, алкоксильной, амино, циано или нитрогруппой); или, по меньшей мере, одна из групп R2, R3, R5, R6 может представлять собой СН=СН-С(O)NRcRd, NHC(O)-СН=СН-С(O)Rb или NHC(O)-СН=СН-С(O)NRcRd (например, СН=СН-С(O)NHOH, NHC(O)-CH=CH-C(O)OH или NHC(O)-СН=СН-С(O)NHOH).
Другой подкласс вышеописанных индолил- или индолинилгидроксаматных соединений включает соединения, в которых, по меньшей мере, одна из групп R2, R3, R5, R6 - может представлять собой CH=CH-C(O)NRcRd, NHC(O)-СН-СН-С(O)Rb или NHC(O)-СН=СН-С(O)NRcRd. В этих соединениях, по меньшей мере, одна из групп R2, R3, R5, R6 - может представлять собой CH=CH-C(O)NHOH, NHC(O)-CH=CH-C(O)OH, или NHC(O)-CH=CH-C(O)NHOH. R1 может представлять собой SO2Ra, при этом Ra - представляет собой арил или гетероарил (например, фенил, необязательно замещенный галогенидной, гидроксильной, алкоксильной, амино, циано или нитрогруппой).
Еще один подкласс вышеописанных индолил или индолинилгидроксаматных соединений включает соединения, в которых R1 - это SO2Ra, a Ra - это арил или гетероарил. Ra может представлять собой фенильную группу, необязательно, с галогенидным, гидроксильным, алкоксильным, амино, циано или нитро заместителем.
Термин "алкил" относится к неразветвленным или разветвленным одновалентным углеводородам, содержащим, если не указано иное, 1-20 атомов углерода (например, С1-С10). К примерам алкильных групп относятся, помимо прочего, метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил и трет-бутил. Термин "алкенил" относится к неразветвленным или разветвленным одновалентным углеводородам, содержащим 2-20 атомов углерода (например, C2-C10) и одну или несколько двойных связей. К примерам алкенильных групп относятя, помимо прочего, этенил, пропенил, аллил и 1,4-бутадиенил. Термин "алкинил" относится к неразветвленным или разветвленным одновалентным углеводородам, содержащим 2-20 атомов углерода (например, С2-С10) и одну или несколько тройных связей. К примерам алкинильных групп относятся, помимо прочего, этинил, 1-пропинил, 1- или 2-бутинил и 1-метил-2-бутинил. Термин "алкокси" относится к -O-алкильному радикалу. К примерам "алкокси-групп" относятся, помимо прочего, метокси-, этокси-, н-пропокси, изопропокси, н-бутокси, изо-пропокси, втор-бутокси и трет-бутокси группы. Термин "амино" относится к NH2, алкиламино или ариламиногруппе. Термин "алкиламино" относится к -N(R)-алкильному радикалу, в котором R может представлять собой Н, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкил, гетероциклоалкенил, арил или гетероарил.
Термин "циклоалкил" относится к одновалентной насыщенной углеводородной циклической системе с 3-30 атомами углерода (например, С3-С12). К примерам циклоалкильных групп относятя, помимо прочего, циклопропил, циклобутил, циклопентил, циклогексил, 1,4-циклогексилен, циклогептил, циклооктил и адамантил. Термин "циклоалкенил" относится к одновалентной неароматической углеводородной циклической системе с 3-30 атомам углерода (например, С3-С20), содержащей одну или несколько двойных связей. К примерах таких систем относятся циклопентенил, циклогексенил и циклогептенил. Термин "гетероциклоалкил" относится к одновалентной неароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической системе с одним или несколькими гетероатомами (такими как О, N, S или Se). К примерам гетероциклоалкильных групп относятся, помимо прочего, пиперазинил, пирролидинил, диоксанил, морфолинил и тетрагидрофуранил. Термин "гетероциклоалкенил" относится к одновалентной неароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической системе с одним или несколькими гетероатомами (такими как О, N, S или Se), содержащей одну или несколько двойных связей.
Термин "арил" относится к одновалентной 6-углеродной моноциклической, 10-углеродной бициклической, 14-углеродной трициклической системе ароматических колец. К примерам арильных групп относятся, помимо прочего, фенил, нафтил и антраценил. Термин "гетероарил" относится к одновалентной ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической системе с одним или несколькими гетероатомами (такими как О, N, S или Se). К примерам гетероарильных групп относятся пиридил, фурил, имидазолил, бензимидазолил, пиримидинил, тиенил, хинолинил, индолил, тетразолил и тиазолил.
Вышеупомянутые алкильная, алкенильная, алкинильная, циклоалкильная, гетероциклоалкильная, циклоалкенильная, гетероциклоалкенильная, амино, арильная и гетероарильные группы включают как замещенные, так и незамещенные компоненты. К возможным заместителями при амино, циклоалкильной, гетероциклоалкильной, циклоалкенильной, гетероциклоалкенильной, арильной и гетероарильной группе относятся, помимо прочего, С1-С10-алкильная, С2-С10-алкенильная, C2-С10-алкинильная, С3-С20-циклоалкильная, С3-С20-циклоалкенильная, C1-C20-гетероциклоалкильная, С1-С20-гетероциклоалкенильная, С1-С10-алкокси, арильная, арилокси, гетероарильная, гетероарилокси, амино, С1-С10-алкиламино, ариламино, гидрокси, галогенидная, оксо (O=), тиоксо (S=), тио, силильная, С1-С10-алкилтио, арилтио, С1-С10-алкилсульфонильная, арилсульфонильная, ациламино, аминоацильная, аминотиоацильная, аминидино, амидо, тиоуреидо, тиоацинатная, сульфонамидо, гуанидиновая, уреидо, циано, нитро, ацильная, тиоацильная, ацилокси, карбамидо, карбамильная (-С(О)NH2), карбоксильная (-СООН) и сложноэфирная группы. С другой стороны к возможным заместителям при алкильной, алкенильной или алкинильной группах относятся все вышеперечисленные заместители, кроме С1-С10-алкила.
Циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, арил и гетероарил могут быть соединены друг с другом.
Описанные в этом документе индолил- или индолинилгидроксаматные соединения включают как соединения сами по себе, так и их соли, сольваты и пролекарственные формы, если такое возможно. Соль, к примеру, может быть образована между анионом и положительно заряженной группой (например, аминогруппой) на индолил- или индолинилгидроксаматном соединении. К подходящим анионам относятся хлорид, бромид, йодид, сульфат, гидросульфат, сульфамат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат, глютамат, глюкуронат, глутарат, соль яблочной кислоты, малеат, сукцинат, фумарат, тартрат, тозилат, салицилат, лактат, нафталинсульфонат и ацетат.Подобным же образом, соль может быть образована между катионом и отрицательно заряженной группой (например, карбоксилатной) на индолил- или индолинилгидроксаматном соединении. К подходящим катионам относятся ион натрия, ион калия, ион магния, ион кальция, и ион аммония, например, ион тетраметиламмония. Индолил или индолинилгидроксаматные соединения также включают соединения, содержащие четвертичные атомы азота. К примерам пролекарств относятся сложные эфиры и другие фармацевтически приемлемые производные, которые при введении больному способны обеспечивать активные индолил-или индолинилгидроксаматные соединения.
В другом аспекте настоящее изобретение относится к способу подавления активности ГДАЦ посредством контактирования клетки с эффективным количеством индолил- или индолинигидроксаматного соединения, описанного выше.
В еще одном аспекте настоящее изобретение относится к способу лечения рака путем введения больному, нуждающемуся в лечении,
эффективного количества индолил- или индолинигидроксаматного соединения, описанного выше.
В пределах объема настоящего изобретения также находятся фармацевтическая композиция, содержащий одно или несколько вышеописанных индолил- или индолинилгидроксаматных соединений, для использования при лечении рака, а также данное терапевтическое применение и использование этих соединений для изготовления лекарственного средства для лечения рака.
Подробности одного или нескольких вариантов осуществления данного изобретения изложены ниже в описании. Другие особенности, объекты и преимущества изобретения очевидны из описания и формулы настоящего изобретения.
Осуществление изобретения
Ниже показаны примерные соединения, описанные в данному документе.
Индолил или индолилгидроксаматные соединения, описанные сданном документе, могут быть получены традиционными химическими превращениями (включая способы с использованием защитных групп), например, по способам, описанным в R.Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W.Greene и P.G.M.Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); LFieser и М.Fieser, Fieser and Fieser′s Reagents for Organic Synthesis, John Wiley and Sons (1994); и L.Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и последующих ее изданиях.
Индолил- или индолинилгидроксаматное соединение, синтезированное таким образом, может быть дополнительно очищено методом флэш-хроматографии на колонке, высокоэффективной жидкостной хроматографии, кристаллизацией или другими подходящими способами.
Упомянутые в данном документе индолил- или индолинилгидроксаматные соединения могут содержать неароматическую двойную связь или один или несколько асимметрических центров. Таким образом, они могут существовать в виде рацематов и рацемических смесей, отдельных энантиомеров, индивидуальных диастереомеров, диастереомерных смесей и в виде цис- или транс-изомеров. Предполагаются все изомерные формы.
Также в пределах объема настоящего изобретения находятся (1) фармацевтическая композиция, которая содержит эффективное количество, по меньшей мере, одно из индолил- или индолинилгидроксаматных соединений данного изобретения и фармацевтически приемлемый носитель и (2) способ лечения рака путем введения больному, нуждающемуся в таком лечении, эффективного количества такого индолил- или индолинилгидроксаматного соединения.
Используемый в данном документе термин "лечение" относится к введению индолил- или индолинилгидроксаматного соединения больному, страдающему от рака или имеющему симптомы рака или предрасположенность к данному заболеванию, с целью излечения, заживления, смягечения, ослабления, изменения, вылечивания, улучшения, оздрововления, воздействия или снижения риска расстройства, симптомов или предрасположенности к раку. Термин "эффективное количество" относится к количеству активного вещества, которое необходимо для обеспечения предполагаемого терапевтического эффекта у больного. Эффективные количества могут варьироваться, что понятно для специалистов в данной области техники, в зависимости от способа введения, использования вспомогательных веществ и возможности совместного использования вместе с другими веществами.
Раковые заболевания, которые могут быть излечены по способам изобретения, включают как солидные опухоли, таки и опухоли кроветворной системы различных органов. К примерам солидных опухолей относятся рак поджелудочной железы, рак мочевого пузыря, рак ободочной и прямой кишки, рак молочной железы, в том числе, метастатический рак молочной железы, рак предстательной железы, в том числе, андроген-зависимый и андроген-независимый рак предстательной железы, рак почек, в том числе, например, метастатический почечноклеточный рак, печеночно-клеточный рак, раклегких, в том числе, например, немелкоклеточный раклегкого (NSCLC), альвеолярно-клеточная опухоль (ВАС) и аденокарцинома легкого, рак яичников, в том числе, например, прогрессирующий эпителиальный рак или рак идиопатического перитонита, рак шейки матки, рак желудочно-кишечного тракта, рак пищевода, рак головы и шеи, в том числе, например, плоскоклеточный рак головы и шеи, меланома, нейроэндрокринный рак, в том числе, метастатические нейроэндрокринныеопули, опухоли головного мозга, в том числе, глиома, анапластическая олигодендроглиома, мультиформная глиобластома взрослого и атипическая астроцитома взрослого, рак костей и саркома мягких тканей. К примерам злокачественных опухолей кроветворной системы относятся острый миелолейкоз (ОМЛ), хронический миелолейкоз (ХМЛ), в том числе прогрессирующий ХМЛ и ХМЛ на недифференцируемой стадии (ХМЛ-НС), острый лимфобластный лейкоз (ОЛЛ), хронический лимфобластный лейкоз (ХЛЛ), болезнь Ходжкина (БХ), не-ходжкинская лимфома (НХЛ), в том числе фоликуллярная лимфома и лимфома из клеток мантийной зоны, В-клеточная лимфома, Т-клеточная лимфома, множественная миелома (ММ), макроглобулинемия Вальденстрема, миелодиспластический синдромы (МДС), в том числе рефракторная анемия (РА), рефракторная анемия с кольцевидными сидеробластами (РАКС), рефракторная анемия с избытком бластов (РАИБ) и рефракторная анемия с избытком бластов на стадии трансформации (РАИБ-Т) и миелопролиферативные синдромы.
Для воплощения способа данного изобретения на практике вышеописанный фармацевтическая композиция может быть введена путем приема внутрь, парентерально, с использованием ингаляционного спрея, местно, через прямую кишку, нос, трансбуккальным, вагинальным способом или через имплантированный резервуар. Используемый в данном документе термин "парентеральный" включает подкожный, внутрикожный, внутривенный, внутримышечный, внутрисуставной, внутриартериальный, надчревной, интратекальный способы, способ введения внутрь пораженных тканей, внутричерепной способы инъекции или инфузии.
Стерильная инъецируемая композиция, например, стерильная водная или маслянистая суспензия для инъекции, может быть составлена по способам, известным в данной области техники, с использованием подходящих диспергирующих или смачивающих веществ (таких как Твин 80) и суспендирующих веществ. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавители или растворители, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых сред и растворителей, которые пригодны для использования, находятся маннит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные жирные масла (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, используют при приготовлении инъецируемых препаратов, в виде природных фармацевтически приемлемых масел, таких как оливковое или касторовое масло, в особенности, в их полиоксиэтилированных вариантах. Данные масляные растворы или суспензии могут также содержать разбавитель или диспергатор на основе длиноцепочечного спирта, либо карбоксиметилцеллюлозу или схожие дисперигующие вещества. Для приготовления композиции могут также использоваться другие обычно используемые поверхностно-активные вещества, такие как твины или спаны, или другие схожие эмульгаторы или усилители биодоступности, которые обычно используют при приготовлении фармацевтически приемлемых твердых, жидких или других лекарственных форм.
Композиция для приема внутрь может также представлять собой перорально приемлемую лекарственную форму, включая, помимо прочего, капсулы, таблетки, эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток для приема внутрь к обычно используемым носителям относятся лактоза и кукурузный крахмал. Как правило, добавляют также смазывающие вещества, такие как стеарат магния. При приеме внутрь в виде капсулы к пригодным разбавителям относятся лактоза и высушенный кукурузный крахмал. При приеме внутрь водных суспензий или эмульсий активный ингредиент может быть суспендирован или растворен в масляной фазе в сочетании с эмульгирующим или суспендирующими веществами. При желании можно добавить определенные подсластители, вкусовые вещества или окрашивающие вещества. Назальные аэрозоль или ингаляционный состав могут быть приготовлены по способам, хорошо известным в области приготовления фармацевтических составов (композиций). Композиции (составы), содержащие индолил- или индолинилгидроксаматные соединения, могут быть также введены в форме суппозиториев для ректального введения.
Носитель в фармацевтическом составе должен быть приемлемым в плане совместимости с активным ингредиентом состава (и, предпочтительно, обладать способностью стабилизации его) и не оказывать неблагоприятного воздействия на больного, подвергающегося лечению. В качестве фармацевтического носителя для доставки активных соединений можно использовать одно или несколько солюбилизирующих веществ (например, циклодекстрины), которые образуют более растворимые комплексы с активными индолил- или индолинилгидроксаматными соединениями. К примерам носителей относятся коллоидный диоксид кремния, стеарат магния, лаурилсульфат натрия и D&C желтый №10 (2-(2-Хинолил)-1,3-индандиондисульфоновая кислота, динатриевая соль).
Для предварительной оценки эффективности противораковыхэффектов индолил- или индолинилгидроксаматных соединений, например, подавления роста опухолевых клеток, можно использовать подходящие in vitro способы анализа. Соединения могут быть, кроме того, оценены на эффективность при лечении рака. Например, соединение может быть введено животному (например, в экспериментальную модель на мыше) с раковым заболеванием, а затем проводится оценка его терапевтической эффективности. На основе полученных результатов может быть определен подходящий диапазон доз и способ введения.
Без проведения дополнительных исследований полагают, что вышеприведенное описание адекватно обеспечивает возможность осуществления настоящего изобретения. Поэтому следующие примеры следует тольковать лишь как иллюстрацию, а не ограничение оставшейся части раскрытия каким бы то ни было образом. Все публикации, цитированные в данном документе, включены в данной документ по сссылке во всей своей полноте.
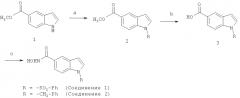
Пример 1. Синтез гидроксиамида 1-бензолсульфонил-1Н-индол-5-
карбоновой кислоты (соединение 1)
Схема 1
Соединение 1 синтезируют по способу, представленному выше на схеме 1 (реагенты и условия: а) хлористый бензил или бензолсульфонилхлорид, t-BuOK, KI, ДМФА; b) 1M LiOH (водн-), диоксан; с) (i) NH2ОТГП (NH2O тетрагидропиран), PyBOP (бензотриазол-1-ил-окситрипирролидинофосфоний гексафторфосфат), NEt3, ДМФА (диметилформамид), комн. темп.; (ii) ТФК(трифторуксусная кислота), МеОН, комн. темп.).
Метиловый эфир 1-бензолсульфонил-1Н-индол-5-карбоновой кислоты (2): После перемешивания в течение 20 мин суспензии метилиндол-5-карбоксилата (1) (0,30 г, 1,71 ммоль), гидросульфата тетрабутиламмония (ТБАГС) (0,19 г, 0,26 ммоль) и КОН (0,19 г, 3,42 ммоль) в CH2Cl2 (15 мл) добавляют бензолсульфонилхлорид (0,32 мл, 2,57 ммоль). Реакционную смесь оставляют перемешиваться на ночь при комнатной температуре, затем гасят водой и экстрагируют CH2Cl2 (20 мл × 3). Объединенные органические вытяжки сушат над безводным MgSO4 и концентрируют при пониженном давлении, получая желтый остаток.
1-Бензолсульфонил-1Н-индол-5-карбоновая кислота (3): 1М водный раствор LiOH (3,87 мл, 3,87 ммоль) добавляют к раствору сырого продукта 2 в диоксане (15 мл). Смесь перемешивают при 40°C на протяжении ночи, а затем концентрируют при пониженном давлении. Остаток растворяют в воде. Затем к раствору добавляют концентрированную HCl до тех пор, пока рН не станет меньше 7, что приводит к выпадению осадка, который высушивают под вакуумом, получая соединение 3 (0,38 г) в виде белого твердого вещества с выходом 74%.
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 6,83 (д, J = 3,70 Гц, 1Н), 7,51-7,54 (м, 2Н), 7,60-7,63 (м, 1Н), 7,75 (д, J = 3,72 Гц, 1Н), 7,95 (д, J = 7,63 Гц, 2Н), 7,97 (дд, J = 8,83, 1,49 Гц, 1Н), 8,03 (д, J = 8,86 Гц, 1Н), 8,25 (д, J = 0,82 Гц, 1Н).
Гидроксиамид 1-бензолсульфонил-1Н-индол-5-карбоновойкислоты (1):
NH2ОТГП (0,08 г, 0,72 ммоль) добавляют к раствору 3 (0,18 г, 0,60 ммоль), PyBOP (0,33 г, 0,63 ммоль) и триэтиламина (0,20 мл, 1,43 ммоль) в ДМФА (1,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, а затем гасят водой и экстрагируют EtOAc (15 мл × 3). Объединенные органические вытяжки сушат над безводным MgSO4 и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем (элюент - CH2Cl2:СН3ОН=30:1:1% NH3(водн)), получая после упаривания белое твердое вещество, которое обрабатывают ТФК (1,70 мл, 22,89 ммоль) в присутствии СН3ОН (31 мл). Реакционную смесь оставляют перемешиваться на ночь при комнатной температуре, а затем концентрируют при пониженном давлении, получая белый остаток. Остаток перекристаллизовывают из СН3ОН, получая соединение 1 (0,10 г).
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 6,80 (д, J = 3,65 Гц, 1Н), 7,49-7,52 (м, 2Н), 7,59-7,62 (м, 1Н), 7,68 (д, J = 8,53 Гц, 1Н), 7,75 (д, J = 3,72 Гц, 1Н), 7,93 (д, J = 7,52 Гц, 2Н), 7,94-7,97 (м, 1Н), 8,04 (д, J = 8,53 Гц, 1Н).
Масс-спектр высокого разрешения (ЭУ) для C15H12N2O4S (M+): вычислено, 316,0518; найдено, 316,0518.
Пример 2. Синтез гидроксиамида 1-бензил-1Н-индол-5-карбоновой кислоты (соединение 2)
Соединение 2 получают по способу, схожему для описанного в Примере 1.
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 5,40 (с, 2Н), 6,60 (д, J = 3,1 Гц, 1Н), 7,11 (д, J = 7,2 Гц, 2Н), 7,21-7,28 (м, 3H), 7,36-7,38 (м, 2Н), 7,50 (дд, J = 8,5, 1,7 Гц, 1Н), 8,02 (д, J = 1,1 Гц, 1Н).
Масс-спектр (ЭУ), m/z: 266. Масс-спектр высокого разрешения (ЭУ) для C16H14N2O2 (M+): вычислено, 266,1055; найдено, 266,1057.
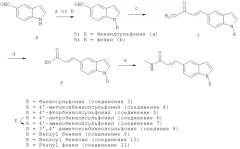
Пример 3. Синтез 3-(1-бензолсульфонил-1Н-индол-5-ил)-Н-гидрокси-акриламида (соединение 3)
Схема 2
Соединение 3 синтезируют по способу, представленному выше на схеме 2 (реагенты и условия: а) хлористый бензил или бензоилхлорид, 4-метокссибензолсульфонилхлорид, 4-фторбензолсульфонилхлорид или 4-нитробензолсульфонилхлорид,1-BuOK, KI, ДМФА; b)4-йодбензол, K2CO3, CuO, ДМФА; с) Ph3P=СН-СООСН3, CH2Cl2; d) 1M LiOH (водн.), диоксан; е) (i) NH2ОТГП, PyBOP, NEt3, ДМФА; (ii) ТФК, МеОН; f) Fe, NH4Cl, изопропанол, Н2О).
1-Бензолсульфонил-1 Н-индол-5-карбальдегид (5): После перемешивания в течение 20 мин суспензии метилиндол-5-карбоксилата (4) (1,00 г, 6,89 ммоль), гидросульфата тетрабутиламмония (0,35 г, 1,03 ммоль) и KOH (0,77 г, 13,78 ммоль) в CH2Cl2 (30 мл) добавляют бензолсульфонилхлорид (1,32 мл, 10,33 ммоль). Реакционную смесь оставляют перемешиваться на ночь при комнатной температуре, затем гасят водой и экстрагируют CH2Cl2 (20 мл × 3). Объединенные органические вытяжки сушат над безводным MgSO4 и концентрируют при пониженном давлении, получая желтый остаток, который очищают хроматографией на колонке с силикагелем (элюент - EtOAc (этилацетат): н-гексан = 1:2). После упаривания получают продукт 5 (1,79 г) в виде белого твердого вещества.
ЯМР 1H (500 МГц, CDCl3), δ, м.д.: 6,78 (д, J = 3,6 Гц, 1Н), 7,45-7,48 (м, 2Н), 7,55-7,58 (м, 1Н), 7,67 (д, J = 3,7 Гц, 1Н), 7,85-7,87 (м, 1Н), 7,89 (д, J = 7,6 Гц, 2Н), 8,06 (с, 1Н), 8,11 (д, J = 8,6 Гц, 1Н), 10,03 (с, 1Н).
Метиловый эфир 3-(1-бензолсульфонил-1Н-индол-5-ил)-акриловой кислоты (7): Ацетат метил(трифенилфосфоранилидена) (2,52 г, 7,53 ммоль) добавляют к раствору 5 (1,79 г, 6,27 ммоль) в CH2Cl2 (25 мл). Реакционную смесь оставляют перемешиваться на ночь при комнатной температуре, затем гасят водой и экстрагируют CH2Cl2 (25 мл × 3). Объединенные органические вытяжки сушат над безводным MgSO4 и концентрируют при пониженном давлении, полученный желтый остаток очищают хроматографией на колонке с силикагелем (элюент - EtOAc: н-гексан = 1:3), получая после упаривания продукт 7 (2,08 г) в виде белого твердого вещества.
3-(1-Бензолсульфонил-1Н-индол-5-ил)-акриловая кислота (8): 1М водный раствор LiOH (11,72 мл, 11,72 ммоль) добавляют к раствору 7 (2,00 г, 5,86 ммоль) в диоксане (20 мл). Реакционную месь перемешивают при 40°C на протяжении ночи, а затем концентрируют при пониженном давлении. Остаток растворяют в воде. Затем к раствору прибавляют концентрированную HCl до тех пор, пока рН не станет кислым, что приводит к выпадению осадка, который высушивают под вакуумом, получая 8 (1,72 г) в виде белого твердого вещества.
ЯМР 1H (500 МГц, CDCl3), δ, м.д.: 6,39 (д, J = 16,1 Гц, 1Н), 6,71 (д, J = 3,6 Гц, 1 Н), 7,45-7,48 (м, 2Н), 7,52 (дд, J = 8,7, 1,4 Гц, 1Н), 7,55-7,58 (м, 1Н),7,61 (д, J = 3,7 Гц, 1Н), 7,67-7,72 (м, 2Н), 7,89 (д, J = 8,9 Гц, 2Н), 7,96 (д, J = 8,7 Гц, 1Н).
3-(1-Бензолсульфонил-1H-индол-5-ил)-N-гидрокси-акриламид (соединение 3): NH2ОТГП (0,43 г, 3,67 ммоль) добавляют к раствору 8 (1,00 г, 3,05 ммоль), PyBOP (1,69 г, 3,24 ммоль) и триэтиламина (1,02 мл, 7,33 ммоль) в ДМФА (1,5 мл). Реакционную смесь перемешиваютпри комнатной температуре в течение 3 ч, а затем гасят водой и экстрагируют EtOAc (20 мл × 3). Объединенные органические вытяжки сушат над безводным MgSO4 и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем (элюент - CH2Cl2 : СН3ОН = 30:1:1% NH3(водн)), получая после упаривания белое твердое вещество, которое обрабатывают ТФК (6,90 мл, 92,90 ммоль) в присутствии СН3ОН (140 мл). Реакционную смесь оставляют перемешиваться на ночь при комнатной температуре. Затем смесь концентрируют при пониженном давлении, полученный белый остаток перекристаллизовывают из СН3ОН, получая соединение 3 (0,85 г) в виде красного твердого вещества.
ЯМР 1H (500 МГц, CDCl3), δ, м.д.: 6,42 (д, J = 15,8 Гц, 1Н), 6,75 (д, J = 3,5 Гц, 1Н), 7,49-7,54 (м, 3H), 7,59-7,62 (м, 1Н), 7,61 (д, J = 15,5 Гц, 1Н), 7,68 (д, J = 3,6 Гц, 1Н), 7,72 (с, 1Н), 7,93 (д, J = 7,7 Гц, 2Н), 7,98 (д, J = 8,6 Гц, 1Н).
Масс-спектр (ЭУ), m/z: 327 (100%), 342 (M+, 3%). Масс-спектр высокого разрешения (ЭУ) для C17H14N2O4S (М+): вычислено, 342,0674; найдено, 342,0673.
Пример 4. Синтез Н-гидрокси-3-(1-(4-метоксибензолсульфонил)-1Н-индол-5-ил)-акриламида (соединение 4)
Соединение 4 получают по способу, схожему для описанного в Примере 3.
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 3,79 (с 3H), 6,43 (д, J = 15,8 Гц, 1Н), 6,73 (д, J = 3,5 Гц, 1Н), 6,99 (д, J = 9,1 Гц, 2Н), 7,52 (д, J = 8,7 Гц, 1Н), 7,62 (д, J = 15,7 Гц, 1Н), 7,65 (д, J = 3,6 Гц, 1Н), 7,71 (с, 1Н), 7,86 (д, J = 8,9 Гц, 2Н), 7,97 (д, J = 8,6 Гц, 1Н). ЖХ-МС, m/z: 373 (М+).
Масс-спектр высокого разрешения (ЭУ) для C18H16N2O5 (М+): вычислено, 372,0780; найдено, 372,0779.
Пример 5. Синтез 3-(1-(4-фторбензолсульфонил)-1Н-индол-5-ил)-Н-гидрокси-акриламида (соединение 5)
Соединение 5 получают по способу, схожему для описанного в Примере 3.
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 6,45 (д, J = 15,9 Гц, 1Н), 6,77 (д, J = 3,5 Гц, 1Н), 7,54 (д, J = 8,6 Гц, 2Н), 7,61 (д, J = 15,4 Гц, 1Н), 7,67 (д, J = 3,7 Гц, 1Н), 7,73 (с, 1Н), 7,98-8,02 (м, 3H). ЖХ-МС, m/z: 361 (М+).
Масс-спектр высокого разрешения (ЭУ) для C17H13FN2O4S (M+): вычислено, 360,0580; найдено, 360,0580.
Пример 6. Синтез N-гидрокси-3-(1-(4-нитробензолсульфонил)-1H-индол-5-ил)-акриламида (соединение 6)
Соединение 6 получают по способу, схожему для описанного в Примере 3.
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 6,44 (д, J = 15,7 Гц, 1Н), 6,81 (д, J = 3,1 Гц, 1Н), 7,56 (д, J = 8,6 Гц, 1Н), 7,61 (д, J = 15,7 Гц, 1Н), 7,72 (д, J = 3,5 Гц, 1Н), 7,74 (с, 1Н), 8,01 (д, J = 8,5 Гц, 1Н), 8,18 (д, J = 8,6 Гц, 2Н), 8,33 (д, J = 8,6 Гц, 2Н).
Масс-спектр высокого разрешения (ЭУ) для C17H13N3O6S (М+): вычислено, 387,0525; найдено, 387,0523.
Пример 7. Синтез 3-(1-(4-амино-бензолсульфонил)-1Н-индол-5-ил)-Н-гидрокси-акриламида (соединение 7)
Соединение 7 синтезируют по способу, представленному на схеме 2 в Примере 3.
Суспенизию соединения 6 (0,10 г, 0,26 ммоль), порошка железа (0,05 г, 0,77 ммоль) и хлорида аммония (0,03 г, 0,52 ммоль) в смеси изопропилового спирта (5 мл) и воды (1 мл) кипятят в течение 4 ч. Реакционную смесь концентрируют при пониженном давлении, затем гасят водой и экстрагируют CH2Cl2. Объединенные органические вытяжки сушат над безводным MgSO4 и концентрируют при пониженном давлении. Реакционную смесь очищают хроматографией на колонке с силикагелем (CH2Cl2 : CH3OH = 10:1:1% NH3(водн)), получая соединение 7 (0,06 г).
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 6,57 (д, J = 8,9 Гц, 2Н), 6,60 (д, J = 15,8 Гц, 1Н), 6,69 (д, J = 3,5 Гц, 1Н), 7,53 (дд, J = 8,5, 1,4 Гц, 1Н), 7,58 (д, J = 9,0 Гц, 2Н), 7,60 (д, J = 8,3 Гц, 1 H), 7,62 (д, J = 3,8 Гц, 1 Н), 7,73 (с, 1 Н), 7,94 (д, J = 8,6 Гц, 1Н).
Масс-спектр высокого разрешения (ЭУ) для C17H15N3O4S (М+): вычислено, 357,0783; найдено, 357,0785.
Пример 8. Синтез 3-(1-(3,4-диметоксибензолсульфонил)-1Н-индол-5-ил)-Н-гидрокси-акриламида (соединение 8)
Соединение 8 получают по способу, схожему для описанного в Примере 3.
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 3,78 (с, 3H), 3,81 (с, 3H), 6,42 (д, J = 15,78 Гц, 1 Н), 6,73 (д, J = 3,57 Гц, 1Н), 7,00 (д, J = 8,61 Гц, 1Н), 7,33 (д, J = 1,99 Гц, 1Н), 7,52-7,56 (м, 2Н), 7,60 (д, J = 15,75 Гц, 1Н), 7,68 (д, J = 3,65 Гц, 1Н), 7,72 (с, 1Н), 7,99 (д, J = 8,66 Гц, 1Н).
Пример 9. Синтез 3-(1-бензил-1Н-индол-5-ил)-N-гидрокси-акриламида (соединение 9)
Соединение 9 получают по способу, схожему для описанного в Примере 3.
ЯМР 1H (500 МГц, CDCl3), δ, м.д.: 5,32 (с, 2Н), 6,57 (д, J = 3,1 Гц, 1Н), 7,10 (д, J = 7,1 Гц, 2Н), 7,14 (д, J = 3,1 Гц, 1Н), 7,25-7,32 (м, 5Н), 7,37 (д, J = 8,3 Гц, 1Н), 7,80 (с, 1Н) 7,85 (д, J = 15,4 Гц, 1Н). ЖХ-МС, m/z: 293 (M+).
Масс-спектр высокого разрешения (ЭУ) для C18H16N2O2 (M+): вычислено, 292,1212; найдено, 292,1213.
Пример 10. Синтез 3-(1-бензоил-1Н-индол-5-ил)-N-гидрокси-акриламида (соединение 10)
Соединение 10 получают по способу, схожему для описанного в Примере 3.
ЯМР 1H (500 МГц, ДМСО), δ, м.д.: 6,48 (д, J = 15,8 Гц, 1Н), 6,78 (д, J = 3,6 Гц, 1Н), 7,42 (д, J = 3,6 Гц, 1Н), 7,54-7,61 (м, 4Н), 7,67-7,70 (м, 1Н), 7,75 (д, J = 7,3 Гц, 2Н), 7,86 (с, 1Н), 8,24 (д, J = 8,6 Гц, 1Н), 9,00 (с, 1Н), 10,73 (с, 1Н).
Масс-спектр (ЭУ), m/z: 306. Масс-спектр высокого разрешения (ЭУ) для C18H14N2O3 (М+): вычислено, 306,1004; найдено, 306,1006.
Пример 11. Синтез N-гидрокси-3-(1-фенил-1Н-индол-5-ил)-акриламида (соединение 11)
1-Фенил-1Н-индол-5-карбальдегид (6): Суспензию метилиндол-5-карбоксилата (4) (0,70 г, 4,82 ммоль), 4-йодбензола (0,65 мл, 5,79 ммоль), K2CO3 (0,93 г, 6,75 ммоль), CuO (0,04 г, 0,48 ммоль) в ДМФА (2 мл) кипятят в течение 2 дней. Реакционную смесь гасят водой и экстрагируют EtOAc (20 мл × 3). Объединенные органические вытяжки сушат над безводным MgSO4 и концентрируют при пониженном давлении, полученный желтый остаток очищают хроматографией на колонке с силикагелем (элюент - EtOAc : н-гексан = 1:4), получая после упаривания 6 (0,30 г). ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 6,83 (д, J = 3,2 Гц, 1Н), 7,431-7,44 (м, 1Н),7,42 (д, J = 3,1 Гц, 1Н), 7,49-7,51 (м, 2Н), 7,54-7,60 (м, 3H), 7,77 (дд, J = 8,7, 1,1 Гц, 1Н), 10,06 (с, 1Н).
Соединение 11 получают по способу, схожему для описанного в Примере 3, с использованием соединения 6 вместо 5.
ЯМР 1H (500 МГц, CD3OD), δ, м.д.: 7,18 (д, J = 15,7 Гц, 1Н), 7,49 (д, J = 3,1 Гц, 1Н), 8,15-8,20 (м, 1Н), 8,30-8,38 (м, 8Н), 8,59 (с, 1Н). Масс-спектр (ЭУ), m/z: 278.
Масс-спектр высокого разрешения (ЭУ) для C17H14N2O2 (M+) вычислено, 278,1055; найдено, 278,1055.
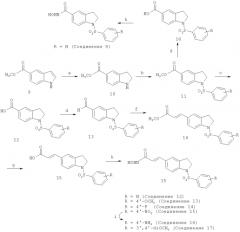
Пример 12. Синтез 3-(1-бензолсульфонил-2,3-дигидро-1Н-индол-5-ил)-N-гидрокси-акриламида (соединение 12)
Схема 3
Соединение 12 синтезируют по способу, представленному выше на схеме 3 (реагенты и условия: (а) NaBH3CN, AcOH; (b) бензолсульфонилхлорид, 4-метоксибензолульфонилхлорид, 3,4-диметоксибензолсульфонилхлорид, 4-фторбензолсульфонилхлорид, 4-фторбензолсульфонилхлорид или 4-нитробензолсульфонилхлорид, пиридин; (с) LiAlH4, ТГФ; (d) PDC (пиридиния дихромат), MS (молекулярные сита), CH2Cl2;(f) Ph3P = СН-COOCH3, CH2Cl2; (g) 1М LiOH (водн.), диоксан; (h) (i) NH2ОТГП, PyBOP, NEt3, ДМФА; (ii) ТФК, MeOH; (i) Fe, NH4Cl, изопропанол, H2O).
Метиловый эфир 2,3-дигидро-1Н-индол-5-карбоновой кислоты (10): Цианборгидрид натрия (0,16 г, 2,57 ммоль) добавляют к раствору метилиндол-5-карбоксилата (9) (0,30 г, 1,71 мм