Противовирусное средство на основе сухого экстракта плодового тела базидиомицета coprinus comatus
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, в частности к противовирусному средству. Противовирусное средство на основе экстракта базидиомицета Coprinus comatus (O.F. .) Pers., которое содержит сухой экстракт указанного гриба, приготовленный методом высушивания этанольного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при определенном содержании компонентов в сухом экстракте, водный раствор которого в концентрации не менее 1,0 мг/мл обладает противовирусной активностью в отношении РНК-геномного вируса гриппа А субтипов H3N2 и H5N1. Вышеописанное средство эффективно в отношении РНК-геномного вируса гриппа А субтипов H3N2 и H5N1. 6 табл., 5 пр.
Реферат
Изобретение относится к средству, полученному на основе сухого экстракта высшего базидиомицета Coprinus comatus (Навозник лохматый) с противовирусной активностью в отношении РНК-геномного вируса (вируса гриппа А) и ДНК-геномных вирусов (ортопоксвирусов: вирусов осповакцины и оспы мышей - эктромелии; и вируса простого герпеса 2-го типа) и может быть использовано в области фармацевтики, химической технологии, вирусологии, медицины и ветеринарии.
Вирусы гриппа А, обладающие высокой степенью изменчивости генома, являются этиологическими агентами опасных инфекционных заболеваний человека и животных, способных протекать в форме обширных эпизоотий, эпидемий и пандемий с высокой смертностью. На протяжении последнего десятилетия Всемирная Организация Здравоохранения (ВОЗ) была озабочена поочередным появлением новых высокопатогенных штаммов вируса гриппа птиц H5N1 и вируса гриппа свиней H1N1, способных передаваться человеку. При этом часть вновь возникающих штаммов проявляет устойчивость не только к применявшимся ранее лекарствам адамантанового ряда - амантадину и ремантадину (ингибиторам мембранного белка М2), но и к современным противогриппозным препаратам - озельтамивиру и занамивиру (ингибиторам вирусных нейраминидаз) [Бурцева Е.И., Шевченко Е.С., Белякова Н.В., Оскерко Т.А., Колобухина Л.В., Меркулова Л.Н., Вартанян Р.В., Прилипов А.Г., Ротанов М., Заплатников А.Л. 2009. Мониторинг чувствительности выделенных в России эпидемических штаммов вирусов гриппа к этиотропным химиопрепаратам. Вопр. вирусол. 5, 25-28; Hurt А.С., Selleck P., Komadina N., Shaw R., Brown L., Barr I.G. 2007. Susceptibility of highly pathogenic A(H5N1) avian influenza viruses to the neuraminidase inhibitors and adamantanes. Antivir. Res. 73, 228-231; Lackenby A., Hungnes O., Dudman S.G., Meijer A., Paget W.J., Hay A.J., Zambon M.C. 2008. Emergence of resistance to oseltamivir among influenza A (H1N1) viruses in Europe. Eurosurveillance. 13, 8026].
Поэтому вопрос о необходимости разработки и поиска новых лекарственных средств защиты от гриппозной инфекции, включающих как профилактические, так и лечебные препараты, представляется крайне важным и особо актуальным.
Прекращение глобальной вакцинации против оспы привело к тому, что большая часть населения в мире уже не имеет иммунитета против данной инфекции. В настоящее время периодически возникают вспышки заболеваний, вызванных ортопоксвирусами, у людей по всему миру [Elsendoorn A., Agius G., Le Moal G. et al. Severe ear chondritis due to cowpox virus transmitted by a pet rat // Journal of Infection. - 2011. - Vol. 63, N 5. - P. 391-393; Reed K.D., Melski J.W., Graham M.B., Regnery R.L., Sotir M.J., Wegner M.V., et al. The detection of monkeypox in humans in the Western Hemisphere. // N Engl J Med. - 2004. - 350: 342-50]. Известно, что наиболее эффективным способом защиты людей от оспы и других ортопоксвирусов является вакцинация. Однако противооспенные вакцины могут вызывать побочные реакции и вакцинальные осложнения [Verardi Р.Н., Titong А., С.J. Hagen. A vaccinia virus renaissance. New vaccine and immunotherapeutic uses after smallpox eradication // Hum Vaccin Immunother. - 2012. - P. 961-970]. Известен ряд противовирусных препаратов с относительно невысокой антивирусной активностью в отношении ортопоксвирусов, таких как цидофовир, гливек [Sliva, K., and В. Schnierle. 2007. From actually toxic to highly specific - novel drugs against poxviruses. Journal of Virology 4:8.].
К настоящему времени наиболее исследованными и перспективными противооспенными препаратами являются разрабатываемые в США препараты гексадецил-оксипропил сидофовир (СМХ001) и ST-246 [Quenelle D.C., Kern E.R. Treatment of Vaccinia and Cowpox Virus Infections in Mice with CMX001 and ST-246. Viruses. 2010; 2 (12): 2681-2695; SIGA Technologies Inc. Advisory Committee Briefing Book. Human BioArmor. Background Package for FDA Advisory Committee Meeting on December 14-15, 2011. vol. 1. USA; 2011]. Однако поскольку в геноме ортопоксвирусов могут появляться мутации, обусловливающие их устойчивость к лекарственным препаратам, необходим поиск новых химических соединений с различными механизмами действия и разработка на их основе новых противовирусных лекарств. В этой связи проблема создания новых высокоэффективных противовирусных препаратов против оспенных заболеваний весьма актуальна.
Герпетические инфекции представляют собой группу инфекционных заболеваний, вызываемых вирусами герпеса человека. На территории России и в странах Содружества независимых государств (СНГ) от хронической герпетической инфекции страдает не менее 22 миллионов человек [Васильев А.Н. Оценка влияния антиоксидантов на специфическую противовирусную активность интерферона альфа-2b человеческого рекомбинантного в отношении вируса простого герпеса в культуре клеток // Антибиотики и химиотерапия. 2010, №7, с. 20-25]. В целом, почти треть населения Земли поражена герпетической инфекцией и у 50% из них ежегодно наблюдаются рецидивы заболевания, так как иммунитета против этой вирусной инфекции нет. Около 90% городского населения во всех странах мира инфицировано одним или несколькими типами вируса герпеса, а рецидивирующие герпесные инфекции наблюдаются у 9-12% жителей разных стран. Инфицированность и заболеваемость постоянно растут, опережая естественный прирост населения Земли. Особенно быстро увеличивается число зарегистрированных случаев генитального герпеса (увеличилось на 168% за последнее десятилетие) [Штро А.А., Слита А.В., Карпинская Л.А., Галочкина А.В., Зарубаев В.В. Активность интерферона в комбинации с антиоксидантами против ДНК- и РНК-содержащих вирусов человека // Лечащий врач. 2012, №10, с. 52-56]. В настоящее время существуют специфические противовирусные препараты для лечения инфекций, вызываемых вирусом простого герпеса. Препаратами выбора для терапии герпеса являются аналоги нуклеозидов - ацикловир, ганцикловир, валацикловир, пенцикловир и фамцикловир, являющиеся единственными, обладающими доказанной эффективностью. Несмотря на наличие в арсенале профилактики и лечения герпетической инфекции набора перечисленных препаратов, вирусы герпеса способны вырабатывать к ним устойчивость, что существенно снижает эффективность противовирусной химиотерапии, а в тяжелых случаях и ставит под угрозу жизнь пациента. Поэтому по-прежнему актуальными являются поиск и разработка эффективных и дешевых противогерпетических препаратов, возможно более широкого спектра действия.
В целом, опыт применения противовирусных препаратов указывает на необходимость использования комбинации нескольких лекарственных средств для повышения эффективности лечения вирусных инфекций и устранения возможности появления резистентных вариантов вирусов. Поэтому вопрос о необходимости разработки и поиска новых лекарственных средств защиты от инфицирования вирусами является чрезвычайно актуальным.
В настоящее время в мире активно проводятся исследования по поиску и разработке противовирусных препаратов на основе соединений природного происхождения, обладающих более мягким терапевтическим действием и низкой токсичностью по сравнению с синтетическими лекарственными средствами. В этом отношении базидиальные грибы представляют значительный интерес как источники лечебных и профилактических средств с противоопухолевой, иммуностимулирующей и противовирусной активностью. Исследования последнего десятилетия показывают, что многие представители базидиальных грибов-макромицетов являются природными источниками различных биологически активных веществ (БАВ) (гликанов (полисахаридов), белков, каротиноидов, тритерпенов) с антибактериальной, антифунгиальной, противоопухолевой, антивирусной активностью и иммуномодулирующим действием.
Предшествующий уровень техники
Показано, что экстрагированные из Ganoderma pfeifferi тритерпены, в частности ганодермадиол, люцидадиол, аппланоксидевая кислота G ингибировали in vitro вирус гриппа A [Mothana R.A.A., Awadh A.N.A., Jansen R. et al. Antiviral lanostanoid triterpenes from the fungus Ganoderma preifferi // Fitoterapia. - 2003. - V. 74. - P. 177-180]. Первое из упомянутых соединений было также активно и в отношении вируса простого герпеса 1-го типа. Известно, что БАВ ганодериола F и ганодерманонтриола, полученные из экстракта гриба Ganoderma lucidum, в концентрациях 7,8 мг/мл проявляют выраженную активность против ВИЧ-1 [El-Mekkawy S., Meselhy M.R., Nakamura N., Tezuka Y., Hattori M, Kakiuchi N. Anti-HIV-1 and anti-HIV-1-protease substances from Ganoderma lucidum. Phytochemistry. 1998. - Vol. 49. - P. 1651-1657].
Обнаружено, что экстракты трутовика лекарственного Fomitopsis officinalis обладают антивирусной активностью в отношении ортопоксвирусов - вируса оспы коров (Cowpox) и вакцинного вир уса (Vaccinia) [Stamets Paul Е. Antipox Properties of Fomitopsis officinalis (Vill.: Fr.) Bondartsev et Singer (Agarikon) from the Pacific Northwest of North America // Int. Journal of Medicinal Mushrooms. - 2005. -Vol. 7. - P. 495-506]. В другом исследовании установлено, что композиции из грибов родов Fomitopsis, Piptoporus, Ganoderma могут быть использованы в профилактике и лечении против разных вирусов, включая ортопоксвирусы [Патент US 20060171958].
Наиболее близким аналогом (прототипом) являются исследования экстракта навозника лохматого (Coprinus comatus), полученного методом водного извлечения, который проявлял противовирусные свойства в отношении ортопоксвирусов и вируса простого герпеса 2-го типа [Костина Н.Е., Ибрагимова Ж.Б., Проценко М.А., Макаревич Е.В., Скарнович М.А., Филиппова Е.И., Горбунова И.А., Власенко В.А., Трошкова Г.П., Мазуркова Н.А., Шишкина Л.Н. Выделение, характеристика и противовирусные свойства биологически активных веществ из высших грибов Западной Сибири // Современные проблемы науки и образования. - 2013. - №. 3].
Однако в вышеуказанном аналоге не исследовалась противовирусная активность экстракта Навозника лохматого, полученного методом этанольного извлечения, в отношении вируса гриппа А субтипов H3N2 и H5N1.
Техническим результатом заявляемого изобретения является расширение спектра противовирусных средств с активностью в отношении РНК-геномного вируса гриппа А субтипов H3N2 и H5N1.
Указанный технический результат достигается тем, что в противовирусном средстве на основе экстракта базидиомицета Coprinus comatus Pers., согласно изобретению оно содержит сухой экстракт указанного гриба, приготовленный методом высушивания этанольного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при следующем содержании компонентов в сухом экстракте, мг/г:
| сухие экстрактивные вещества | 250 |
| полисахариды | не менее 95 |
| суммарные белки | не менее 9-34 |
| фенольные соединения | не более 5 , |
водный раствор которого в концентрации не менее 1,0 мг/мл обладает противовирусной активностью в отношении РНК-геномного вируса гриппа А субтипов H3N2.
Полных данных по химическому составу плодовых тел Навозника лохматого из источников научно-технической и патентной информации не обнаружено.
Полисахариды базидиомицетов способны ингибировать репродукцию вирусов, блокируя процесс их адсорбции на клетках [Полiщук О.М., Коваленко О.Г. Бiологична актиiвнiсть глiкополiмерiв базидiальных грибiв // Biopolymers and Cell, 2009. - vol. 25. - N 3. - P. 181-193].
Пример 1. Получение сухого экстракта из плодовых тел гриба методом высушивания этанольного извлечения из измельченного и гомогенизированного сырья
10 г измельченных и гомогенизированных плодовых тел гриба суспендировали в 200 мл 70%-го водного раствора этанола трехкратно в течение 8 часов общего времени экстрагирования при температуре 60°С. Использование 70%-ного водного раствора этанола было оптимальным для максимального извлечения экстрактивных веществ (ЭВ) из гриба Coprinus comatus (табл. 1).
Использование температуры экстрагирования 60°C при прочих равных условиях было оптимальным для максимального извлечения экстрактивных веществ из гриба Coprinus comatus (табл. 2), использование температуры экстрагирования 70°C не увеличивало выход ЭВ и при этом требовало больших энергетических затрат.
Затем объединенные охлажденные экстракты фильтровали через стеклянные фильтры, выпаривали на ротационном испарителе и высушивали при температуре 60°C в сушильном шкафу.
Пример 3. Определение органолептических и физико-химических показателей экстрактов
Определение органолептических и физико-химических показателей водных и этанольных экстрактов проводили следующим образом: потерю в массе при высушивании определяли по фармакопейной методике, содержание тяжелых металлов проводили по ГФ XII, содержание полисахаридов определяли спектрофотометрически модифицированным антроновым методом Дрейвуда.
Результаты определения органолептических и физико-химических показателей экстрактов приведены в таблице 3.
Пример 4. Определение характеристик этанольного экстракта гриба
Определение суммы экстрактивных веществ проводили по методике ГФ XII изд., вып. 2. Для качественного обнаружения флавоноидных соединений в экстрактах гриба применяли качественные реакции с раствором натрия гидроксида, алюминия хлорида, железа хлорида, а также метод тонкослойной хроматографии (ТСХ). Для обнаружения тритерпенов и каротиноидов использовали метод ТСХ.
Количественное содержание белка в образцах определяли по Бредфорду по фармакопейной методике.
Суммарное содержание полисахаридов определяли спектрофотометрически модифицированным антроновым методом Дрейвуда, включающим кислотный гидролиз полисахаридов серной кислотой с получением моносахаридов, образующих с антроном окрашенные комплексы сине-зеленого цвета с максимумом спектра поглощения при 520-625 нм. При разбавлении реакционной смеси этиловым спиртом максимум спектра поглощения смещается до 430 нм. Определение содержания полисахаридов проводили в пересчете на глюкозу, используя предварительно построенный калибровочный график зависимости величины оптической плотности глюкозы (λ=430 нм) от концентрации.
Результаты определения химических характеристик этанольного извлечений из гриба Coprinus comatus Pers. приведены в таблице 4.
Пример 5. Определение противовирусной активности этанольного экстракта гриба Coprinus comatus в культурах клеток MDCK и Vero и на лабораторных животных
Культура клеток. Для тестирования противовирусной активности препаратов использовали перевиваемые культуры клеток MDCK и Vero, полученные из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор». По 100 мкл суспензии клеток MDCK в среде RPMI-1640 (или Vero в среде DMEM) вносили в 96-луночные планшеты 12-канальной автоматической пипеткой. Планшеты с клетками помещали в термостат при температуре +37°C, 5% CO2 и 100% влажности на 2-3 сут. до образования клеточного монослоя.
Определение токсичности экстракта. Для определения токсических концентраций экстрактов образцы разводили в несколько раз и оценивали наличие токсического действия в монослоях культур клеток MDCK и Vero с помощью инвертированного микроскопа. Для этого делали разведения исходного образца в 5 раз, в 10, 100, 1000, 10000, 100000, 1000000 раз средой RPMI-1640 (для клеток MDCK) или средой DMEM (для клеток Vero), содержащей 5% сыворотки крови плодов коровы, вносили по 150 мкл в соответствующие лунки планшета и ставили в термостат при температуре +37°C, 5% CO2 и 100% влажности на 2-4 сут. Через 2-4 сут с помощью инвертированного микроскопа оценивали наличие токсического действия в монослоях клеток MDCK и Vero, инкубированных с разными концентрациями грибных экстрактов.
В опытах по определению противовирусной активности грибных экстрактов на культурах клеток MDCK и Vero использовали предварительно определенные их максимально переносимые концентрации (МПК) для этих клеточных культур.
Определение противовирусной активности экстракта in vitro и in vivo. В работе использовали штаммы РНК-геномного вируса: штамм вируса гриппа птиц A/chicken/Kurgan/05/2005 (H5N1) и штамм вируса гриппа человека A/Aichi/2/68 (H3N2), полученные из Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» (п. Кольцово, Новосибирская обл.).
Определение противовирусной активности экстракта в отношении РНК-содержащих вирусов на клетках MDCK. Наработку вируса гриппа производили на 10-суточных куриных эмбрионах (КЭ), титрование вируса гриппа проводили на культуре клеток MDCK. Концентрации вируса гриппа субтипов A/H5N1 и A/H3N2 в вирусаллантоисной жидкости (ВАЖ) составляли от 7,8 до 8,2 lg ТЦД50/мл (50% тканевых цитопатических доз в мл). В опытах по определению противовирусной активности грибных экстрактов в отношении вируса гриппа готовили разведения ВАЖ каждого вируса от 1 до 8 с десятикратным шагом с использованием среды RPMI-1640 (ООО «Биолот», Россия), содержащей 2 мкг/мл трипсина ТРСК (Sigma, США). Для определения противовирусной активности образцов в монослой культуры клеток MDCK вносили по 50 мкл выбранного разведения экстракта на среде RPMI-1640, содержащей 2 мкг/мл трипсина, и 100 мкл разведенного от 1 до 8 или неразведенного ВАЖ. В случае использования неразведенных грибных экстрактов или ВАЖ трипсин вносили до конечной концентрации 2 мкг/мл поддерживающей среды в лунке 96-луночного планшета. Клетки инкубировали 2 сут при температуре 37°C в атмосфере 5% CO2 в термостате ТС-1/80 СПУ (Россия). Через 2 сут в каждой лунке с помощью инвертированного микроскопа регистрировали цитопатическое действие (ЦПД) в монослое клеток и определяли наличие вируса в среде культивирования по реакции гемагглютинации (РГА) с 1%-й суспензией эритроцитов кур. Определяли титры вируса в lg ТЦД50/мл в контроле (50%-я инфицирующая доза - ИД50 in vitro без препарата) и в опыте (ИД50 in vitro с препаратом), а затем высчитывали индекс нейтрализации (ИН) вирусов под влиянием экстракта: ИН=ИД50контроль - ИД50опыт (lg).
В качестве контроля использовали:
1. Контроль клеток MDCK, культивируемых в питательной среде RPMI-1640 (ООО «Биолот», С-Петербург), содержащей 2 мкг/мл трипсина TPCK (Sigma, США).
2. Контроль репродукции штаммов вируса гриппа A/Aichi/2/68 (H3N2) и A/chicken/Kurgan/05/2005 (H5N1) с 1 до 8 разведения с десятикратным шагом без внесения грибных экстрактов.
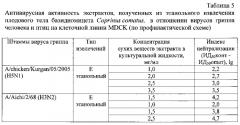
В таблице 5 представлены результаты определения противовирусной активности экстракта, полученного из этанольного извлечения плодового тела гриба Coprinus comatus, в зависимости от концентрации сухих веществ в среде, в отношении штамма A/Aichi/2/68 (H3N2) вируса гриппа человека и штамма A/chicken/Kurgan/05/2005 (H5N1) вируса гриппа птиц по профилактической схеме в монослое клеток MDCK.
Как видно из таблицы 5, этанольный экстракт данного гриба проявил выраженный противовирусный эффект в отношении используемых в эксперименте штаммов вируса гриппа субтипов H3N2 и H5N1.
Индекс нейтрализации (ИН) для вируса гриппа человека A/Aichi/2/68 (H3N2) под действием экстракта, полученного из этанольного извлечения навозника лохматого, в концентрации 1,0 мг/мл составил 2,0 lg (табл. 5).
При использовании большей концентрации, а именно: 1,5 мг/мл, была обнаружена более высокая противовирусная активность (ИН для вируса гриппа человека A/Aichi/2/68 (H3N2) под действием экстрактов, полученных из этанольного извлечения Навозника лохматого, составили 3,8 lg соответственно).
Индекс нейтрализации вируса гриппа птиц A/chicken/Kurgan/05/2005 (H5N1) под действием экстракта, полученного из этанольного извлечения навозника лохматого, в концентрации 3,5 мг/мл составил 3,5 lg, (табл. 5).
Определение противовирусной активности экстрактов в отношении РНК-содержащего вируса (вируса гриппа А) на лабораторных мышах.
В работе были использованы аутбредные мыши ICR массой 14-16 г, полученные из питомника ФБУН ГНЦ ВБ «Вектор». Мышей содержали на стандартном рационе с достаточным количеством воды, подвергали эвтаназии в соответствии с требованиями по гуманному содержанию и использованию животных в экспериментальных исследованиях [Руководство по содержанию и использованию лабораторных животных. Washington, D.C.: National Akademy Press; 1996. 138].
В опытах по изучению протективных свойств экстрактов, полученных из водного и этанольного извлечений базидиального плодового тела гриба Coprinus comatus, в отношении вируса гриппа A/Aichi/2/68 (H3N2) использовали лечебно-профилактическую схему - экстракты с концентрацией 1 мг/мл вводили перорально мышам (по 200 мкл/мышь) за час до заражения вирусом гриппа A/Aichi/2/68 (H3N2). Мышей инфицировали интраназально под легким эфирным наркозом при введении в обе ноздри суммарно 40 мкл соответствующего разведения штамма вируса гриппа A/Aichi/2/68 (H3N2) в дозе 20 ЛД50 (50%-х летальных доз), равной 4,3±0,3 lg ТЦД50/гол. (десятичных логарифмов 50%-й тканевой цитопатической дозы), применение которой приводило к инфицированию 100% животных. Далее экстракты вводили 2 раза в сутки в течение 5 суток (включая день заражения животных вирусом). За животными наблюдали в течение 14 суток. Высчитывали процент выживаемости животных в опыте и контроле, коэффициент защиты (КЗ) и среднюю продолжительность жизни (СПЖ) мышей. При определении СПЖ в каждой экспериментальной группе учитывали число животных, проживших определенное количество дней после заражения до гибели, и число выживших животных. За максимальное значение СПЖ для выживших животных принимали 14 суток, т.е. следующий день после прекращения гибели инфицированных мышей. КЗ высчитывали по формуле: % гибели мышей в контроле - % гибели мышей в опыте.
Статистическая обработка результатов. При расчетах 50%-х инфицирующих доз и титров вируса гриппа в биологических образцах в каждом единичном повторе использовали метод Спирмана-Кербера: определяли 95%-й доверительный интервал (I95) и сравнивали по z-критерию [Закс Л. Статистическое оценивание. М.: Статистика; 1976; - 598 С.]. Для нескольких повторов определяли среднее значение показателя (М) и ошибку среднего (m), достоверность различия средних величин устанавливали с помощью t-критерия Стьюдента [Закс Л. Статистическое оценивание. М.: Статистика, 1976; - 598 С.].
В таблице 6 представлены результаты определения противовирусной активности экстрактов, полученных из этанольного извлечения плодовых тел гриба Coprinus comatus, на лабораторных мышах в отношении вируса гриппа A/Aichi/2/68 (H3N2) в лечебно-профилактической схеме.
Как видно из таблицы 6, в опытах in vivo, проведенных по лечебно-профилактической схеме, достоверный протективный эффект по влиянию на процент выживаемости мышей, инфицированных вирусом гриппа A/Aichi/2/68 (H3N2), проявил этанольный экстракта гриба Coprinus comatus.
В инфицированной группе сравнения (введение Тамифлю) выжило 60% животных, тогда как в контрольной инфицированной группе (введение дистиллированной воды) погибло 100% животных (табл. 6).
Средняя продолжительность жизни (СПЖ) мышей, получавших экстракт из этанольного извлечения навозника лохматого, достоверно не отличалась от показателя в контрольной группе, тогда как СПЖ мышей, получавших коммерческий противогриппозный препарат Тамифлю, была достоверно выше, чем в контроле (табл. 6).
Противовирусное средство на основе экстракта базидиомицета Coprinus comatus (O.F. .) Pers., характеризующееся тем, что оно содержит сухой экстракт указанного гриба, приготовленный методом высушивания этанольного извлечения биологически активных веществ из измельченного и гомогенизированного сырья, при следующем содержании компонентов в сухом экстракте:
| сухие экстрактивные вещества | 250 мг/г |
| полисахариды | не менее 95 мг/г |
| суммарные белки | не менее 9-34 мг/г |
| фенольные соединения | не более 5 мг/г, |