Агонисты протеинтирозинфосфатазы-1, содержащей домен гомологии-2 src, и способы лечения с применением указанных агонистов
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы I, которые обладают агонистической активностью в отношении протеинтирозинфосфатазы-1, содержащей домен гомологии-2 Src (SHP-1). В формуле I R1 и R3 независимо представляют собой водород, и R2 представляет собой , , , , или R1 независимо представляет собой водород, R3 представляет собой метил, и R2 представляет собой или или R2 и R3 независимо представляют собой водород, и R1 представляет собой . Изобретение относится также к фармацевтическим композициям, содержащим указанное соединение, к способу повышения экспрессии в клетке протеинтирозинфосфатазы-1, содержащей домен гомологии-2 Src (SHP-1), способу лечения заболевания или патологического состояния, характеризующегося пониженной экспрессией SHP-1, и к применению указанного соединения для получения лекарственного средства для лечения заболевания или патологического состояния, характеризующегося пониженной экспрессией SHP-1. 7 н. и 4 з.п. ф-лы, 6 табл., 23 ил., 2 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к новым соединениям, обладающим агонистической активностью в отношении протеинтирозинфосфатазы-1, содержащей домен гомологии-2 Src, (SHP-1), и способам лечения с применением указанных соединений.
УРОВЕНЬ ТЕХНИКИ
[0002] SHP-1, представляющая собой протеинтирозинфосфатазу с двумя доменами гомологии-2 (SH2) Src, является регулятором различных внутриклеточных сигнальных молекул, таких как сигнальный трансдуктор и активатор транскрипции 3 (STAT3), KIT, CD22, CD5, CD72, SHPS-1, TIMP (металлопротеиназы), CDK2, р27, SRC, ZAP70, IL-10, NF-κВ, Lck, 3ВР2, Lyn и циклин D1.
[0003] STAT3 представляет собой фактор транскрипции, который регулирует рост и выживаемость клеток посредством модуляции экспрессии генов-мишеней. Указанный фактор транскрипции выступает в качестве онкогена, который является конститутивно активным при многих злокачественных новообразованиях, включая рак печени, легких, головы и шеи, предстательной железы и молочной железы, а также миелому и лейкоз. Основным регулятором активности STAT3 является SHP-1. Что касается механизма действия, SHP-1 проявляет протеинфосфатазную активность, которая снижает уровень фосфо-STAT3 (P-STAT) и, как следствие, блокирует димеризацию P-STAT3. Вследствие этого значительно снижается экспрессия генов-мишеней, таких как циклин D1 и сурвивин, транскрибируемых STAT3. Кроме того, исследования белка SHP-1 и мРНК SHP-1 показали, что в большинстве клеток злокачественных новообразований уровень экспрессии SHP-1 был низким, и генетическое повышение уровня SHP-1 в клетках злокачественных новообразований приводило к подавлению роста клеток, что позволяет предположить, что ген SHP-1 действует как супрессор опухолей. С точки зрения поиска новых лекарственных средств, разработка синтетического лекарственного средства, которое может понижать уровень Р-STAT3 и повышать уровень SHP-1, представляет собой перспективное направление терапии злокачественных новообразований. Также SHP-1 играет важную роль в ремоделировании костной ткани, процессе формирования костной ткани с помощью остеобластов и резорбции костной ткани с помощью остеокластов. Утрата функции SHP-1 приводит к образованию остеокластов и в конечном итоге вызывает остеопороз. Таким образом, повышение активности SHP-1 может представлять собой предписание для пациента, страдающего остеопорозом. Кроме того, повышение SHP-1 оказывает положительное действие на макрофагов у пациентов, страдающих рассеянным склерозом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] Настоящее изобретение основано на неожиданном обнаружении того факта, что разработанные в настоящем изобретении соединения выступают в качестве агонистов SHP-1 и обладают способностью снижать P-STAT3, а также подходят для лечения некоторых заболеваний, таких как онкологические заболевания. При этом соединения согласно настоящему изобретению не блокируют активность киназ, таких как Raf-1 и VEGFR2.
[0005] В частности, в одном из аспектов настоящего изобретения предложено соединение формулы I
,
где R1, R2, и R3 независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил, -(C)mNHC(X)NH(C)nRa-, -(C)pNHC(X)Rb-, -(C)qNHS(O)2Rc, -(C)r(X)NHRd- или -(C)sNH(C)tRe,
где Ra, Rb, Rc, Rd и Re независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил;
X представляет собой О или S; а
m, n, p, q, r, s, t составляют 0, 1 или 2.
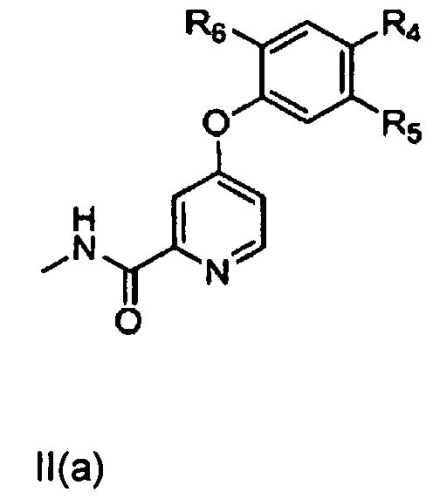
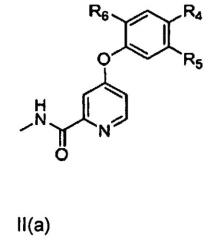
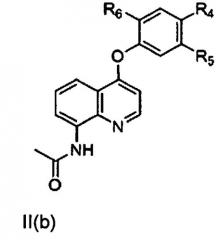
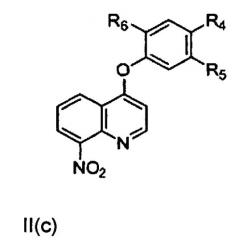
[0006] В другом аспекте настоящего изобретения предложено соединение формулы II, включая соединение формулы II(а), соединение формулы II(b) или соединение формулы II(с),
,
где R4, R5 и R6 независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил, -(C)mNHC(X)NH(C)nRa-, -(C)pNHC(X)Rb-, -(C)qNHS(O)2Rc, -(C)r(X)NHRd- или -(C)sNH(C)tRe;
где Ra, Rb, Rc, Rd и Re независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил;
X представляет собой О или S; а
m, n, p, q, r, s, t составляют 0, 1 или 2.
[0007] В еще одном аспекте настоящего изобретения предложено соединение формулы III
,
где R7 представляет собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил, -(C)mNHC(X)NH(C)nRa-, -(C)pNHC(X)Rb-, -(C)qNHS(O)2Rc, -(C)r(X)NHRd- или -(C)sNH(C)tRe;
где Ra, Rb, Rc, Rd и Re независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил;
X представляет собой О или S; а
m, n, p, q, r, s, t составляют 0,1 или 2.
[0008] В настоящем изобретении также предложена фармацевтическая композиция, содержащая одно или более вышеописанных соединений. Фармацевтическая композиция согласно настоящему изобретению может быть применена для повышения уровня экспрессии или биологической активности SHP-1 в клетке или лечения заболевания или патологического состояния, характеризующегося пониженным уровнем экспрессии или пониженной биологической активностью протеинтирозинфосфатазы-1, содержащей домен гомологии-2 Src, которое включает, но не ограничивается указанными, злокачественное новообразование (например, гепатоцеллюлярную карциному, лейкоз, рак легкого, рак молочной железы, рак почки, рак щитовидной железы, рак головы и рак шеи), склероз и остеопороз. Также в объем настоящего изобретения входит применение любого из вышеописанных соединений для повышения уровня экспрессии или биологической активности SHP-1 в клетке или лечения заболевания или патологического состояния, характеризующегося пониженным уровнем экспрессии или пониженной биологической активностью SHP-1, описанного в настоящей заявке, и для производства лекарственного средства для лечения указанного заболевания или патологического состояния.
[0009] Также в настоящем изобретении предложен способ повышения уровня экспрессии или биологической активности SHP-1 в клетке, включающий приведение указанной клетки в контакт с эффективным количеством соединения или фармацевтической композиции, описанной в настоящей заявке.
[0010] Также в настоящем изобретении предложен способ лечения заболевания или патологического состояния, характеризующегося пониженным уровнем экспрессии или пониженной биологической активностью SHP-1, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения или фармацевтической композиции, описанной в настоящей заявке.
[0011] Различные варианты реализации настоящего изобретения подробно описаны ниже. Другие особенности настоящего изобретения будут в явном виде представлены с помощью следующих подробных описаний и чертежей различных вариантов реализации и формулы изобретения.
[0012] Предполагается, что средний специалист в области техники, к которой принадлежит настоящее изобретение, может применять настоящее изобретение в самом полном объеме на основании описаний, приведенных в настоящей заявке, без необходимости в дополнительной иллюстрации. Таким образом, следует понимать, что следующие описания приведены с целью иллюстрации, а не ограничения объема настоящего изобретения каким бы то ни было образом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0013] С целью иллюстрации настоящего изобретения на чертежах представлены варианты реализации, которые в настоящее время являются предпочтительными. Однако следует понимать, что настоящее изобретение не ограничено представленными предпочтительными вариантами реализации.
[0014] На чертежах:
[0015] На Фиг. 1 представлена химическая структура сорафениба и соединения SC-1.
[0016] На Фиг. 2 представлена общая технология синтеза соединений формул I, II и III согласно настоящему изобретению.
[0017] На Фиг. 3 представлена активность Raf-1 в клетках, обработанных сорафенибом и соединением 1 соответственно. Клетки Huh-7 подвергали воздействию сорафениба или соединения 1 в концентрации 10 мкМ в течение 24 часов и клеточные лизаты подвергали анализу для определения активности raf-1. Столбики отражают среднее значение; планки погрешностей отражают SD (n=3). *Р<0,05.
[0018] На Фиг. 4 представлены результаты твердофазного ИФА, касающиеся ингибирующего воздействия соединений 1-25 на IL-6 стимулированный P-STAT в клетках PLC5 после 24 ч обработки по сравнению с сорафенибом, при этом концентрация каждого из соединений составляла 10 мкМ. Столбики отражают среднее значение, планки погрешностей отражают SD (N=3).
[0019] На Фиг. 5 представлены результаты вестерн-блоттинга, касающиеся воздействия соединений 1 и 12, каждое из которых находилось в концентрациях 5 мкМ и 10 мкМ, на фосфорилирование P-STAT3, STAT3, циклина D и сурвивина в клетках PLC5 в ФБС-содержащей среде после 24 ч обработки.
[0020] На Фиг. 6 представлены (А) результаты твердофазного ИФА, касающиеся гибели клеток, индуцированной соединениями 1 и 12 в концентрациях 5 и 10 мкМ, после 24 ч обработки клеток PLC5, и (В) результаты проточно-цитометрического анализа гибели клеток, индуцированной соединениями 1 и 12 в концентрациях 5 и 10 мкМ, после 24 ч обработки клеток PLC5.
[0021] На Фиг. 7 представлены (А) воздействие сорафениба и SC-1 на фосфо-VEGFR2 в клетках HUVEC, причем указанные клетки подвергали воздействию сорафениба или SC-1 в концентрации 10 мкМ в течение 24 ч; (В) влияние сорафениба и SC-1 на активность Raf-1, причем клетки подвергали воздействию сорафениба или SC-1 в концентрации 10 мкМ в течение 24 ч. Точки отражают среднее значение, планки погрешностей отражают SD (n=6).
[0022] На Фиг. 8 представлены влияние сорафениба и SC-1 на жизнеспособность клеток в четырех линиях клеток ГЦК при повышении дозы, причем клетки подвергали воздействию сорафениба или SC-1 в указанных дозах в течение 72 ч, и жизнеспособность клеток оценивали посредством МТТ-анализа (А); и влияние сорафениба и SC-1 на апоптоз в четырех линиях клеток ГЦК при повышении дозы, причем клетки подвергали воздействию сорафениба или SC-1 в указанных дозах в течение 24 ч, и клеточные лизаты анализировали посредством проточной цитометрии (В) или твердофазного ИФА гибели клеток (С). Точки отражают среднее значение, планки погрешностей отражают SD (n=6).
[0023] На Фиг. 9 представлены (А) воздействие сорафениба или SC-1 на STAT3-зависимые белки, причем клетки обрабатывали сорафенибом или SC-1 в концентрации 10 мкМ в течение 24 ч; (В) воздействие сорафениба или SC-1 на фосфо-STAT3 в клетках PLC5 при повышении дозы, причем клетки обрабатывали лекарственными средствами в указанных концентрациях в течение 24 ч; (С) влияние сорафениба и SC-1 на активность STAT3 (левая, твердофазный ИФА фосфо-STAT3; правая, люциферазный репортерный анализ STAT3), причем клетки обрабатывали сорафенибом или SC-1 в концентрации 10 мкМ в течение 24 ч, и измеряли фосфо-STAT3 методом твердофазного ИФА или активность люциферазы; (D) защитное воздействие STAT3 на апоптоз, индуцированный сорафенибом в клетках PLC5, причем клетки (дикого типа или с эктопической экспрессией STAT3) подвергали воздействию сорафениба или SC-1 в концентрации 10 мкМ в течение 24 ч, и апоптотические клетки анализировали посредством проточной цитометрии. Столбики отражают среднее значение, планки погрешностей отражают SD (n=3). *Р<0,05.
[0024] На Фиг. 10 показано, что ингибирование SHP-1 аннулирует воздействие сорафениба и SC-1 на фосфо-STAT3 и апоптоз. На Фиг. 10А слева представлено воздействие ванадата, представляющего собой неспецифический ингибитор фосфатаз. На Фиг. 10А справа представлено воздействие специфического ингибитора SHP-1. Столбики отражают среднее значение; планки погрешностей отражают SD (n=3). *Р<0,05. На Фиг. 10В слева показано, что выключение SHP-1 посредством миРНК снижает воздействие сорафениба или SC-1 на p-STAT3 в клетках ГЦК. Клетки PLC5 трансфицировали контрольной миРНК или миРНК SHP-1 в течение 24 ч, затем обрабатывали сорафенибом или SC-1 в течение еще 24 ч. На средней диаграмме представлена активность SHP-1 в клетках PLC5. Столбики отражают среднее значение; планки погрешностей отражают SD (n=3). *Р<0,05. На Фиг. 10В справа представлено влияние сорафениба или SC-1 на белковые взаимодействия между SHP-1 и STAT3. Клетки PLC5 обрабатывали сорафенибом или SC-1 в концентрации 10 мкМ в течение 24 часов. На Фиг. 10С показано, что нокдаун SHP-2 не оказывает влияния на воздействие сорафениба или SC-1 на p-STAT3 и апоптоз. На Фиг. 10D показано, что нокдаун РТР-1 В не оказывает влияния на воздействие сорафениба на p-STAT3 и апоптоз. Клетки PLC5 трансфицировали контрольной миРНК или миРНК SHP-2 или миРНК РТР-1В в течение 24 ч, затем обрабатывали сорафенибом или SC-1 в концентрации 10 мкМ в течение 24 ч.
[0025] На Фиг. 11 показано, что SC-1 обеспечивает даун-регуляцию p-STAT3 и индуцирует апоптоз в клетках HUVEC. На Фиг. 11А представлено воздействие сорафениба или SC-1 на p-STAT3 (слева) и апоптоз (справа) в клетках HUVEC. Клетки подвергали воздействию сорафениба или SC-1 в концентрации 10 мкМ в течение 24 ч. Апоптотические клетки анализировали посредством проточной цитометрии (sub-G1). На Фиг. 11В представлено влияние SC-1 на сенсибилизацию к TRAIL в ГЦК. Клетки PLC5 обрабатывали SC-1 (10 мкМ) и/или TRAIL (100 нг/мл) в течение 24 ч. На Фиг. 11С показано, что выключение Raf-1 не оказывает влияния на воздействие указанных лекарственных средств на p-STAT3. Клетки PLC5 трансфицировали контрольной миРНК или миРНК Raf-1 в течение 24 ч, затем обрабатывали сорафенибом или SC-1 в концентрации 10 мкМ в течение 24 ч. На Фиг. 11D представлено влияние сорафениба и SC-1 на активность JAK2. Клетки PLC5 подвергали воздействию сорафениба или SC-1 в концентрации 10 мкМ в течение 24 ч. Точки отражают среднее значение; планки погрешностей отражают SD (n=6). На Фиг. 11Е представлено воздействие сорафениба и SC-1 на SOCS-1 и SOCS-3. Клетки Sk-Hep1 предварительно обрабатывали IL-6 в течение 24 ч, затем обрабатывали сорафенибом или SC-1 в указанных дозах в течение еще 24 ч в присутствии IL-6. На Фиг. 11F представлено влияние STAT-C на апоптоз, индуцированный SC-1 в клетках PLC5. Клетки (дикого типа или с эктопической экспрессией STAT3-C) подвергали воздействию сорафениба или SC-1 в концентрации 10 мкМ в течение 24 ч. На Фиг. 11G представлено воздействие сорафениба и SC-1 на SHP-1. Столбики отражают среднее значение; планки погрешностей отражают SD (n=3). *Р<0,05.
[0026] На Фиг. 12 представлено in vivo воздействие сорафениба и SC-1 на «голых» мышей с ксенотрансплантатными клетками Huh-7. На Фиг. 12А показано, что сорафениб демонстрирует противоопухолевое воздействие на опухоли Huh-7. На графике слева точки отражают среднее значение (n=6); планки погрешностей отражают SE. *, P<0,05; **, P<0,01. На Фиг. 12A справа сверху представлен вестерн-блоттинг p-STAT3 и STAT3 в опухолях Huh-7. На Фиг. 12А справа снизу представлена активность SHP-1 в опухолях Huh-7. На Фиг. 12В показано, что SC-1 демонстрирует значительное противоопухолевое воздействие на опухоли Huh-7. На графике слева точки отражают среднее значение (n=6); планки погрешностей отражают SE. На Фиг. 12В справа сверху представлен вестерн-блоттинг p-STAT3 и STAT3 в опухолях Huh-7. На Фиг. 12В справа снизу представлена активность SHP-1 в опухолях Huh-7.
[0027] На Фиг. 13 представлен антипролиферативный эффект SC-1 и SC-43 в линиях клеток различных злокачественных новообразований, включая линии клеток рака молочной железы (A) MDAMB231, (В) MDAMB468 и (С) MCF-7 и линии клеток лейкоза (D) HL-60, (Е) KG-1 и (F) ML-1.
[0028] На Фиг. 14 показано, что производные сорафениба индуцируют значительный апоптоз в степени, зависящей от дозы, где (А), (В), (С), (D) и (Е) относятся к SC-43 в случае PLC5, HepG2, Hep3B, НА59Т и SK-Hep1 клеток соответственно; a (F), (G), (Н), (I) и (J) относятся к SC-40 в случае PLC5, HepG2, Hep3B, НА59Т и SK-Hep1 клеток соответственно. Точки отражают среднее значение; планки погрешностей отражают SD (n=6).
[0029] На Фиг. 15 показано, что SC-43 подвергает даун-регуляции фосфо-STAT3-зависимый сигнальный путь в клетках ГЦК, включая клетки PLC5, HepG2, Hep3B, НА59Т и SK-Hep1.
[0030] На Фиг. 16 показано, что SC-40 подвергает даун-регуляции фосфо-STAT3-зависимый сигнальный путь в клетках ГЦК, включая клетки PLC5, HepG2, Hep3B, НА59Т и SK-Hep1.
[0031] На Фиг. 17 показано, что SC-43 демонстрирует лучшее ингибирование p-STAT3-зависимого сигнального пути в клетках ГЦК, а именно (A) PLC5 и (В) Hep3B, чем сорафениб.
[0032] На Фиг. 18 показано, что как SC-43, так и SC-40 индуцируют сильное ингибирование активности p-STAT3, причем (А) и (В) относятся к твердофазному ИФА p-STAT3 для SC-43 и SC-40 соответственно, а (С) и (D) относятся к репортерному анализу STAT3 для SC-43 и SC-40 соответственно.
[0033] На Фиг. 19 показано, что SC производные, повышают фосфатазную активность SHP-1 in vitro, (A) SC-43, (В) SC-40 и (С) SC-49.
[0034] На Фиг. 20 показано, что SC производные, повышают фосфатазную активность SHP-1 in vitro, (A) SC-43 и (В) SC-40.
[0035] На Фиг. 21 представлены (А) противоопухолевое воздействие SC-40 на клетки опухолей PLC5; (В) вестерн-блоттинг p-STAT3 и STAT3 в клетках опухолей PLC5; (С) масса тела животных; (D) масса опухолей и (Е) активность SHP-1 в клетках опухолей PLC5. Точки отражают среднее значение (n=6); планки погрешностей отражают SE.
[0036] На Фиг. 22 показано, что SC-43 обнаруживает противоопухолевый эффект в условиях in vitro и in vivo, а именно представлены (А) цитотоксичность SC-43 в клетках ГЦК, (В) противоопухолевое воздействие SC-43 на мышей, являющихся носителями ГЦК, (С) активность SHP-1, индуцированная SC-43, и (D) вестерн-блоттинг p-STAT3 и STAT3 в клетках ГЦК, обработанных SC-43 (10 мкМ и 20 мкМ).
[0037] На Фиг. 23 представлены (А) изображение мышей, подвергнутых лечению, полученное посредством системы неинвазивной визуализации in vivo imaging system, (В) масса тела указанных мышей и (С) графики выживаемости мышей контрольной группы и мышей, подвергнутых лечению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0038] Если не указано иное, все технические и научные термины в настоящей заявке имеют значения, обычно подразумеваемые специалистом в области техники, к которой принадлежит настоящее изобретение. Все публикации, упомянутые в настоящей заявке, включены в настоящее описание посредством ссылок для раскрытия и описания способов и/или материалов, в связи с которыми цитируются указанные публикации.
[0039] В настоящей заявке формы единственного числа включают ссылки на формы множественного числа кроме случаев, когда из контекста явно следует иное. Таким образом, например, упоминание «образца» включает множество таких образцов и их эквивалентов, известных специалистам в данной области.
[0040] Сорафениб (BAY43-9006, Нексавар) клинически применяют для лечения почечно-клеточной карциномы и гепатоцеллюлярной карциномы (ГЦК). Указанное средство известно как мультикиназный ингибитор, который подавляет активность Raf-1 и других тирозинкиназ, таких как VEGFR2, VEGFR3, Flt-3, PDGFR и FGFR-1.
[0041] В настоящем изобретении авторы изучали взаимосвязь между структурой сорафениба и его биоактивностью и модифицировали структуру сорафениба. Исходя из этого, авторы настоящего изобретения разработали ряд производных сорафениба, не обладающих способностью блокировать активность киназы, и неожиданно обнаружили, что указанные соединения демонстрируют хороший терапевтический эффект при некоторых заболеваниях, таких как онкологические заболевания, по меньшей мере сравнимый с эффектом сорафениба. Согласно настоящему изобретению недавно разработанные соединения согласно настоящему изобретению действуют как агонисты SHP-1 и подходят для лечения заболевания или патологического состояния, характеризующегося пониженным уровнем экспрессии или пониженной биологической активностью SHP-1, такого как злокачественное новообразование (например, гепатоцеллюлярная карцинома, лейкоз, рак легкого, рак молочной железы, рак почки, рак щитовидной железы, рак головы и шеи), склероз и остеопороз. Соединения согласно настоящему изобретению также обеспечивают новый вариант терапии для пациентов с устойчивостью к ингибиторам киназы. Указанные опухоли вызывают мутацию киназы после лечения в конститутивно активную фосфорилированную форму даже в присутствии ингибитора киназы. Таким образом, повышающая регуляция супрессора опухолей, в частности SHP-1, для подавления активных мутантных форм киназ является перспективным направлением для пациентов, устойчивых к химиотерапии. Другими словами, соединения согласно настоящему изобретению, действующие по новому таргетному механизму (киназанезависимому), обеспечивают альтернативные варианты терапии, которые могут быть полезными в лечении онкологических заболеваний при наличии устойчивости к традиционной терапии.
[0042] В одном из аспектов настоящего изобретения предложено соединение формулы I
,
[0043]
где R1, R2, и R3 независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил, -(C)mNHC(X)NH(C)nRa-, -(C)pNHC(X)Rb-, -(C)qNHS(O)2Rc, -(C)r(X)NHRd- или -(C)sNH(C)tRe;
где Ra, Rb, Rc, Rd и Re независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил;
X представляет собой О или S; а
m, n, p, q, r, s, t составляют 0, 1 или 2.
[0044] В одном из вариантов реализации настоящего изобретения соединение формулы I включает те соединения, в которых R1, R2 и R3 независимо представляют собой водород, необязательно замещенный низший алкил, -(C)mNHC(X)NH(C)nRa-, -(C)pNHC(X)Rb-, -(C)qNHS(O)2Rc или -(C)sNH(C)tRe.
[0045] В другом варианте реализации настоящего изобретения соединение формулы I включает те соединения, в которых Ra, Rb, Rc, Rd и Re независимо представляют собой фенил или нафтил, необязательно замещенный 1-3 группами, выбранными из группы, состоящей из галогена, необязательно замещенного низшего алкила (такого как галогензамещенный низший алкил, например трифторметил), необязательно замещенного алкоксила (например, такого как галогензамещенный низший алкоксил, например трифторметил) и необязательно замещенного арилокси (например, цианозамещенного фенокси).
[0046] В некоторых примерах соединение формулы I представляет собой одно из соединений SC-1, SC-48, SC-49, SC-54, SC-55, SC-56, SC-58, SC-43, SC-44, SC-45, SC-50, SC-51, SC-52, SC-59, SC-60 и SC-40, перечисленных в таблице 1.
[0047]
[0048] В другом аспекте настоящего изобретения предложено соединение формулы II, включая соединение формулы II(а), соединение формулы II(b) или соединение формулы II(с)
,
[0049] где R4, R5 и R6 независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил, -(C)mNHC(X)NH(C)nRa-, -(C)pNHC(X)Rb-, -(C)qNHS(O)2Rc, -(C)r(X)NHRd- или -(C)sNH(C)tRe;
где Ra, Rb, Rc, Rd и Re независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил;
X представляет собой О или S; а
m, n, p, q, r, s, t составляют 0, 1 или 2.
[0050] В одном из вариантов реализации настоящего изобретения соединение формулы II включает те соединения, в которых R4, R5 и R6 независимо представляют собой водород, необязательно замещенный низший алкил, -(C)mNHC(X)NH(C)nRa-, -(C)pNHC(X)Rb-, -(C)qNHS(O)2Rc или -(C)sNH(C)tRe.
[0051] В другом варианте реализации настоящего изобретения соединение формулы II включает те соединения, в которых Ra, Rb, Rc, Rd и Re независимо представляют собой фенил или нафтил, необязательно замещенный 1-3 группами, выбранными из группы, состоящей из галогена, необязательно замещенного низшего алкила (такого как галогензамещенный низший алкил, например трифторметил), необязательно замещенного алкоксила (например, такого как галогензамещенный низший алкоксил, например трифторметил) и необязательно замещенного арилокси (например, цианозамещенного фенокси).
[0052] В некоторых примерах соединение формулы II представляет собой одно из соединений SC-31, SC-32, SC-33, SC-34 и SC-35, перечисленных в Таблице 2.
[053]
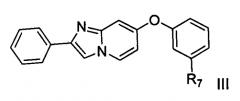
[0054] В другом аспекте настоящего изобретения предложено соединение формулы III
,
где R7 представляет собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил, -(C)mNHC(X)NH(C)nRa-, -(C)pNHC(X)Rb-, -(C)qNHS(O)2Rc, -(C)r(X)NHRd- или -(C)sNH(C)tRe;
где Ra, Rb, Rc, Rd и Re независимо представляют собой водород, галоген, гидроксил, необязательно замещенный алкоксил, необязательно замещенный тиоалкокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный циклоалкил, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, необязательно замещенный гетероаралкил;
X представляет собой О или S; и
m, n, p, q, r, s, t составляют 0, 1 или 2.
[0055] В одном из вариантов реализации настоящего изобретения соединение формулы III включает те соединения, в которых R7 независимо представляет собой водород, необязательно замещенный низший алкил, -(C)mNHC(X)NH(C)nRa-, (C)pNHC(X)Rb-, -(C)qNHS(O)2Rc или -(C)sNH(C)tRe.
[0056] В другом варианте реализации настоящего изобретения соединение формулы III включает те соединения, в которых Ra, Rb, Rc, Rd и Re независимо представляют собой фенил или нафтил, необязательно замещенный 1-3 группами, выбранными из группы, состоящей из галогена, необязательно замещенного низшего алкила (такого как галогензамещенный низший алкил, например трифторметил), необязательно замещенного алкоксила (например, такого как галогензамещенный низший алкоксил, например трифторметил) и необязательно замещенного арилокси (например, цианозамещенного фенокси).
[0057] В некоторых примерах соединение формулы III представляет собой одно из соединений SC-36, SC-37 и SC-38, перечисленных в Таблице 3.
[0058]
[0059] Термин «гало» или «галоген» отдельно или в комбинации означает любой из галогенов, такой как фтор (F), хлор (Cl), бром (Br) или йод (I).
[0060] Термин «гидроксил» означает группу -ОН.
[0061] Термины «тио» и «меркапто» используются взаимозаменяемо и означают группу -SH.
[0062] Термин «алкил» отдельно или в комбинации означает радикал, представляющий собой производное алкана, содержащий, если не указано иное, 1-20 атомов углерода (С1-С20), предпочтительно 1-15 атомов углерода (С1-С15), более предпочтительно 1-10 атомов углерода (C1-С10). Указанный радикал представляет собой алкильные группы с прямой цепью, разветвленные алкильные группы или циклоалкильные группы, предпочтительно неразветвленные или разветвленные алкильные группы, содержащие 1-15, более предпочтительно 1-8, еще более предпочтительно 1-6, еще более предпочтительно 1-4 и наиболее предпочтительно 1-2 атома углерода, такие как метил, этил, пропил, изопропил, бутил, трет-бутил и т.п. Термин «низший алкил» в настоящей заявке используется для описания алкильных групп с прямой цепью, описанных выше. Предпочтительно циклоалкильные группы представляют собой моноциклические, бициклические или трициклические кольцевые системы из 3-8, более предпочтительно 3-6, атомов в одном кольце, такие как циклопропил, циклопентил, циклогексил, адамантил и т.п. Алкил также включает алкильную группу с прямой цепью или разветвленную алкильную группу, которая содержит циклоалкильный фрагмент или прерывается им. Алкильную группу с прямой или разветвленной цепью присоединяют по любому доступному положению с получением стабильного соединения. Примеры указанных алкилов включают, но не ограничиваются указанными, 4-(изопропил)циклогексилен или 2-метилциклопропилпентил. Замещенный 1-3 группами или заместителями, представляющими собой галоген, гидроксил, алкокси, алкилтио, алкилсульфинил, алкилсульфонил, ацилокси, арилокси, гетероарилокси, амин, необязательно моно- или дизамещенный алкильными, арильными или гетероарильными группами, амидино, мочевину, необязательно замещенную алкильными, арильными, гетероарильными или гетероциклильными группами, аминосульфинил, необязательно N-моно- или N,N-дизамещенный алкильными, арильными или гетероарильными группами, алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, алкилкарбониламино, арилкарбониламино, гетероарилкарбониламино или иные подобные заместители.
[0063] Термин «алкенил» отдельно или в комбинации означает неразветвленный, разветвленный или циклический углеводород, содержащий 2-20, предпочтительно 2-17, более предпочтительно 2-10, еще более предпочтительно 2-8, наиболее предпочтительно 2-4 атома углерода, и по меньшей мере одну, предпочтительно 1-3, более предпочтительно 1-2, наиболее предпочтительно одну двойную связь углерод-углерод. В случае циклоалкенильной группы сопряжение более чем одной двойной связи углерод-углерод отличается от сопряжения, придающего кольцу ароматичность. Двойные связи углерод-углерод могут содержаться или в циклоалкильном фрагменте, за исключением циклопропила, или во фрагменте, представляющем собой прямую или разветвленную цепь. Примеры алкенильных групп включают этенил, пропенил, изопропенил, бутенил, циклогексенил, циклогексенилалкил и т.п. Замещенный алкенил представляет собой алкенильные группы с прямой цепью, разветвленные алкенильные группы или циклоалкенильные группы, определенные ранее, независимо замещенные 1-3 группами или заместителями, представляющими собой галоген, гидроксил, арилокси, алкилтио, алкилсульфинил, алкилсульфонил, независимо замещенный алкильными, арильными или гетероарильными группами, амидино, мочевину, необязательно замещенную алкильными, арильными, гетероарильными или гетероциклильными группами, аминосульфонил, необязательно N-моно- или N.N-дизамещенный алкильными, арильными или гетероарильными группами, алкилсульфониламино, алкилкарбониламино, арилкарбониламино, арилоксикарбонил, гетероарилоксикарбонил или иные подобные заместители, присоединенные по любому доступному положению с получением стабильного соединения.
[0064] Термин «алкинил» отдельно или в комбинации означает неразветвленный, разветвленный или циклический углеводород, содержащий 2-20, предпочтительно 2-17, более предпочтительно 2-10, еще более предпочтительно 2-8, наиболее предпочтительно 2-4 атома углерода, и по меньшей мере одну, предпочтительно 1-3, более предпочтительно 1-2, наиболее предпочтительно одну тройную связь углерод-углерод. Примеры алкинильных групп включают этинил, пропинил, изопропинил, бутинил и т.п. Замещенный алкинил представляет собой алкинильные группы с прямой цепью, разветвленные алкинильные группы, определенные ранее, независимо замещенные 1-3 группами или заместителями, представляющими собой галоген, гидроксил, арилокси, алкилтио, алкилсульфинил, алкилсульфонил, независимо замещенный алкильными, арильными или гетероарильными группами, амидино, мочевину, необязательно замещенную алкильными, арильными, гетероарильными или гетероциклильными группами, аминосульфонил, необязательно N-моно- или N,N-дизамещенный алкильными, арильными или гетероарильными группами, алкилсульфониламино, алкилкарбониламино, арилкарбониламино, арилоксикарбонил, гетероарилоксикарбонил или иные подобные заместители, присоединенные по любому доступному положению с получением стабильного соединения.
[0065] Термин «алкилалкенил» означает группу -R-CR′=CR″R′′′, где R представляет собой низший алкил или замещенный низший алкил, R′, R″, R′′′ независимо могут представлять собой водород, галоген, низший алкил, замещенный низший алкил, ацил, арил, замещенный арил, гетарил или замещенный гетарил, определенный ниже.
[0066] Термин «алкилалкинил» означает группу -R-CCR′, где R представляет собой низший а