Вакцинная композиция для борьбы с заражениями эктопаразитами
Иллюстрации
Показать всеНастоящие изобретения относятся к области ветеринарии и касаются иммуногенной композиции (варианты) и применения пептида рибосомального белка Р0 эктопаразитов. Охарактеризованная иммуногенная композиция содержит пептид рибосомального белка Р0 экстопаразитов, либо нуклеиновую кислоту, кодирующую такой полипептид. Этот пептид локализован между аминокислотами 267 и 301 белка P0, и может быть получен рекомбинантными способами или химическим синтезом. Этот пептид можно сливать с белком или пептидом-носителем, или с иммунным носителем и включать в масляный состав. Составы, содержащие пептид, обеспечивают защиту против клещей, например, вида Rhipicephalus microplus, Rhipicephalus sanguineus и Ixodes scapularis и эктопаразитов, известных как «морские вши», таких как Caligus и Lepeophtheirus. и могут быть использованы для борьбы с заражениями эктопаразитами или с переносом ассоциированных с ними патогенов. 3 н. и 9 з.п. ф-лы, 13 ил., 5 табл., 12 пр.
Реферат
Область изобретения
Настоящее изобретение относится к области ветеринарии, в частности к борьбе с заражениями эктопаразитами и с переносом ассоциированных с ними патогенов. Эту борьбу осуществляют посредством использования пептида рибосомального белка P0 в изготовлении вакцинных композиций. Вакцинные составы, содержащие пептид, обеспечивают защиту без вызова аутоиммунитета у организма-хозяина.
Уровень техники
Наземные кровососущие эктопаразиты, такие как комары, блохи и клещи, являются переносчиками для передачи инфекционных агентов, вызывающих заболевания. Некоторые из этих заболеваний непосредственно поражают людей и/или чувствительных к ним животных, в то время как другие являются причиной огромных экономических потерь в области сельского хозяйства. Примерами заболеваний, переносимых эктопаразитами, являются малярия, лейшманиоз, лихорадка Денге, эрлихиоз и Болезнь Лайма. Клещей считают вторым переносчиком заболеваний людям после комаров (P. Parola and D. Raoult, Clin. Microbiol. Infect. 2001, 7:80-83). Гемопаразитарные инфекции, переносимые клещами, являются причиной ежегодных потерь порядка миллиардов долларов США в промышленном животноводстве, в первую очередь поражая скотоводство в тропических и субтропических областях. Заболевания, наиболее важные в этом отношении, включают в себя анаплазмоз, бабезиоз, болезнь Лайма (вызванную Borrelia burdogferi) и так называемую восточно-береговую лихорадку (вызванную Theileria parva).
Эктопаразиты, известные как морские вши (Copepoda, Caligidae), являются наиболее широко распространенным морским патогеном в последние 30 лет в промышленном производстве лосося, в последние 15 лет распространяясь на другие виды искусственно выращенной рыбы и дикие стаи лососевых (Pike, A.W. and Wadsworth, S.L. Advances in Parasitology 2000, 44:233-337, Ragi, V. et al. Aquaculture 2004, 242:727-733). Экономические потери вызваны организмами родов Caligus и Lepeophtheirus. Эти так называемые морские вши могут вызывать физиологические изменения у их хозяев, включая развитие стрессового ответа, сниженную иммунную функцию, нарушение осмотической регуляции и гибель при отсутствии лечения инфекции (Johnson, S.C., et al. Zool Studies 2004, 43:8-19). Существуют также некоторые доказательства того, что морские вши могут являться переносчиками инфекций, вызванных у рыбы вирусами и бактериями (Barker, E.D., et al. Parasitology Research 2009, 105:1173-1177).
Широкое множество химических веществ и лекарственных средств использовали для борьбы с заражениями клещами и морскими вшами. Применение химических пестицидов, таких как амидины, органофосфаты, пероксид водорода и другие, в настоящее время составляет основную меру для контроля этих эктопаразитов. Однако интенсивное использование этих химических веществ обладает такими недостатками, как контаминация пищи (рыбы, мяса и молока), загрязнение окружающей среды и развитие устойчивости у эктопаразитов (Y.E. Shahein Vet. Immunol. And Immunopathol. 2008, 121:281-289, Denholm, I. Pest Manag Sci 2002, 58:528-536, Bravo, S. et al. Aquaculture 2008, 282:7-12, Lees et al. J. Fish Dis. 2008, 31:947-951).
Вакцинацию рассматривают как многообещающую альтернативу для борьбы с заражениями эктопаразитами с точки зрения эффективности, безопасности для окружающей среды и экономической приемлемости. Осуществимость использования антигенов, полученных способами рекомбинантной ДНК, для этой цели, показано с помощью коммерческих вакцин на основе Bm86 против клеща Rhipicephalus microplus (TickGARD, Hoechst Animal Health, Australia, и Gavac, продаваемый Heber Biotec, Cuba). Для последнего доказана эффективность в полевых исследованиях, где применение включено в программу комплексного контроля. В случае морских вшей существуют некоторые преимущества в использовании белков в качестве кандидатов для вакцины, как в случае акирина-2 Caligus rogercresseyi, который называют my32. Исследования заражения с помощью my32 проводили с многообещающими результатами (Патентная заявка WO 2008/145074 «Sequences of nucleic acids and amino acids, and vaccine for the control of infestations by ectoparasites in fish»).
Идентификация новых защитных антигенов является ограничивающей стадией в увеличении эффективности этих вакцин. Хотя недавно идентифицированы перспективные белки клещей и предложены в качестве потенциальных защитных молекул, только ограниченное их количество оценивали в исследованиях вакцин в качестве антигенов, полученных способами рекомбинантной ДНК. В случае морских вшей, которые являются эктопаразитами, которые питаются слизью, кожей и кровью хозяина, и, таким образом, имеют только ограниченный контакт с иммунной системой хозяина (Boxaspen, K. ICES Journal of Marine Science 2006, 63:1304-1316), в качестве кандидатов для вакцины исследовали иммуномодулирующие белки паразитов, супрессирующие иммунный ответ хозяина в участках прикрепления и питания (Wikel, S.K. et al. «Arthropod modulation of host immune responses». In: The Immunology of Host-Ectoparasiticide Arthropod Relationships. Editors: Wikel, S.K., CAB Int, 1996, pp.107-130). Исследовали также другие подобные вителлогенину молекулы и белки для прикрепления к хозяину (Johnson, S.C. et al. Zool Studies 2004, 43:8-19; Boxaspen, K. ICES Journal of Marine Science 2006, 63:1304-1316), но из-за плохого знания механизмов и патологии заражения лосося морскими вшами идентификация мишеней для предотвращения и лечения этой инфекции не являлась успешной. Однако результаты исследований для оценки различных кандидатов для вакцин при исследованиях иммунизации показали, что комбинированное использование нескольких молекул, вовлеченных в различные физиологические процессы, является целесообразным способом борьбы с заражениями эктопаразитами.
Эукариотические рибосомы составлены из отдельных молекул рибосомальной РНК (рРНК) и более чем 80 белков, организованных в большую и малую субъединицы. Большинство рибосомальных белков являются основными (изоэлектическая точка (pI)>8,5), но существует также группа кислых белков (pI=3,0-5,0), которые формируют стеблеподобную структуру в большой субъединице рибосомы. Эти кислые белки называют P-белками (P0, P1 и P2) из-за их способности становиться фосфорилированными, что играет фундаментальную роль в регуляции трансляционной активности рибосом (Wojda I. et al. Acta biochar. Pol. 2002, 49:947-957). P-белки содержат консервативную C-концевую область приблизительно из 17 аминокислот, последние шесть остатков которой являются высококонсервативными, что составляет основу способности к перекрестной иммунологической реакции между ними и P-белками из других видов. Белок P0 является необходимым для сборки субъединицы рибосомы 60S. P0 связывается непосредственно с P1, P2, 28S рРНК и фактором eEF2. Его отсутствие приводит к образованию дефицитных рибосом из субъединицы 60S, которые являются неактивными по синтезу белка, что приводит к гибели клеток.
P-белки являются высокоиммуногенными, и их интенсивно исследовали у человека из-за их ассоциации с аутоиммунными заболеваниями и канцерогенезом. Эти применения рибосомальных белков защищены патентами соответствующих авторов. Рибосомальный белок P0, в частности, является многообещающим кандидатом для вакцины против нескольких простейших и бактерий. Он являлся иммуногенным в форме рекомбинантного антигена (с использованием либо целого белка, либо C-концевой области, состоящей из последних 11-16 аминокислот) или при иммунизации голой ДНК против Toxoplasma gondii, Neospora caninum (H. Zhang et al. Mol. Biochem. Parasitol 2007, 153:141-148), Trypanosoma cruzi (Skeiky Y.A. et al. J. Immunol. 1993, 151:5504-5515), Leishmania infantum (S. Iborra et al., Infect. Immunol. 2003, 71:6562-6572 и 2005, 72:5515-5521) и нескольких видов Babesia (Terkawi M.A. et al., Vaccine 2007, 25:2027-2035; Terkawi M.A. et al. Parasitol. Res 2007, 102:35-40) и Plasmodium (S. Chatterjee et al. Infect. Immunol. 2000, 68:4312-4318; Rajeshwari K. et al. Infect. Immunol. 2004, 72:5515-5521). Иммунный ответ, полученный в большинстве из этих экспериментов, характеризовался получением высоких титров специфических антител, способных обеспечивать активную и пассивную защиту против инфекции, активацию T-лимфоцитов и продукцию гамма-интерферона (IFNγ) как часть профиля Th1-ответа.
Его использование в качестве иммуногена против различных бактерий и простейших, без регистрации аутоиммунных реакций у хозяина было обусловлено относительно низкой идентичностью аминокислотных последовательностей этого белка между этими микроорганизмами и млекопитающими. Наиболее поразительным случаем являлась иммунизация мышей пептидом, состоящим из последних 16 аминокислот рибосомального белка P0 Plasmodium falciparum (Rajeshwari K. et al., Infect. Immunol. 2004, 72:5515-5521), который обладает 68% идентичностью с C-концом такого же белка у мышей. Однако использование этого целого белка или его C-концевой области в качестве иммуногенов для борьбы с заражениями клещами и морскими вшами является ограниченным из-за высокой степени идентичности аминокислот, существующей для этого антигена среди эктопаразитов и их организмов-хозяев.
Недавние эксперименты с выключением экспрессии этого белка с помощью специфической РНК-интерференции у клещей Haemaphysalis longicornis показали значительное уменьшение набора массы клещами и смертность 96%, вызванную неестественностью на структурном уровне слюнной железы и кутикулы, что позволяет предполагать, что рибосомальный белок P0 является необходимым для всасывания крови и жизнеспособности клещей и, возможно, других эктопаразитов (Gong H. et al. Vet. Parasitol. 2008, 151:268-278). Однако разработка кандидатов для вакцин на основе этого антигена обладает в качестве недостатков высокой степенью идентичности между опубликованными последовательностями для хозяев-позвоночных и их эктопаразитов, таких как клещи и морские вши, которая выше на C-конце белка. Это может приводить к индукции устойчивости или к образованию аутоантител у организма-хозяина.
Интенсивное использование химических веществ и лекарственных средств для борьбы с заражениями клещами и морскими вшами обладает такими недостатками, как контаминация пищи остатками химических веществ, загрязнение окружающей среды и развитие устойчивости у эктопаразитов. Таким образом, вакцинацию рассматривают как многообещающую альтернативу, и существует необходимость идентификации новых антигенов для вакцин, которые являются способными обеспечивать защиту сами по себе или которые можно включать в существующие вакцины.
Краткое изложение сущности изобретения
Настоящее изобретение решает вышеуказанную проблему посредством предоставления вакцинной композиции для борьбы с заражениями эктопаразитами, содержащей пептид рибосомального белка P0 этих эктопаразитов. Эта композиция содержит в качестве антигена иммуногенную область рибосомального белка P0, которая является малоконсервативной среди эктопаразитов и пораженных ими организмов, согласно результатам исследования, впервые описанного в этом изобретении. Область, идентифицированная в рибосомальном белке P0, представляет собой его аминокислоты между 267 и 301.
Присутствие P0 во всех организмах в качестве структурного компонента рибосом и необходимость для жизнеспособности клеток является преимуществом для использования этих последовательностей с целью получения кандидатов для вакцин против различных видов эктопаразитов. Однако использование этого белка или его C-концевой области в качестве иммуногена для борьбы с заражениями клещами и морскими вшами ограничено высокой степенью идентичности аминокислот, существующей для этого антигена среди эктопаразитов и их организмов-хозяев.
Этой ситуации впервые избегают в этом изобретении, посредством идентификации высокоиммуногенных областей в белке, совпадающих с областями низкого сходства последовательности между этими группами организмов. Посредством биоинформатических предсказаний обнаружено, что эти области совпадают с областями низкой гидрофобности и высокой степени доступности белка, что, вероятно, приводит к экспонированию этих аминокислотных последовательностей.
Комплементарные ДНК (кДНК) получали обратной транскрипцией, начиная с тотальной РНК личинок Rhipicephalus microplus и R. sanguineus и взрослых морских вшей вида Caligus rogercresseyi. Нуклеотидные последовательности, кодирующие рибосомальный белок P0 этих клещей (SEQ ID NO:1 и SEQ NO:2) и этих морских вшей, амплифицировали посредством полимеразной цепной реакции (ПЦР) с использованием этих кДНК и специфических олигонуклеотидов.
Полипептидные последовательности белка P0 эктопаразитов R. microplus и R. sanguineus являлись идентичными и были обозначены как SEQ ID NO:3. Для этой последовательности и последовательности P0 C. rogercresseyi показана идентичность последовательности более 70% с белками P0 их организмов-хозяев, все еще более высокая для последних C-концевых 16 аминокислот, описанных как наиболее иммуногенные в белке. Область меньшего сходства в аминокислотной последовательности, которая, в свою очередь, вероятно, является экспонированной и является иммуногенной, во всех случаях детектирована в области между аминокислотами 267 и 301 (SEQ ID NO:4, пептид, соответствующий белку P0 Rhipicephalus microplus [pP0] SEQ ID NO:6, пептид, соответствующий белку P0 Ixodes scapularis [pP0Is] SEQ ID NO:8, пептид, соответствующий белку P0 Caligus clemensi [pP0Cc], SEQ ID NO:9, пептид, соответствующий белку P0 L. salmonis [pP0Ls] и SEQ ID NO:10, пептид, соответствующий белку P0 C. rogercresseyi [pP0Cr]).
Таким образом, в одном варианте осуществления изобретения вакцинная композиция содержит пептид c аминокислотной последовательностью, идентифицированной как SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:9 или SEQ ID NO:10, фрагмент этих последовательностей, или пептид или полипептид, обладающий по меньшей мере 70% идентичностью с такими последовательностями. Настоящее изобретение относится также к таким вакцинным композициям, где указанный пептид P0 сливают, комбинируют или вводят совместно с другой молекулой для увеличения их иммуногенности или усиления их защитного эффекта. Такие молекулы представляют собой белки-носители и иммунные носители. В одном варианте осуществления изобретения эта молекула выбрана из группы, состоящей из гемоцианина, T-клеточных эпитопов, белков, формирующих вирусоподобные частицы, белка Bm86 из клеща R. microplus, белка Rs86 из клеща R. sanguineus и белка my32 морских вшей C. rogercresseyi или L. salmonis.
Пептиды, идентифицированные как SEQ ID NO:4, 6, 9 и 10, между 35 и 36 аминокислотами, и их фрагменты по 20 аминокислот получали химическим синтезом и конъюгировали с гемоцианином (английский: Keyhole Limpet Hemocyanin, сокращенно KLH) из Megathura crenulata для усиления иммуногенности. Эксперименты по иммунизации с заражением в контролируемых условиях проводили с этими конъюгатами для оценки их защитных способностей. Пептид P0 (pP0-SEQ ID NO:4) тестировали против R. sanguineus и R. microplus на кроликах и крупном рогатом скоте соответственно. pP0Is (SEQ ID NO:6) оценивали против I. scapularis у кроликов.
Со своей стороны, пептиды pP0Ls и pP0Cr (SEQ ID NO:9 и SEQ ID NO:10 соответственно) оценивали против L. salmonis и C. rogercresseyi соответственно, оба на Salmo salar.
Иммунизация кроликов и крупного рогатого скота вакцинным составом, содержащим конъюгат белка (pP0-KLH) и адъювант Монтанид 888, являлась способной индуцировать сильный специфический гуморальный иммунный ответ против пептида в обоих случаях. Не существовало доказательств возникновения специфического аутоиммунного ответа у использованных экспериментальных животных, запущенного посредством распознавания и реакционной способности белка P0 этих млекопитающих для антител, образованных против пептида pP0. Это подтверждено посредством теста «in vitro» перекрестной реакционной способности на лини клеток RK-13 почки кролика, с использованием гипериммунной сыворотки против пептида, полученной в мышах. Вакцинации конъюгатом pP0-KLH индуцировали защиту против заражений R. sanguineus и R. microplus, вызывая структурные повреждения и нарушая биологические параметры у обоих видов клещей. Кроме того, сходные результаты получены против клещей I. scapularis после иммунизации синтетическим пептидом из белка P0 этого клеща (pP0Is), конъюгированным с гемоцианином.
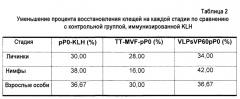
Вакцинация лосося конъюгатами pP0Ls-KLH и pP0Cr-KLH индуцировала защиту против заражений обоими видами морских вшей, как доказано по значительному уменьшению количества паразитов на рыбу. Эксперименты по иммунизации проводили также с pP0 и pP0Cr, полученными рекомбинантными способами, слитыми с T-эпитопами токсина столбняка и белка слияния вируса кори (английский: Measles Virus Fusion protein, сокращенно MVF) в одной и той же генетической конструкции. В результате экспериментов по иммунизации этими химерными антигенами, в случае морских вшей, авторы настоящего изобретения обнаружили, что слияние со случайными T-эпитопами значительно улучшает защиту по сравнению с антигеном, конъюгированным с KLH.
pP0 сливали также с вирусоподобными частицами (VLP) вируса геморрагической болезни кроликов (RHDV) и дополнительно обнаружили, что когда пептид P0 сливают с антигеном Bm86, защитный эффект пептида усиливается. Это может быть обусловлено комбинированным эффектом антител, образованных против обоих иммуногенов, и/или тем фактом, что структурное повреждение, вызванное антителами, направленными против антигена Bm86, в кишечнике клещей, способствует действию специфических антител против пептида рибосомального белка P0. С другой стороны, pP0Cr сливали с белком my32 в другой генетической конструкции, и в этом случае получены наиболее значительные эффекты на повреждение C. rogercresseyi, предположительно, посредством усиления индивидуальных специфических эффектов двух антигенов.
Таким образом, по изобретению показано, что вакцинные композиции на основе пептида pP0 являются эффективными для борьбы с заражениями эктопаразитами, такими как клещи и морские вши. Таким образом, композиции на основе pP0 также являются пригодными для контроля переноса патогенов, ассоциированных с этими эктопаразитами.
Эта вакцина содержит иммунологически эффективное количество антигена в фармацевтически приемлемом адъюванте, которое предназначено для контроля этих патогенов. Как указано, антиген в этой вакцине представляет собой пептид рибосомального белка P0 этих эктопаразитов, между 267 и 301 аминокислотами, который соответствует области наименьшего сходства аминокислотной последовательности белка эктопаразита с такой же областью белка в их соответствующих организмах-хозяевах. Этот пептид получают рекомбинантными способами или химическим синтезом. Слитые полипептиды, содержащие пептид P0, также можно получать рекомбинантными способами. Как известно специалистам в этой области технологии, для получения таких антигенов рекомбинантными способами можно использовать систему экспрессии в дрожжах, бактериях, растениях, личинках насекомых, клетках насекомых или клетках млекопитающих.
В одном варианте осуществления изобретения вакцинные композиции могут дополнительно содержать вакцинный адъювант. В контексте изобретения оценивали вакцинные составы, содержащие только масляный тип адъюванта. Однако в качестве адъювантов можно использовать, среди прочего, соли алюминия, липосомные везикулы, связанные с иммунной системой молекулы, такие как цитокины.
Композиции по изобретению можно вводить многими различными способами. В одном варианте осуществления изобретения композицию вводят посредством инъекции. В другом варианте осуществления составы вводят с пищей. В случае когда композиции вводят рыбе, их можно наносить с использованием ванн для погружения.
Другой целью настоящего изобретения является вакцинная композиция для борьбы с заражениями эктопаразитами, содержащая нуклеиновые кислоты, кодирующие пептид рибосомального белка P0 этих эктопаразитов, соответствующие области между 267 и 301 аминокислотами белка, и вызывающая иммунный ответ против пептида посредством иммунизации голой ДНК. В одном варианте осуществления изобретения этот пептид обладает аминокислотной последовательностью, идентифицированной как SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:9 или SEQ ID NO:10, или представляет собой фрагмент этих последовательностей, или пептид или полипептид, обладающий по меньшей мере 70% идентичностью с такими последовательностями.
Изобретение также относится к использованию области между 267 и 301 аминокислотами рибосомального белка P0 эктопаразитов для изготовления вакцинной композиции для борьбы с заражениями этими паразитами или ассоциированными с ними патогенами. В одном варианте осуществления указанный пептид обладает аминокислотной последовательностью, идентифицированной как SEQ ID NO:4, 10 SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:9 или SEQ ID NO:10, или он представляет собой фрагмент этих последовательностей, или пептид или полипептид, обладающий по меньшей мере 70% идентичностью с такими последовательностями.
Преимущества предложенного решения
Настоящее изобретение показывает защитную способность вакцинного состава, который содержит пептид между аминокислотами 267 и 301 рибосомального белка P0 различных эктопаразитов, против клещей, таких как R. microplus, R. sanguineus и I. scapularis, и эктопаразитов, известных как морские вши L. salmonis и C. rogercresseyi, без возникновения перекрестной реакции с таким же белком в организмах-хозяевах. При всех иммунизациях pP0 вводили конъюгированным или слитым с молекулой иммунного носителя для усиления иммунного ответа животных. В случае клещей, введение этого пептида (или его фрагментов), слитых с белком Bm86 или комбинированных с ним, индуцирует большее нарушение жизнеспособности и биологических параметров этих членистоногих, чем повреждения, вызванные антигенами при отдельном использовании. Таким образом, использование этих химерных белков или их комбинации в качестве части программы комплексного контроля может приводить к большему контролю заражений этими или другими видами клещей так же, как уменьшать заболеваемость переносимыми клещами гемопаразитарными заболеваниями. В случае морских вшей, наибольшие повреждения наблюдали, когда pP0Cr сливали со случайными T-эпитопами и белком my32. Высокая степень консервативности аминокислотной последовательности пептида среди большинства видов членистоногих и морских вшей и низкая идентичность этой последовательности с соответствующим фрагментом белка у млекопитающих и рыб делают этот пептид рибосомального белка P0 (или его фрагменты) антигеном для разработки вакцин против эктопаразитов.
Краткое описание фигур
Фигура 1. Предсказание степени доступности аминокислотных остатков в рибосомальном белке P0 R. microplus и R. sanguineus. Область, соответствующая последовательности, обозначенной как SEQ ID NO:4, отмечена кругом.
Фигура 2. Ответ специфических антител IgG против пептида P0, детектированный посредством ELISA в сыворотке мышей BALB/с, иммунизированных конъюгатом pP0-KLH. Данные выражены как обратная величина среднего титра антител, определенного как последнее разведение сыворотки со средней оптической плотностью (OD), более чем в три раза превышающей среднюю OD отрицательной сыворотки. Стандартные отклонения представлены планками погрешностей в положительном направлении. Не детектировали титров антител у каких-либо животных на сутки ноль.
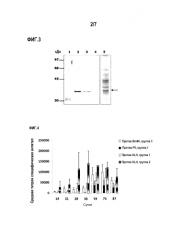
Фигура 3. Профиль экспрессии рибосомального белка P0 клещей Rhipicephalus в линии клеток кролика RK-13, анализированный Вестерн-блоттингом с поликлональным антителом, образованным у мышей против P0. 1. Стандарт молекулярной массы, 2. Лизат клеток RK-13, трансфицированных плазмидой pAdTrack-P0Rs, в восстанавливающих условиях, 3. Лизат клеток RK-13, трансфицированных плазмидой pAdTrack-P0Rs, в невосстанавливающих условиях, 4. Лизат клеток RK-13, не трансфицированных, в восстанавливающих условиях, 5. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) в восстанавливающих условиях лизата клеток RK-13, трансфицированных плазмидой pAdTrack-P0Rs.
Фигура 4. Ответы антител IgG против KLH, против пептида P0 и против Bm86, детектированные посредством ELISA в сыворотке кроликов, иммунизированных этими антигенами (пример 6). Данные выражены как обратная величина среднего титра антител, определенного как последнее разведение сыворотки со средней OD, более чем в три раза превышающей среднюю OD групп отрицательного контроля, соответствующих случаю. Стандартные отклонения представлены планками погрешностей в положительном направлении. Не детектировали титров специфических антител против антигенов у каких-либо животных на сутки ноль исследования.
Фигура 5. Восстановление личинок, нимф и взрослых особей R. sanguineus у кроликов, иммунизированных в примере 6. Данные выражены как средние проценты личинок, нимф и взрослых особей, восстановленных в различных экспериментальных группах. Стандартные отклонения в группах представлены планками погрешностей в положительном направлении. Различные буквы представляют статистически значимые различия между экспериментальными группами (ANOVA и тест Бонферрони для множественных сравнений [P<0,01]. Для анализа данные отношений предварительно преобразовывали до арксинуса их квадратного корня).
Фигура 6. Недавно прошедшие линьку нимфы R. sanguineus из личинок, питавшихся на различных экспериментальных группах из примера 6. (A) Группа отрицательного контроля; (B) Иммунизированные Bm86; (C) Иммунизированные конъюгатом pP0-KLH; и (D) Появление мертвых нимф, после линьки из личинок, питавшихся на кроликах, иммунизированных pP0-KLH.
Фигура 7. Процент вылупления из яиц R sanguineus от напитавшихся самок, питавшихся на кроликах, иммунизированных в примере 6. Данные выражены как среднее для группы. Стандартные отклонения для каждой группы представлены планками погрешностей в положительном направлении. Значимые различия указаны звездочкой (ANOVA и тест Бонферрони для множественных сравнений (p<0,05)).
Фигура 8. Ответ антител IgG против пептида P0 (A) и выживаемость личинок, нимф и взрослых особей R. sanguineus (B) для кроликов, иммунизированных вариантами этого пептида, слитыми с различными молекулами иммунного носителя. Стандартные отклонения представлены планками погрешностей в положительном направлении.
Фигура 9. Профиль экспрессии химерного белка Bm86-pP0 в преципитате разрушенных клеток штамма MP36 P. pastoris, анализированный Вестерн-блоттингом с использованием гипериммунных сывороток, полученных против пептида pP0 (A) и против белка Bm86 (B). В обоих случаях дорожка 1. Преципитат разрушенных клеток в восстанавливающих условиях, 2. Преципитат разрушенных клеток в невосстанавливающих условиях, 3. Дегликозилированный белок после расщепления ферментом ПНГазой F.
Фигура 10. Ответ антител IgG против пептида P0 и против Bm86, детектированный посредством ELISA в сыворотке крупного рогатого скота, иммунизированного этими антигенами по отдельности, в комбинации или с химерным белком Bm86-pP0. Данные выражены как обратная величина среднего титра антител, определенного как последнее разведение сыворотки со средней OD, более чем в три раза превышающей среднюю OD группы отрицательного контроля. Стандартные отклонения представлены планками погрешностей в положительном направлении. Не детектировали титров антител в каких-либо группах на начало эксперимента.
Фигура 11. Средняя масса яиц и напитавшихся самок R. microplus, питавшихся на крупном рогатом скоте, иммунизированном в примере 8. Статистически значимые различия между экспериментальными группами и для каждой группы по сравнению с отрицательным контролем представлены различными буквами (ANOVA и тест Ньюмена-Кеулса для множественных сравнений [p<0,05]).
Фигура 12. Ответ антител IgG против pP0Is, детектированный посредством ELISA в сыворотке кроликов, иммунизированных этим антигеном и затем зараженных I. scapularis. Данные выражены как обратная величина среднего титра антител, определенного как последнее разведение сыворотки со средней OD, более чем в три раза превышающей среднюю OD группы отрицательного контроля. Стандартные отклонения представлены планками погрешностей в положительном направлении. Не детектировали титров антител в какой-либо группе на сутки ноль исследования.
Фигура 13. Показатели биологических параметров I. scapularis у кроликов, иммунизированных конъюгатом pP0Is-KLH. Представлены жизнеспособность личинок и восстановление нимф и взрослых особей (A) и процент вылупления из яиц (B). Данные выражены как среднее для группы. Стандартные отклонения представлены планками погрешностей в положительном направлении. Статистически значимые различия по сравнению с группой отрицательного контроля представлены звездочками (ANOVA и тест Бонферрони для множественных сравнений [p<0,05]).
Подробное описание вариантов осуществления
ПРИМЕРЫ
Пример 1
Амплификация и клонирование нуклеотидных последовательностей, кодирующих рибосомальный белок P0 R. microplus, R. sanguineus и C. rogercresseyi.
Комплементарные ДНК (кДНК) получали реакцией обратной транскрипции с тотальной РНК личинок R. microplus и R. sanguineus и взрослых особей C. rogercressey. Реакции проводили, следуя инструкциям из набора «Reverse Transcription System» (Promega, USA # A3500). Нуклеотидные последовательности, кодирующие рибосомальный белок P0 R. microplus и R. sanguineus (SEQ ID NO:1 и SEQ ID NO:2) и последовательность P0 C. rogercresseyi амплифицировали полимеразной цепной реакцией (ПЦР) с полученных кДНК. В качестве праймеров для ПЦР для клещей использовали синтетические олигонуклеотиды, сконструированные из нуклеотидной последовательности, опубликованной в Genebank для белка P0 Haemaphysalis longicornis (http://www.ncbi.nlm.nih.gov/Genbank/) под номером доступа EU048401:
Прямой олигонуклеотид: 5 'ATGGTCAGGGAGGACAAGACCACCTGG 3'
Обратный олигонуклеотид: 5 'CTAGTCGAAGAGTCCGAAGCCCATGTCG 3'
В качестве праймеров для амплификации с кДНК C. rogercresseyi использовали вырожденные синтетические олигонуклеотиды, сконструированные из нуклеотидных последовательностей, опубликованных в Genebank для белка P0 различных видов клещей (Haemaphysalis longicornis и Ixodes scapularis) и насекомых (Drosophila melanogaster, Culex quinquefasciatus и Aedes aegypti):
Прямые олигонуклеотиды:
F1 5' ATGGGCAAGAACAC(C/G)ATGAT(C/G)ACMC(G/A)GC 3'
F2 5' ATGG(T/G)(T/C)AGGGAG(G/A)ACAA(G/A)(A/G)С(С/A/T)(G/A)C (G/G)TGGAA 3'
Обратный олигонуклеотид: R1 5' ТС(G/A)AA(A/С/G)AG(G/A/T)С (С/T)GAA(T/G/A)CCCAT(A/G)TC(А/G)ТС 3'
В результате реакций с комплементарной ДНК из клещей в обоих случаях получили полосу ДНК приблизительно 957 п.о., которую клонировали в коммерческий вектор pGEM-Teasy (Promega, USA) для секвенирования. В случае реакции ПЦР с комплементарной ДНК C. rogercresseyi, авторы настоящего изобретения получили полосу ДНК приблизительно 780 п.о. для комбинации праймеров F1-R1 и полосу приблизительно 960 п.о. для комбинации олигонуклеотидов F2-R1. В обоих случаях полосы клонировали в коммерческий вектор pGEM-Teasy (Promega, USA) для секвенирования.
Пример 2
Биоинформатический анализ
Анализ идентичности аминокислотных последовательностей проводили с использованием программ BlastX и ClustalW (http://www.ebi.ac.uk/). Последовательности из 318 аминокислот, выведенные из последовательностей ДНК, амплифицированных с кДНК, являлись идентичными между собой (SEQ ID NO:3) и обладали 95% и 93% идентичностью при сравнении с последовательностями рибосомального белка P0 Haemaphysalis longicornis и Ixodes scapularis (Genebank, номер доступа DQ066213) соответственно. Эта последовательность также обладала 96% идентичностью с полипептидной последовательностью, выведенной из частичной рамки считывания, включенной в TC533 из базы данных Amblyoma variegatum, и 99% идентичностью с полипептидными последовательностями, выведенными из двух открытых рамок считывания, содержащихся в TC1424 и TC9038, базы данных EST из R. appendiculatus и R. microplus соответственно (http://compbio.dfci.harvard.edu/index.html).
Для полипептидной последовательности, соответствующей белку P0 R. sanguineus и R. microplus, обозначенной как SEQ ID NO:3, также показана 70% идентичность последовательности с бычьим P0 (Bos taurus, номер доступа в Genebank AAX09097), составляющую 87% для последних 16 аминокислот C-концевой области, описанной как наиболее иммуногенная в белке. Для этой последовательности показана также 71% идентичность последовательности с P0 собаки (Canis familiaris, номер доступа в Genebank XM535894).
В случае аминокислотной последовательности P0, выведенной из последовательности кДНК С. rogercresseyi, авторы настоящего изобретения наблюдали высокий процент идентичности с опубликованными последовательностями для других видов морских вшей, таких как C. clemensi и L. salmonis. Как и в случае клещей и их хозяев, существовала высокая идентичность последовательности P0 морских вшей по отношению к P0 Salmo salar (номер доступа в Genebank ACI70184).
Высокая идентичность последовательности P0 этих эктопаразитов по отношению к P0 хозяев делает очень рискованным использование этих молекул в качестве вакцинного антигена для контроля их заражений, из-за возможности вызвать аутоиммунитет против белка хозяина. Этот риск увеличен для использования C-концевой области (последние 11-16 аминокислот), которая является высококонсервативной среди всех организмов.
Область белка P0 обоих видов клещей, обладающая меньшим сходством последовательности с белками P0 млекопитающих, находится между аминокислотами 267 и 301 (SEQ ID NO:4). С использованием биоинформатических инструментов на сайтах, включая http://www.ca.expasv.orq/sprot/, обнаружили, что эта область белка совпадает с областью низкой гидрофобности, что дает высокие шансы экспонирования в белке (фиг.1). Затем авторы настоящего изобретения оценивали иммуногенность этого пептида и его применимость в качестве вакцинного антигена для борьбы с заражениями этими или другими видами клещей.
Посредством трансляции последовательности клонированного гена, кодирующего белок P0 морских вшей Caligus rogercresseyi, идентифицировали сходный пептид с низкой гомологией с P0 Salmo salar в той же самой области между аминокислотами 267 и 301 (SEQ ID NO:10, pP0Cr). Кроме того, идентифицированы также такие же области более низкого сходства аминокислот (SEQ ID NO:8 и 9, pP0Cc и pP0Ls) в опубликованном белке P0 для Caligus clemensi (номер доступа в Genebank AC014779) и Lepeophtheirus salmonis (номер доступа в Genebank AC012290).
Пример 3
Синтез пептидов и конъюгация с KLH
Пептиды, идентифицированные как SEQ ID NO:4, SEQ ID NO:9 и SEQ ID NO:10, и фрагменты из 20 аминокислот этих пептидов получали химическим синтезом и очищали обращенно-фазовой хроматографией с использованием системы HPLC (жидкостная хроматография высокого давления). Авторы настоящего изобретения получили 15 мг каждого синтетического пептида с чистотой 99,3%. Молекулярную массу каждого подтверждали масс-спектрометрией.
Для усиления иммуногенности пептиды сливали с белком KLH. Конъюгацию синтетических пептидов с KLH проводили способом с использованием растворимого карбодиимида. Янтарный ангидрид использовали в качестве спейсерного средства. Разделение конъюгатов проводили гель-фильтрационной хроматографией. Конечную концентрацию каждого конъюгата определяли способом с бицинхониновой кислотой.
Пример 4
Получение гипериммунной сыворотки мышей против пептида рибосомального белка P0 R. microplus и R. sanguineus (pP0)
В эксперименте использовали шесть самцов мышей Balb/c в возрасте 6 недель с массами тела между 18 и 22 г. Их иммунизировали подкожно на сутки 0, 14, 21, 20 и 28 250 мкг конъюгата pP0-KLH (эквивалент 125 мкг пептида и 125 мкг KLH) в адъюванте Фрейнда. Забор крови проводили на сутки 0, 7, 14, 21, 40 и 65. Животным выпускали кровь на сутки 65, и сыворотку получали центрифугированием в течение 10 минут при 3500 об/мин.
Кинетику антител мониторировали посредством непрямого ELISA. Для покрытия планшетов использовали 1 мкг pP0 на лунку, и детекцию проводили с помощью антител против IgG мыши, конъюгированных с пероксидазой хрена в разведении 1:15000. Проявление проводили с использованием раствора субстрата, содержащего o-фенилендиамин, 0,4 мг/мл в 0,1 M лимонной кислоте, и 0,2 M Na2HPO4, pH 5,0 и 0,015% пероксид водорода. Реакцию останавливали 2,5 M H2SO4. Титр антитела определяли как обратную величину наибольшего разведения, при котором средняя OD для рассматриваемой сыворотки в три раза превышала среднюю OD отрицательной контрольной сыворотки.
Для иммунизированных животных, начиная с суток 14 эксперимента, показаны титры специфических антител против пептида, которые стали 1:10240 для двух из животных на сутки 65 (фиг.2). Смесь, содержащую равные количества гипериммунных сывороток, полученных от шести мышей, иммунизированных конъюгатом pP0-KLH, использовали в качестве поликлонального антитела в анализах экспрессии и перекрестной реакционной способности «in vitro».
Пример 5
Анализ «in vitro» экспрессии рибосомального белка P0 клещей Rhipicephalus в линии клеток RK-13 и перекрестной реакционной способности
Последовательность ДНК, кодирующую рибосомальный белок P0 R. sanguineus (SEQ ID NO:2), клонировали в плазмиду pAdTrack-CMV (9,2 т.п.о), под контролем немедленного/раннего промотора/энхансера цитомегаловируса человека (pCMVITh) и позднего сигнала терминации/полиаденилирования вакуолизирующего обезьяньего вируса (SV40). Этот вектор содержит в своей последовательности репортерный ген, кодирующий зеленый флуоресцентный белок (GFP), и ген, придающий устойчивость к канамицину (He T.C. et al., Proc. Natl. Acad Sci U.S.A. 1998, 95:2509-2514). Полученную плазмиду использовали для трансфекции линии клеток почки кролика RK-13. Трансфекцию проводили с использованием липофектамина (Invitrogen, USA) согласно инструкциям производителя. Эффективность трансфекции определяли чере