Слитый белок, обладающий активностью фактора vii
Иллюстрации
Показать всеПредставленная группа изобретений касается слитого белка, ДНК, кодирующей такой белок, рекомбинантного вектора и клетки-хозяина. Охарактеризованный слитый белок содержит фактор VII (FVII) и трансферрин, где указанный трансферрин соединен с С-концом указанного FVII, необязательно через линкер. Предложенный слитый белок FVII имеет улучшенную удельную активность FVII по сравнению с существующими слитыми белками FVII, содержащими другие партнеры слияния, отличные от трансферрина, и, таким образом, может быть эффективно использован в терапии с использованием FVII. 4 н. и 12 з.п. ф-лы, 7 ил.,6 табл., 8 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к слитому белку, обладающему активностью фактора VII (FVII); и, более конкретно, к слитому белку, содержащему FVII и трансферрин и обладающему удельной активностью FVII 0,7 или более по сравнению с неслитым FVII природного типа, ДНК, кодирующей его, рекомбинантному вектору, содержащему ДНК, и клетке-хозяину, содержащей рекомбинантный вектор.
УРОВЕНЬ ТЕХНИКИ
Различные геморрагические нарушения обусловлены недостатком факторов свертывания крови. Наиболее обычные нарушения представляют собой гемофилию A и B, обусловленные недостаточностью или аномалиями факторов свертывания крови VIII и IX, соответственно.
Гемофилия A представляет собой генетическое нарушение кровотечения, обусловленное X-сцепленным рецессивным признаком дефективного гена фактора VIII. Концентрат полученного из плазмы или рекомбинантного фактора VIII использовали для лечения гемофилии A. Гемофилия B обусловлена недостаточностью или нарушением функции фактора IX, которое лечат посредством использования концентрата полученного из плазмы или рекомбинантного фактора IX. Однако образование аллогенных антител против замещающих факторов остается серьезной медицинской проблемой в лечении гемофилии A и B. Образование антител против фактора VIII происходит у вплоть до 30% пациентов с гемофилией А. Несмотря на то, что образование антител против фактора IX происходит в меньшей степени, они менее чувствительны к индукционной терапии иммунной толерантности, что ведет к более серьезным результатам.
Инициация коагуляции крови происходит посредством формирования комплекса между тканевым фактором, который становится доступен для циркулирующей крови после повреждения стенки сосуда, и активированной формы фактора VII (FVIIa). Такой комплекс активирует фактор IX и фактор X и получаемый фактор Xa образует ограниченное количество тромбина. В контуре положительной обратной связи тромбин активирует различные факторы (такие как фактор VIII, фактор V, фактор XI и т.д.) коагуляционного каскада крови, и активированные факторы образуют комплекс протеазы фактора X или протромбиназный комплекс. Эти комплексы дополнительно усиливают образование самих себя и образование тромбина. Это достаточное количество тромбина, которое называют «тромбиновым взрывом», превращает фибриноген в местах кровотечения в фибрин, тем самым достигая полного гемостаза. Однако в случае с пациентами с гемофилией, которые имеют высокую концентрацию нейтрализующих антител против фактора VIII или фактора IX, достаточного гемостаза не достигают, поскольку не могут быть получены комплексы протеазы фактора X, указанные выше. FVIIa использовали в качестве основного терапевтического средства для пациентов, которые имеют нейтрализующие антитела против фактора VIII или фактора IX, поскольку он может активировать фактор X, даже в отсутствие фактора VIII и фактора IX, тем самым в конечном итоге создавая достаточное количество тромбина для достижения желаемых терапевтических эффектов.
FVII представляет собой одноцепочечный гликопротеин, состоящий из 406 аминокислот, имеет молекулярную массу 50 кДа и секретируется в кровоток в виде зимогена. FVII состоит из четырех отдельных доменов, т.е. домен аминоконцевой карбоксиглутаминовой кислоты (Gla), два подобных эпидермальному фактору роста (EGF) домена и домен сериновой протеазы (Hagen FS et al., Proc. Natl. Acad. Sci. USA, 83(8):2412-2416, 1986). FVII превращается в свою активированную форму FVIIa посредством формирования двух полипептидных цепей, связанных дисульфидной связью, т.е. N-концевой легкой цепи (24 кДа) и C-концевой тяжелой цепи (28 кДа) через протеолиз одной пептидной связи, расположенной в Arg152-Ile153. В плазме FVII представлен в концентрации 500 нг/мл, и 1% (т.е. 5 нг/мл) FVII представлен в виде FVIIa.
Между тем, сообщалось о том, что время полужизни FVII в плазме составляет приблизительно 4 часа (3~6 часов), тогда как таковое для FVIIa составляет приблизительно 2,5 часа. В связи с коротким временем полужизни, FVIIa необходимо вводить в виде нескольких внутривенных инъекций или непрерывной инъекции. Однако, это будет ограничивать терапевтическое использование FVIIa с точки зрения высоких затрат на лечение и причинения пациенту неудобств.
Для того, чтобы преодолеть эти проблемы, предоставлены способы получения слитых белков, содержащих FVII и партнер слияния, соединенный с ним, но получаемые белки имели проблему утраты их биологических активностей, даже несмотря на то, что короткое время полужизни in vivo было несколько улучшено по сравнению с неслитым белком.
Соответственно, существует потребность в предоставлении и укреплении слитого белка FVII, который имеет улучшенное время полужизни in vivo, при этом сохраняя биологическую активность FVII природного типа.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Цель настоящего изобретения состоит в том, чтобы предоставить слитый белок, имеющий биологическую активность FVII природного типа.
Другая цель настоящего изобретения состоит в том, чтобы предоставить ген, кодирующий слитый белок.
Дополнительная цель настоящего изобретения состоит в том, чтобы предоставить рекомбинантный вектор, содержащий ген.
Еще одна другая цель настоящего изобретения состоит в том, чтобы предоставить клетку-хозяина, содержащую рекомбинантный вектор.
РЕШЕНИЕ ПРОБЛЕМЫ
В соответствии с одним аспектом настоящего изобретения, предоставлен слитый белок, содержащий фактор VII (FVII) и трансферрин, где трансферрин соединен с C-концом FVII.
В соответствии с другим аспектом настоящего изобретения, предоставлена ДНК, которая кодирует слитый белок.
В соответствии с дополнительным аспектом настоящего изобретения, предоставлен рекомбинантный вектор, который содержит ДНК.
В соответствии с еще одним дополнительным аспектом настоящего изобретения, предоставлена клетка-хозяин, которая содержит рекомбинантный вектор.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Слитый белок в соответствии с настоящим изобретением имеет улучшенное время полужизни in vivo по сравнению с FVII природного типа, при этом сохраняя высокую биологическую активность FVII, и, таким образом, его можно эффективно использовать в терапии с использованием FVII.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Приведенные выше и другие цели и признаки настоящего изобретения будут очевидны из следующего описания изобретения, когда берут в сочетании с сопроводительными рисунками, на которых, соответственно, представлено:
На фиг. 1 представлено схематическое изображение, показывающее процедуру клонирования для конструирования экспрессирующего вектора FVII-Tf из вектора, содержащего кДНК, которая кодирует последовательность FVII, и вектора, содержащего кДНК, которая кодирует последовательность трансферрина (Tf);
На фиг. 2 представлено схематическое изображение, на котором показана процедура конструирования экспрессирующего вектора FVII-GS1 (линкер)-Tf посредством перекрывающейся ПЦР;
На фиг. 3 представлено схематическое изображение, показывающее процедуру конструирования экспрессирующих векторов FVII-линкер GS-Tf, которые содержат GS3, GS5, GS7, GS9, GS11, GS13, GS15 или GS-1-T в качестве линкера;
На фиг. 4 представлены результаты вестерн-блоттинга слитых белков VII-Tf, FVII-GS1-Tf, FVII-GS3-Tf, FVII-GS5-Tf, FVII-GS7-Tf, FVII-GS9-Tf, FVII-GS11-Tf, FVII-GS13-Tf, FVII-GS15-Tf, FVII-GS1-T-Tf и FVII-Спираль-Tf по настоящему изобретению, слитого белка FVII-альбумин (FVII-Alb) и FVII (NovoSevenTM);
На фиг. 5 представлен график, показывающий удельные активности слитых белков по настоящему изобретению FVII-Tf, FVII-GS1-Tf, FVII-GS3-Tf, FVII-GS5-Tf, FVII-GS7-Tf, FVII-GS9-Tf, FVII-GS11-Tf, FVII-GS13-Tf, FVII-GS15-Tf, FVII-GS1-T-Tf и FVII-Спираль-Tf и слитого белка FVII-альбумин (FVII-Alb);
На фиг. 6 представлена структура линкера и последовательности узнавания рестрикции на обоих концах в слитом белке FVII-GS1-T-Tf; и
На фиг. 7 представлены результаты вестерн-блоттинга очищенных слитых белков по настоящему изобретению FVII-Tf, FVII-GS1-Tf, FVII-GS1-T-Tf, FVII-GS3-Tf и FVII-GS15-Tf, NovoSevenTM и FVII.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к слитому белку, содержащему фактор VII (FVII) и трансферрин.
FVII и трансферрин для слитого белка по настоящему изобретению можно извлекать у любого млекопитающего, предпочтительно у человека. Более предпочтительно, FVII и трансферрин, используемые в настоящем изобретении, могут иметь не менее чем 95% гомологии последовательности относительно таковой у природного типа белков, найденных в крови человека, соответственно. Наиболее предпочтительно, FVII имеет аминокислотную последовательность SEQ ID NO: 1 и трансферрин имеет аминокислотную последовательность SEQ ID NO: 2.
Вдобавок, FVII или трансферрин, используемые в слитом белке по настоящему изобретению, могут представлять собой функциональный эквивалент или функциональное производное их природного типа, которое имеет по существу эквивалентную функциональную активность. Образцовые функциональные эквиваленты включают мутанты, которые возникают посредством делеции, инсерции или неконсервативной или консервативной замены любых аминокислотных остатков или их сочетания в аминокислотных последовательностях, представленных посредством SEQ ID NO: 1 и 2, соответственно, в которых такие изменения по существу не изменяют активные центры или домены, обеспечивающие биологические активности в FVII.
В некоторых случаях, слитый белок по настоящему изобретению можно модифицировать, например, через фосфорилирование, сульфатирование, акрилирование, гликозилирование, метилирование, фарнезилирование, ацетилирование, амидирование и другое, для улучшения или снижения его физических или химических свойств, и такие функциональные производные также попадают в объем настоящего изобретения при условии, что биологическая активность FVII по существу сохранена.
В слитом белке по настоящему изобретению трансферрин предпочтительно соединен с C-концом FVII. Слитый белок с порядком FVII-трансферрин превосходит слитый белок с порядком трансферрин-FVII, вероятно, в связи с доступностью N-конца FVII (см. таблицу 3).
Слитый белок по настоящему изобретению дополнительно может содержать последовательность(и) узнавания для рестрикционного фермента между FVII и трансферрином для того, чтобы облегчать инсерцию линкера, как описано ниже. Последовательность узнавания рестрикции может представлять собой любую последовательность узнавания рестрикции, известную специалисту в данной области, и предпочтительно можно использовать последовательность узнавания AgeI (A/CCGGT). Другими словами, слитые белки, в которых последовательность узнавания рестрикции связана с C-концом FVII и трансферрин связан с последовательностью узнавания рестрикции, включены в объем настоящего изобретения.
Настоящее изобретение относится к слитому белку, содержащему линкер между FVII и трансферрином.
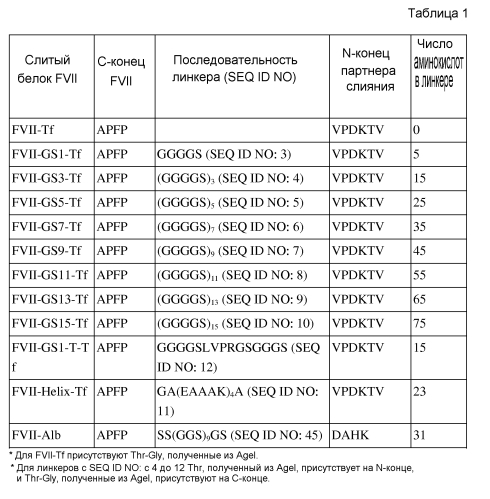
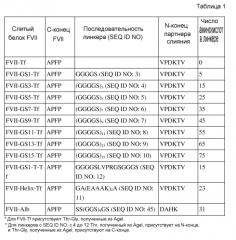
Линкер может иметь от 1 до 100 аминокислот, предпочтительно от 1 до 75 аминокислот, более предпочтительно от 5 до 25 аминокислот, и он может представлять собой любые пептиды, которые могут функционально разделять FVII и трансферрин. Линкер может иметь стабильную вторичную структуру, такую как спираль, или может происходить из шарнирной области IgG. Предпочтительно, линкер может свободно вращаться в водном растворе и не имеет фиксированной структуры и, следовательно, он будет неиммуногенным и будет увеличивать активности FVII слитых белков посредством минимизации потенциального препятствия между двумя партнерами слияния. В качестве примера, такой линкер может представлять собой спиральный линкер, представленный посредством аминокислотной последовательности SEQ ID NO: 11. Кроме того, такой гибкий линкер может содержать глицин (G) и серин (S) в повторяющемся или случайном паттерне. Например, линкер содержит (GGGGS)N (где N представляет собой целое число в диапазоне от 1 до 20), и предпочтительно имеет только одно, выбранное из группы, состоящей из аминокислотных последовательностей SEQ ID NO: с 3 до 11 (см. таблицу 1). Вдобавок, любые аминокислотные последовательности, имеющие гомологию с линкером не менее чем 80%, предпочтительно имеющие гомологию не менее чем 85%, также можно использовать в слитом белке по настоящему изобретению.
Кроме того, линкер также может содержать сайт(ы) расщепления протеазы, который распознает протеаза(ы), присутствующие в поврежденной ткани в изобилии. Сайт расщепления можно расщеплять посредством протеазы, выбранной из группы, состоящей из тромбина, фактора Xa, фактора IXa и фактора VIIa. Слитый белок, имеющий такой сайт расщепления протеазы, расщепляют в рабочем сайте для того, чтобы получить каждый белок, т.е. FVII и трансферрин, и получаемые белки выполняют функцию отдельных белков. Предпочтительно, линкер имеет аминокислотную последовательность SEQ ID NO: 12 (см. таблицу 1).
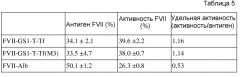
Линкер можно вставлять внутрь слитого белка более легко посредством последовательности узнавания рестрикционного фермента, которая расположена между FVII и трансферрином. Соответственно, последовательность узнавания рестрикционного фермента может быть представлена на любом одном конце или обоих концах линкера и в свою очередь быть транслирована в аминокислоты, кодируемые посредством последовательности. Например, когда используют последовательность узнавания рестрикционного фермента AgeI, Thr может присутствовать на N-конце линкера и Thr-Gly может присутствовать на C-конце линкера. То есть, когда используют линкер (GGGGS)3, последовательность узнавания и линкер могут присутствовать в форме --T(GGGGS)3TG--. Аминокислоты, транслируемые на N- и C-концах линкера могут варьировать в зависимости от используемых последовательностей узнавания рестрикционного фермента, но их присутствие не влияет на активности слитых белков (см. таблицу 5).
Слитый белок по настоящему изобретению проявляет удельную активность FVII не менее чем 0,7 по сравнению с неслитым FVII природного типа.
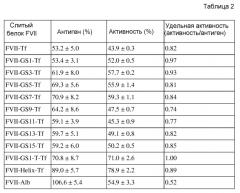
В одном из аспектов настоящего изобретения слитый белок, который содержит FVII, представленный посредством аминокислотной последовательности SEQ ID NO: 1, и трансферрин, представленный посредством аминокислотной последовательности SEQ ID NO: 2, имеет приблизительно от 0,82 приблизительно до 0,92 удельной активности FVII по сравнению с неслитым FVII природного типа (см. таблицы 2 и 3).
Вдобавок, слитый белок, который содержит FVII, представленный посредством аминокислотной последовательности SEQ ID NO: 1, линкер, представленный посредством аминокислотной последовательности SEQ ID NO: 3, и трансферрин, представленный посредством аминокислотной последовательности SEQ ID NO: 2, имеет удельную активность FVII приблизительно 0,97 по сравнению с неслитым FVII природного типа (см. таблицу 2).
Слитые белки в соответствии с настоящим изобретением, в которые другие линкеры вставлены между FVII и трансферрином, также имеют удельные активности FVII от приблизительно 0,74 приблизительно до 1 по сравнению с неслитым FVII природного типа (см. таблицу 2).
Кроме того, слитый белок по настоящему изобретению имеет время полужизни 3~4 раза более длительное, чем таковое у FVII без трансферрина, связанного с ним (см. таблицу 6).
Настоящее изобретение также относится к ДНК, кодирующей слитый белок.
ДНК, кодирующую слитый белок, можно подвергать различным изменениям и модификациям вследствие вырожденности кодонов или принимая во внимание кодоны, предпочтительные для экспрессии слитого белка организмом, если аминокислотная последовательность слитого белка по существу не изменена, и модифицированная ДНК также включена в объем настоящего изобретения. В настоящем изобретении ДНК, кодирующая слитый белок, предпочтительно может быть представлена посредством любой одной из нуклеотидных последовательностей SEQ ID NO: с 13 до 24. ДНК, кодирующая слитый белок по настоящему изобретению, может быть предоставлена посредством вектора для экспрессии ДНК.
Настоящее изобретение относится к рекомбинантному вектору, содержащему ДНК, кодирующую слитый белок.
Термин «вектор», используемый в настоящем документе, относится к средству для введения ДНК, кодирующей указанный слитый белок, в клетку-хозяина и экспрессии в ней слитого белка. Вектор может включать все стандартные векторы, такие как плазмидные векторы, космидные векторы, бактериофаговые векторы, вирусные векторы и другие, предпочтительно плазмидный вектор.
Подходящий экспрессирующий вектор содержит экспрессионные регуляторные элементы, такие как промоторы, инициирующие кодоны, терминирующие кодоны, сигналы полиаденилирования и энхансеры, а также сигнальные последовательности или лидерные последовательности для нацеливания на мембрану или секреции, и его можно получать различными способами согласно с целями. Следует убедиться, что инициирующий кодон и терминирующий кодон будут работать в организме, в который вводят генную конструкцию, и что они совпадают по рамке считывания с кодирующей последовательностью. Кроме того, экспрессирующий вектор содержит маркер селекции для отбора клеток-хозяев, содержащих вектор, и участок начала репликации, если экспрессирующий вектор является репродуцируемым. Вектор может самореплицироваться или может быть встроен внутрь ДНК клетки-хозяина.
В частности, рекомбинантный экспрессирующий вектор в соответствии с настоящим изобретением можно получать посредством вставки ДНК, кодирующей последовательность слитого белка, внутрь вектора pcDNA3.1-hygro.
Кроме того, настоящее изобретение относится к клетке-хозяину, которая продуцирует слитый белок посредством трансформации с использованием указанного рекомбинантного экспрессирующего вектора.
Поскольку уровни экспрессии и модификации белков варьируют в зависимости от типа клеток-хозяев, предпочтительно выбирать клетку-хозяина, наиболее подходящую для этой цели. Примеры клеток-хозяев включают клетки млекопитающих, например, клетки яичника китайского хомяка (CHO), эмбриональные клетки почки человека (HEK293), клетки почки хомяка (BHK 21), клетки злокачественной опухоли печени человека (Hep G2) и другие, но без ограничения.
Для того чтобы трансформировать клетку-хозяина рекомбинантным экспрессирующим вектором в соответствии с настоящим изобретением, можно использовать любой способ, известный специалистам в данной области, и примеры такого способа включают, но без ограничения, электропорацию, слияние протопластов, преципитацию фосфатом кальция (CaPO4), преципитацию хлоридом кальция (CaCl2), и другие.
ВАРИАНТ ИЗОБРЕТЕНИЯ
Следующие примеры приведены только с целью иллюстрации, и не предназначены для того, чтобы ограничивать объем настоящего изобретения.
Пример 1: Получение плазмидного вектора фактора VII (FVII) (pcDNA3.1-hygro-FVII)
Общую РНК, очищенную от клеток Hep G2 (KCLB № 88065) использовали в качестве матрицы для обратной транскрипции. Комплементарный ДНК (кДНК) транскрипт амплифицировали посредством ПЦР с использованием специфичных к гену FVII праймеров, FVII-F и FVII-R (SEQ ID NO: 25 и 26), чтобы получить открытую рамку считывания гена FVII человека. ПЦР осуществляли посредством обработки 50 мкл реакционного раствора (0,5 мкл кДНК, 0,4 мкМ (10 пмоль/мкл) праймеров SEQ ID NO: 25 и 26, 0,2 мМ dNTP, 5 единиц ДНК полимеразы Taq и вода) при следующих условиях: 1 цикл денатурации при 94°C в течение 5 мин, 35 циклов амплификации при 94°C в течение 1 мин, при 60°C в течение 1 мин и при 72°C в течение 2,5 мин, и 1 цикл конечной элонгации при 72°C в течение 5 мин. Очищенный продукт ПЦР клонировали в вектор pGEM-T Easy (Promega, № по каталогу: A1360). Положительные клоны отбирали посредством рестрикционного расщепления с использованием EcoRI и NcoI. Отобранные клоны дополнительно верифицировали посредством секвенирования ДНК. Для того, чтобы перенести ORF из FVII (FVII-ORF) в экспрессирующий вектор, FVII-ORF, расщепленный с использованием NotI, затупляли посредством T4 ДНК полимеразы и лигировали с использованием вектора pcDNA3.1-hygro (Invitrogen), расщепленного с использованием HindIII/XbaI и затупленного. Лигированный вектор подтверждали посредством рестрикционного расщепления с использованием ApaI, XbaI, EcoRI, NcoI, PstI и секвенирования ДНК. Этот вектор обозначили «pcDNA3.1-hygro-FVII».
Пример 2: Конструирование экспрессирующего вектора FVII-Tf (pcDNA3.1-hygro-FVII-Tf)
кДНК FVII, полученную в примере 1, сливали с кДНК трансферрина (Tf) человека для того, чтобы экспрессировать в виде одного зимогена в клетке животного. кДНК трансферрина человека приобретали в Origene (№ по каталогу: SC322130) и проверяли, совпадает ли она с последовательностью с номером доступа GenBank NM_001063.2. Праймеры, используемые в слиянии, разрабатывали для того, чтобы удалить терминирующий кодон FVII и сигнальный пептид трансферрина. Для того, чтобы облегчить инсерцию линкеров различных размеров между FVII и Tf, сайт AgeI (ACCGGT), который будет транслирован в треонин (Thr) и глицин (Gly), добавляли в связывающие праймеры. Получаемый слитый белок будет иметь следующую структуру: (лидерный пептид)-(зрелый FVII)-(Thr-Gly)-(зрелый Tf) (в котором лидерный пептид состоит из сигнального пептида (пептид-предшественник), не присутствующего в зрелом FVII, и пропептида, подлежащего расщеплению посредством процессирующего фермента, который состоит из 38 аминокислот и соответствует аминокислотам в диапазоне положений от 1 до 38 в аминокислотной последовательности SEQ ID NO:1). кДНК для FVII и Tf амплифицировали посредством использования праймеров FVII-S1, FVII-AS1, Tf-S1 и Tf-AS1 (SEQ ID NO: с 27 до 30) и использовали вектор, как описано в примере 1. Праймеры с SEQ ID NO: 27 и 30 содержат сайты NheI и XhoI, соответственно.
Стратегия клонирования для соединения кДНК FVII и кДНК Tf изображена на фиг. 1. Сначала, кДНК FVII амплифицировали из вектора pcDNA3.1-hygro-FVII посредством ПЦР. ПЦР осуществляли посредством обработки 50 мкл реакционного раствора (1 мкл матрицы вектора, 1 мкл набора праймеров, FVII-S1 и FVII-AS1 (10 мкМ), 10 мкл 5× буфера Phusion HF, 200 мкМ dNTP, 0,5 мкл ДНК полимеразы Phusion (FINNZYMES, #F-530S, 2 единицы/мкл) и 35,5 мкл воды) при следующих условиях: 1 цикл денатурации при 98°C в течение 30 сек, 30 циклов амплификации при 98°C в течение 10 сек, при 60°C в течение 45 сек и при 72°C в течение 30 сек, и 1 цикл конечной элонгации при 72°C в течение 7 мин.
Затем Tf амплифицировали с использованием кДНК трансферрина в качестве матрицы. Указанную выше процедуру ПЦР повторяли, за исключением использования набора праймеров (Tf-S1: 10 мкМ; Tf-AS1: 10 мкМ).
Амплифицированные FVII и кДНК Tf соединяли посредством серии рестрикций и лигирований. Каждую ДНК, амплифицированную посредством ПЦР, расщепляли с использованием AgeI и XhoI, или с использованием NheI. Расщепленную ДНК очищали и лигировали с молярным отношением 1:1. Лигированную ДНК субклонировали в вектор pcDNA3.1-hygro (Invitrogen), расщепленный с использованием NheI/XhoI. Размер и последовательность вставки дополнительно верифицировали посредством секвенирования ДНК.
Пример 3: Конструирование экспрессирующего вектора FVII-линкер GS-Tf
Пептид, состоящий из 5 аминокислот, содержащих глицин и серин, использовали в качестве базового линкерного блока. Базовый линкерный блок содержит четыре глицина и один серин при следующей последовательности: «GGGGS». Базовый линкерный блок (далее в настоящем документе обозначаемый как «линкер GS-X», в котором X представляет собой число повторений базового линкерного блока GS) использовали для того, чтобы составить более длинные линкеры GS. В этом примере конструировали линкеры в диапазоне от GS-1 до GS-15.
1) Конструирование экспрессирующего вектора FVII-линкер GS-1-Tf
Набор праймеров, GS-FV-AS1 и GS-Tf-S1 (SEQ ID NO: 31 и 32), содержащих базовый линкерный блок GS, синтезировали и вставляли между FVII и Tf посредством перекрывающейся ПЦР (см. фиг. 2).
Линкер GS-1 соединяли с FVII посредством ПЦР с использованием набора праймеров FVII-S1 и GS-FV-AS1 (SEQ ID NO: 27 и 31) и ДНК полимеразы Phusion (FINNZYMES, #F-530S). ПЦР осуществляли посредством обработки 50 мкл реакционного раствора (1 мкл вектора pcDNA3.1-hygro-FVII-Tf, 1 мкл FVII-S1 (10 пмоль/1 мкл), 1 мкл GS-FV-AS1 (10 пмоль/мкл), 1 мкл 10 мМ dNTP, 10 мкл 5× буфера Phusion HF, 35,5 мкл воды и 0,5 мкл ДНК полимеразы Phusion (2 ед/мкл)) при следующих условиях: 1 цикл денатурации при 98°C в течение 30 сек, 35 циклов амплификации при 98°C в течение 10 сек, при 64°C в течение 30 сек и при 72°C в течение 45 сек, и 1 цикл конечной элонгации при 72°C в течение 7 мин. Между тем, чтобы соединить линкер GS-1 с Tf, повторяли приведенную выше процедуру ПЦР, за исключением использования набора праймеров GS-Tf-S1 и Tf-AS1 (SEQ ID NO: 32 и 30). Амплифицированные продукты ПЦР использовали в качестве матриц для перекрывающейся ПЦР. Перекрывающуюся ПЦР осуществляли посредством обработки реакционного раствора (1 мкл амплифицированных продуктов ПЦР, 1 мкл FVII-S1 (10 пмоль/мкл, SEQ ID NO: 27), 1 мкл антисмыслового праймера (Tf-AS1 10 пмоль/мкл, SEQ ID NO: 30), 10 мкл 5× буфера Phusion HF, 1 мкл 10 мМ dNTP, 34,5 мкл воды, 0,5 мкл ДНК полимеразы Phusion (2 ед/мкл)) при следующих условиях: 1 цикл денатурации при 98°C в течение 1 мин, 45 циклов амплификации при 98°C в течение 10 сек, при 66/68°C в течение 30 сек, и при 72°C в течение 45 сек, и 1 цикл конечной элонгации при 72°C в течение 7 мин. Амплифицированный продукт перекрывающейся ПЦР клонировали в pcDNA3.1-hygro-lacZ, расщепленный с использованием NheI и XhoI.
2) Конструирование экспрессирующего вектора FVII-GS-3 линкер-Tf
Синтезировали набор праймеров, GS3-S и GS3-AS (SEQ ID NO: 33 и 34), содержащий GS-3 и сайт AgeI. Чтобы создать двухцепочечный линкер GS-3, праймеры отжигали посредством нагревания смеси (5 мкл GS3-S (100 пмоль/мкл), 5 мкл GS3-AS (100 пмоль/мкл), 2 мкл 10× буфера для отжига (100 мМ Tris-Cl [pH 8,0], 1 M NaCl, 10 мМ ЭДТА) и 8 мкл воды) при 98°C в течение 10 мин и охлаждали при 25°C в течение 1 часа. Отожженный линкер расщепляли с использованием AgeI, а также вектор pcDNA3.1-hygro-FVII-Tf, полученный в примере 2, расщепляли с использованием AgeI. Расщепленный вектор обрабатывали в 1 мкл CIP (кишечная фосфатаза теленка; NEB, #M0290S) при 37°C в течение 1 часа и подвергали процедуре экстрагирования в геле (QIAGEN, #28704), за чем следовало лигирование при молярном отношении 1:3 (вектор:вставка) с использованием ДНК лигазы T4 (TAKARA, #2011A).
3) Конструирование экспрессирующих векторов с FVII-GS-5 линкер-Tf до FVII-GS-15 линкер-Tf
Для того, чтобы конструировать экспрессирующий слитый белок вектор, содержащий линкер GS-5, реализовали новую стратегию. Векторы слияния FVII-Tf, содержащие удлиненные линкеры, конструировали посредством следующих двух стадий.
Первая стадия представляет собой добавление синтезированного двухцепочечного (ds) линкера GS2 в предварительно полученный линкер. После подтверждения удлинения линкера, линкер вырезали и вставляли между генами FVII и Tf в вектор pcDNA3.1-hygro-FVII-Tf. Например, для того, чтобы удлинить линкер GS-3 до линкера GS-5, синтезированный линкерный блок dsGS-2 SEQ ID NO: 35 расщепляли с использованием BglII и лигировали с использованием вектора pcDNA3.1-hygro-FVII-GS3-Tf, обработанного с использованием BamHI и StuI. Затем, после подтверждения удлинения линкера посредством расщепления BamHI и AgeI, удлиненный линкер вырезали с использованием AgeI и субклонировали в вектор pcDNA3.1-hygro-FVII-Tf, обработанный с использованием AgeI и CIP. Экспрессирующие слияние FVII-Tf векторы, содержащие линкеры GS-7, GS-9, GS-11, GS-13 и GS-15, конструировали посредством аналогичной стратегии (см. фиг. 3).
Пример 4: Конструкция экспрессирующего вектора FVII-Tf (pcDNA3.1-hygro-FVII-GS1-T-Tf), содержащего линкер, содержащий сайт расщепления тромбина
Линкер, содержащий сайт расщепления тромбина, получали посредством присоединения блока GS-1 к обоим концам последовательности узнавания тромбина (далее в настоящем документе обозначаемой «линкер GS1-T»). Линкер dsGS1-T с SEQ ID NO: 36 (смысловая) разрабатывали и синтезировали, чтобы он содержал сайты AgeI на обоих концах. Линкер dsGS1-T расщепляли с использованием AgeI и очищали с использованием PCR Purification Kit (Qiagen, № по каталогу: 28104). Очищенный линкер лигировали в вектор pcDNA3.1-hygro-FVII-Tf, обработанный с использованием CIP/AgeI.
Пример 5: Конструкция экспрессирующего вектора FVII-Tf (pcDNA3.1-hygro-FVII-Спираль-Tf), содержащего спиральный линкер
Спиральный линкер ДНК получали способом, который раскрыт в выложенной публикации США № 2009/0170163. Сайт AgeI добавляли на оба конца полученного спирального линкера ДНК посредством использования праймеров, спиральный линкер S и спиральный линкер AS (SEQ ID NO: 37 и 38). Праймеры спиральный линкер S и спиральный линкер AS отжигали и расщепляли с использованием AgeI, за чем следовала вставка внутрь вектора pcDNA3.1-hygro-FVII-Tf, обработанного с использованием AgeI и CIP. Сконструированный вектор подтверждали посредством секвенирования ДНК.
Сравнительный пример 1: Конструирование экспрессирующего слияние FVII-альбумин вектора (FVII-Alb)
Конструировали слитый белок FVII-альбумин, раскрытый в патенте EP № 1816201. кДНК альбумина человека получали посредством ОТ-ПЦР с использованием мРНК печени человека (Clontech) в качестве матрицы и геноспецифических праймеров для альбумина, альбумин-S и альбумин-AS (SEQ ID NO: 39 и 40). ОТ-ПЦР осуществляли посредством использования AccuScript High Fideleity RT-PCR System Kit (№ по каталогу 600180) в соответствии с руководством производителя. Сначала 10 мкл реакционного раствора для обратной транскрипции (1 мкл 10× буфера для обратной транскриптазы, 0,6 мкл праймера oligo-dT, 1 мкл dNTP, 0,4 мкл воды, 5 мкл мРНК печени человека (10 нг/мкл)) держали при 65°C в течение 5 мин и при комнатной температуре в течение 5 мин, и подвергали реакции с 1 мкл 100 мМ DTT и 1 мкл обратной транскриптазы при 42°C в течение 1 часа. Последовательность альбумина человека получали посредством ПЦР с использованием синтезированной кДНК в качестве матрицы и праймеров альбумин-S и альбумин-AS. ПЦР осуществляли посредством обработки 50 мкл реакционного раствора (1 мкл кДНК, 10 мкл 5× буфера Phusion HF, 1 мкл праймеров Альбумин-S и Альбумин-AS, соответственно, 1 мкл 10 мМ dNTP, 0,5 мкл ДНК полимеразы Phusion (FINNZYMES, #F-530S; 2 ед/мкл) и 35,5 мкл воды) при следующих условиях: 1 цикл денатурации при 98°C в течение 1 мин, 30 циклов амплификации при 98°C в течение 10 сек, при 62°C в течение 30 сек и при 72°C в течение 60 секунд, и 1 цикл конечной элонгации при 72°C в течение 7 мин. Синтезированные олигонуклеотиды с SEQ ID NO: 41 и 42 отжигали к линкеру GS [SS(GGS)9GS] (SEQ ID NO: 45), раскрытому в патенте EP № 1816201. Для того, чтобы соединить кДНК FVII, полученную в примере 1, с указанным выше линкером, терминирующий кодон FVII в векторе pcDNA3.1-hygro-FVII заменяли на сайт XhoI посредством мутагенеза на основе ПЦР с использованием праймеров mut FVII(XhoI)-S и mut FVII(XhoI)-AS (SEQ ID NO: 43 и 44). Используя сайты XhoI/ApaI, линкер GS [SS(GGS)9GS] сливали с 3'-концом кДНК FVII в векторе pcDNA3.1-hygro-FVII. В конце кДНК альбумина человека, расщепленную с использованием BamHI, вставляли внутрь вектора pcDNA3.1-hygro-FVII-GS-линкер. Полученный экспрессирующий вектор pcDNA3.1-hygro-FVII-GS-линкер-альбумин подтверждали посредством секвенирования ДНК.
Характеристики экспрессирующих векторов, сконструированных в примерах со 2 по 5 и сравнительном примере 1, приведены в таблице 1.
Экспериментальный пример 1: Измерение удельных активностей FVII-слитых белков
FVII-слитые белки, сконструированные в примере со 2 по 5 и сравнительном примере 1, экспрессировали в клетках CHO (CHO(VK2)) которые стабильно экспрессируют VKORC1 (субъединица 1 комплекса эпоксидредуктазы витамина K).
Экспрессирующие векторы, сконструированные в примере со 2 по 5 и сравнительном примере 1, очищали посредством использования Endo-free Plasmid Maxi Kit (Qiagen, #27104). β-галактозидазу использовали в качестве внутреннего контроля для трансфекции. Клетки CHO (VK2) высевали с плотностью 1,5×106 клеток/лунка в 6-луночные планшеты. Клетки инкубировали в α-MEM (Lonza, #12-169F) с добавлением 10% FBS (Lonza, #14-501F), 1× HT (Invitrogen, #11067-030), 4 мМ L-глутамина (Lonza, #17-605E) и 200 мкг/мл гигромицина (Invitrogen, #10687-010) в течение 24 часов, и затем осуществляли трансфекцию с использованием липофектамина 2000 (Invitrogen) в соответствии с руководством изготовителя. Через четыре часа после трансфекции среду заменяли бессывороточной средой (OptiMEM) и добавляли 5 мкг/мл витамина K. После 48 часов инкубации брали образцы среды для культивирования и хранили их при -70°C.
Экспрессируемые слитые белки FVII анализировали на их хромогенные активности и количества антигенов с использованием COATEST Factor VII Assay Kit (Chrmogenix, #821900-63) и FVII ELISA Kit (Cedarlene Lab, #CL20030K), соответственно. Анализы осуществляли в соответствии с руководством изготовителя. Стандартную плазму человека, нормализованную по стандарту ВОЗ, использовали в качестве контрольного FVII в обоих анализах. Экспрессию белка оценивали посредством анализа вестерн-блоттинга. Основываясь на результатах ELISA, загружали равные количества слитых FVII белков. Обнаружено, что экспрессируемые слитые белки FVII обладают ожидаемыми размерами без обнаружимой фрагментации (см. фиг. 4).
Между тем, удельные активности слитых белков FVII-трансферрин составляли от 0,74 до 1, что было выше по сравнению с таковыми слитого белка FVII-альбумин (0,52) (см. таблицу 2). Слитые белки FVII-трансферрин, содержащие линкеры, также сохраняли не менее чем 70% активности FVII. Зависимость между длиной линкера и удельной активностью отсутствует, но FVII слитые белки с более короткими линкерами GS показывали несколько более высокие удельные активности, чем слитые белки с более длинными. В частности, слитые белки FVII-GS1-Tf и FVII-GS1-T-Tf показывали сравнимые удельные активности (см. фиг. 5).
Пример 6: Определение характеристик слитых белков FVII в соответствии с направлением слияния Tf
В этом примере слитый белок, в котором трансферрин человека (Tf) связан с N-концом FVII, получали и сравнивали со слитым белком, в котором трансферрин связан с C-концом FVII для того, чтобы проверить изменение характеристик в соответствии с направлением слияния в слитых белках. Детальная процедура представляет собой следующее.
<6-1> Конструирование экспрессирующих векторов Tf-FVII и Tf-GS1-T-FVII
Два слитых белка с Tf, соединенным с N-концом FVII, разрабатывали согласно следующему: (1) (лидерный пептид из Tf)-(зрелый Tf)-(Thr-Gly)-(зрелый FVII); и (2) (лидерный пептид из Tf)-(зрелый Tf)-(Thr)-(GS1-T; SEQ ID NO: 12)-(Thr-Gly)-(зрелый FVII).
Сначала для того, чтобы получить последовательность гена Tf, содержащего лидерный пептид, прямой праймер (Nhe-Tf: SEQ ID NO: 46) разрабатывали так, чтобы он содержал сайт NheI для целей клонирования, и обратный праймер (Tf-Age: SEQ ID NO: 47) разрабатывали так, чтобы он содержал сайт AgeI для целей удаления терминирующего кодона трансферрина и клонирования. Для клонирования зрелого FVII с удаленным лидерным пептидом, прямой праймер (Age-FVII: SEQ ID NO: 48) разрабатывали так, чтобы он содержал сайт AgeI, и обратный праймер разрабатывали так, чтобы он содержал сайт XhoI.
Для гена Tf, кДНК, приобретенную в Origene (№ по каталогу: SC322130) как в примере 2 использовали в качестве матрицы для ПЦР. ПЦР осуществляли посредством обработки 50 мкл реакционного раствора (1 мкл матрицы вектора, 2 мкл праймеров Nhe-Tf и Tf-AgeI (10 мкМ), 10 мкл 5× буфера Phusion HF, 1 мкл 10 мМ dNTP, 0,5 мкл ДНК полимеразы Phusion (FINNZYMES, #F-530S, 2 ед/мкл) и 33,5 мкл воды) при следующих условиях: 1 цикл денатурации при 98°C в течение 30 сек, 25 циклов амплификации при 98°C в течение 10 сек, при 70°C в течение 30 сек и при 72°C в течение 36 сек, и 1 цикл конечной элонгации при 72°C в течение 10 мин. FVII амплифицировали посредством ПЦР с использованием вектора pcDNA3.1-hygro-FVII-GS1-T-Tf в качестве матрицы, как в примере 4. Условия ПЦР аналогичны приведенным выше условиям ПЦР Tf, за исключением использования праймеров Age-FVII (10 мкМ) и VII-Xho (10 мкМ).
Амплифицированный ген Tf вставляли внутрь вектора pcDNA3.1-hygro-FVII-GS1-T-Tf посредством использования NheI/AgeI для того, чтобы получить вектор pcDNA3.1-hygro-Tf-Tf. Вектор pcDNA3.1-hygro-Tf-Tf и продукт ПЦР FVII расщепляли с использованием AgeI/XhoI и лигировали для того, чтобы сконструировать экспрессирующий вектор, содержащий слитый белок pcDNA3.1-hygro-Tf-FVII. Экспрессирующий вектор pcDNA3.1-hygro-Tf-GS1-T-FVII конструировали посредством вставки последовательности dsGS1-T, синтезированной в примере 4, посредством AgeI. Сконструированные экспрессирующие векторы подтверждали посредством рестрикционного картирования и секвенирования ДНК.
<6-2> Экспрессия слитых белков и определение характеристик
Для того чтобы охарактеризовать слитые белки с Tf, связанным с N-концом FVII, экспрессирующие их векторы, т.е. pcDNA3.1-hygro-FVII-Tf, pcDNA3.1-hygro-FVII-GS1-Tf-VII, pcDNA3.1-hygro-Tf-FVII и pcDNA3.1-hygro-Tf-GS1-T-FVII, транзиторно экспрессировали в клетках CHO.
ДНК сконструированных четырех плазмид выделяли с использованием Endo-free Maxi Prep Kit (Qiagen). За один день до трансфекции, клетки CHO (DG44), которые культивировали в колбах T75, выделяли посредством трипсина и высевали при плотности 1,5×106 клеток/лунка в 6-луночные планшеты. После 24 часов клетки трансфицировали в соответствии с руководством изготовителя. Через четыре часа после трансфекции среду в каждой лунке удаляли и заменяли на 2 мл среды для выращивания с добавлением 5 мкг/мл витамина K. После трансфекции 6-луночный планшет инкубировали в 37°C, 5% CO2 инкубаторе, и через 48 часов среду собирали. Собра