Гепатозащитное действие гарцинола
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к гастроэнтерологии, и может быть использована для защиты гепатоцитов млекопитающих при их повреждении. Для этого вводят эффективное количество гарцинола. Это позволяет подавить повышенные уровни TGF-β, ICAM-1,С-реактивного белка, Т-клеточный иммунный ответ, билирубина, сывороточных ферментов, TNF-α при более низких концентрациях по сравнению с другими гепатопротекторами.5 н. и 17 з.п. ф-лы, 13 ил.,7 табл., 10 пр.
Реферат
Данная заявка представляет собой безусловную заявку предварительной заявки 61/428643, поданной 30 декабря 2010 года.
Область техники
Изобретение, в общем, относится к лекарственным средствам для управления гепатотоксичностью (токсичным действием на печень). Конкретнее, оно относится к гепатозащитному потенциалу гарцинола.
Предшествующий уровень техники
Термин "гепатотоксичность", в общем, относится к повреждению печени, вызванному химическими веществами. Такое повреждение встречается главным образом, когда печень выполняет свою природную функцию трансформации и очистки химических веществ в организме.
Тесная связь между печенью, желудочно-кишечным трактом и селезенкой через систему воротной вены, как часть ее метаболической функции, дополнительно усиливает воздействие токсичности в связи с циркулирующими лекарственными средствами.
Nilesh Mehta с соавт. (Drug-Induced Hepatotoxicity- Medscape REFERENCE-Drugs, Diseases and Procedures) сообщает, что 75% идиосинкразических реакций на лекарственные средства приводят к пересадке печени или смерти. Те же авторы также сообщают, что в США ежегодно встречаются приблизительно 2000 случаев острой печеночной недостаточности, и 50% таких случаев могли бы объясняться воздействиям лекарственных средств. Авторы дополнительно освещают патофизиологические механизмы, лежащие в основе гепатотоксичности, вызываемой лекарственными средствами. Они включают:
(i) разрушение гепатоцитов, которое сопровождается разборкой актиновых фибрилл вследствие ковалентного связывания лекарственного средства с внутриклеточными белками и снижения уровней АТФ (аденозинтрифосфат).
(ii) вызываемое лекарственными средствами блокирование транспортных насосов, предотвращающее нормальное выведение с желчью, с причинением холестаза.
(iii) иммунный ответ, опосредованный связыванием лекарственного средства с ферментом Р-450.
(iv) вызванный TNF-α (tumor necrose factor - фактор некроза опухолей) апоптоз гепатоцитов.
(v) разрушение митохондрий вследствие пониженного образования АТФ, обусловленного подавлением НАД (никотинамидадениндинуклеотид) и ФАД (флавинадениндинуклеотид), вызванным лекарственными средствами, в процессе образования энергии при бета-окислении.
(vi) вызванное токсичными метаболитами повреждение желчного протока.
(vii) активация типов клеток печени, подобных клеткам Бровича-Купфера, и вследствие того рецепторов, подобных Toll-подобному рецептору 4 (TLR4) и CD14, в течение раннего повреждения печени, вызванного этанолом, приводя к интернализации липополисахаридной фракции клеточных стенок грамм-отрицательных бактерий, которые населяют кишку в среде, богатой спиртом. Затем это приводит к активации провоспалительных цитокинов, подобных TNF-α, и супероксидов, которые поступают в звездчатые клетки, приводя к синтезу коллагена, фиброзу и, в конечном счете, циррозу печени.
Гепатозащита в качестве постоянно действующих терапевтических (как предупредительных, так и профилактических) средств, таким образом, приобретает огромное значение при патологических состояниях, когда происходит взаимодействие одного или более чем одного упомянутого выше механизма при причинении повреждения печени. Такие патологические состояния включают:
(i) неалкогольный стеатогепатит (НАСГ), который представляет собой накопление жира в печени с ее последующим воспалением. Хотя он напоминает заболевание печени, вызванное алкоголем, он встречается у людей, которые не являются алкоголиками или которые употребляют очень мало алкоголя. НАСГ является загадочным в том смысле, что он может регрессировать сам по себе или ухудшаться в замедленном темпе, приводя к фиброзу и впоследствии угрожающему жизни циррозу. Дополнительно, не существует специфических видов терапии для этого заболевания, за исключением способов управления образом жизни.
(ii) алкогольная зависимость, являющаяся следствием запойного или продолжительного употребления;
(iii) хемотерапия для лечения рака;
(iv) патологические состояния, такие как неалкогольная жировая болезнь печени, где в печени происходит отложение жира без признаков и симптомов воспаления или повреждения печени;
(v) вирусный, острый или хронический гепатит, где последние патологическое состояние может приводить к фиброзу и угрожающему жизни циррозу/раку печени.
Гарцинол, выделенный из кожицы плода Garcinia sp., известен из уровня техники как антиоксидант и хемозащитный агент (Tanaka, Т. et. al. Prevention of colonic aberrant crypt foci by dietary feeding of garcinol in male F3444 rats. Carcinogenesis, June 2000: 21 (6): 1183-9).
Гарцинол и изогарцинол оценивали с точки зрения их антибактериальной активности против метициллин-устойчивого Staphylococcus aureus (Linuma М et al, Antibacterial activity of some Garcinia benzophenone derivatives against methicillin-resistant Staphylococcus aureus. Biol Pharm Bull 1996 February; 19(2): 311-4).
О роли гарцинола как потенциального ингибитора гистонацетилтрансфераз (HAT) как in vitro, так и in vivo сообщалось Tapas с соавт. в 2004 ("Polyisoprenylated Benzophenone, Garcinol, a Natural Histone Acetyl transferase Inhibitor, Represses Chromatin Transcription and Alters Global GeneExpression", The Journal of Biological Chemistry, Vol.279, No.32, Issue of August 6, pp.33716-33726, 2004).
В настоящем изобретении к медицинскому потенциалу гарцинола в описании дополнительно добавляют гепатозащитное действие молекулы посредством регулирования одного или более чем одного патофизиологического действия, освещенного выше в данном документе. Конкретно, в настоящем изобретении старались изучить воздействия гарцинола на изменение биохимических маркеров, связанных с гепатотоксичностью.
Краткое описание изобретения
В настоящем изобретении раскрыт потенциал гарцинола в качестве гепатопротектора. Показали защиту культур клеток Нер-2 в присутствии эффективных концентраций гарцинола. Также показано опосредованное гарцинолом изменение биохимических маркеров у экспериментальных животных при гепатотоксичности, вызванной токсином CCl4, лекарственным средством парацетомол и алкоголем.
Краткое описание графических материалов
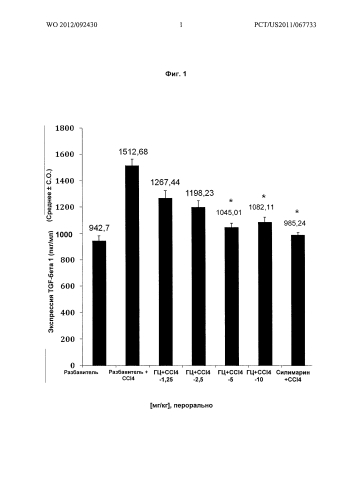
На Фиг.1 показано графическое представление воздействия различных доз гарцинола на экспрессию TGF-бета 1 (Transforming Growth Factor - трансформирующий фактор роста) (пкг/мл) в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4). Значения выражены как среднее ± С.О. (стандартная ошибка), n=6; значение Р*: <0,001.
На Фиг.2 показано графическое представление воздействия различных доз гарцинола на экспрессию (пкг/мл) молекулы межклеточной адгезии 1 (ICAM-1 или CD52) в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,001.
На Фиг.3 показано графическое представление воздействия различных доз гарцинола на экспрессию (мг/мл) С-реактивного белка в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,001.
На Фиг.4 показано графическое представление (проточно-цитометрические анализы) воздействия различных доз гарцинола на уровень фактора некроза опухолей-α (TNF-α) в крови, взятой из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4).
На Фиг.5 показано графическое представление (проточно-цитометрические анализы) воздействия различных доз гарцинола на уровень интерлейкина-2 (IL-2) в крови, взятой из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4).
На Фиг.6 показано графическое представление воздействия различных доз гарцинола на уровень интерлейкина-4 (IL-4) в крови, взятой из экспериментальных животных при гепатотоксичности, вызванной токсином (CCl4).
На Фиг.7 показано графическое представление воздействия различных доз гарцинола на экспрессию TGF-бета 1 (пкг/мл) в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной лекарственным средством (парацетамолом). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,01., **: <0.001., ГЦ : Гарцинол; АРАР : Парацетамол.
На Фиг.8 показано графическое представление воздействия различных доз гарцинола на экспрессию молекулы межклеточной адгезии 1 (ICAM-1 или CD52) (пкг/мл) в гомогенатах печени из экспериментальных животных при гепатотоксичности, вызванной лекарственным средством (парацетамол). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,01., **: <0.001., ГЦ : Гарцинол; АРАР : Парацетамол.
На Фиг.9 показано графическое представление (проточно-цитометрические анализы) воздействия различных доз гарцинола на уровень фактора некроза опухолей α (TNF-α) в крови, взятой из экспериментальных животных при гепатотоксичности, вызванной лекарственным средством (парацетамол).
На Фиг.10 показано графическое представление воздействия различных доз гарцинола на уровень фактора некроза опухолей α (TNF-α) и интерлейкина-1β (IL-1β) в сыворотке экспериментальных животных при гепатотоксичности, вызванной алкоголем (этиловый спирт). Значения выражены как среднее ± C.O., n=6; значение Р*: <0,01., **: <0,001., ГЦ : гарцинол.
На Фиг.11 показано графическое представление воздействия различных доз гарцинола на уровень интерлейкина-12 (IL-12) в сыворотке экспериментальных животных при гепатотоксичности, вызванной алкоголем (этиловый спирт).
На Фиг.12 показано графическое представление цитотоксического потенциала (% цитотоксичности) гарцинола в линии раковых клеток печени Hep G2 по сравнению с силимарином, известным гепатопротекторным агентом.
На Фиг.13 показано графическое представление гепатозащитного действия гарцинола по сравнению с известным гепатозащитным агентом силимарином в линии раковых клеток печени Hep G2.
Подробное описание (Фиг.1-13) - предпочтительное воплощение
В наиболее предпочтительном воплощении настоящее изобретение относится к способу защиты гепатоцитов млекопитающих, причем указанный способ включает стадию приведения в контакт гепатоцитов млекопитающих с эффективной концентрацией гарцинола. Конкретнее, эффективная концентрация гарцинола составляет от примерно 0,78 мкг/мл до примерно 6,25 мкг/мл (Фиг.12 и 13). В другом наиболее предпочтительном воплощении настоящее изобретение относится к способу гепатозащиты, причем указанный способ включает стадию введения терапевтически эффективного количества гарцинола нуждающемуся в этом объекту. Конкретнее, данным объектом является млекопитающее.
В другом предпочтительном воплощении настоящее изобретение относится к способу снижения повышенных уровней экспрессии цитокинов в моделях повреждения печени (гепатотоксичности) у млекопитающих, причем указанный способ включает стадию введения эффективного количества гарцинола указанным модельным объектам (Фиг.1, 4, 5, 6, 7, 9, 10 и 11). В конкретных воплощениях цитокины представляют собой трансформирующий фактор роста G-β1 (TGF-β1), фактор некроза опухоли α, интерлейкин-2 (IL-2), интерлейкин-4 (IL-4) и интерлейкин-12 (IL-12). В дополнительном, конкретном воплощении гепатотоксичность у модельных млекопитающих можно вызывать токсином, лекарственным средством или этиловым спиртом. В другом конкретном воплощении повреждение печени вызывают сочетаниями токсина, лекарственного средства и этилового спирта.
В еще другом предпочтительном воплощении настоящее изобретение относится к способу снижения повышенных уровней экспрессии адгезивной молекулы в моделях повреждения печени (гепатотоксичности) у млекопитающих, вызываемом токсинами и/или лекарственными средствами, причем указанный способ включает стадию введения эффективного количества гарцинола указанным модельным млекопитающим (Фиг.2 и 8). В конкретном воплощении адгезивная молекула представляет собой молекулу межклеточной адгезии 1 (ICAM-1 или CD52).
В еще одном предпочтительном воплощении настоящее изобретение относится к способу снижения повышенных уровней ферментов печени и/или желчных пигментов в моделях повреждения печени (гепатотоксичности) у млекопитающих, причем указанный способ включает стадию введения эффективного количества гарцинола указанным модельным объектам. В конкретных воплощениях ферменты печени представляют собой аланинтрансаминазу, аспартатаминотрансферазу и щелочную фосфатазу (Таблицы 3, 4 и 5). В другом конкретном воплощении желчный пигмент представляет собой билирубин. В дополнительном, конкретном воплощении повреждение печени у модельных млекопитающих может быть вызвано токсином, лекарственным средством или этиловым спиртом. В другом конкретном воплощении повреждение печени вызывают сочетаниями токсина, лекарственного средства и этилового спирта.
Потенциальное терапевтическое значение гарцинола как гепатопротектора можно понять посредством примеров, освещенных ниже в данном документе.
Пример 1
Острая пероральная безопасность гарцинола: смертности не наблюдали вплоть до 2000 мг/кг. Пероральный прием внутрь у мышей вплоть до двух недель наблюдения. Изучаемые параметры и записанные наблюдения включены в Таблицу 1. (OECD Guidelines for Testing of Chemicals. Guideline 423, Acute Oral Toxicity - Acute Toxic Class Method, Adopted, (1996). Organization for Economic Cooperation and Development).
| Таблица 1 | |
| Изучаемые параметры по острой пероральной безопасности гарцинола | |
| Общее поведение | Кожа |
| Агрессивность: отсутствует | Побледнение: отсутствует |
| Чувство страха: отсутствует | Гиперемия: отсутствует |
| Пассивность: отсутствует | Цианоз: отсутствует |
| Общее движение: нормальное | |
| Общая локомоторная активность: | |
| нормальная | |
| Центральная нервная система | Общие наблюдения |
| Возбуждение: отсутствует | Мышечная слабость: отсутствует |
| Двигательная активность: нормальная | Слюноотделение: нормальное |
| Тремор: отсутствует | пилоэрекция: отсутствует |
| Клонические судороги: отсутствуют | Диарея: отсутствует |
| Дыхательная система | Рефлексы |
| Частота дыхания: нормальная | Корнеальный: никакого действия |
| Глубина дыхания: нормальная | Пиннальный: никакого действия |
| Автономная нервная система | Пища и вода (прием/выделение) |
| Двигательная активность: нормальная | Масса выделенного кала: нормальная |
| Атаксия: отсутствует | Диурез: нормальный |
| Частота дыхания: нормальная | |
| Диарея: отсутствует |
Пример 2
Воздействие различных доз гарцинола (ГЦ) на экспрессии TGF-β1, ICAM-1 и CRP (C-reactive protein - С-реактивный белок) в гомогенатах печени у крыс при повреждении печени, вызванном четыреххлористым углеродом.
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: Силимарин (50 мг/кг), перорально
Способ: повреждение печени вызывали введением четыреххлористого углерода (CCl4), смешанного с жидким парафином (5-кратное разведение). Животным давали разовую дозу CCl4 1 мл/кг, перорально с последующим введением гарцинола с разными временными интервалами (Таблица 2). [(i) Bramanti G, Murmann W, Pierini P and Comporti M (1978). Effect of cicloxilic acid on CCl4 - induced liver injury. Drug Research 28: 1112-1217. (ii) В Singh, A K Saxena, B K Chandan, K K Anand (1998). Hepatoprotective activity of Verbenalin on experimental liver damage in rodents. Fitoterapia LXIX 2: 135-140. (iii) B.K. Chandan, A.K. Sharma, K.K. Anand Boerhaavia diffusa: A study of its hepatoprotective activity. Journal of Ethnopharmacology Volume 31, Issue 3, March 1991, Pages 299-307].
| Таблица 2 | |||
| Подробности дневного плана-графика и расписания введения CCl4 и гарцинола | |||
| Дневной план-график и расписание введения токсина/лекарственного средства (ГЦ) | Обработка | Время, прошедшее с момента введения токсина | |
| День 1 | 10 до полудня | CCl4 | 0 ч |
| 4 после полудня | ГЦ | 6 ч после CCl4 | |
| День 2 | 10 до полудня | ГЦ | 24 ч после CCl4 |
| День 3 | 10 до полудня | ГЦ | 48 ч после CCl4 |
| 12 дня | Отбор образцов (печень и кровь) | 50 ч после CCl4 / 2 ч после последней обработки исследуемым веществом (ГЦ) |
Ткань печени гомогенизировали на льду с помощью политрона, и гомогенат центрифугировали при 5000 g в течение 15 мин. Аликвоты надосадочной жидкости отделяли и применяли для биохимического анализа. Надосадочные жидкости хранили при -80°С до анализа цитокинов. TGFβ, ICAM-1, С-реактивный белок (CRP) оценивали, используя коммерчески доступные наборы на основе методики ELISA (enzyme-linked immunosorbent assay-иммуноферментный анализ) "сэндвич"-типа и конкурентного ELISA согласно инструкциям производителей. Все измерения концентраций цитокинов проводили с помощью колориметрического измерения при 450 нм на ELISA сканирующем спектрофотометре для прочтения планшетов путем интерполяции по стандартной кривой, [(i) Magari K, Miyata S, Ohkubo Y, Mutoh S, (2004). Inflammatory cytokine levels in paw tissues during development of rat collagen-induced arthritis: Effect of FK506, an inhibitor of T cell activation. Inflammation Research. 53: 469-474 (Magari et al., 2004); and (ii) Modulation of Th1/Th2 cytokines and inflammatory mediators by hydroxychavicol in adjuvant induced arthritic tissues. Anjali Pandey, Sarang Bani, Prabhu Dutt, Krishna Avtar Suri. Cytokine 49 (2010) 114-121].
Результаты: гарцинол подавлял повышенные уровни TGFβ (Фиг.1) ICAM-1 (Фиг.2), С-реактивного белка (CRP) (Фиг.3), связанные с острым гепатитом, являющимся результатом повреждения печени у крыс, вызванного четыреххлористым углеродом.
Пример 3
Воздействие различных доз гарцинола (ГЦ) на TNF-α, IL-2 и IL-4 в крови у крыс при повреждении печени, вызванном четыреххлористым углеродом
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: Силимарин (50 мг/кг), перорально
Способ: повреждение печени вызывали введением четыреххлористого углерода (CCl4), смешанного с жидким парафином (5-кратное разведение). Животным давали разовую дозу CCl4 1 мл/кг, перорально с последующим введением гарцинола (см. вышеуказанную Таблицу 2). [(i) Bramanti G, Murmann W, Pierini P and Comporti M (1978). Effect of cicloxilic acid on CCl4 - induced liver injury. Drug Research 28: 1112-1217. (ii) В Singh, А K Saxena, В K Chandan, K K Anand (1998). Hepatoprotective activity of Verbenalin on experimental liver damage in rodents. Fitoterapia LXIX 2: 135-140. (iii) B.K. Chandan, A.K. Sharma, K.K. Anand Boerhaavia diffusa: A study of its hepatoprotective activity. Journal of Ethnopharmacology, Volume 31, Issue 3, March 1991, Pages 299-307].
Животным пускали кровь ретроорбитально, и кровь собирали в покрытые EDTA (Ethylenediaminetetraacetic acid - этилендиаминтетрауксусная кислота) пробирки для оценки экспрессии меченных РЕ (phycoerythrin - фикоэритрином) моноклональных антител против TNF-альфа, IL-2 и IL-4 крысы. Анализ выполняли на проточном цитометре (BD-FACS CANTO II). Эти меченные флуоресцирующие моноклональные антитела добавляли непосредственно к 100 мкл цельной крови, которую затем лизировали, используя лизирующий реагент для цельной крови. После последнего центрифугирования образцы ресуспендировали в забуференном фосфатом физиологическом растворе (рН, 7,4) и анализировали непосредственно на проточном цитометре. Возбудитель флуоресценции устанавливали по параметру РЕ (FL2) для сбора данных, [(i) Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Gupta BD, Satti NK, Qazi GN, (2006). Suppression of T lymphocyte activity by lupeol isolated from Crataeva religiosa. Phytotherapy Research; 20(4): 279-287. And (ii) Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Satti NK, (2005). Immunosuppressive properties of an ethyl acetate fraction from Euphorbia royleana. Journal of Ethnopharmacology; 99: 185-192].
Результаты: гарцинол (ГЦ) вызывал зависимое от дозы подавление Т-клеточного иммунного ответа, о котором судили по подавлению TNF-α (Фиг.4), IL-2 (Фиг.5) и IL-4 (Фиг.6), экспрессирующихся в крови у крыс при повреждении печени, вызванном четыреххлористым углеродом.
Пример 4
Воздействие различных доз гарцинола (ГЦ) на билирубин и сывороточные ферменты аланинтрансаминазу (АЛТ), аспартатаминотрансферазу (ACT) и щелочную фосфатазу (ЩФ) у крыс при повреждении печени, вызванном четыреххлористым углеродом
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: Силимарин (50 мг/кг), перорально
Способ: повреждение печени вызывали введением четыреххлористого углерода (CCl4), смешанного с жидким парафином (5-кратное разведение). Животным давали разовую дозу CCl4 1 мл/кг, перорально с последующим введением гарцинола (Таблица 2). [(i) Bramanti G, Murmann W, Pierini P and Comporti M (1978). Effect of cicloxilic acid on CCl4 - induced liver injury. Drug Research 28: 1112-1217. (ii) В Singh, А K Saxena, В K Chandan, K K Anand (1998). Hepatoprotective activity of Verbenalin on experimental liver damage in rodents. Fitoterapia LXIX 2: 135-140. (iii) B.K. Chandan, A.K. Sharma, K.K. Anand Boerhaavia diffusa: A study of its hepatoprotective activity. Journal of Ethnopharmacology, Volume 31, Issue 3, March 1991, Pages 299-307].
Кровь собирали из ретроорбитального сплетения экспериментальных животных и не добавляли антикоагулянт. Кровь должна была стоять при комнатной температуре в течение 1 часа. Затем ее центрифугировали, и осветленную сыворотку отделяли. Сыворотку затем хранили для анализа. Ссылка: (Magari et al., 2004).
Биохимия сыворотки I (аспартатаминотрансфераза и аланинаминотрансфераза), Ссылка: Ritman S, Frankel S, (1957). A colorimeteric method for the determination of serum glutamic oxaloacetic and glutamic pyruvic transaminases. American Journal of Clinical Pathology; 28: 56-63.
Способ: 0,2 мл сыворотки, собранные из опытных и контрольных образцов, смешивали с 1,0 мл буферного раствора и инкубировали в течение 60 мин при 37°С на водяной бане. После добавления 1,0 мл раствора хромогена образцы держали при комнатной температуре в течение 20 минут для того, чтобы реакция протекала, и добавляли 10 мл NaOH. Данные по оптической плотности считывали при 546 нм после 5 мин. Для холостого опыта сыворотку добавляли после добавления раствора хромогена.
Биохимия сыворотки II (щелочная фосфатаза), ссылка: Klaus Walter and Schutt С. (1974). Acid and alkaline phosphatase in serum. In: Methods of Enzymatic Analysis. Eds. Hans Ulrich Bergmeyer, Verlag ChemieWeinheim. Academic press, Inc. New York, 2nd Edition, Vol.2, pp.855-64.
Способ: измерение активности щелочной фосфатазы основано на способности фермента гидролизовать п-нитрофенолфосфат в щелочных условиях. Продукт расщепления п-нитрофенол является желтым в щелочном растворе, и его оценивают при 400-420 нм (Klaus and Schutt, 1974). 2,0 мл забуференного субстрата отбирали в пробирки "Опыт", "Контроль" и "Холостая проба" с последующим добавлением сыворотки и дистиллированной воды (0,1 мл) в пробирки "Опыт" и "Холостая проба", соответственно, и инкубировали на водяной бане в течение 30 минут при 25°С. После инкубирования во все пробирки добавляли гидроксид натрия (0,25 н., 2 мл) с последующим добавлением сыворотки (0,1 мл) в пробирки, обозначенные как "Контроль". Развившуюся желтую окраску оценивали спектрофотометрически против холостой пробы при 410 нм.
Биохимия сыворотки III [билирубин (BRBN)], Ссылка: Malloy Н Т and Evelyn K А (1937). The determination of bilirubin with photoelectric colorimeter. Journal of Biological Chemistry 119: 481-490.
Способ: сывороточный билирубин оценивали способом Malloy и Evelyn (1937). В две партии исследуемых пробирок, обозначенных как "Опыт" и "Контроль", добавляли сыворотку (0,2 мл) и дистиллированную воду (1,8 мл). В пробирки, обозначенные как "Опыт" и "Стандарт", добавляли диазореагент (0,5 мл). В исследуемые пробирки, обозначенные как "Контроль" и "Холостая проба", добавляли диазо-холостую пробу (0,5 мл). В конце в каждую исследуемую пробирку добавляли метанол (2,5 мл). Пробирки перемешивали, и им давали постоять в течение 30 минут в темноте. Пробирки анализировали после 10 минут при 540 нм.
Результаты: гарцинол снижал повышенные уровни билирубина и сывороточных ферментов аланинтрансаминазы (АЛТ), аспартатаминотрансферазы (ACT) и щелочной фосфатазы (ЩФ) у крыс при повреждении печени, вызванном четыреххлористым углеродом (Таблица 3).
Пример 5
Воздействие различных доз гарцинола (ГЦ) на экспрессию TGF-бета 1 и ICAM-1 в гомогенатах печени у крыс при повреждении печени, вызванном Парацетамолом.
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
| Таблица 3 | ||||||
| Воздействие гарцинола на билирубин, АЛТ, ACT и ЩФ у крыс при повреждении печени, вызванном четыреххлористым углеродом | ||||||
| Параметры сыворотки | ||||||
| Обработки | Доза (мг/кг) | АЛТ мкмоль/мин/л | ACT мкмоль/мин/л | ЩФ мкмоль/мин/л | Билирубин, мг % | Средняя защита, % |
| Разбавитель | - | 110,30±13,70 | 107,70±14,00 | 30,90±0,72 | 0,40±0,05 | - |
| Разбавитель + CCl4 | - | 1460,03±78,30 | 878,10±41,52 | 87,99±3,35 | 1,17±0,07 | - |
| ГЦ + CCl4 | 1,25 | 1272,50±109,19 (12,84) | 746,81±36,93 (14,95) | 78,49±6,58 (10,79) | 1,03±0,04 (11,96) | 12,63 |
| ГЦ + CCl4 | 2,50 | 1027,07±68,26* (29,65) | 646,90±50,53* (26,32) | 70,32±3,89* (20,08) | 0,89±0,05** (23,93) | 24,99 |
| ГЦ + CCl4 | 5,00 | 828,59±46,56** (43,24) | 500,66±49,22** (42,98) | 59,19±4,45** (32,73) | 0,78±0,04** (33,33) | 38,07 |
| ГЦ + CCl4 | 10,00 | 891,36±45,72** (38,94) | 522,43±57,50** (40,50) | 59,70±3,69** (32,15) | 0,75±0,04** (35,89) | 36,87 |
| Силимарин + CCl4 | 50 | 744,76±40,16** (48,99) | 460,76±25,60** (47,52) | 49,84±2,80** (43,35) | 0,64±0,04** (48,71) | 47,14 |
| (Значения как Среднее ± C.O., n=6); относительное изменение величин, стоящих в круглых скобках; Р значение *: <0,01; **: <0,001.(АЛТ) Аланинтрансаминаза; (ACT) Аспартатаминотрансфераза; (ЩФ) щелочная фосфатаза. |
Способ: Экспериментальные животные перорально получали парацетамол (400 мг/кг массы тела) в течение семи дней. Животные из группы, обрабатываемой лекарственным средством, получали 400 мг/кг массы тела парацетамола, растворенного в воде, перорально вместе с возрастающими дозами исследуемого лекарственного средства Гарцинол в течение семи дней. Стандартная группа животных получала 50 мг/кг массы тела стандартизированного лекарственного средства силимарин и 400 мг/кг массы тела парацетамола в течение семи дней и служила в качестве стандартного контроля [N. Kanchana and A. Mohamed Sadiq, Hepatoprotective effect of Plumbago zeylanica on paracetamol induced liver toxicity in rats, Int J Pharm Pharm Sci, Vol 3, Issuel, 151-154 (2011)].
Ткань печени экспериментальных животных гомогенизировали на льду политроном, и гомогенат центрифугировали при 5000 g в течение 15 минут. Аликвоты надосадочной жидкости отделяли и применяли для биохимического анализа. Надосадочные жидкости хранили при -80°С до анализа цитокинов. TGFβ и ICAM-1 оценивали с применением коммерчески доступных наборов на основе методики ELISA "сэндвич"-типа и конкурентного ELISA согласно инструкциям производителей. Все измерения концентраций цитокинов проводили с помощью колориметрического измерения при 450 нм на ELISA сканирующем спектрофотометре для прочтения планшетов путем интерполяции по стандартной кривой [(i) Magari K, Miyata S, Ohkubo Y, Mutoh S, (2004). Inflammatory cytokine levels in paw tissues during development of rat collagen-induced arthritis: Effect of FK506, an inhibitor of T cell activation. Inflammation Research. 53: 469-474 (Magari et al., 2004); and (ii) Modulation of Th1/Th2 cytokines and inflammatory mediators by hydroxychavicol in adjuvant induced arthritic tissues. Anjali Pandey, Sarang Bani, Prabhu Dutt, Krishna Avtar Suri. Cytokine 49 (2010) 114-121].
Результаты: гарцинол приводил к зависимому от дозы подавлению повышенных уровней экспрессии TGF-бета и ICAM-1 в печени, связанных с вызванным парацетамолом острым гепатитом (Фиг.7 и Фиг.8).
Пример 6
Воздействие различных доз гарцинола (ГЦ) на сывороточные ферменты аланинтрансаминазу (АЛТ), аспартатаминотрансферазу (ACT) и щелочную фосфатазу (ЩФ) у крыс при повреждении печени, вызванном парацетамолом (ацетил-пара-аминофенолом-АРАР)
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм. Дозы гарцинола (ГЦ), используемые для исследования: 1, 25, 2,5, 5, 10 мг/кг, перорально. Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
Способ: Экспериментальные животные перорально получали парацетамол (400 мг/кг массы тела) в течение семи дней. Животные из группы, обрабатываемой лекарственным средством, получали 400 мг/кг массы тела парацетамола, растворенного в воде, перорально вместе с возрастающими дозами исследуемого лекарственного средства Гарцинол в течение семи дней. Стандартная группа животных получала 50 мг/кг массы тела стандартизированного лекарственного средства силимарин и 400 мг/кг массы тела парацетамола в течение семи дней и служила в качестве стандартного контроля [N. Kanchana and A. Mohamed Sadiq, Hepatoprotective effect of Plumbago zeylanica on paracetamol induced liver toxicity in rats, Int J Pharm Pharm Sci, Vol 3, Issuel, 151-154 (2011)].
Кровь собирали из ретроорбитального сплетения экспериментальных животных и не добавляли антикоагулянт. Кровь должна была стоять при комнатной температуре в течение 1 часа. Затем ее центрифугировали и осветленную сыворотку отделяли. Сыворотку затем хранили для анализа. Ссылка: (Magari et al., 2004).
Биохимия сыворотки I (аспартатаминотрансфераза и аланинаминотрансфераза), ссылка: Ritman S, Frankel S, (1957). A colorimeteric method for the determination of serum glutamic oxaloacetic and glutamic pyruvic transaminases. American Journal of Clinical Pathology; 28: 56-63.
Способ: 0,2 мл сыворотки, собранные из опытных и контрольных образцов, смешивали с 1,0 мл буферного раствора и инкубировали в течение 60 мин при 37°С на водяной бане. После добавления 1,0 мл раствора хромогена образцы держали при комнатной температуре в течение 20 минут для того, чтобы реакция протекала, и добавляли 10 мл NaOH. Данные по оптической плотности считывали при 546 нм после 5 мин. Для холостого опыта сыворотку добавляли после добавления раствора хромогена.
Биохимия сыворотки II (щелочная фосфатаза), ссылка: Klaus Walter and Schutt С. (1974). Acid and alkaline phosphatase in serum. In: Methods of Enzymatic Analysis. Eds. Hans Ulrich Bergmeyer, Verlag ChemieWeinheim, Academic press, Inc. New York, 2nd Edition, Vol.2, pp.855-64.
Способ: измерение активности щелочной фосфатазы основано на способности фермента гидролизовать п-нитрофенолфосфат в щелочных условиях. Продукт расщепления п-нитрофенол является желтым в щелочном растворе, и его оценивают при 400-420 нм (Klaus and Schutt, 1974). 2,0 мл забуференного субстрата отбирали в пробирки "Опыт", "Контроль" и "Холостая проба" с последующим добавлением сыворотки и дистиллированной воды (0,1 мл) в пробирки "Опыт" и "Холостая проба" соответственно и инкубировали на водяной бане в течение 30 минут при 25°С. После инкубирования во все пробирки добавляли гидроксид натрия (0,25 н., 2 мл) с последующим добавлением сыворотки (0,1 мл) в пробирки, обозначенные как "Контроль". Развившуюся желтую окраску оценивали спектрофотометрически против холостой пробы при 410 нм.
Биохимия сыворотки III [билирубин (BRBN)], Ссылка: Malloy Н Т and Evelyn K А (1937). The determination of bilirubin with photoelectric colorimeter. Journal of Biological Chemistry 119: 481-490.
Способ: Сывороточный билирубин оценивали способом Malloy и Evelyn (1937). В две партии исследуемых пробирок, обозначенных как "Опыт" и "Контроль", добавляли сыворотку (0,2 мл) и дистиллированную воду (1,8 мл). В пробирки, обозначенные как "Опыт" и "Стандарт", добавляли диазореагент (0,5 мл). В исследуемые пробирки, обозначенные как "Контроль" и "Холостая проба", добавляли диазо-холостую пробу (0,5 мл). В конце в каждую исследуемую пробирку добавляли метанол (2,5 мл). Пробирки перемешивали, и им давали постоять в течение 30 минут в темноте. Пробирки анализировали после 10 минут при 540 нм.
Результаты: гарцинол снижал повышенные уровни билирубина и сывороточных ферментов аланинтрансаминазы (АЛТ), аспартатаминотрансферазы (ACT) и щелочной фосфатазы (ЩФ) у крыс при повреждении печени, вызванном парацетамолом (Таблица 4).
| Таблица 4 | |||||
| Воздействие гарцинола на билирубин, АЛТ, ACT и ЩФ у крыс при повреждении печени, вызванном парацетамолом | |||||
| Параметры сыворотки | |||||
| Обработки | Доза (мг/кг) | АЛТ (мкмоль мин/л) | АСТ (мкмоль мин/л) | ALP (мкмоль мин/л) | Средняя защита, % |
| Разбавитель | - | 98,32±5,20 | 117,49±8,26 | 21,42±2,04 | - |
| Разбавитель + АРАР | - | 1102,10±46,98 | 839,79±59,17 | 40,54±3,61 | - |
| ГЦ + АРАР | 1,25 | 862,97±53,38 (21,69) | 761,61±43,96 (9,30) | 37,21±3,44 (8,21) | 13,06 |
| ГЦ + АРАР | 2,50 | 808,64±38,55* (26,62) | 650,88±35,84* (22,49) | 34,28±1,98 (15,44) | 21,51 |
| ГЦ + АРАР | 5,00 | 661,67±51,40** (39,96) | 463,41±38,56** (44,81) | 30,74±2,05** (24,17) | 36,31 |
| ГЦ + АРАР | 10,00 | 590,22±50,98** (46,44) | 536,39±44,13** (36,12) | 33,60±1,93* (17,11) | 33,22 |
| Силимарин + АРАР | 50 | 377,04±14,44** (65,78) | 379,64±23,22** (54,79) | 26,90±2,24** (33,64) | 51,40 |
| (Значение как Среднее ± CO., n=6); относительное изменение величин, стоящих в круглых скобках; Р значение *: <0,01; **: <0,001.(АЛТ) Аланинтрансаминаза; (ACT) Аспартатаминотрансфераза; (ЩФ) Щелочная Фосфатаза |
Пример 7
Воздействие различных доз гарцинола (ГЦ) на TNF-α а крови у крыс при повреждении печени, вызванном парацетамолом.
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
Способ: Экспериментальные животные перорально получали парацетамол (400 мг/кг массы тела) в течение семи дней. Животные из группы, обрабатываемой лекарственным средством, получали 400 мг/кг массы тела парацетамола, растворенного в воде, перорально вместе с возрастающими дозами исследуемого лекарственного средства Гарцинол в течение семи дней. Стандартная группа животных получала 50 мг/кг массы тела стандартизированного лекарственного средства силимарин и 400 мг/кг массы тела парацетамола в течение семи дней и служила в качестве стандартного контроля [N. Kanchana and A. Mohamed Sadiq, Hepatoprotective effect of Plumbago zeylanica on paracetamol induced liver toxicity in rats, Int J Pharm Pharm Sci, Vol 3, Issuel, 151-154 (2011)].
Животным пускали кровь ретроорбитально, и кровь собирали в покрытые EDTA пробирки для оценки экспрессии меченных РЕ моноклональных антител против TNF-альфа крысы. Анализ проводили на проточном цитометре (BD-FACS CANTO II). Эти меченные флуоресцирующие моноклональные антитела добавляли непосредственно к 100 мкл цельной крови, которую затем лизировали, используя лизирующий реагент для цельной крови. После последнего центрифугирования образцы ресуспендировали в забуференном фосфатом физиологическом растворе (рН, 7,4) и анализировали непосредственно на проточном цитометре. Возбудитель флуоресценции устанавливали по параметру РЕ (FL2) для сбора данных, [(i) Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Gupta BD, Satti NK, Qazi GN, (2006). Suppression of T lymphocyte activity by lupeol isolated from Crataeva religiosa. Phytotherapy Research; 20(4): 279-287. And (ii) Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Satti NK, (2005). Immunosuppressive properties of an ethyl acetate fraction from Euphorbia royleana. Journal of Ethnopharmacology; 99: 185-192].
Результаты: на Фиг.9 показано, что гарцинол вызывает зависимое от дозы снижение повышенных уровней TNF-α в печени, встречающихся при остром гепатите, обусловленном повреждением печени, вызванным лекарственным средством (парацетамолом).
Пример 8
Воздействие различных доз гарцинола (ГЦ) на фактор некроза опухолей-α (TNF-α), интерлейкин-1β (IL-1β) и IL-12 в сыворотке экспериментальных животных с вызванной алкоголем (этиловым спиртом-EtOH) гепатотоксичностью.
Животные, используемые в эксперименте: крысы-самцы Wistar
Масса животных: 140-160 грамм
Дозы гарцинола (ГЦ), используемые для исследования: 1,25, 2,5, 5, 10 мг/кг, перорально
Стандартизованное лекарственное средство: силимарин (50 мг/кг), перорально
Способ: крысам-самцам Wistar, с массой 180-200 г, перорально давали 0,5-0,6 мл этанола. Начальная доза этанола составляла 6 г/кг/сутки (растворы, максимально содержащие 56% спирта), и дозу постепенно увеличивали в течение недели 1 до поддерживающейся дозы 8 г/кг/сутки, что продолжалось в течение еще 5 недель. Все крысы имели регулярный стандартный крысиный корм, доступный на всем протяжении 6-недельного периода. Крыс взвешивали три раза в неделю [Guangjin Yuan, Zuojiong Gong *, Xiaorong Zhou, Pin Zhang, Xiaomei Sun and Xi Li. Epigallocatechin-3-Gallate Ameliorates Alcohol-Induced Liver Injury in Rats. Int. J. Mol. Sci. 2006, 7, 204-219].
Кровь собирали из ретроорбитального сплетения экспериментальных животных, обработанных спиртом, и смешивали с EDTA для оценивания уровня цитокинов. Для сбора сыворотки в кровь не добавляли антикоагулянт, и ей нужно было стоять при комнатной температуре в течение 1 ч. Затем кровь центрифугировали, и осветленную сыворотку отделяли и хранили для анализа. Уровень TNF-α, IL-1β и IL-12 оценивали, используя коммерчески доступные наборы на основе методики ELISA "сэндвич"-типа и конкурентного ELISA согласно инструкциям производителей. Все измерения концентраций цитокинов проводили с помощью колориметрического измерения при 450 нм на ELISA сканирующем спектрофотометре для прочтения планшетов путем интерполяции по стандартной кривой.
Результат: гарцинол (ГЦ) снижал повышенные уровни TNF-альфа, интерлейкина-1 бета и интерлейкина-12 (Фиг.10 и Фиг.11), вызванные TLR-4 активацией клеток Купфера LPS (липополисахаридом) грамм-отрицательных бактерий в кишке, активация и избыточный рост которых обусловлен употреблением этилового спирта.
Пример 9
Воздействие