Фармацевтическая композиция, содержащая производные пиридона
Иллюстрации
Показать всеИзобретение относится к соединению производного пиридона, представленного формулой I или его фармацевтически приемлемой соли, R или S изомеру, где А представляет собой C1-С10-гетероарильную группу, которая является незамещенной или замещена одним или двумя заместителями, выбранными из группы, состоящей из галогеновой группы, С1-С6-алкильной группы, С3-С7-циклоалкильной группы, С6-С12-аралкильной группы, С1-С6-алкоксигруппы и С6-С12-арильной группы; В представляет собой О или NH; и C1-С10-гетероарильная группа выбрана из группы, состоящей из тиазолила, бензотиазолила, пиридила, изоксазолила, изохинолила, хинолила, бензотиадиазола, тиадиазола, пиразолила и пиразинила. Изобретение также относится к фармацевтической композиции для профилактики или лечения когнитивного нарушения, где композиция содержит соединение производного пиридона формулы I, его фармацевтически приемлемую соль, R или S изомер, в терапевтически эффективном количестве и фармацевтически приемлемый носитель. Технический результат - производное пиридона, в качестве агониста или частичного агониста α7-никотинового ацетилхолинового рецептора. 2 н. и 4 з.п. ф-лы, 2 табл., 48 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединению производного замещенного азабициклоалканом пиридона в качестве агониста или частичного агониста α7-никотинового ацетилхолинового рецептора (nAChR) и его фармацевтически приемлемой соли, изомеру, сольвату или гидрату.
Предшествующий уровень техники
Никотиновые ацетилхолиновые рецепторы (nAChR), которые относятся к семейству лиганд-зависимых ионных каналов, являются широко распространенными в центральной нервной системе (ЦНС) и периферической нервной системе (ПНС) и участвуют в ряде физиологических функций. Эти рецепторы служат в качестве важных факторов в регуляции физиологических функций ЦНС посредством регуляции высвобождения ряда нейромедиаторов, таких как ацетилхолин, норадреналин, дофамин, серотонин и гамма-аминомасляная кислота (ГАМК). Таким образом, наряду с регуляцией таких нейромедиаторов и системы передачи сигналов в клетках AChR можно использовать при лечении заболеваний, ассоциированных с нарушениями когнитивных функций, обучения и памяти, нейродегенеративным нарушением, болью и воспалением, психоневрозом и нарушением настроения, и компульсивным и аддиктивным поведениями, при подавлении и лечении воспаления или воспалительных заболеваний и при облегчении боли.
В ЦНС и ПНС представлены различные подтипы nAChR. Как правило, nAChR представляют собой ионные каналы, способные избирательно пропускать различные катионы, с пятью мономерами, окружающими центральную проводящую ионы пору ионного канала. У людей экспрессируются по меньшей мере 12 мономеров, α2-α10 и β2-β4, где эти мономеры образуют различные гомомерные или гетеромерные комплексы посредством комбинации друг с другом. Известно, что в ЦНС в основном экспрессируются гетеромерный α4β2 nAChR с высокой аффинностью связывания с никотином и гомомерный α7 nAChR с низкой аффинностью к никотину [Gotti C., Zoli M., Clementi F. (2006) Trends in Pharmacol. Sci. 27, 482-491].
α7-Никотиновые рецепторы, которые экспрессируются в коре головного мозга и гиппокампе, которые отвечают за когнитивные и сенсорные функции головного мозга, обнаружены в пресинаптических и постсинаптических терминалях, и, таким образом, предполагают, что они являются существенным фактором в синаптической передачи [Burghaus L., Schutz U., Krempel U., de Vos RAI, Jansen Steur ENH, Wevers A., Lindstrom J., Schroder H. (2000), Mol. Brain Res., 76, 385-388; Banerjee C., Nyengaard R.J., Wevers A., de Vos RAI, Jansen Steur ENH, Lindstrom J., Pilz K., Nowacki S., Bloch W., Schroder H. (2000), Neurobiol. Disease, 7, 666-672]. α7-Никотиновые рецепторы по своей природе являются высокопроницаемыми для ионов кальция, и, таким образом, предполагают, что они являются существенным фактором в различных кальций-зависимых системах передачи нервных импульсов [Oshikawa J., Toya Y., Fujita T., Egawa M., Kawabe J., Umemura S., Ishikawa Y. (2003) Am. J. Physiol. Cell Physiol., 285, 567-574; Marrero M.B., Bencherif M. (2009) Brain Res. 1256, 1-7; Ospina J.A., Broide R.S., Acevedo D., Robertson R.T., Leslie F.M. (1998) J. Neurochem., 70, 1061-1068].
Вследствие того, что никотиновые ацетилхолиновые рецепторы участвуют в регуляции различных церебральных функций, включая когнитивную функцию и внимание, предполагают, что вещества, которые способны непосредственно или опосредованно активировать такие никотиновые ацетилхолиновые рецепторы, в конечном итоге оказывают положительное действие при уменьшении нарушений когнитивных функций, таких как деменция альцгеймеровского типа, ассоциированные с шизофренией когнитивные нарушения и дефицит внимания, такой как синдром дефицита внимания с гиперактивностью (ADHD) [Levin E.D., McClemon F.J., Rezvani A.H. (2006) Psychopharmacology, 184, 523-539].
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Настоящее изобретение относится к соединению производного замещенного азабициклоалканом пиридона в качестве агониста или частичного агониста α7-никотинового ацетилхолинового рецептора (nAChR) и его фармацевтически приемлемой соли, изомеру, сольвату или гидрату.
Решение проблемы
Согласно аспектам настоящее изобретение относится к соединению производного пиридина, представленного ниже формулой I, и его фармацевтически приемлемой соли, изомеру, сольвату или гидрату, где в формуле I A представляет собой C1-C10-гетероарильную группу, замещаемую по меньшей мере одной, выбранной из группы, состоящей из галогеновой группы, C1-C6-алкильной группы, C3-C7-циклоалкильной группы, C6-C12-аралкильной группы, C1-C6-алкоксигруппы и C6-C12-арильной группы, и B представляет собой O или NH.
Формула I
В некоторых вариантах осуществления B может представлять собой NH.
Используемый в настоящем описании термин "гетероарильная группа" относится к системе по меньшей мере с одним ароматическим кольцом, которое содержит по меньшей мере один гетероатом, выбранный из атомов N, O и S, и оставшиеся атомы которого представляют собой углерод, а также подразумевают, что он включает конденсированное кольцо (бициклический гетероарил). В некоторых вариантах осуществления C1-C10-гетероарильную группу можно выбирать из группы, состоящей из тиазолила, бензотиазолила, пиридила, изоксазолила, изохинолила, хинолила, бензотиадиазола, тиадиазола, пиразолила и пиразинила.
В некоторых вариантах осуществления аралкильная группа и арильная группа могут быть замещенны другой галогеновой или алкильной группой.
В некоторых вариантах осуществления соединение производного пиридона формулы I может быть получено из любого известного соединения или любого легко получаемого из него соединения специалистом в данной области. Таким образом, следующие ниже описания, связанные со способами получения соединения производного пиридона, предоставлены только в иллюстративных целях и не предназначены для ограничения объема настоящего изобретения. Например, при необходимости можно изменять порядок единичных операций.
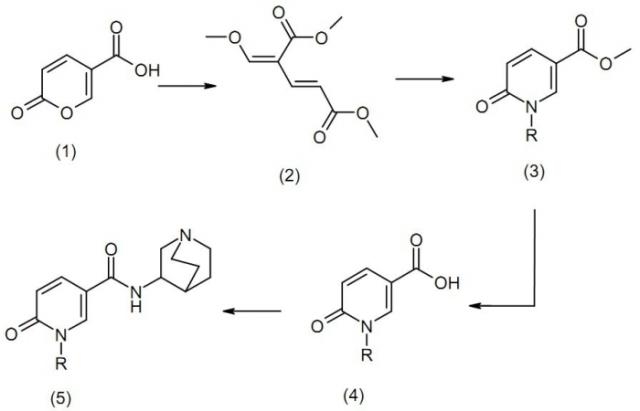
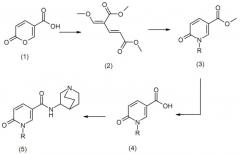
Схема 1
В проиллюстрированной выше схеме R может представлять собой гетероарильную группу. В способе общего синтеза, проиллюстрированного на проиллюстрированной выше схеме, после синтеза промежуточного соединения (2) из кумариловой кислоты (1) в качестве исходного вещества промежуточное соединение (2) может взаимодействовать с аминогетероарильным соединением (R-NH2) и диметилформамидом (ДМФА) при приблизительно 150°C с получением соединения (3) 6-пиридона, которое можно затем гидролизовать в 6-пиридон-3-карбоновую кислоту (4), а затем можно получать конечное соединение (5) путем введения хинуклидина.
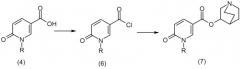
Схема 2
В проиллюстрированной выше схеме R может представлять собой гетероарильную группу. После синтеза 6-оксо-3-карбонилхлорида (6) из 6-пиридон-3-карбоновой кислоты (4) можно получать конечное соединение (7) путем введения хинуклидинола.
Примеры производного пиридина представляют собой соединения, представленные формулой I, их фармацевтически приемлемые соли, такие как аддитивные соли кислоты или основания, и любой стереохимический изомер, где эти соли не являются конкретно ограниченными и могут представлять собой любую соль, которая способна сохранять активность своего исходного соединения у индивидуума-мишени и не вызывает какого-либо нежелательного эффекта. Примерами таких солей являются неорганические и органические соли, такие как соли уксусной кислоты, азотной кислоты, аспарагиновой кислоты, сульфоновой кислоты, серной кислоты, малеиновой кислоты, глутаминовой кислоты, муравьиной кислоты, янтарной кислоты, фосфорной кислоты, фталевой кислоты, дубильной кислоты, винной кислоты, бромистоводородной кислоты, пропионовой кислоты, бензолсульфоновой кислоты, бензойной кислоты, стеариновой кислоты, крезиловой кислоты, молочной кислоты, биугольной кислоты, бисерной кислоты, бивинной кислоты, щавелевой кислоты, бутиловой кислоты, эдетат кальция, камсиловой кислоты, угольной кислоты, хлорбензойной кислоты, лимонной кислоты, эдетовой кислоты, толуолсульфоновой кислоты, эдисиловой кислоты, эсиловой кислоты, фумаровой кислоты, глюцептовой кислоты, памовой кислоты, глюконовой кислоты, глюколлиларсаниловой кислоты, метилнитрат, полигалактуроновой кислоты, гексиллизорциновой кислоты, малоновой кислоты, гидрабамовой кислоты, хлористоводородной кислоты, йодистоводородной кислоты, оксинафтойной кислоты, изэтионовой кислоты, лактобионовой кислоты, миндальной кислоты, эстоловой кислоты, муциновой кислоты, муконовой кислота, пара-нитрометансульфоновой кислоты, гексаминовой кислоты, пантотеновой кислоты, гидрофосфорной кислоты, дигидрофосфорной кислоты, салициловой кислоты, сульфаминовой кислоты, сульфаниловой кислоты, метансульфоновой кислоты и тиокловой кислоты. Примеры основной соли представляют собой аммонийную соль, соль щелочного или щелочноземельного металла, такого как литий, натрий, калий, магний или кальций, соль, содержащую органическое основание, такое как бензатин, N-метил-D-глюкамин или гидрабамин, и соль, содержащую аминокислоту, такую как аргинин или лизин. Эти соли можно переводить в свободную форму обработкой соответствующей кислотой или основанием. Термин "аддитивная соль" можно интерпретировать как включающий сольваты, получаемые из любых соединений формулы I и их солей. Примеры таких сольватов представляют собой гидраты и алкоголяты.
В некоторых вариантах осуществления стереохимические изомеры соединения производного пиридона могут представлять собой любые соединения, получаемые из соединений, представленных формулой I. Если не отмечено или указано иное, химическое название соединения включает смесь любых возможных стереохимически изомерных форм, которые может иметь соединение, где смесь может содержать любые диастереомеры и/или энантиомеры основной молекулярной структуры соединения. В частности, стереоцентр может находиться в R- или S-конфигурации, заместитель двухвалентного циклического (частично) насыщенного радикала может находиться в цис- или транс-конфигурации. Соединение с двойной связью может содержать E- или Z-стереохимию в двойной связи. Любой стереохимический изомер соединения формулы I или формулы II также входит в объем настоящего изобретения.
В некоторых вариантах осуществления соединение производного пиридина можно выбирать из группы, состоящей из N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-тиазолил)-3-пиридинкарбоксамида, N-[(3R)-1-азабицикло[2.2.2]октан-3-ил]-6-оксо-1-(2-тиазолил)-3-пиридинкарбоксамида, N-[(3S)-1-азабицикло[2.2.2]октан-3-ил]-6-оксо-1-(2-тиазолил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-пиридинил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(3-пиридинил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-хлор-2-пиридинил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(5-фенил-2-пиридин-1-ил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(3-изоксазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(3-фенил-5-изоксазолил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-метил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-[(3R)-1-азабицикло[2.2.2]октан-3-ил]-1-(5-метил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-[(3S)-1-азабицикло[2.2.2]октан-3-ил]-1-(5-метил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-этил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-[(3R)-1-азабицикло[2.2.2]октан-3-ил]-1-(5-этил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-[(3S)-1-азабицикло[2.2.2]октан-3-ил]-1-(5-этил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(5-пропил-2-тиазолил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(5-пропан-2-ил-2-тиазолил)-3-пиридинкарбоксамида, N-[(3R)-1-азабицикло[2.2.2]октан-3-ил]-6-оксо-1-(5-пропан-2-ил-2-тиазолил)-3-пиридинкарбоксамида, N-[(3S)-1-азабицикло[2.2.2]октан-3-ил]-6-оксо-1-(5-пропан-2-ил-2-тиазолил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-трет-бутил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-[(3R)-1-азабицикло[2.2.2]октан-3-ил)]-1-(5-трет-бутил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-[(3S)-1-азабицикло[2.2.2]октан-3-ил)]-1-(5-трет-бутил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-циклопентил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-циклогексил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-фенил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-хлор-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-[(3R)-1-азабицикло[2.2.2]октан-3-ил]-1-(5-хлор-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-[(3S)-1-азабицикло[2.2.2]октан-3-ил]-1-(5-хлор-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-[5-(фенилметил)-2-тиазолил]-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(4-метил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-[4-(4-хлорфенил)-2-тиазолил]-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(4,5-диметил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(1,3-бензотиазол-2-ил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(4-метокси-1,3-бензотиазол-2-ил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5,6-диметил-1,3-бензотиазол-2-ил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(2,1,3-бензотиадиазол-4-ил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(1,3-бензотиазол-6-ил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-метил-2-фенил-3-пиразолил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(1-изохинолинил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-изохинолинил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(5-хинолинил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-метил-1,3,4-тиадиазол-2-ил)-6-оксо-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(5-фенил-1,3,4-тиадиазол-2-ил)-3-пиридинкарбоксамида, N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-пиразинил)-3-пиридинкарбоксамида, (1-азабицикло[2.2.2]октан-3-ил)-1-(5-метил-1,3-тиазол-2-ил)-6-оксо-3-пиридинкарбоксилата и (1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(5-пропан-2-ил-1,3-тиазол-2-ил)-3-пиридинкарбоксилата.
В некоторых вариантах осуществления соединение производного пиридина может представлять собой агонист или частичный агонист α7-никотинового ацетилхолинового рецептора.
Подразумевают, что используемый в настоящем описании термин "агонист" приведен в своем наиболее широком значении, т.е. как любая молекула, которая частично или полностью активирует по меньшей мере одну биологическую активность вещества-мишени (например, α7-никотинового ацетилхолинового рецептора). Например, термин соединение "агонист" относится к соединению, которое увеличивает или индуцирует биологическую активность белка (например, c-Met α7-никотинового ацетилхолинового рецептора), с которым соединение агонист связывается. Например, соединение производного пиридина может специфически связываться с внеклеточным доменом α7-никотинового ацетилхолинового рецептора, индуцируя внутриклеточную передачу сигнала, обеспечивая эффективность профилактики или лечения когнитивных нарушений и неврологического восстановления.
Известно, что α7-никотиновые рецепторы играют значительную роль в улучшении когнитивных функций, например, в обучении, памяти и внимании. Например, α7-никотиновые рецепторы ассоциированы с умеренным когнитивным нарушением, болезнью Альцгеймера, ассоциированными с возрастом и другими когнитивными нарушениями, психоневрологическим когнитивным нарушением, синдромом дефицита внимания, синдромом дефицита внимания с гиперактивностью (ADHD), деменцией, вызываемой инъекцией или нарушением обмена веществ, деменцией с тельцами Леви, судорогами, такими как эпилепсия, множественным церебральным инфарктом, нарушением настроения, компульсивным и аддитивным поведениями, воспалительным заболеванием и заболеваниями и состояниями, ассоциированными с подавлением боли, вызываемой этими нарушениями. Активность α7-никотинового рецептора можно изменять или регулировать введением лигандов α7-рецептора, неограничивающие примеры которых представляют собой антагонисты, агонисты, частичные агонисты и обратные агонисты. Лиганды α7-рецептора являются пригодными для лечения и профилактики этих различных типов когнитивных нарушений и других состояний и заболеваний, и известно, что его агонисты и частичные агонисты улучшают когнитивные функции и внимание у грызунов, не являющихся человеком приматов и у людей [Gotti C. and Clementi F. (2004) Prog. Neurobiol., 74, 363-396; Jones H.E., Garrett B.E., Griffiths R.R. (1999) J. Pharmacol. Exp. Ther. 288, 188-197; Castner S.A., Smagin G.N., Piser T.M., Wang Y., Smith J.S., Christian E.P., Mrzljak L., Williams G.V. (2011) Biol. Psychiatry 69, 12-18; Wallace T.L., Callahan P.M., Tehim A., Bertrand D., Tombaugh G., Wang S., Xie W., Rowe W.B., Ong V., Graham E., Terry A.V. Jr., Rodefer J.S., Herbert B., Murray M., Porter R., Santarelli L., Lowe D.A. (2011) J. Pharmacol. Exp. Ther. 336, 242-253; Bitner R.S., Bunnelle W.H., Decker M.W., Drescher K.U., Kohlhaas K.L., Markosyan S., Marsh K.C., Nikkei A.L., Browman K., Radek R., Anderson D.J., Buccafusco J., Gopalakrishnan M. (2010) J. Pharmacol. Exp. Ther. 334, 875-886; Woodruff-Pak D.S., Santos I.S. (2000) Behav. Brain Res. 113, 11-19; Spinelli S., Ballard T., Feldon J., Higgins G.A., Pryce C.R. (2006) Neuropharmacology 51, 238-250].
По другому аспекту настоящее изобретение относится к фармацевтической композиции для профилактики или лечения когнитивного нарушения, которая содержит описанное выше соединение производного пиридона или его фармацевтически приемлемую соль, изомер, сольват или гидрат в терапевтически эффективном количестве и фармацевтически приемлемый носитель.
В некоторых вариантах осуществления когнитивное нарушение может быть выбрано из группы, состоящей из пресенильной деменции, болезни Альцгеймера с ранним началом, сенильной деменции, деменции альцгеймеровского типа, деменции с тельцами Леви, обусловленной микроинфарктами деменции, связанной со СПИД деменции, обусловленной ВИЧ деменции, деменции, ассоциированной с тельцами Леви, ассоциированной с синдромом Дауна деменции, болезни Пика, умеренного когнитивного нарушения, ассоциированного с возрастом нарушения памяти, ухудшения краткосрочной памяти, ассоциированного с возрастом когнитивного нарушения, ассоциированного с лекарственным средством когнитивного нарушения, ассоциированного с синдром иммунодефицита когнитивного нарушения, ассоциированного с сосудистым заболеванием когнитивного нарушения, шизофрении, синдрома дефицита внимания, (ADHD) и дефицита научения. Фармацевтическая композиция является нейропротекторной в отношении профилактики или лечения, например, болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза (ALS) или болезни Хантингтона.
Используемый в настоящем описании термин "когнитивное нарушение" относится к нарушениям в широком диапазоне когнитивных функций или когнитивных областей у животных, например, кратковременной памяти, внимания и активного внимания, вербального научения и памяти, визуального научения и памяти, мышления и решения проблем, и в частности, например, исполнительных функций, скорости обработки задач и/или социального познания. Известно, что когнитивные нарушения проявляются в дефиците внимания, дезорганизованном мышлении, заторможенности мышления, трудности понимания, низком внимании, утрате способности решения проблем, неточной памяти, трудностях выражения мыслей и/или интеграции мыслей, восприятия и поведения или отказа от иррациональных мыслей. Термины "когнитивное нарушение" и "когнитивный дефицит" являются взаимозаменяемыми.
Термин "лечение" можно использовать, включая профилактику, подавление и облегчение (регрессию) заболеваний, нарушений или состояний, ассоциированных с когнитивным нарушением у животных, у которых никогда не диагностировали таких заболеваний, нарушений или состояний, обусловленных когнитивным нарушением, но которые являются подверженными таким заболеваниям, нарушениям или состояниям. Таким образом, термин "терапевтически эффективное количество" относится к эффективной дозе клинического маркера, необходимого для облегчения, уменьшения или профилактики симптомов подлежащих лечению заболеваний или эффективной дозе эффективного активного соединения для уменьшения или задержки начала появления таких симптомов, что можно эмпирически определять в эксперименте на модели in vivo и/или in vitro подлежащего лечению заболевания.
В некоторых вариантах осуществления фармацевтическую композицию можно формулировать в любой форме для введения любым подходящим путем, например, пероральным, ректальным, назальным, легочным, местным, трансдермальным, интрацистернальным, интраперитонеальным, вагинальным и парентеральным (включая подкожным, внутримышечным, интратекальным, внутривенным и внутрикожным) путем, где пероральный путь является предпочтительным. Для перорального введения фармацевтическая композиция может содержать широко используемый в данной области фармацевтически приемлемый носитель. В некоторых вариантах осуществления для пероральных жидких составов, таких как суспензии, сиропы, эликсиры и растворы, примеры носителей представляют собой воду, гликоль, масло и спирт. Для твердых составов, таких как пилюли, капсулы, таблетки-леденцы, примеры носителей представляют собой крахмал, сахар, каолин, смазочные средства, связывающие средства и дезинтегранты. Однако следует понимать, что предпочтительный путь зависит от общего состояния, возраста подлежащего лечению индивидуума, характера подлежащего лечению состояния и выбранного активного ингредиента. В некоторых вариантах осуществления фармацевтическую композицию можно получать в стандартной лекарственной форме в соответствии с подходящим введением и дозой.
В некоторых вариантах осуществления фармацевтическую композицию можно вводить любым подходящим путем, например, парентеральным путем, в форме инъекций или пероральным путем в форме, например, таблеток, капсул, порошков, гранул, осадков, пастилок, драже, пилюль, таблеток-леденцов, водных или неводных растворов, суспензий, эмульсий "вода-в-масле" или "масло-в-воде", эликсиров или сиропов. Для парентерального введения фармацевтическую композицию можно получать в виде дисперсий, суспензии, эмульсий, стерильных инъекционных растворов или содержащих стерильный порошок дисперсий. Фармацевтическая композиция также является пригодной в виде инъекции вещества с замедленным всасыванием. Другие подходящие формы введения фармацевтической композиции представляют собой суппозитории, спреи, мази, кремы, гели, лекарственные формы для ингаляции и кожные пластыри. Фармацевтическую композицию можно получать в любой из перечисленных выше форм известным в данной области способом. Можно использовать любой фармацевтически приемлемый носитель разбавитель, эксципиент или другие широко используемые в данной области добавки.
В некоторых вариантах осуществления для диагностических целей фармацевтическую композицию можно вводить в стандартной лекарственной форме приблизительно 0,001-100 мг/кг или в многодозовой лекарственной форме. Общая суточная доза активных соединений, описываемых в настоящем описании может составлять приблизительно от 0,001 мг/кг приблизительно до 100 мг/кг на массу тела и в некоторых вариантах осуществления может составлять приблизительно от 0,01 мг/кг приблизительно до 10 мг/кг на массу тела, но не является ограниченной ими, которая зависит от общих состояний пациента и активности вводимых активных соединений. В некоторых вариантах осуществления фармацевтическую композицию можно вводить приблизительно от одного до трех раз в сутки. При некоторых обстоятельствах соединения производного пиридона формулы I и формулы II можно формулировать в виде эффективных фармацевтических композиций по типу пролекарств.
В некоторых вариантах осуществления фармацевтическая композиция может дополнительно содержать другие вспомогательные компоненты, которые не ингибируют или не способствуют функции активных компонентов, и ее можно формулировать в любой из ряда известных в данной области форм.
Согласно другому аспекту настоящее изобретение относится к способу лечения когнитивного нарушения, где способ включает контактирование подлежащего лечению индивидуума с описанной выше фармацевтической композицией. Контактирование можно проводить in vitro или in vivo. Контактирование in vivo может включать введение фармацевтическое композиции индивидууму. Индивидуум может представлять собой клетки, ткани, органы или индивидуумов. В некоторых вариантах осуществления фармацевтическую композицию можно вводить в клетку, ткань или орган путем непосредственного контактирования фармацевтической композиции после растворения в подходяще растворе буфера или можно вводить парентерально индивидууму. Как описано выше, используемые при лечении фармацевтическая композиция и способ введения подробно не описывают в настоящем описании. Индивидуум, которому вводят фармацевтическую композицию, может представлять собой любое животное, например, людей, или не являющееся человеком животное, такое как собаки, кошки и мыши.
Полезные эффекты изобретения
В некоторых вариантах осуществления фармацевтическая композиция может эффективно предотвращать или лечить когнитивные нарушения, ассоциированные с ухудшением когнитивных функций.
Способ осуществления изобретения
Один или более вариантов осуществления настоящего изобретения подробно описаны ниже со ссылкой на следующие ниже примеры. Однако эти примеры приведены исключительно с иллюстративными целями и не предназначены для ограничения объема одного или более вариантов осуществления настоящего изобретения.
Пример 1: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-тиазолил)-3-пиридинкарбоксамида
Пример 1-1: синтез диметил-4-(метоксиметилен)-2-пентандиоата
52 мл (0,73 ммоль) ацетилхлорида медленно капельно добавляли в смешанный раствор 500 мл метанола и 50 г (0,36 моль) кумалиновой кислоты при приблизительно 0°C в течение приблизительно 10 минут при перемешивании. Получаемый реакционный раствор перемешивали при кипячении с обратным холодильником в течение приблизительно 10 часов. После определения окончания реакции жидкостной хроматографией, продукт реакции перегоняли с использованием метанола при пониженном давлении с получением соединения. Соединение экстрагировали три раза водой и этилацетатом и очищали органическую фазу при пониженном давлении с применением колоночной хроматографии (гексан:этилацетат=1:5), таким образом получая целевое соединение (фактический выход продукта: 38 г, процентный выход: 53%).
(Отношение основных/второстепенных пиков=5,8:1)
1H-ЯМР (CDCl3, 200 МГц, основной) δ 7,64 (с, 1H), 7,58 (д, 1H), 6,62 (д, 1H), 4,02 (с, 3H), 3,73 (м, 6H).
1H-ЯМР (CDCl3, 200 МГц, второстепенный) δ 8,87 (с, 1H), 8,31 (д, 1H), 6,34 (д, 1H), 3,89 (с, 3H), 3,73 (м, 6H).
Пример 1-2: синтез метил 6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоксилата
После растворения получаемых в примере 1-1 2 г (9,9 ммоль) диметил-4-(метоксиметилен)-2-пентендиоата в 10 мл ДМФА, к раствору добавляли 1 г (9,9 ммоль) 2-аминотиазола. В дальнейшем получаемый реакционный раствор перемешивали при кипячении с обратным холодильником при приблизительно 150°C в течение 6 часов. После определения окончания реакции жидкостной хроматографией, удаляли растворитель в вакууме и затем отмывали с использованием насыщенного солевого раствора с последующей сушкой с использованием сульфата магния и фильтрованием. После перегонки при пониженном давлении, получаемый продукт очищали с использованием колоночной хроматографии (гексан:этилацетат=1:3) с получением целевого соединения (фактический выход продукта: 1 г, процентный выход: 43%).
1H-ЯМР (CDCl3, 500 МГц) δ 9,65 (с, 1H), 7,99 (д, 1H), 7,75 (с, 1H), 7,34 (с, 1H), 6,79 (д, 1H), 3,95 (с, 3H).
Пример 1-3: синтез метил-6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоновой кислоты
После растворения 680 мг (2,88 ммоль) метил-6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоксилата в 12 мл метанола и 4 мл воды, к раствору добавляли 207 мг (8,64 ммоль) гидроксида лития. В дальнейшем получаемый реакционный раствор перемешивали при приблизительно 75°C в течение 5 часов. После определения окончания реакции жидкостной хроматографий, удаляли растворитель в вакууме, а затем добавляли к реакционному раствору водную HCl, титруя до получения pH 2. Получаемое твердое соединение фильтровали с получением целевого соединения (фактический выход продукта: 466 мг, процентный выход: 73%).
1H-ЯМР (ДМСО-d6, 500 МГц) δ 13,29 (с, шир., 1H), 9,40 (с, 1H), 7,92 (д, 1H), 7,81 (с, 1H), 7,69 (с, 1H), 6,76 (д, 2H).
Пример 1-4: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-тиазолил)-3-пиридинкарбоксамида
N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-тиазолил)-3-пиридинкарбоксамид синтезировали одним из следующих ниже способов.
Способ 1: После растворения 720 мг (3,15 ммоль) 6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоновой кислоты в 20 мл тетрагидрофурана и 2 мл ДМФА, к раствору добавляли 450 мг (3,78 ммоль) хинуклидина дигидрохлорид и 1,28 г (9,43 ммоль) диэтилизопропиламида. После перемешивания реакционного раствора при комнатной температуре в течение приблизительно 30 минут, к реакционному раствору добавляли 1,4 г (3,78 ммоль) O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфата (HATU), этот реакционный раствор перемешивали при комнатной температуре в течение приблизительно 24 часов. После определения окончания реакции жидкостной хроматографией, удаляли растворитель в вакууме с последующей экстракцией три раза хлороформом и водным раствором NaOH (pH 12) и очисткой с использованием жидкостной хроматографии (хлороформ:метанол:водный раствор аммиака=10:1:0,1) с получением целевого соединения (фактический выход продукта: 676 мг, процентный выход: 67%).
Способ 2: После растворения 200 мг (0,90 ммоль) 6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоновой кислоты в 10 мл дихлорметана, к раствору добавляли 363 мг (2,86 ммоль) оксалилхлорида, а затем добавляли к нему каталитическое количество ДМФА. После перемешивания при комнатной температуре в течение приблизительно 2 часов, растворитель удаляли в вакууме. После добавления 220 мг (1,36 ммоль) хинуклидина дигидрохлорида к 10 мл ацетонитрила, к раствору добавляли 445 мг (3,45 ммоль) диэтилизопропиламида. Полученный реакционный раствор перемешивали при комнатной температуре в течение приблизительно 1 часа. После добавления подвергнутой перегонки при пониженном давлении реакционной смеси к ацетонитрилу, к нему медленно добавляли реакционный раствор хинуклидина дигидрохлорида с последующим перемешиванием при комнатной температуре в течение приблизительно 24 часов и удаляли растворитель в вакууме. Получаемое соединение экстрагировали три раза хлороформом и водным раствором NaOH (pH=12), а затем очищали с использованием жидкостной хроматографии (хлороформ:метанол:водный раствор аммиака=10:1:0,1) с получением целевого соединения (фактический выход продукта: 95 мг, процентный выход: 32%).
1H-ЯМР (CDCl3, 500 МГц) δ 9,26 (с, 1H), 7,86 (д, 1H), 7,55 (д, 1H), 7,24 (д, 1H), 7,19 (шир., 1H), 6,65 (д, 1H), 4,13 (м, 1H), 3,39 (м, 1H), 3,01 (м, 1H), 2,80 (м, 4H), 2,05 (м, 1H), 1,86 (м, 1H), 1,71 (м, 2H), 1,50 (м, 1H).
Пример 2: синтез N-[(3R)-1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-тиазолил)-3-пиридинкарбоксамида
6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоновую кислоту синтезировали таким же образом, как в примере 1-2 и примере 1-3. Целевое соединение получали из синтезируемой 6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоновой кислоты и 3R-хинуклидина дигидрохлорида таким же образом, как в примере 1-4 и способе 1.
1H-ЯМР (CDCl3, 500 МГц) δ 9,26 (с, 1H), 7,86 (д, 1H), 7,55 (д, 1H), 7,24 (д, 1H), 7,19 (шир., 1H), 6,65 (д, 1H), 4,13 (м, 1H), 3,39 (м, 1H), 3,01 (м, 1H), 2,80 (м, 4H), 2,05 (м, 1H), 1,86 (м, 1H), 1,71 (м, 2H), 1,50 (м, 1H).
Пример 3: синтез N-[(3S)-1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-тиазолил)-3-пиридинкарбоксамида
6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоновую кислоту синтезировали таким же образом, как в примере 1-2 и примере 1-3. Целевое соединение получали из синтезируемой 6-оксо-1-(2-тиазолил)-1,6-дигидро-3-пиридинкарбоновой кислоты и 3S-хинуклидина дигидрохлорида таким же образом, как в примере 1-4 и способе 1.
1H-ЯМР (CDCl3, 500 МГц) δ 9,26 (с, 1H), 7,86 (д, 1H), 7,55 (д, 1H), 7,24 (д, 1H), 7,19 (шир., 1H), 6,65 (д, 1H), 4,13 (м, 1H), 3,39 (м, 1H), 3,01 (м, 1H), 2,80 (м, 4H), 2,05 (м, 1H), 1,86 (м, 1H), 1,71 (м, 2H), 1,50 (м, 1H).
Пример 4: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(2-пиридинил)-3-пиридинкарбоксамида
Целевое соединение получали таким же образом, как в примере 1 и способе 1, за исключением того, что в качестве исходного вещества использовали 2-аминопиридин.
1H-ЯМР (CDCl3, 500 МГц) δ 8,61 (с, 1H), 8,51 (с, 1H), 7,89 (м, 2H), 7,78 (д, 1H), 7,40 (м, 1H), 6,67 (д, 1H), 6,18 (шир., д, 1H), 4,12 (м, 1H), 3,44 (м, 1H), 2,86 (м, 4H), 2,60 (м, 1H), 2,04 (м, 1H), 1,72 (м, 3H), 1,54 (м, 1H).
Пример 5: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(3-пиридинил)-3-пиридинкарбоксамида
Целевое соединение получали таким же образом, как в примере 1 и способе 1, за исключением того, что в качестве исходного вещества использовали 3-аминопиридин.
1H-ЯМР (CDCl3, 500 МГц) δ 8,75 (с, 1H), 8,69 (м, 1H), 8,11 (м, 1H), 7,85 (м, 1H), 7,52 (м, 1H), 7,49 (м, 1H), 6,72 (м, 1H), 6,03 (шир., 1H), 4,14 (м, 1H), 3,49 (м, 1H), 2,89 (м, 4H), 2,61 (м, 1H), 2,05 (м, 1H), 1,75 (м, 3H), 1,58 (м, 1H).
Пример 6: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-хлор-2-пиридинил)-6-оксо-3-пиридинкарбоксамида
Целевое соединение получали таким же образом, как в примере 1 и способе 1, за исключением того, что в качестве исходного вещества использовали 2-амино-5-хлорпиридин.
1H-ЯМР (CDCl3, 500 МГц) δ 8,47 (с, 1H), 8,08 (м, 1H), 7,81 (д, 1H), 7,74 (д, 1H), 7,52 (д, 1H), 6,70 (д, 1H), 6,05 (шир., 1H), 4,13 (м, 1H), 3,48 (м, 1H), 2,84 (м, 4H), 2,57 (м, 1H), 2,03 (м, 1H), 1,73 (м, 3H), 1,57 (м, 1H).
Пример 7: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-(5-фенил-2-пиридин-1-ил)-3-пиридинкарбоксамида
Целевое соединение получали таким же образом, как в примере 1 и способе 1, за исключением того, что в качестве исходного вещества использовали 2-амино-5-фенилпиридин.
1H-ЯМР (CDCl3, 500 МГц) δ 8,80 (с, 1H), 8,59 (м, 1H), 8,01 (м, 2H), 7,84 (м, 1H), 7,57 (м, 2H), 7,47 (м, 3H), 6,68 (д, 1H), 6,43 (шир., 1H), 4,19 (м, 1H), 3,42 (м, 1H), 3,08 (м, 1H), 2,84 (м, 4H), 2,10 (м, 1H), 1,77 (м, 3H), 1,58 (м, 1H).
Пример 8: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-1-(3-изоксазолил)-6-оксо-3-пиридинкарбоксамида
Целевое соединение получали таким же образом, как в примере 1 и способе 1, за исключением того, что в качестве исходного вещества использовали 3-аминоизоксазол.
1H-ЯМР (CDCl3, 500 МГц) δ 8,58 (с, 1H), 8,48 (с, 1H), 7,90 (м, 1H), 7,17 (с, 1H), 6,95 (шир., 1H), 6,63 (д, 1H), 4,25 (м, 1H), 3,48 (м, 1H), 3,25 (м, 1H), 2,91 (м, 4H), 2,14 (м, 1H), 1,78 (м, 3H), 1,58 (м, 1H).
Пример 9: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-6-оксо-1-[3-фенил-5-изоксазолил)-3-пиридинкарбоксамида
Целевое соединение получали таким же образом, как в примере 1 и способе 1, за исключением того, что в качестве исходного вещества использовали 5-амино-3-фенилизоксазол.
1H-ЯМР (ДМСО-d6, 500 МГц) δ 8,66 (с, 1H), 8,33 (м, 1H), 8,02 (д, 1H), 7,95 (м, 2H), 7,57 (м, 3H), 7,50 (с, 1H), 6,70 (д, 1H), 3,96 (м, 1H), 3,19 (м, 1H), 2,89 (м, 1H), 2,70 (м, 4H), 1,81 (м, 2H), 1,61 (м, 2H), 1,34 (м, 1H).
Пример 10: синтез N-(1-азабицикло[2.2.2]октан-3-ил)-1-(5-метил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида
Целевое соединение получали таким же образом, как в примере 1 и способе 1, за исключением того, что в качестве исходного вещества использовали 2-амино-5-метилтиазол.
1H-ЯМР (CDCl3, 500 МГц) δ 9,23 (с, 1H), 7,85 (д, 1H), 7,33 (с, 1H), 6,73 (д, 1H), 6,56 (шир., 1H), 4,14 (м, 1H), 3,42 (м, 1H), 2,82 (м, 4H), 2,65 (м, 1H), 2,48 (с, 3H), 2,04 (м, 1H), 1,74 (м, 3H), 1,56 (м, 1H).
Пример 11: синтез N-[(3R)-1-азабицикло[2.2.2]октан-3-ил]-1-(5-метил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида
6-оксо-1-(5-метил-2-тиазолил)-1,6-дигидро-3-пиридинкарбоновую кислоту синтезировали таким же образом, как в примере 1-2 и примере 1-3, за исключением того, что в качестве исходного вещества использовали 2-амино-5-метилтиазол. Целевое соединение получали из синтезируемой 6-оксо-1-(5-метил-2-тиазолил)-1,6-дигидро-3-пиридинкарбоновой кислоты и 3R-хинуклидина дигидрохлорида таким же образом, как в примере 1-4 и способе 1.
1H-ЯМР (CDCl3, 500 МГц) δ 9,23 (с, 1H), 7,85 (д, 1H), 7,33 (с, 1H), 6,73 (д, 1H), 6,56 (шир., 1H), 4,14 (м, 1H), 3,42 (м, 1H), 2,82 (м, 4H), 2,65 (м, 1H), 2,48 (с, 3H), 2,04 (м, 1H), 1,74 (м, 3H), 1,56 (м, 1H).
Пример 12: синтез N-[(3S)-1-азабицикло[2.2.2]октан-3-ил]-1-(5-метил-2-тиазолил)-6-оксо-3-пиридинкарбоксамида
6-оксо-1-(5-метил-2-тиазолил)-1,6-дигидро-3-пиридинкарбоновую кислоту синтезировали таким же образом, как