Способ снижения иммуногенности
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан способ снижения иммуногенности фрагмента антитела scFv, где способ включает стадию замены одного или более аминокислотных остатков вариабельного домена легкой цепи в положениях 101 и/или 148 (нумерация АНо) и замены аминокислотных остатков в положениях 12, 103 и 144 (нумерация АНо) вариабельного домена тяжелой цепи. Представлена фармацевтическая композиция с пониженной иммуногенностью, содержащая фрагмент антитела, содержащий замену одного или более аминокислотных остатков вариабельного домена легкой цепи в положениях 101 и/или 148 (нумерация АНо) и замену аминокислотных остатков в положениях 12, 103 и 144 (нумерация АНо) вариабельного домена тяжелой цепи. 2 н. и 9 з.п. ф-лы, 5 ил., 4 табл., 1 пр.
Реферат
Перекрестная ссылка на родственные заявки
На основании 35 U.S.C. §119 по настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/289446, поданной 23 декабря 2009 года, полное содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу изменения иммуногенности вариабельных доменов антитела, в частности scFv.
Предшествующий уровень техники
Терапевтические антитела, вводимые при необходимости индивиду, часто идентифицируются иммунной системой индивида как чужеродные. Даже если вводимые антитела были гуманизированы, например, посредством трансплантации мышиных CDR в каркасы иммуноглобулина человека для минимизации мышиного компонента, они по-прежнему могут вызывать иммунный ответ, который нарушает эффективность и/или безопасность терапевтического средства.
В соответствии с литературой гумаральный ответ у пациентов зависит от наличия как B-клеточных антигенных эпитопов, так и T-клеточных эпитопов. Когда B-клеточный рецептор распознает и связывает антиген, такой как вводимое терапевтическое антитело, антиген интернализируется в В-клетку посредством опосредуемого рецептором эндоцитоза и подвергается протеолитическому процессингу. Получающиеся в результате пептиды затем презентируются молекулами MHC класса II. При распознавании T-клеточного эпитопа клеткой Т-хелпером последнее стимулирует соответствующие В-клетки к пролиферации и дифференциации в продуцирующие антитело плазматические клетки.
Для того чтобы уменьшить ответ иммунной системы пациента на вводимые антитела в уровне техники существует несколько технологий деиммунизации. Большинство из современных подходов направлены на удаление T-клеточных эпитопов, тогда как имеется только ограниченное количество примеров способов снижения B-клеточной иммуногенности.
В WO 93/18792 описан процесс модификации антител частичным восстановлением антитела. Это изменяет их иммуногенность, таким образом, их способность вызывать антиизотипический ответ селективно понижается, тогда как они остаются способны вызывать антиидиотипический ответ. Несмотря на то, что способ подходит для вакцин, антиидиотипические ответы не желательны для других терапевтических применений.
В статье Molineux G (2003) Pharmacotherapy 23: 35-85 описано связывание белков с полиэтиленгликолем с большой молекулярной массой. Тем не менее Onda, M. et al. (2008), PNAS Vol 105(32): 11311-11316 сообщили о незначительном успехе этого подхода с гибридными белками, состоящими из вариабельного фрагмента, присоединенного к бактериальному или растительному токсину. Их гибридные белки были инактивированы; кроме того, они обнаружили только незначительное уменьшение иммуногенности.
Второй подход заключается в проведении химиотерапии перед введением антитела, когда пациенты получают лечение циклофосфамидом или флударабином. Этот подход нецелесообразен для пациентов, так как лечение повреждает иммунную систему (Kusher, BH et al. (2007), Pediatr Blood Cancer 48: 430-434; Leonard JP et al. (2005), J Clin Oncol 23: 5696-5704).
В статье Nataga, S. and Pastan, I. (2009), Adv Drug Deliv Rev, p. 977-985 and Onda, M. et al. (2008), PNAS Vol 105(32): 11311-11316 предложено введение точечных мутаций в "горячие антигенные точки" на поверхности чужеродного белка, тем самым удаляя B-клеточный эпитоп. Эти мутации заменяли объемные гидрофильные остатки с большими экспонированными областями небольшими аминокислотами (аланин, глицин и серин). Аланин предпочтителен для замещения, так как он, как правило, присутствует в скрытых и в экспонированных положениях всех вторичных структур и, кроме того, не вызывает образование новой водородной связи. У аланина отсутствуют атомы боковой цепи после β-углерода, которые могут взаимодействовать с антителами и, кроме того, он поддерживает конформацию антигена. Тем не менее упомянутые "горячие точки", описанные в статье Nataga and Pastan, представляют собой конформационные эпитопы, которые расположены в дискретных кластерах на поверхности белка. Необходима обширная экспериментальная работа для определения расположений эпитопов, которая не может быть осуществлена посредством компьютерного моделирования и, таким образом, их способ не является общим решением для снижения иммуногенности антител, которое может использоваться во всех случаях. Кроме всего прочего, главная особенность этого способа заключается в том, что во взаимодействие с антителом хозяина вовлечены преимущественно гидрофильные остатки на поверхности молекулы. Для большинства чужеродных белков этот факт имеет место, тем не менее, при использовании только участков (например, фрагментов, доменов) белка природного происхождения, вполне может иметь место то, что также гидрофобные аминокислоты, изначально экранированные взаимодействием с другими доменами, становятся экспонированными в растворитель и представляют собой эпитоп для иммунной системы. Это явно видно в случае Fv фрагментов антитела, в которых поверхностные остатки вариабельного домена закрыты в Fab фрагменте, но экспонированы в выделенных вариабельных доменах. Доступные в настоящее время алгоритмы прогнозирования В-клеточных эпитопов недостаточно обоснованы и, как правило, малоэффективны.
Таким образом, в данной области существует необходимость в наличии достоверных прямых способов, которые эффективно снижают иммуногенность фрагментов антитела и, в частности, вариабельных доменов.
Сущность изобретения
Таким образом, основная задача изобретения заключается в создании способа снижения иммуногенности любого вариабельного домена антитела без необходимости проведения трудоемкого молекулярного моделирования. В частности, изобретение относится к способу удаления B-клеточных эпитопов из вариабельных доменов антитела.
Таким образом, изобретение относится к способу снижения иммуногенности вариабельных доменов антитела, содержащего легкую вариабельную цепь и/или тяжелую вариабельную цепь, где способ предусматривает стадии замещения одного или нескольких аминокислотных остатков легкой вариабельной цепи и/или тяжелой вариабельной цепи, при этом указанный остаток находится на границе между вариабельной цепью и константной цепью соответствующего полноразмерного антитела или Fab.
В одном из вариантов вариабельный домен антитела представляет собой scFv, Fv фрагмент или антитело с одним доменом, в частности, scFv.
В одном из вариантов один или несколько аминокислотных остатков легкой вариабельной цепи и/или тяжелой вариабельной цепи, которые должны быть заменены, являются консенсусными остатками соответствующего подтипа.
В другом варианте один или более аминокислотных остатков, которые должны быть заменены, являются лейцином (L), валином (V), аспарагиновой кислотой (D), фенилаланином (F), аргинином (R) и/или глутаминовой кислотой (E).
В некоторых вариантах один или более аминокислотных остатков легкой вариабельной цепи находятся в положениях 99, 101 и/или 148 (нумерация AHo). В других вариантах один или более аминокислотных остатков тяжелой вариабельной цепи находятся в одном или более положениях 12, 97, 98, 99, 103 и/или 144 (нумерация AHo).
В еще одном другом варианте один или более аминокислотных остатков, которые должны быть заменены в тяжелой вариабельной цепи, являются (a) лейцином (L) в аминокислотном положении 12 тяжелой цепи; (b) валином (V) в аминокислотном положении 103 тяжелой цепи и/или (c) лейцином (L) в аминокислотном положении 144 тяжелой цепи.
В другом варианте изобретение относится к вариабельным доменам антитела, которые получены способом, раскрытым в настоящем описании, и к фармацевтическим композициям, содержащим указанные вариабельные домены антитела.
Краткое описание чертежей
Изобретение будет более понятно, а объекты, отличные от вышеизложенных, станут очевидны при рассмотрении нижеприведенного подробного описания. В этом описании имеются ссылки на прилагаемые чертежи.
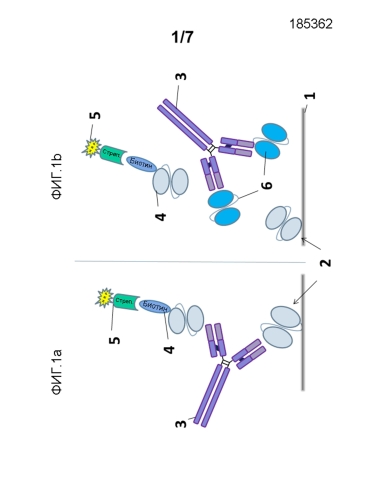
На фигуре 1a представлено схематическое изображение ELISA с мостиковым конъюгированием, используемого для детектирования предсуществующих анти-scFv антител. 1: поверхность планшета, 2: scFv903; 3: антитело к лекарственному средству (ADA); 4: биотинилированный scFv903; 5: конъюгат стрептавидина с HRP (пероксидаза хрена).
На фигуре 1b показан принцип для подтверждающего анализа, где ADA, связанное с лекарственным средством и биотинилированным scFv903, конкурировало с избытком scFv903, 34 max (791), scFv903_DHP (961) и scFv105 (100 мкг/мл).
На фигуре 2 показана интенсивность сигнала 149 индивидуальных сывороток в колориметрическом исследовании (ELISA с мостиковым конъюгированием) для детектирования анти-scFv 903 антител. Сигналы выше разделяющей точки анализа свидетельствуют о наличии анти-scFv 903 антител (ADA) в соответствующем образце сыворотки. Приблизительно 30% тестируемых образцов сывороток дали положительный сигнал в анализе.
На фигуре 3 показано выравнивание последовательности экспонированных в растворитель положений легкой вариабельной цепи четырех различных scFv. Верхний блок: аминокислоты в каждом scFv, отличающиеся по типу от соответствующей аминокислоты в scFv 903, выделены жирным шрифтом. На нижнем блоке указана категория эпитопа, с которым связано каждое отдельное положение, и процент сывороток человека, в которой было обнаружено связывание с соответствующей категорией эпитопа.
На фигуре 4 показано выравнивание последовательности экспонированных в растворитель положений тяжелой вариабельной цепи четырех различных scFv. Верхний блок: аминокислоты в каждом scFv, отличающиеся по типу от соответствующих аминокислот в scFv 903, выделены жирным шрифтом. На нижнем блоке указана категория эпитопа, с которым связано каждое отдельное положение, и процент сывороток человека, в которой было обнаружено связывание с соответствующей категорией эпитопа.
На фигуре 5 показана смоделированная молекулярная структура scFv 903. 5a: вид спереди; 5b: вид при повороте на 180°. Серый: остатки, потенциально принимающие участие в эпитопе категории β; черный: остатки, потенциально принимающие участие в эпитопе категории б.
Раскрытие сущности изобретения
Для большей ясности изобретения вначале определены некоторые термины. Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, как это общепринято среди специалистов в области настоящего изобретения. Несмотря на то что способы и материалы, сходные или эквивалентные описанным в настоящем описании, могут быть использованы при практическом осуществлении или испытании изобретения, подходящие способы и материалы описаны ниже. Все публикации, заявки на патент, патенты и другие источники, указанные в настоящем документе, включены в настоящее описание в качестве ссылки в полном объеме. В случае несоответствия настоящее описание, включая определения, должно иметь приоритет. При этом материалы, способы и примеры являются лишь иллюстративными, и не предназначены для ограничения изобретения.
Выражение "иммуногенность", которое используется в настоящем описании, обозначает присутствие В-клеточных или антигенных эпитопов антитела на белке, вводимом индивиду, при этом такие В-клетки или антитела (также называемые антитела к лекарственному средству; ADA) могут существовать перед введением указанного белка.
Величина иммуногенности может быть определена анализом ELISA и может быть выражена как процент сывороток человека, которые содержат поддающиеся измерению количества предсуществующих ADA. Снижение иммуногенности между белком и соответствующим белком, сконструированным для снижения его иммуногенности, может быть измерено сравнением процента образцов сыворотки, содержащих ADA с сконструированным белком, с процентом образцов сыворотки, содержащих ADA к первоначальному белку. Более низкое количество или процент положительных образцов сыворотки для сконструированного белка указывает на снижение иммуногенности для сконструированного белка. В более чувствительном измерении, которое может быть использовано на основе одиночного образца сыворотки, используется метод ELISA конкурентного типа. В таком ELISA конкурентного типа сконструированный белок конкурирует с первоначальным белком за связывание ADA в тестируемой сыворотке. Чем ниже способность сконструированного белка конкурировать с первоначальным белком, тем более успешно было снижение иммуногенности.
Предпочтительно, величиной снижения иммуногенности называется процент образцов сыворотки, в которых сконструированный белок больше не способен эффективно конкурировать с первоначальным белком. Эффективное конкурирование определяется порогом (относительный сигнал в конкурентном ELISA), где -100 обозначает абсолютный конкурент (нет снижения иммуногенности) и 0 обозначает полное отсутствие конкурирования (полное отсутствие эпитопов ADA). Как правило, порог для эффективного конкурирования может составлять -90, -80, -70, -60, -50, -40, -30, -20, -10 или >-10.
"Граница" или "контакт поверхность-поверхность" в значении, используемом в настоящем описании, относится к областям, локализованным между вариабельными доменами и константными областями 1 (CL1 или CH1) полноразмерного антитела или между Fab участком и Fc доменом (CH2 и CH3).
"ADA" в значении, используемом в настоящем описании, является аббревиатурой для антител против лекарственного средства, которая относится к предсуществующим антителам в сыворотке или сыворотках пациентов.
Термин "вариабельный домен антитела" (V-Домен) относится к молекуле, которая содержит весь или часть антиген-связывающего сайта антитела, например, всю или часть тяжелой и/или легкой цепи вариабельного домена так, что вариабельный домен антитела специфично распознает целевой антиген. Термин, таким образом, соответствует V-J-области или V-D-J-области иммуноглобулина. Эти V-домены обозначены следующим образом: VL (V-домен легкой цепи Ig) или VH (V-домен тяжелой цепи Ig). Не ограничивающие примеры вариабельных доменов антитела включают
(i) Fv фрагменты, содержащие VL и VH домены одиночной цепи антитела,
(ii) одноцепочечные Fv фрагменты (scFv),
(iii) однодоменные антитела, такие как Dab фрагменты (Ward et al., (1989) Nature 341:544-546), которые состоят из VH или VL домена, Camelid (Hamers-Casterman, et al., Nature 363:446-448 (1993), and Dumoulin, et al., Protein Science 11:500-515 (2002)) или акульи антитела (например, shark Ig-NARs Nanobodies®).
Термин "каркас антитела" или "каркас" в значении, используемом в настоящем описании, относится к части вариабельного домена или VL, или VH, которая служит в качестве остова для антиген-связывающих петель этого вариабельного домена (Kabat, E.A. et al., (1991) Sequences of proteins of immunological interest. NIH Publication 91-3242).
Термин "CDR антитела" или "CDR" в значении, используемом в настоящем описании, относится к определяющим комплементарность областям антитела, которые состоят из антиген-связывающих петель, как это описано в Kabat E.A. et al., (1991) Sequences of proteins of immunological interest. NIH Publication 91-3242). Каждый из двух вариабельных доменов фрагмента Fv антитела содержит, к примеру, три CDR.
Термин "одноцепочечное антитело" или "scFv" относится к молекуле, содержащей вариабельную область тяжелой цепи антитела (VH) и вариабельную область легкой цепи антитела (VL), соединенные линкером. Такие молекулы scFv могут иметь общие структуры: NH2-VL-линкер-VH-COOH или NH2-VH-линкер-VL-COOH.
Термин "подтип" относится к набору V-доменов, которые принадлежат одной группе в данных видах и которые имеют высокий процент идентичности. Термин "подтип" относится к подтипу, определяемому соответствующей консенсусной последовательностью, как описано в Knappik (2000). Термин "подсемейство" или "подкласс" используется в качестве синонима для термина "подтип". Термин "подтип" в значении, используемом в настоящем описании, относится к последовательностям, имеющим высокую степень идентичности и сходство с соответствующей консенсусной последовательностью, представляющей их подтип. То, к какому "подтипу" принадлежит некоторый вариабельный домен, определяется выравниванием соответствующей последовательности или со всеми известными человеческими сегментами эмбрионального типа или с определенными консенсусными последовательностями соответствующего подтипа и последующей ассоциацией с некоторым подтипом на основании наибольшей гомологии. Способы определения видов гомологии и объединения последовательностей в группы посредством использования поисковых схем, таких как BLOSUM (Henikoff 1992), хорошо известны специалисту в данной области.
"Консенсусный остаток" в конкретном положении может быть определен генерированием аминокислотной консенсусной последовательности данного подтипа. "Аминокислотная консенсусная последовательность" в значении, используемом в настоящем описании, относится к аминокислотной последовательности, которая может быть генерирована с использованием матриц по меньшей мере двух и, предпочтительно, более выровненных аминокислотных последовательностей, и при этом предоставляет возможность разрывов в выравнивании, так что возможно определить наиболее часто встречающийся в каждом положении аминокислотный остаток. Консенсусная последовательность представляет собой последовательность, которая содержит аминокислоты, которые наиболее часто представлены в каждом положении. В случае если две или более аминокислот одинаково часто представлены в одном положении, то консенсусная последовательность включает обе или все из этих аминокислот. Аминокислотная последовательность белка может быть проанализирована на различных уровнях. К примеру, консервативность или вариабельность может проявляться на уровне одиночного остатка, на уровне множества остатков, множества остатков с разрывами и т.д. Остатки могут проявлять консервативность идентичного остатка или могут быть консервативны на уровне класса. Другие классы известны специалисту в данной области и могут быть определены с использованием структурных расчетов или других показателей для оценки взаимозаменяемости. В этом смысле, заменяемая аминокислота может относиться к любой аминокислоте, которая может быть заменена в этом положении, и при этом будет поддерживаться функциональная консервативность. В настоящем описании, когда одну аминокислотную последовательность (например, первую VH или VL последовательность) выравнивают с одной или более дополнительными аминокислотными последовательностями (например, с одной или более последовательностями VH или VL в базе данных), аминокислотное положение в одной последовательности (например, первая последовательность VH или VL) может подвергаться сравнению с "соответствующим положением" в одной или более дополнительных аминокислотных последовательностях. В настоящем описании "соответствующее положение" представляет эквивалентное положение в последовательности(ях), с которой(ыми) должно быть выполнено сравнение, когда последовательности оптимально выровнены, т.е. когда последовательности выровнены для достижения наивысшего процента идентичности или процента сходства.
Система нумерации AHo, используемая по всему описанию, описана в A. Honegger и A. Pluckthun (2001), J.Mol.Biol. 309: 657-670.
Термин "пациент" относится к человеку или к животному.
Термин "лечить", "лечащий" или "лечение" относится к терапевтическим и/или профилактическим мерам для предупреждения, устранения, замедления, уменьшения тяжести или облегчения одного или более симптомов болезни или рецидива, или для увеличения выживаемости индивида по сравнению с ожидаемой выживаемостью в отсутствие такого лечения.
"Гидрофильные" аминокислоты являются полярными и электрически заряженными аминокислотами, такими как Asp, Glu, Lys, Arg и His.
Аминокислотами, которые полярны и не заряжены, являются Gly, Ser, Thr, Cys, Asp, Gln и Tyr.
"Гидрофобные" аминокислоты представляют собой, как правило, неполярные аминокислоты, такие как Ala, Val, Leu, Ile, Met, Phe, Trp и Pro.
В первом аспекте изобретение относится к способу снижения иммуногенности вариабельного домена антитела. Вариабельный домен антитела содержит легкую вариабельную цепь и/или тяжелую вариабельную цепь, и способ предусматривает стадию замены одного или более аминокислотных остатков легкой вариабельной цепи и/или тяжелой вариабельной цепи, при этом указанный остаток присутствует на границе между вариабельной цепью и константной цепью соответствующего полноразмерного антитела (или Fab, т.е. любого антитела или фрагмента антитела, содержащих константный домен или его части).
Указанные один или более аминокислотных остатков, выбранных для замещения, предпочтительно, являются остатками, которые расположены на границе между вариабельной цепью и константной цепью соответствующего полноразмерного антитела (или Fab, т.е., любого антитела или фрагмента антитела, содержащего константный домен или его части) и являются экспонированными в растворитель в вариабельном домене антитела, таком как scFv. Указанная граница также обозначается граница V/C домена.
Вариабельный домен антитела является, например, scFv, Fv фрагментом или антителом с одним доменом, предпочтительно, scFv.
Особый интерес представляют аминокислотные остатки в положениях, которые образуют прерывистые, т.е. конформационные, B-клеточные эпитопы. Такие остатки включают остатки, обнаруженные в следующих положениях (нумерация AHo):
положения 99, 101 и/или 148 легкой вариабельной цепи и
положения 12, 97, 98, 99, 103 и/или 144 тяжелой вариабельной цепи.
Известны остатки в положениях 99, 101 и 148 (нумерация AHo) легкой цепи, а также остатки в положениях 12, 98, 103 и 144 (нумерация AHo) тяжелой цепи (Nieba et al. (1997) Protein Eng., Apr;10(4):435-44 (также раскрытые в патенте США 6815540)) для улучшения способности антител к укладке посредством белковой инженерии. Nieba предлагает замещать гидрофобные аминокислоты гидрофильными в указанных положениях; тем не менее, в документе ничего не говорится о том, что эти замены могут влиять на иммуногенность молекулы. Кроме того, авторы подчеркивают, что не все из этих гидрофобных остатков являются одинаково эффективными вариантами для замен. Несмотря на то что существование гидрофобных скоплений сохраняется во всех антителах, их точное положение и степень гидрофобности изменяются.
Как известно в данной области, в частности, аминокислоты, которые
(i) расположены в области изгиба вторичной структуры,
(ii) имеют длинную гибкую боковую цепь или объемную боковую цепь или
(iii) являются гидрофобными,
особенно предрасположены к тому, чтобы быть частью B-клеточного эпитопа и, таким образом, вызывать иммуногенную реакцию. Посредством удаления иммуногенной аминокислоты B-клеточные эпитопы прерываются, и устойчивость пациента к вариабельному домену антитела может быть повышена.
Предпочтительно, выбранные один или более аминокислотных остатков заменены аминокислотой, которая является менее иммуногенной, чем выбранные аминокислоты, т.е. не вызывает иммунный ответ или вызывает слабый иммунный ответ. Такие менее иммуногенные аминокислоты, являются аминокислотами, которые снижают реакционную способность ADA по сравнению с реакционной способностью ADA по отношению к вариабельному домену антитела, содержащего первоначальную (т.е. незамещенную) аминокислоту.
Иммуногенность, т.е. способность вызывать гуморальный иммунный ответ в организме пациента, может, например, быть предсказана его антигенной способностью, т.е. реакционной способностью по отношению к предсуществующим антителам. Антигенная способность может, например, быть определена посредством реакционной способности ADA с помощью ELISA с мостиковым конъюгированием (смотрите пример 1 и фигуру 1) с использованием сывороток от доноров, которые потенциально содержат предсуществующие антитела. Следовательно, для определения менее иммуногенной аминокислоты вариабельный домен антитела может быть мутирован в указанных положениях. Влияние таких мутаций на иммуногенность может быть оценено посредством конкурирования сигнала исходного антитела в ELISA с мостиковым конъюгированием с его предположительно менее иммуногенным сконструированным производным, как описано в настоящем описании. Связывание ADA против антитела может также быть оценено посредством использования анализов связывания без использования мечения, таких как поверхностный плазмонный резонанс, резонансный перенос энергии флуоресценции (FRET), калориметрические анализы и другие.
В одном из вариантов осуществления аминокислоты, отобранные для замены, расположены в одном или более положений, выбранных из группы, состоящей из остатков 99, 101 и 148 легкой вариабельной цепи и остатков 12, 97, 98, 99, 103 и 144 тяжелой вариабельной цепи.
Предпочтительные аминокислоты, выбранные для замен, экспонированы на поверхность, но возможно, что они закрыты константным доменом в соответствующем полноразмерном антителе или Fab.
В одном из вариантов осуществления, один или более аминокислотных остатков легкой вариабельной цепи и/или тяжелой вариабельной цепи, которые должны быть заменены, являются консенсусными остатками соответствующего подтипа. К примеру, предпочтительными аминокислотами, выбранными для замен, являются лейцин (L), валин (V), аспарагиновая кислота (D), фенилаланин (F), аргинин (R) и/или глутаминовая кислота (E).
Более предпочтительно, один или более аминокислотных остатков, выбранных для замены, выбраны из группы, состоящей из остатков D99, F101 и L148 легкой вариабельной цепи и остатков L12, R97, A98, E99, V103 и L144 тяжелой вариабельной цепи.
Еще более предпочтительно, лейцин (L), валин (V), фенилаланин (F) и/или аланин (A) заменены полярными аминокислотами, предпочтительно, серином (S) и/или треонином (T).
В частности, было обнаружено, что DHP мотив, как это описано в PCT/CH2009/00022, снижает иммуногенность вариабельных доменов антитела без побочного воздействия на термическую устойчивость, рефолдинг, уровень экспрессии, агрегирование и/или связывающую способность вариабельного домена антитела. Указанный DHP мотив содержит аминокислотные остатки 12, 103 и 144 (нумерация AHo) тяжелой вариабельной цепи, в которых представлены следующие аминокислоты:
(a) серин (S) в аминокислотном положении 12 тяжелой цепи;
(b) серин (S) или треонин (T) в аминокислотном положении 103 тяжелой цепи и/или
(c) серин (S) или треонин (T) в аминокислотном положении 144 тяжелой цепи.
В документе PCT/CH2009/00022 не дано никаких указаний на то, что предлагаемые модификации подходят для снижения иммуногенности вариабельных доменов антитела.
DHP мотив расположен на V/C границе Fab фрагмента и становится экспонированным в растворитель при удалении константных доменов. Таким образом, в предпочтительном варианте осуществления настоящего изобретения один или более аминокислотных остатков выбраны для замены из группы, состоящей из остатков 12, 103 и 144 (нумерация AHo) тяжелой вариабельной цепи. Предпочтительно,
(a) лейцин (L) присутствует в аминокислотном положении 12 тяжелой цепи;
(b) валин (V) присутствует в аминокислотном положении 103 тяжелой цепи и/или
(c) лейцин (L) присутствует в аминокислотном положении 144 тяжелой цепи.
Эти остатки высококонсервативны в каркасах человека. Таким образом, замещение одного или более из указанных остатков предоставляет общее решение для деиммунизации вариабельных доменов антитела без воздействия на биофизические свойства молекул, и способ, изложенный в настоящем описании, применим к любому каркасу вариабельного домена антитела. Предпочтительно, остатки, присутствующие в указанном(ых) положении(ях), заменены
(a) серином (S) в аминокислотном положении 12 тяжелой цепи;
(b) серином (S) или треонином (T) в аминокислотном положении 103 тяжелой цепи и/или
(c) серином (S) или треонином (T) в аминокислотном положении 144 тяжелой цепи.
Еще более предпочтительно, когда осуществлены следующие замены: L12S, V103T и/или L144T.
Вариабельный домен антитела может быть направлен против любой мишени и специфично связывает указанную мишень. Характерные примеры мишеней включают, но ими не ограничены: трансмембранные молекулы, рецептор, лиганд, фактор роста, гормон роста, фактор коагуляции, препятствующий свертыванию крови фактор, активатор плазминогена, сывороточный альбумин, рецептор гормона или фактора роста, нейротрофический фактор, ростовой фактор нервов, фактор роста фибробластов, трансформирующие факторы роста (TGF), CD белок, интерферон, колониестимулирующий фактор (CSF), интерлейкин (IL), T-клеточный рецептор, поверхностный мембранный белок, вирусный белок, опухолеассоциированный антиген, интегрин или интерлейкин, VEGF; ренин; гормон роста человека; гормон роста быка; фактор, стимулирующий выделение гормона роста; паратиреоидный гормон; тиреостимулирующий гормон; липопротеин; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; фактор коагуляции VIIIC; фактор коагуляции IX; тканевой фактор (TP); фактор фон Виллебранда; белок C; атриальный натрийдиуретический фактор; легочный сурфактант; урокиназу; мочу человека; тканевой активатор плазминогена (t-PA); бомбезин; тромбин; гематопоэтический фактор роста; фактор некроза опухолей альфа или бета; энкефалиназу; RANTES (Regulated on Activation Normally T-cell Expressed and Secreted); макрофагальный белок воспаления (MIP-1)-альфа человека; сывороточный альбумин человека; ингибирующее вещество Мюллера; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; микробный белок, бета-лактамазу; ДНКазу; IgE; цитотоксичный ассоциированный с T- лимфоцитом антиген (CTLA); CTLA-4; ингибин; активин; фактор роста эндотелия сосудов (VEGF); протеин A или D; ревматоидный фактор; полученный из кости нейротрофический фактор (BDNF); нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6); NGF-бета; фактор роста тромбоцитов (PDGF); aFGF; bFGF; эпидермальный фактор роста (EGF); TGF-альфа; TGF-бета, включая TGF-бета1, TGF-бета2, TGF-бета3, TGF-бета14 или TGF-бета5; инсулиноподобный фактор роста -I или -II (IGF-I или IGF-II); дез(1-3)-IGF-I (мозговой IGF-I), связывающий инсулиноподобный фактор роста белок, эритропоэтин; остеоиндуктивный фактор; иммунотоксин; костный морфогенетический белок (BMP); интерферон-альфа, -бета или -гамма; M-CSF, GM-CSF или G-CSF; IL-1-IL-10; супероксиддисмутазу; комплементзависимый стимулятор гомолиза; белок оболочки AIDS; транспортный белок; "хоминг"-рецептор; адрессин; регуляторный белок; CD3, CD4, CD8, CD11a, CD11b, CD11c, CD18, CD19, CD20, CD34, CD40 или CD46, ICAM, VLA-4 или VCAM; или HER2, HER3 или HER4 рецептор; член семейства рецепторов ErbB; EGF рецептор; HER2, HER3 или HER4 рецептор; молекулы клеточной адгезии; LFA-1, Mac1, p150.95, VLA-4, ICAM-1, VCAM, альфа4/бета7 интегрин или альфа/бета3 интегрин; альфа или бета субъединицу молекулы клеточной адгезии; антитела; фактор роста, VEGF; тканевой фактор (TF); TGF-бета; альфа интерферон (альфа-IFN); IL-8; IgE; антигены группы крови Apo2, рецептор смерти; flk2/flt3 рецептор; рецептор ожирения (OB); mpl рецептор; CTLA4 или протеин C.
В другом варианте осуществления изобретение относится к антиген-связывающему фрагменту, получаемому способом, изложенным в настоящем описании. Указанный антиген-связывающий фрагмент может, например, быть использован для терапевтического или диагностического применения.
Последовательности, используемые в примерах в настоящем описании, включают:
> 903 или 578minmax (SEQ ID NO: 1)
EIVMTQSPSTLSASVGDRVIITCQASEIIHSWLAWYQQKPGKAPKLLIYLASTLASGVPSRFSGSGSGAEFTLTISSLQPDDFATYYCQNVYLASTNGANFGQGTKLTVLGGGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVQPGGSLRLSCTASGFSLTDYYYMTWVRQAPGKGLEWVGFIDPDDDPYYATWAKGRFTISRDTSKNTVYLQMNSLRAEDTAVYYCAGGDHNSGWGLDIWGQGTLVTVSS
> 791 или 34max (SEQ ID NO: 2)
MEIVMTQSPSTLSASLGDRVIITCQSSQSVYGNIWMAWYQQKSGKAPKLLIYQASKLASGVPSRFSGSGSGAEFSLTISSLQPDDFATYYCQGNFNTGDRYAFGQGTKLTVLGGGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVQPGGSLRLSCTASGFTISRSYWICWVRQAPGKGLEWVACIYGDNDITPLYANWAKGRFPVSTDTSKNTVYLQMNSLRAEDTAVYYCARLGYADYAYDLWGQGTLVTVSS
> scFv105 (SEQ ID NO: 3)
DIVMTQSPSSLSASVGDRVTLTCTASQSVSNDVVWYQQRPGKAPKLLIYSAFNRYTGVPSRFSGRGYGTDFTLTISSLQPEDVAVYYCQQDYNSPRTFGQGTKLEVKRGGGGSGGGGSGGGGSSGGGSQVQLVQSGAEVKKPGASVKVSCTASGYTFTHYGMNWVRQAPGKGLEWMGWINTYTGEPTYADKFKDRFTFSLETSASTVYMELTSLTSDDTAVYYCARERGDAMDYWGQGTLVTVSS
> 961 или 578minmaxDHP (SEQ ID NO: 4)
EIVMTQSPSTLSASVGDRVIITCQASEIIHSWLAWYQQKPGKAPKLLIYLASTLASGVPSRFSGSGSGAEFTLTISSLQPDDFATYYCQNVYLASTNGANFGQGTKLTVLGGGGGSGGGGSGGGGSGGGGSEVQLVESGGGSVQPGGSLRLSCTASGFSLTDYYYMTWVRQAPGKGLEWVGFIDPDDDPYYATWAKGRFTISRDTSKNTVYLQMNSLRAEDTATYYCAGGDHNSGWGLDIWGQGTTVTVSS
Пример 1
ELISA с мостиковым конъюгированием антитела к лекарственному средству (ADA-ELISA)
1.1 Предшествующий уровень техники
Предсуществующие антитела против моноклонального антитела могут быть направлены как на константные области, на положения вариабельного домена каркаса, так и на антиген-связывающие петли, CDR. Предсуществующие антитела, связанные специфично с Fv фрагментами, но не с IgG, вероятно, будут распознавать области, которые были исходно экранированы в IgG. Такие области в основном являются границами домена, расположенными между вариабельными доменами и константными областями 1 (CL1 или CH1) или между Fab участком и Fc доменом (CH2 и CH3). Антитела, которые распознают такие границы, по всей вероятности, являются специфической формой. Так как последовательность каркаса scFv903 является высококонсервативной у людей, то, по-видимому, предсуществующие антитела к scFv903 в сыворотке человека связывают или CDR, или остатки V/C-поверхности. Эпитопы для таких предсуществующих анти-scFv903 антител охарактеризовывали сэндвич-ELISA посредством определения способности различных scFv к конкурированию со связыванием антител к лекарственному средству (ADA) с ESBA903. Испытываемые scFv представляли собой:
- scFv, содержащие такой же каркас, как scFv903, но различные CDR (34_max (791)),
- scFv с каркасом, отличным от scFv903, и различными CDR (scFv105) и
- вариант scFv903 (scFv903 DHP (961)), содержащий замены в исходной V/C границе.
ELISA, выполненный для отбора анти-scFv903 антител, является квазиколичественным анализом, и его проводили в формате мостикового конъюгирования (см., фиг.1), который позволяет детектирование ответов всех изотипов антитела из различных видов.
Кратко и со ссылкой на фиг.1), микротитрационные планшеты покрывали scFv 903 1, 2, с которыми были связаны образцы, содержащие анти-scFv 903 антитела 3,6. В качестве первого детекционного агента использовали биотинилированный scFv 903 4 для обнаружения любых связанных scFv 903/анти-scFv 903 комплексов, которые в свою очередь детектировали вторым детекционным агентом 4, конъюгатом стрептавидина с HRP 5. Количество анти-scFv 903 антител, присутствующих в контроле качества и в образцах, определяли с использованием субстрата пероксидазы (POD) (3,3'-5,5'-тетраметилбензидин(TMB)).
Визуализацию ADA ELISA выполняли с положительным контрольным антителом, обозначенным AB903-3. Исходный раствор анти-scFv 903 антитела (кроличьи поликлональные анти-scFv 903 IgG, обозначенные AB903-3) получали иммунизацией кролика scFv 903 и последующей аффинной очисткой сыворотки (Squarix Biotechnology). Как изображено на Фигуре 1b, эпитопы предсуществующих антител на scFv 903 охарактеризовывали посредством конкурирования связывания ADA с scFv 903 с scFv, описанным выше.
1.2 Методика анализа
На микротитрационный планшет (Nunc Maxisorp) наносили 0,1 мкл/мл scFv 903 в PBS (Dulbecco, Sigma). Герметично закрытый планшет инкубировали в течение ночи при 4°C.
Планшет промывали три раза с 300 мкл/лунку промывочного буфера (TBST 0,005% Tween (20) в Atlantis Microplate Washer (ASYS). Неспецифические сайты блокировали 280 мкл/лунку блокирующего буфера (PBS, 10 мг/мл BSA 1% (масс./об.), 0,1 мл/50 мл Tween 20 (0,2%, об./об.). Герметично закрытый планшет инкубировали в течение 1,5 часа при комнатной температуре (25°C) со встряхиванием. Впоследствии планшет промывали три раза, как указано выше.
Аналитический контроль (или аффинно-очищенные кроличьи поликлональные анти-scFv 903 IgG, обозначенные AB903-3, или сыворотка человека) добавляли в трех различных концентрациях:
HiQC: 2500 нг/мл AB903
MeQC: 500 нг/мл AB903
LoQC: 250 нг/мл AB903
QC вводили в соответствующий пул NSB сыворотки (пул всей сыворотки использовали для определения разделяющей точки анализа, >30). Образцы, в которых должно быть осуществлено измерение, наносили в разбавлениях от 1 до 10. 50 мкл образца наносили в лунку; герметично закрытый планшет инкубировали 2,0 часа при комнатной температуре (25°C).
Как указано выше, планшет промывали три раза промывочным буфером. В качестве первого детекционного агента добавляли биотинилированный scFv 903 (500 мкг белка, биотинилированного с помощью Lightning-Link kit (protocol: Lightning-Link™ Biotin Conjugation Kit, Type A, # 704-0015, Innova Biosciences)). Для указанной цели биотинилированный scFv 903 разбавляли в разбавляющем буфере в концентрации 250 нг/мл (PBS, 10 мг/мл BSA 1% (масс./об.), добавляли 0,1 мл/50 мл Tween 20 (0,2% об./об.)). Добавляли 50 мкл/лунку. Герметично закрытый планшет инкубировали 1,0 час при комнатной температуре (примерно 25°C) при встряхивании.
Планшет промывали еще три раза, как описано выше. Второй детекционный агент, Streptavidin-Poly-HRP (Stereospeciflc Detection Technologies, 1 мг/мл), разбавляли 1:5000 в буфере для разбавления и до