Способ получения биодеградируемого полимерного покрытия с контролируемым выходом лекарственного средства для малоинвазивной хирургии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно малоинвазивной медицине. Способ получения биодеградируемого полимерного покрытия для контролируемого выхода лекарственного средства включает растворение хитозана в кислотах, добавление лекарственного средства, окунание проволоки из никелида титана в полученный раствор, фиксацию покрытия и сушку. Для растворения хитозана в качестве растворителя используют фосфорную, соляную, глутаминовую или уксусную кислоты с концентрацией от 1 до 4% вес. В качестве лекарственного средства используется линкомицин, гентамицин или цефотоксим с концентрацией от 0,9 до 7% вес. Фиксация покрытия происходит в спиртовом аммиачном растворе в соотношении 1:2 с последующей сушкой при температуре 40-45°С в течение 24 часов. Изобретение обеспечивает однородную толщину покрытия и контролируемую скорость выхода лекарственного средства в зависимости от толщины покрытия. 3 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к медицине, в частности к получению биодеградируемых полимерных покрытий для малоинвазивной хирургии.
Патологические изменения в просветах сосудов и других трубчатых органов могут вести к их сужению и полному закупориванию. Атеросклероз, как и острый тромбоз, часто является причиной таких состояний, как инфаркт миокарда или апоплексия.
Другой обычной опасностью, которой подвергаются просветы сосудов и других трубчатых органов, является рост злокачественных и доброкачественных новообразований. В результате интенсивного неконтролируемого деления клеток опухоли, находящейся вблизи или внутри какого-либо трубчатого органа, сужаются или закупориваются просветы затронутых процессом трубчатых органов. В качестве примеров таких состояний можно назвать рак желудка, рак кишечника, рак легких, рак почки, закупоривание (окклюзию) желчных протоков, протоков поджелудочной железы и мочеиспускательного канала.
За последние два десятилетия для местного лечения сужения кровеносных сосудов во многих случаях хорошо зарекомендовало себя применение стентов. После расширения пораженного участка сосуда баллонным катетером - или даже после удаления суженного участка - в этой области устанавливается стент, который при раскрытии расширяет стенку трубчатого органа, восстанавливая диаметр просвета до нормальной величины, и поддерживает проходимость трубчатого органа в дальнейшем. В частности, важным обстоятельством является то, что стент при контакте с кровью может вызвать, как чужеродное тело, развитие повторного сужения (рестеноза) просвета. Усилия по совершенствованию стентов направлены на повышение биологической совместимости материалов для стентов, на повышение эластичности и упругости материалов в сочетании со снижением склонности материалов к усталости, а также на уменьшение площади поверхности контакта с чужеродным материалом, благодаря чему снижается риск рестеноза, вызванного имплантацией стента.
В дополнение к упомянутым основным направлениям совершенствования стентов, многообещающим направлением оказалось нанесение на поверхность стента покрытия, состоящего из биосовместимых, биорасщепляемых (рассасывающихся) или биостабильных материалов, которые могут служить также в качестве носителей активных веществ, противодействующих рестенозу.
Одним из возможных решений данной проблемы может быть формирование биоактивных и биоинертных покрытий на основе производных природных биополимеров (например, хитозан различной молекулярной массы) на медицинском изделии с целью оптимизации процесса биоинтеграции имплантата. Обладая высокой биосовестимостью, антибактериальным эффектом, способный к полной биодеградации, хитозан используется во многих областях медицины. Из-за большого количества водородных связей, которые может образовывать хитозан, он способен удерживать в своей структуре растворитель и растворенное вещество, давая возможность ввести лекарственное средство для улучшения противовоспалительных свойств покрытия. Эти активные вещества должны, как предполагается, останавливать процесс рестеноза, поступая в организм в течение желательного периода времени и в требуемой концентрации. Постепенная контролируемая за счет изменения молекулярной массы и толщины слоя биодеградация хитозана обеспечивает пролонгированный местный выход медицинского препарата, снижая вероятный риск послеоперационных осложнений.
В патенте WO 2004112863 А1 получают пористое хитозановое покрытие, используя пластификатор, преимущественно полиэтиленоксид (ПЭО). Хитозан растворяли в 0,1 М растворе уксусной кислоты (2% вес.) в течение ночи и фильтровали. ПЭО растворяли в ледяной уксусной кислоте и добавляли к раствору хитозана в соотношении 70/30. Смесь перемешивалась в течение 4 часов, дегазировалась и наносилась методом литья, после чего сушилась и промывалась 1 н. раствором NaOH. Предлагалось также введение гепарина для улучшения тромбогенных свойств покрытия. Однако при пористой структуре покрытия выход лекарственного агента оказывается неравномерным, а предлагаемый контроль скорости биодеградации покрытия за счет изменения толщины оказывается неэффективным из-за потери требуемых механических свойств.
Наиболее близким к заявляемому является способ получения биодеградируемого хитозанового покрытия с введенным лекарственным средством, описанный в патенте WO 2012138184 А2. Хитозан растворяли в 0,2 М уксусной кислоты и смешивали с раствором дексаметазона. Нанесение на стент осуществлялось методом окунания и последующей сушкой в течение часа при температуре 100°С. При использовании сушки для фиксации покрытия его толщина оказывается неоднородна, что ведет к неравномерным биодеградации и выходу лекарственного средства.
Задачей изобретения является создание способа получения биодеградируемого полимерного покрытия для малоинвазивной хирургии.
Техническим результатом является однородная толщина покрытия и контролируемая скорость выхода лекарственного средства.
Технический результат достигается тем, что способ получения биодеградируемого полимерного покрытия с контролируемым выходом лекарственного средства для малоинвазивной хирургии включает:
1) растворение хитозана в кислотах, добавление лекарственного средства, окунание проволоки из никелида титана в полученный раствор, фиксацию покрытия раствором аммиака и сушку;
2) использование в качестве растворителя фосфорной, или соляной, или глутаминовой, или уксусной кислоты с концентрацией от 1 до 4% вес.;
3) использование в качестве лекарственного средства линкомицина, либо гентамицина, либо цефотоксима с концентрацией от 0,9 до 7% вес.;
4) фиксирование покрытия в спиртовом аммиачном растворе в соотношении 1:2 с последующей сушкой при температуре 40-450°С в течение 24 часов.
Сущность изобретения
Биодеградируемое полимерное покрытие должно обладать возможностью длительного и стационарного поддержания необходимого уровня лекарственного препарата в зоне имплантации в течение требуемого времени несмотря на ток крови, что может быть обеспечено равномерным контролируемым выходом лекарственного средства из покрытия.
В качестве исходных компонентов для покрытия используется хитозан (линейный биодеградируемый полисахарид, известен своей нетоксичностью, неиммуногенностью, заживлением ран и антимикробными свойствами; в структуре хитозана присутствуют активные амино- и гидроксильные функциональные группы, пригодные для закрепления и постепенного выделения лекарственных средств непосредственно в месте лечения) высокомолекулярный (500 кДа) и среднемолекулярный (500 кДа).
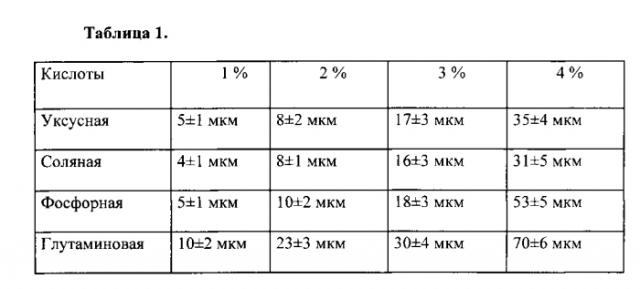
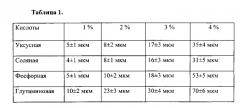
Растворы хитозана готовят на основе уксусной, соляной, фосфорной и глутаминовой кислот концентрацией от 1 до 4%, способствующей гомогенности полимерного слоя толщиной от 4 до 70 мкм. Из таблицы 1 видна зависимость толщины покрытия от типа и концентрации растворителя. Оптимальной выбрана концентрация кислоты 3%, способствующая формированию толщины 15-30 мкм с наилучшими механическими характеристиками и биодеградацией. В качестве наполнителя слоя используются антибиотики. Скорость биодеградации покрытия при рН среды от 5,8 до 9,2 в зависимости от хитозана (высокомолекулярный или среднемолекулярный) и типа антибиотика (линкомицин, цефотоксим, гентамицин) составляет от 4 до 358 дней. В зависимости от вводимого антибиотика и его концентрации от 0,9 до 7% наблюдается изменение скорости выхода от 100% в течение первых суток до начала выхода только на 10 сутки. При разном составе и толщине покрытия можно получить различную биодеградацию покрытий в зависимости от необходимого применения.
Пример 1
Получали покрытие хитозан с введенным линкомицином на проволоке из никелида титана.
Приготовление 3%-ных растворов высокомолекулярного хитозана (500 кДа, поставщик Aldrich) в 3%-ных растворах кислот (на 100 грамм дистиллированной воды 3,2 грамма хитозана и 3,2 грамма кислоты) проводили перемешиванием до гомогенного состояния в течение полутора часов с помощью верхнеприводной мешалки при температуре раствора 40°C. В качестве исходной кислоты использовалась глутаминовая. В полученный гомогенный раствор вводили лекарственный препарат (линкомицин) в количестве, необходимом для получения 3,2% растворов (в 50 мл раствора добавляют 2 г порошка антибиотика). Смешивание производится в стеклянном стакане с помощью механической лопастной мешалки. Скорость перемешивания составляет 200 об/мин, время перемешивания - 30 мин.
Проволока из никелида титана окунается в охлажденный (+5°C) раствор хитозана с лекарственными препаратами, после чего перекладывается в фиксирующий раствор (готовят смешением аммиачной воды и этилового спирта в отношении 2 к 1) и выдерживается. Затем проводят сушку при температуре 40-45°C в течение 24 часов. Образцы отмывают в фиксирующем растворе для нейтрализации и удаления кислот в течение 5 часов при комнатной температуре с последующей промывкой в дистиллированной воде, а затем в этиловом спирте. Полученное покрытие, нанесенное на никелид титана, сушат при 40°C в течение 24 часов.
Динамика выхода линкомицина из покрытия в растворы, моделирующие внеклеточные жидкости организма, представлена на рис. 1, из которого видно, что равномерный выход линкомицина достигается на 6-й день.
Пример 2
Получали покрытие хитозан с введенным цефотоксимом на проволоке из никелида титана.
Приготовление 3%-ных растворов высокомолекулярного хитозана (500 кДа, поставщик Aldrich) в 3%-ных растворах кислот (на 100 грамм дистиллированной воды 3,2 грамма хитозана и 3,2 грамма кислоты) проводили перемешиванием до гомогенного состояния в течение полутора часов с помощью верхнеприводной мешалки при температуре раствора 40°C. В качестве исходной кислоты использовалась глутаминовая. В полученный гомогенный раствор вводили лекарственный препарат (цефотоксим) в количестве, необходимом для получения 3,2% растворов (в 50 мл раствора добавляют 2 г порошка антибиотика). Смешивание производится в стеклянном стакане с помощью механической лопастной мешалки. Скорость перемешивания составляет 200 об/мин, время перемешивания 30 мин.
Проволока из никелида титана окунается в охлажденный (+5°C) раствор хитозана с лекарственными препаратами, после чего перекладывается в фиксирующий раствор (готовят смешением аммиачной воды и этилового спирта в отношении 2 к 1) и выдерживается. Затем проводят сушку при температуре 40-45°C в течение 24 часов. Образцы отмывают в фиксирующем растворе для нейтрализации и удаления кислот в течение 5 часов при комнатной температуре с последующей промывкой в дистиллированной воде, а затем в этиловом спирте. Полученное покрытие, нанесенное на никелид титана, сушат при 40°C в течение 24 часов.
Динамика выхода цефотоксима из покрытия в растворы, моделирующие внеклеточные жидкости организма, представлена на рис. 2, из которого видно, что равномерный выход цефотоксима достигается на 1-й день.
Пример 3
Получали покрытие хитозан с введенным гентамицином на проволоке из никелида титана.
Приготовление 3%-ных растворов высокомолекулярного хитозана (500 кДа, поставщик Aldrich) в 3%-ных растворах кислот (на 100 грамм дистиллированной воды 3,2 грамма хитозана и 3,2 грамма кислоты) проводили перемешиванием до гомогенного состояния в течение полутора часов с помощью верхнеприводной мешалки при температуре раствора 40°C. В качестве исходной кислоты использовалась глутаминовая. В полученный гомогенный раствор вводили лекарственный препарат (гентамицин) в количестве, необходимом для получения 3,2% растворов (в 50 мл раствора добавляют 2 г порошка антибиотика). Смешивание производится в стеклянном стакане с помощью механической лопастной мешалки. Скорость перемешивания составляет 200 об/мин, время перемешивания 30 мин.
Проволока из никелида титана окунается в охлажденный (+5°C) раствор хитозана с лекарственными препаратами, после чего перекладывается в фиксирующий раствор (готовят смешением аммиачной воды и этилового спирта в отношении 2 к 1) и выдерживается. Затем проводят сушку при температуре 40-45°C в течение 24 часов. Образцы отмывают в фиксирующем растворе для нейтрализации и удаления кислот в течение 5 часов при комнатной температуре с последующей промывкой в дистиллированной воде, а затем в этиловом спирте. Полученное покрытие, нанесенное на никелид титана, сушат при 40°C в течение 24 часов.
Динамика выхода гентамицина из покрытия в растворы, моделирующие внеклеточные жидкости организма, представлена на рис. 3, из которого видно, что равномерный выход гентамицина достигается на 7-й день.
Способ получения биодеградируемого полимерного покрытия с контролируемым выходом лекарственного средства для малоинвазивной хирургии, включающий растворение хитозана в кислотах, добавление лекарственного средства, окунание проволоки из никелида титана в полученный раствор, фиксацию покрытия и сушку, отличающийся тем, что для растворения хитозана в качестве растворителя используются фосфорную, или соляную, или глутаминовую, или уксусную кислоты с концентрацией от 1 до 4% вес., в качестве лекарственного средства используется линкомицин, либо гентамицин, либо цефотоксим с концентрацией от 0,9 до 7% вес., фиксация покрытия происходит в спиртовом аммиачном растворе в соотношении 1:2 с последующей сушкой при температуре 40-45°С в течение 24 часов.