Способ получения пан-цзк-ингибиторов формулы (i), а также промежуточные соединения для получения
Иллюстрации
Показать всеИзобретение относится к новому способу получения ингибиторов пан-ЦЗК (циклинзависимой киназы) общей формулы (I). Соединения общей формулы (I)
в которой R4 означает (С1-С6)-алкильную группу или (С3-С7)-циклоалкильное кольцо, получают путем катализируемого бензолсульфоновой кислотой присоединения предварительно полученных соединений (I-7-A) к (I-4-R) с получением солей бензолсульфоновой кислоты (BSA) защищенных анилинопиримидинов формулы (I-8-R-BSA)
,
с отщеплением защитных групп в солях формулы (I-8-R-BSA) гидрированием водородом в присутствии палладия на активном угле в метаноле и обработкой карбонатом калия в метаноле с получением соединений формулы (I).
Изобретение также относится к новым промежуточным соединениям структурных формул (I-8-А-R-BSA) и (I-11-A-R-D-Tol-Tart).
,
Способ упрощает условия получения промежуточных и целевых продуктов, что позволяет его использовать в промышленном масштабе. 3 н. и 4 з.п. ф-лы, 2 табл.
Реферат
Данное изобретение относится к новому способу получения пан-ЦЗК (циклин зависимой киназы)-ингибиторов формулы (I), а также к промежуточным соединениям для получения.
Новый способ относится к соединениям формулы (I), в частности, к соединению (2R,3R)-3-{[2-{[4-(S-циклопропилсульфонимидоил)-фенил]амино}-5-(трифторметил)пиримидин-4-ил]окси}бутан-2-олу (соединение А), которое проявляет свою противоопухолевую активность через клеточнотоксичный механизм. Был открыт способ получения соединения общей формулы (I)
,
в которой
R4 означает (C1-С6)-алкильную группу или (C3-C7)-циклоалкильное кольцо,
который подходит для крупного масштабного производства и в котором преодолены недостатки способа уровня техники для получения соединений этого класса веществ.
Этот способ получения особенно подходит для получения соединения А
В данном изобретении использованы следующие обозначения:
(С1-С6)-алкил
Под (C1-С6)-алкильной группой в каждом случае понимают линейный или разветвленный алкильный радикал, такой как, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил или гексил.
(С3-С7)-циклоалкил
Под (С3-С7)-циклоалкильным кольцом понимают циклопропильное, циклобутильное, циклопентильное, циклогексильное или циклогептильное кольцо.
Соединения общей формулы (I), в частности, также соединение А и способ их получения опубликованы в WO 2010/046035 A1, эта публикация соответствует современному уровню техники.
Способ согласно WO 2010/046035 A1 представляет собой 10-стадийный конвергентный способ с общим выходом для самой длинной последовательности около 7%.
Способ согласно WO 2010/046035 A1 включает, как минимум, одну из следующих стадий:
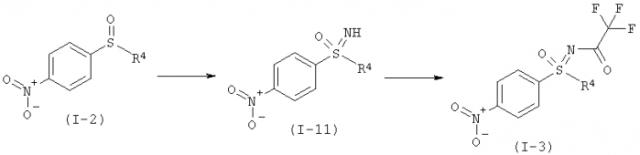
а) Окисление нитрофенилсульфида формулы (I-1) в нитрофенил-сульфоксид формулы (I-2).
b1) Прямое иминирование нитрофенилсульфоксида формулы (I-2) в защищенный трифторацетатом нитрофенилсульфоксимин формулы (I-3).
b2) Иминирование нитрофенилсульфоксида формулы (I-2) в нитрофенилсульфоксимин формулы (I-11) и последующее введение защитной группы с образованием защищенного трифторацетатом нитрофенилсульфоксимина формулы (I-3).
с) Восстановление соединения формулы (I-3) в соединение формулы (I-4).
d) Функционализирование 4-положения 2,4-дихлор-5-йодпиримидина путем взаимодействия с монозащищенным диолом формулы (I-5) с образованием защищенного гидрокси-алкокси-пиримидина формулы (I-6).
e) Получение защищенного 5-CF3 промежуточного соединения (I-7).
f) Связывание соединений формулы (I-7) и (I-4) с образованием двукратно защищенного анилино-пиримидина формулы (I-8).
g) Отщепление защитной группы (PG) с образованием однократно защищенного анилино-пиримидина (I-9).
h) Отщепление защитной группы у сульфоксимина с образованием соединений формулы (I).
Причем, в WO 2010/046035A1
R1 означает метил, этил, пропил или изопропил, и
R2 и R3 независимо один от другого означают водород, метил или этил, и
R4 означает (C1-С6)-алкил или (С3-С7)-циклоалкильное кольцо.
Диастереомеры формулы I разделяют с помощью препаративной хроматографии. Подробности эксперимента приведены в WO 2010/046035 A1.
Для соединения А в WO 2010/046035 A1 опубликованы следующие условия для отдельных стадий синтеза.
Получение промежуточных продуктов
1-Циклопропилсульфанил-4-нитробензол (I-1-А)
К циклопропантиолу в тетрагидрофуране (ТГФ) / диэтиловом эфире добавляют по порциям гидрид натрия и перемешивают при комнатной температуре. Затем добавляют по порциям 1-фтор-4-нитробензол. Реакционную смесь перемешивают в течение 2 часов при 40°С. После охлаждения реакционную смесь подают в воду и проводят трехкратную экстракцию бензолом. Отгоняют растворитель из объединенных органических фаз и остаток чистят хроматографически (гексан / уксусный эфир 95:5). (Выход: 61%).
(RS)-1-Циклопропансульфинил-4-нитробензол (I-2-A)
К 1-циклопропилсульфанил-4-нитробензолу в ацетонитриле добавляют хлорид железа(III) и перемешивают при комнатной температуре. Затем добавляют по порциям перйодную кислоту. Реакционную смесь перемешивают в течение 30 минут и затем выливают при перемешивании в охлажденный насыщенный раствор тиосульфата натрия. Проводят двукратную экстракцию эфиром уксусной кислоты. Объединенные органические фазы сушат над Na2SO4, фильтруют и отгоняют растворитель. Полученный остаток чистят на хроматографе (гексан / уксусный эфир 1:1). (Выход: 76%).
(RS)-S-Циклопропил-S-(4-нитрофенил)-N-(трифторацетил)-сульфоксимид (I-3-А)
К суспензии (RS)-1-циклопропансульфинил-4-нитробензола, трифторацетамида, йодбензолдиацетата и оксида магния в дихлорметане (ДХМ) добавляют в атмосфере аргона димер ацетата родия(II) и перемешивают в течение ночи при комнатной температуре. Реакционную смесь фильтруют через целит и отгоняют растворитель. Полученный остаток чистят хроматографически (гексан / эфир уксусной кислоты 2:1) (выход: 78%).
(RS)-S-(4-аминофенил)-S-циклопропил-N-(трифторацетил)-сульфоксимид (I-4-А)
К раствору (RS)-S-циклопропил-S-(4-нитрофенил)-N-(трифторацетил)сульфоксимида в этаноле и тетрагидрофуране добавляют палладий на угле и гидрируют в течение 1 часа при нормальном давлении и температуре 25°С. Добавляют еще палладия на угле и продолжают гидрирование еще 4,5 часа при нормальном давлении. Реакционную смесь фильтруют, к фильтрату снова добавляют палладий на угле и гидрируют еще 45 минут. Реакционную смесь фильтруют и отгоняют растворитель (выход: 93%).
(2R,3R)-3-бензилоксибутан-2-ол (I-5-A)
К раствору (2R,3R)-бутан-2,3-диола в ТГФ при комнатной температуре добавляют трет-бутилат калия и реакционную смесь нагревают в течение 15 минут в условиях рефлюкса. Реакционную смесь охлаждают до температуры около 50°С и добавляют бензилбромид. Нагревают в условиях рефлюкса в течение 3 часов, после этого перемешивают в течение ночи при комнатной температуре. Реакционную смесь разбавляют эфиром уксусной кислоты и раствором хлористого натрия, а затем промывают однократно 1 Н раствором хлористого водорода и двукратно раствором хлористого натрия. Органическую фазу сушат над Na2SO4, фильтруют и отгоняют растворитель. Полученный остаток чистят хроматографически (гексан / эфир уксусной кислоты 1:1) (выход: 43%).
4-((1R,2R)-2-бензилокси-1-метилпропокси)-2-хлор-5-йодпиримидин (I-6-A)
К (2R,3R)-3-бензилоксибутан-2-олу в диэтиловом эфире добавляют при температуре 0°С при перемешивании по порциям гидрид натрия. Через 10 минут убирают ледяную баню и перемешивают еще 3 минуты при комнатной температуре. Образовавшуюся суспензию добавляют при температуре 0°С к раствору 2,4-дихлор-5-йодпиримидина. Реакционную смесь перемешивают в течение 4 часов при температуре 40°С и затем добавляют разбавленный раствор хлористого натрия. Экстрагируют двукратно эфиром уксусной кислоты. Объединенные органические фазы сушат над Na2SO4, фильтруют и отгоняют растворитель. Полученный остаток чистят хроматографически (гексан / эфир уксусной кислоты 4:1) (выход: 41%).
4-((1R,2R)-2-бензилокси-1-метилпропокси)-2-хлор-5-трифторметил-пиримидин (I-7-А)
К раствору 4-((1R,2R)-2-бензилокси-1-метилпропокси)-2-хлор-5-йодпиримидина в N-метилпирролидиноне (NMП) и ТГФ добавляют при комнатной температуре при перемешивании йодид меди(1), фторид калия и (трифторметил)триметилсилан. Реакционную смесь перемешивают в течение 5,5 часов при температуре 80°С. После охлаждения реакционную смесь подают в разбавленный раствор хлористого натрия и 2 раза экстрагируют эфиром уксусной кислоты. Объединенные органические фазы сушат над Na2SO4, фильтруют и отгоняют растворитель. Полученный остаток чистят хроматографически (гексан / эфир уксусной кислоты 4:1) (выход: 54%).
(RS)-S-(4-{[4-{[(1R,2R)-2-(бензилокси)-1-метилпропил]окси}-5-(трифторметил)пиримидин-2-ил]амино)фенил)-S-циклопропил-N-(трифторацетил)сульфоксимид (I-8-А)
К 4-((1R,2R)-2-бензилокси-1-метилпропокси)-2-хлор-5-трифтор-метилпиримидину и (RS)-S-(4-аминофенил)-S-циклопропил-N-(трифторацетил)сульфоксимиду в ацетонитриле добавляют 4Н раствор хлористого водорода в диоксане и перемешивают в течение 5 часов при температуре 80°С. После охлаждения реакционную смесь разбавляют эфиром уксусной кислоты и промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлористого натрия, сушат над Na2SO4, фильтруют и отгоняют растворитель. Полученный остаток чистят хроматографически (гексан / эфир уксусной кислоты 4:1) (выход: 56%).
(RS)-S-циклопропил-S-(4-{[4-{[(1R,2R)-2-гидрокси-1-метилпропил]-окси}-5-(трифторметил)пиримидин-2-ил]амино)фенил)-N-(трифторацетил)сульфоксимид (I-9-А)
К раствору (RS)-S-(4-{[4-{[(1R,2R)-2-(бензилокси)-1-метил-пропил]окси}-5-(трифторметил)пиримидин-2-ил]амино}фенил)-S-циклопропил-N-(трифторацетил)сульфоксимида в этаноле добавляют палладий на угле (10-процентный) и гидрируют при нормальном давлении при комнатной температуре. Реакционную смесь фильтруют и отгоняют растворитель (выход: 79%).
Получение соединения А
К (RS)-S-циклопропил-S-(4-{[4-{[(1R,2R)-2-гидрокси-1-метил-пропил]окси}-5-(трифторметил)пиримидин-2-ил]амино}фенил)-N-(трифторацетил)сульфоксимиду в 35 мл метанола добавляют карбонат калия и перемешивают в течение 1,5 часов при комнатной температуре. Разбавляют насыщенным раствором хлористого натрия и экстрагируют 3 раза эфиром уксусной кислоты. Объединенные органические фазы сушат над Na2SO4, фильтруют и отгоняют растворитель.
Смесь диастереомеров разделяют препаративной жидкостной хроматографией высокого разрешения (ЖХВР) на чистые стереоизомеры:
колонка: Chiralpak IA 5 мкм 250×30 мм,
элюент: гексан / этанол 8:2,
поток: 40,0 мл/мин,
детектор: УФ 254 нм,
температура: комнатная температура,
время удерживания: 10,8-13,4 мин; стереоизомер 1, 13,6-18,5 мин; стереоизомер 2 (соединение А).
Это получение соединения формулы (I) согласно WO 2010/046035А1 не подходит для способа производства.
К критическим пунктам относятся:
- На большей части промежуточных стадий проводится хроматографическая очистка. Это является дорогостоящим и затратным при больших масштабах.
- Исходный материал (I-1) получают из циклопропилсульфида, который отсутствует в продаже в больших количествах.
- Для получения (I-2) применяется рацемический способ окисления. Поэтому стереоизомеры по окончании синтеза должны быть разделены хроматографически. В связи с тем, что разделение проводят только после окончания синтеза, общий выход для последовательного синтеза сильно уменьшается.
- При получении (I-3) применяют большие количества димера ацетата родия (II). Это дорого и родий необходимо удалить, для того чтобы не загрязнять биологически активное вещество. Йодбензолдиацетат не подходит для крупного масштабного производства, так как в больших количествах его трудно получить и он потенциально является взрывчатым веществом.
- Альтернативное получение (I-3) через (I-2) и (I-2/3) непросто осуществить, исходя из оснований безопасности, так как применяются токсичные и взрывчатые вещества, такие как азид натрия или о-мезитиленсульфонилгидроксиламин (МСГ).
- Синтез (I-5-А) не является селективным, так как также происходит двойное алкилирование. Выход составляет поэтому только 43%.
- Последовательность (I-6)-(I-7) не конвергентна, так как трифторметильная группа не переносится вместе с пиримидиновой основой. Выходы обеих стадий плохие. В связи с тем, что превращения связаны с образованием многих побочных компонентов, приходится проводить затратную хроматографию.
- Промежуточное соединение (I-8) образуется в виде масла, которое чистят только хроматографически. Масло трудно получить в промышленном масштабе, и оно отличается плохой стабильностью при хранении по сравнению с твердым веществом.
- На стадии (I-9) проводят препаративное разделение диастереомеров. Это очень затратно и дорого. Кроме того, теряется много от общего выхода, так как разделение предпринимают на последней стадии синтеза.
Эти аспекты следовало бы оптимизировать при расширении синтеза в многограммовом, соответственно, килограммовом масштабе.
В связи с этим задача данного изобретения состояла в том, чтобы представить в распоряжение способ получения пан-ЦЗК-ингибиторов общей формулы (I), в частности, соединения А, у которого отсутствуют приведенные выше недостатки.
I. Стадии способа согласно данному изобретению для получения соединения общей формулы (I)
Способ получения согласно данному изобретению отличается различными предпочтительными стадиями получения, а также промежуточными веществами.
Способ получения согласно данному изобретению соединений общей формулы (I) характеризуется, как минимум, одной из следующих стадий:
I.а). Алкилирование 4-нитротиофенола в присутствии карбоната калия в N-метилпирролидиноне (NMП) с получением нитрофенил-сульфида формулы (I-1)
,
причем, X означает Br, Cl, I, О-SO2-СН3 или O-SO2-(4-метилфенил).
I.b). Окислительное аминирование нитрофенилсульфида формулы (I-1) в защищенный трифторацетатом нитрофенилсульфилимин формулы (I-10)
,
I.с) Окисление защищенного трифторацетатом нитрофенилсульфилимина формулы (I-10) в защищенный трифторацетатом нитрофенилсульфоксимин формулы (I-3) и последующее снятие защиты с образованием нитрофенилсульфоксимина формулы (I-11)
.
I.d) Расщепление рацематов (гас.) нитрофенилсульфоксимина формулы (I-11) с помощью (+)-ди-О-п-толуол-D-винной кислоты (D-Tol-Tart)
,
причем, R-энантиомер нитрофенилсульфоксимина формулы (I-11-R) высвобождают исключительно из солей и вновь вводят трифторацетатную защитную группу с образованием R-энантиомера защищенного трифторацетатом нитрофенилсульфоксимина формулы (I-3-R).
I.e) Гидрирование защищенного трифторацетатом нитрофенилсульфоксимина формулы (I-3-R) с образованием защищенного трифторацетатом анилиносульфоксимина формулы (I-4-R) в присутствии легированного железом палладиевого катализатора
I.f). Получение (2R,3R)-3-(бензилокси)бутан-2-ола (I-5-A) в двухстадийном процессе через (4R,5R)-4,5-диметил-2-фенил-1,3-диоксолан (I-12-A), причем, первую стадию с пиридиний-п-толуолсульфонатом проводят в толуоле и затем проводят восстановление диизобутилалюминийгидридом в толуоле
.
I.g). Присоединение (I-5-А) к 2,4-дихлор-5-трифторметил-пиримидину происходит с образованием 4-{[(2R,3R)-3-(бензилокси)бутан-2-ил]окси}-2-хлор-5-(трифторметил)-пиримидина (I-7-A) в присутствии Li-оснований в простых эфирных растворителях
I.h) Получение солей бензолсульфоновой кислоты (BSA) двукратно защищенных анилинопиримидинов формулы (I-8-R-BSA) путем катализируемого бензолсульфоновой кислотой присоединения (I-7-A) к (I-4-R)
I.i) Отщепление защитных групп в солях бензолсульфоновой кислоты (BSA) двукратно защищенных анилинопиримидинов формулы (I-8-R-BSA) путем гидрирования водородом в присутствии паладия на активном угле в метаноле, а также обработки карбонатом калия в метаноле с получением соединений формулы (I)
Стадии получения "северной половины" соединений формулы (I)
I.a) Получение нитрофенилсульфидов формулы (I-1)
Одним из объектов данного изобретения относится к стадии алкилирования 4-нитрофенола.
Согласно WO 2010/046035 А1 исходный материал (I-1) получен из циклопропилсульфида. Последний имеется в продаже только в небольших количествах. В связи с этим перестроились на алкилирование имеющегося в продаже 4-нитротиофенола с применением алкилирующих агентов (X-R4) в присутствии вспомогательного основания, причем, Х означает Br, Cl, I, O-SO2-СН3 или O-SO2-(4-метилфенил). В качестве оснований подходят карбонат натрия, карбонат калия или карбонат цезия, более предпочтителен карбонат калия. В качестве растворителя подходят N,N-диметилформамид. N-метилпирролидинон, диметилсульфоксид, N,N-диметилацетамид, более предпочтителен N-метилпирролидинон (NMП).
Другие объекты данного изобретения относятся к окислительному аминированию нитрофенилсульфидов формулы (I-1) с образованием защищенных трифторацетатом нитрофенилсульфилиминов формулы (I-10) (фиг.2) и заключительное окисление в нитрофенил-сульфоксимины формулы (I-11) (фиг.3).
I.b) Получение защищенных трифторацетатом нитрофенилсульфилиминов формулы (I-10)
Современный уровень техники для получения сульфилиминов
Цель состояла в прямом аминировании сульфидов для препаративно хорошо применяемых защищенных трифторацетатом сульфилиминов с применением простых исходных материалов, таких как, например, 2,2,2-трифторацетамид (CF3CONH2). Carreira и др. (Orgr. Lett. 1999, 1, 149-151) описывают Cu-катализируемое прямое аминирование в защищенные трифторацетатом сульфилимины с помощью литиированного гидроксиламина трифторуксусной кислоты (ТФУК), который однако до этого надо получить в две стадии и который отсутствует в продаже. Энантиоселективно удается осуществить это превращение со стехиометрическим количеством нитридо-Mn комплекса (Helv. Chim. Acta. 2002, 3773-3783).
Bolm и др. сообщают (Tetrahedron Letters 2005), что прямое без участия металлов иминирование сульфидов возможно. Предлагаются п-нитрофенилсульфонамид (носиламид, Nos-NH2) и (диацетоксийод)бензол (PhI(OAc)2) и получают носил-защищенные сульфинимины после 16 часов нагревания в условиях рефлюкса. Для реакции в крупных промышленных масштабах эти условия однако мало подходят, так как п-нитрофенилсульфонамидная защитная группа с трудом удаляется и (диацетоксийод)бензол имеется в продаже в небольших количествах.
В качестве окислительного средства в превращении согласно данному изобретению согласно фиг.2 применяют среди других N-бромсукцинимид, йод, гипобромид натрия, 1,3-дибром-5,5-диметилгидантоин, N-хлорсукцинимид и трихлорциануровую кислоту в присутствии таких оснований, как карбонат цезия, трет-бутилат калия, трет-бутилат натрия, водный натронный щелок, метанолат натрия, этанолат натрия, гидрид натрия (NaH) в таких растворителях, как метанол, дихлорметан, тетрагидрофуран-вода, ацетонитрил, ацетонитрил-вода, тетрагидрофуран (ТГФ), пропионитрил, метил-трет-бутиловый эфир, 1,4-диоксан, хлорбензол.
Предпочтительным окислительным средством является 1,3-дибром-5,5-диметилгидантоин.
В качестве комбинации растворитель-основание предпочтительны комбинации ацетонитрил-карбонат цезия, 1,4-диоксан-гидрид натрия, дихлорметан-трет-бутилат калия, ацетонитрил-гидрид натрия, тетрагидрофуран-гидрид натрия или метил-трет-бутиловый эфир-гидрид натрия.
Желательная реакция протекает полностью уже при температуре около 20°С в течение нескольких часов без добавления катализатора.
По сравнению с известными из литературы способами новый способ окислительного аминирования, показанный на фиг.2, обладает следующими преимуществами:
- можно отказаться от применения дорогого и потенциально взрывоопасного (диацетоксийод)бензола, а также от добавок солей металлов;
- образуется только небольшое количество сульфоксида и реакция протекает при мягких условиях уже при температуре около 20°С с использованием коммерчески доступных базовых веществ и реагентов;
- трифторацетатная группа легко гидролизуется (например, карбонатом калия в метаноле) и в связи с этим представляет собой большую препаративную ценность.
Не только нитрофенилсульфиды формулы (1-1) удается окислительно аминировать согласно стадии I.b).
Этим способом можно также получить другие защищенные трифторацетатом сульфилимины.
В таблице 1 показаны другие, получаемые с помощью этой стадии доступные сульфилимины.
| Таблица 1 | ||
| Вещество | Сульфилимин | Выход |
| 1 | 81% | |
| 2 | 88% | |
| 3 | 80% | |
| 4 | 75% | |
| 5 | 74% | |
| 6 | 71% |
I.с) Получение нитрофенилсульфоксиминов формулы (I-11)
Окисление защищенного трифторацетатом нитрофенилсульфилимина (I-10) в нитрофенилсульфоксимин (I-11) происходит предпочтительно при применении пероксомоносульфата калия (оксон®) в качестве окислительного средства.
Желательное окисление происходит особенно быстро в основной области рН-значений. В этих условиях одновременно отщепляется трифторацетатная группа, так что при необходимости примыкающая стадия снятия защиты может быть проведена как реакция, происходящая в одном реакторе.
Реакцию предпочтительно проводят в смеси метанол-вода с добавлением тетраметиленсульфона (сульфолан), в качестве вещества, способствующего растворению. Пероксомоносульфат калия (оксон®) добавляют по порциям и рН-значение после каждого дозирочного шага устанавливают равным рН 10.
I.d) Расщепление рацематов нитрофенилсульфоксиминов формулы (I-11).
Другой объект данного изобретения относится к расщеплению рацематов нитрофенилсульфоксиминов формулы (I-11).
Расщепление рацематов опирается на следующую стадию:
Неожиданно, например, для нитрофенилсульфоксимина формулы (I-11-А) было обнаружено, что с помощью (+)-ди-О-п-толуоил-D-винной кислоты (D-Tol-Tart) удается получить соотношение энантиомеров 95:5 в кристаллизате. В качестве растворителя можно применять ацетонитрил, пропионитрил или толуол. Более предпочтительны ацетонитрил или пропионитрил.
Интегрирование процесса кристаллизации в способ получения может происходить в результате того, что защитную трифторацетатную группу в (I-3) отщепляют карбонатом калия в метаноле и неочищенный нитрофенилсульфоксимин (I-11) подвергают взаимодействию с (+)-ди-О-п-толуоил-D-винной кислотой с образованием (I-11-R-D-Tol-Tart).
Толуоил-О-винную кислоту удаляют основной экстракцией из соли и оптически активный нитрофенилсульфоксимин формулы (I-11-R) можно с помощью способа, проводимого в одном реакторе, защитить ангидридом трифторуксусной кислоты в присутствии триэтиламина с образованием (I-3-R).
I.e) Гидрирование защищенного трифторацетатом нитрофенил-сульфоксимина формулы (I-3-R) в защищенный трифторацетатом анилиносульфоксимин формулы (I-4-R)
Другим объектом данного изобретения является гидрирование защищенного трифторацетатом нитрофенилсульфоксимина формулы (I-3-R) с получением защищенного трифторацетатом анилино-сульфоксимина формулы (I-4-R) в присутствии легированного железом палладиевого катализатора.
Восстановление нитрогруппы в соединении (I-3-R) в соответствующую анилиновую группу (I-4-R) удается эффективно провести путем гидрирования с помощью иммобилизированного палладиевого катализатора. При этом предпочтительны легированные железом палладиевые катализаторы на угле. В качестве растворителей могут применяться метанол, этанол, изо-пропанол, тетрагидрофуран или уксусная кислота. Более предпочтителен метанол.
Стадии получения "южной половины" соединении формулы (I)
I.f) Получение (R,R)-диметилдиоксолана (I-12-A) и (R,R)-бензилбурандиола (I-5-А)
Другой объект данного изобретения относится к получению (4R,5R)-4,5-диметил-2-фенил-1,3-диоксолана (I-12-A) и (2R,3R)-3-(бензилокси)бутан-2-ола (I-5-A) для "южной половины" соединений формулы (I).
Согласно WO 2010/046035A1 подвергают взаимодействию имеющийся в продаже (R,R)-бутан-2,3-диол с бензилхлоридом в одну стадию с получением монобензилированного (I-5-A). В связи с тем, что взаимодействие протекает не селективно с получением моносоединения, реакционную смесь необходимо чистить хроматографически и в связи с этим выходы составляют около менее 50%.
В качестве альтернативы вводится двухстадийный процесс (Bloorg. Med. Cheia. Lett. 2006, 16, 186-190).
Объектом изобретения является выяснение экспериментальных условий для полного превращения, а также простое выделение и очистка, которые подходят для промышленных масштабов производства.
Промежуточное соединение (4R,5R)-4,5-диметил-2-фенил-1,3-диоксолан (I-12-A) получают подходящим образом путем превращения бензальдегиддиметилацеталя и избытка (2R,3R)-бутан-2,3-диола в присутствии пиридиний-п-толуолсульфоната в толуоле в качестве растворителя. Реакция протекает при температуре около 50°С полностью в течение 3 часов, причем, метанол следует постоянно отгонять при пониженном давлении.
В рамках водной переработки избыток диола удаляют путем экстракции. Остающуюся толуольную фазу можно напрямую применять на следующей стадии.
Для последующего восстановления с помощью диизобутилалюминийгидрида (ДИБАЛ) добавляют 1,5 М раствор диизобутилалюминийгидрида в толуоле при температуре 55-60°С. Для переработки дозируют декагидрат сульфата натрия и растворитель отгоняют после фильтрования. Получают соединение (I-5-A) с хорошей чистотой и выходом. Продукт без дальнейшей очистки можно применять на следующей стадии.
I.g) Получение 4-{[(2R,3R)-3-(бензилокси)бутан-2-ил]окси)-2-хлор-5-(трифторметил)пиримидина (I-7-А)
Нуклеофильное монозамещение одного атома хлора в коммерчески доступном 2,4-дихлор-5-трифторметилпиримидине происходит предпочтительно во 2-положении
Неожиданно было открыто, что вариацией условий замещения можно направить замещение в желательное 4-положение. Удалось показать, что Li-основания в растворах простых эфиров при температуре -30°С дает хорошие выходы и в лучшем случае соотношение 4-изомера / 2-изомеру, равное 1,2:1. В качестве растворителя можно применять, например, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, метил-трет-бутиловый эфир, диизопропиловый эфир, ди-н-бутиловый эфир, 2-метилтетрагидрофуран или циклопентилметиловый эфир. Более предпочтителен тетрагидрофуран. В качестве оснований можно, например, применять гексаметилдисилазид лития, н-бутиллитий, диизопропиламид лития или литий-2,2,6,6-тетраметилпиперидин. Более предпочтителен гексаметилдисилазид лития. Работают в температурном интервале от -78°С до +20°С. Из этого выводится стадия способа согласно данному изобретению, которая проводится с гексаметилдисилазидом лития в тетрагидрофуране при температуре -30°С с получением после хроматографирования желательного изомера (I-7-A) с выходом до 46% и чистотой более 95 F1% (процентная доля площади).
Соединение вместе северной и южной половины и получение соединений формулы (I)
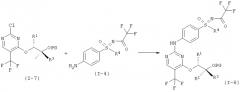
I.h) Получение анилинопиримидинов формулы (I-8-R-BSA)
Оба структурных элемента (I-7-A) и (I-4-R) соединяют в (I-8-R). Это взаимодействие проводят в присутствии кислоты. К подходящим кислотам относятся, например, хлористоводородная кислота, п-толуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота. Более предпочтительна бензолсульфоновая кислота.
Свободные основания (I-8-R) обычно являются маслами, что затрудняет их очистку, а также хранение. Неожиданно было открыто, что при применении бензолсульфоновой кислоты (BSA) из реакционной смеси кристаллизуются образовавшиеся соли бензолсульфоновой кислоты (I-8-R-BSA). Соли (I-8-R-BSA) можно чистить кристаллизацией и стабильны при хранении.
Альтернативно можно применять толуолсульфоновую кислоту или метансульфоновую кислоту.
I.i) Получение соединений формулы (I)
На последних двух стадиях отщепляют защитные группы (фиг.11).
Гидрирование при нормальном давлении проводят с палладием / углеродом и водородом в метаноле в течение нескольких часов с образованием промежуточного соединения формулы (I-9-R-BSA).
Промежуточное соединение формулы (I-9-R-BSA) можно далее напрямую превратить в конечную стадию. Отщепление группы можно полностью завершить с помощью карбоната калия, и кристаллизация конечной стадии проводится из этилового эфира уксусной кислоты/н-гептана.
II. Промежуточные соединения
Далее предметом данного изобретения являются следующие промежуточные соединения
II.а) Защищенные трифторацетатом нитрофенилсульфинилимины формулы (I-10), в частности (I-10-A)
, .
II.b) Нитрофенилсульфоксимины формулы (I-11-R), в частности (I-11-A) и (I-11-A-R)
, , .
II.с) (R)-энантиомеры защищенных трифторацетатом нитрофенил-сульфоксиминов формулы (I-3-R), в частности (I-3-A-R)
, .
II.d) Соли (I-11-R-D-Tol-Tart) нитрофенилсульфоксиминов формулы (I-11-R) с (+)-ди-О-п-толуоил-D-винной кислоты (D-Tol-Tart), в частности (I-11-A-R-D-Tol-Tart)
, .
I.e) Анилинопиримидины формулы (I-8-R-BSA), в частности (I-8-A-R-BSA)
, .
причем, R4 в каждом случае означает (C1-C6)-алкильную группу или (С3-С7)-циклоалкильное кольцо.
1-А. Получение соединения А
Получение "северной половины" соединения А
1-А.а) Получение циклопропилнитрофенилсульфида (I-1-A)
На первой стадии последовательности реакций 4-нитротиофенол алкилируют бромциклопропаном в присутствии карбоната калия. Желательное превращение проводят в N-метилпирролидиноне (NMП) в течение 8-10 часов при предпочтительной температуре 135°С.
Выделение (I-1-A) происходит путем дозирования реакционной смеси в ледяную воду и выделения сырого кристаллизата с хорошей чистотой типично 89-93 F1% с выходом 82-87%.
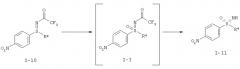
I-A.b) Получение защищенного трифторацетатом циклопропил-нитрофенилсульфилимина (I-10-А)
На второй стадии проводят окислительное аминирование с образованием защищенного трифторацетатом циклопропилнитрофенил-сульфилимина (I-10-A).
При широком скрининге было исследовано превращение циклопропил-нитрофенилсульфида (I-1-A) в защищенный трифторацетатом циклопропилнитрофенилсульфилимин (I-10-A).
В качестве окислительного средства при превращении согласно данному изобретению по фиг.13 можно применять N-бромсукцинимид, 1,3-дибром-5,5-диметилгидантион в присутствии таких оснований, как калий-трет-бутилат, гидрид натрия в таких растворителях, как дихлорметан, тетрагидрофуран или ацетонитрил. Желательная реакция протекает в температурном интервале 0-50°С, причем, температура 20°С более предпочтительна.
В качестве окислительного средства тестировали 1,3-дибром-5,5-диметилгидантоин, N-хлорсукцинимид и трихлорциануровую кислоту в присутствии оснований трет-бутилата калия, трет-бутилата натрия, водного натронного щелока, гидроксида натрия, метанолата натрия, гидрида натрия в растворителях метаноле, дихлорметане, тетрагидрофуране-воде, ацетонитриле, ацетонитриле-воде, тетрагидрофуране, пропионитриле, метил-трет-бутиловом эфире, диоксане, хлорбензоле.
В ходе превращения вначале в реакционный сосуд помещают гидрид натрия в тетрагидрофуране, а затем по каплям добавляют циклопропилнитрофенилсульфид (I-1-A) с трифторацетамидом. При охлаждении дозируют раствор 1,3-дибром-5,5-диметилгидантоина в тетрагидрофуране и перемешивают при комнатной температуре. Переработку проводят восстановительно (сульфит натрия) и кристаллизуют из диизопропилэтилового эфира / н-гептана. Получают продукт (I-10-A) с хорошими выходами и чистотой.
I-А.с) Получение 1-(циклопропилсульфонимидоил)-4-нитробензол (I-II-А)
Окисление защищенных трифторацетатом нитрофенилсульфилиминов ((I-10-A)) с получением 1-(циклопропилсульфонимидоил)-4-нитробензола (I-11-A) проводят предпочтительно с помощью пероксомоносульфата калия (оксон®) в качестве окислительного средства.
Реакцию проводят в смеси метанола-воды и добавляют тетраметиленсульфон (сульфолан) в качестве вспомогательного средства для растворения. Пероксомоносульфат калия (оксон®) добавляют по порциям и рН-значение после каждой стадии дозировки устанавливают равным рН 10.
Через 5 часов наблюдают 99% превращение в желательный рацемический 1-(циклопропилсульфонимидоил)-4-нитробензол (I-11-А). Перерабатывают водой (сульфит натрия) и продукт кристаллизуют из органической фазы (метиленхлорид) после сушки над сульфатом магния из н-гептана.
I-A.d) Расщепление рацематов 1-(циклопропилсульфонимидоил)-4-нитробензола (I-11-A)
Расщепление рацематов опирается на следующую стадию:
Неожиданно было обнаружено, что с помощью (+)-ди-О-п-толуоил-D-винной кислоты в ацетонитриле получают соотношение энантиомеров как минимум 95:5 в кристаллизате. Выходы составляют около 40-45%. Альтернативно ацетонитрилу можно также применять пропионитрил. Путем перекристаллизации из ацетонитрила или пропионитрила можно еще более улучшить оптическую чистоту.
Интегрирование процесса кристаллизации в способ получения может происходить, если защитную трифторацетатную группу в (I-3-A) отщепляют с помощью карбоната калия в метаноле и взаимодействия неочищенного нитрофенилсульфоксимина (I-11-A) с (+)-ди-O-п-толуоил-D-винной кислотой в ацетонитриле с образованием (I-11-A-D-Tol-Tart).
Оптически активный нитрофенилсульфоксимин выделяют основной экстракцией и затем в ходе реакции проводимой в одном сосуде защищают ангидридом трифторуксусной кислоты в присутствии триэтиламина с образованием (I-3-A-R).
Описанный в WO 2010/046035A1 путь получения защищенного трифторацетатом нитрофенилсульфоксимина (I-3-A) дает северную структурную группу в виде рацемата.
1-А.е) Гидрирование защищенного трифторацетатом анилино-сульфоксимина (I-4-A-R)
Превращение нитро-группы в соединении (I-3-A-R) в соответствующую анилиновую группу (I-4-A-R) проводят путем гидрирования в присутствии иммобилизированных палладиевых катализаторов. Особе