Способ получения хиральных триазолонов
Иллюстрации
Показать всеИзобретение относится к способу получения соединения формулы (IVb), включающему (1.1) использование соединения формулы (Ia) или его соли
(1.2) использование производного фосгена формулы (IIb)
в которой Y1N- и Y2N- обозначают одинаковые или разные необязательно замещенные азотсодержащие гетероциклические фрагменты, предпочтительно выбранные из группы, включающей имидазолил и бензимидазолил;
(1.3) использование соединения формулы (III) или его соли
в которой R1 обозначает этил, и в которой -R обозначает -Н;
(2) смешивание и введение в реакцию соединений формул (Ia), (IIb) и (III) в растворителе в любом порядке с получением реакционной смеси, содержащей хиральное соединение формулы (IVb)
Изобретение также относится к хиральному соединению формулы (IVb), к необязательно кристаллическому хиральному соединению формулы (IVb) и к соединению формулы (IIc) для получения соединения формулы (IVb) или формулы (IVd). Технический результат: новый нетоксичный способ получения соединения формулы (IVb). 4 н. и 25 з.п. ф-лы, 5 ил., 6 пр.
Реферат
Настоящее изобретение относится к способу получения хирального соединения, предпочтительно получения хиральных триазолонов, более предпочтительно к получению дизамещенных триазолоновых фунгицидных средств, предпочтительно позаконазола. В способе, предлагаемом в настоящем изобретении, особенно предпочтительным соединением, применяющимся для указанного получения, является карбонилдиимидазол (КДИ) и, таким образом, настоящее изобретение также относится к применению КДИ для получения хирального соединения, предпочтительно позаконазола.
Уровень техники
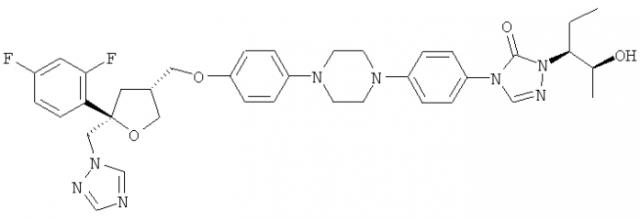
Позаконазол (регистрационный №CAS 171228-49-2; название CAS: 2,5-ангидро-1,3,4-тридезокси-2-C-(2,4-дифторфенил)-4-[[4-[4-[4-[1-[(1S,2S)-1-этил-2-гидроксипропил]-1,5-дигидро-5-оксо-4H-1,2,4-триазол-4-ил]фенил]-1-пиперазинил]фенокси]метил]-1-(1H-1,2,4-триазол-1-ил)-D-трео-пентит) является триазольным фунгицидным лекарственным средством, обладающим структурой:
Позаконазол используется, например, для предупреждения и/или лечения инвазивных грибковых инфекций, вызванных штаммами Candida, штаммами Mucor, штаммами Aspergillus, штаммами Fusarium или штаммами Coccidioides, у пациентов с ослабленным иммунитетом и/или у пациентов, у которых заболевание устойчиво к воздействию других фунгицидных средств, таких как амфотерицин B, флуконазол или итраконазол, и/или у пациентов, которые не переносят эти фунгицидные средства.
Известные в настоящее время способы получения включают двухстадийный способ, в котором реакцию проводят в жестких условиях, для которых необходимы очень стабильные защитные группы, что снижает выход и качество получаемого триазолона.
Способ получения триазолона предшествующего уровня техники раскрыт в WO 96/33178. В этой реакции триазолоновое кольцо позаконазола образуется при нагревании ароматического карбамата, полученного из соответствующего амина и фенилхлорформиата и защищенного по атому O гидразида в течение 24-48 ч при температуре выше 100°C. Такие жесткие условия проведения реакции конденсации триазолонового кольца предположительно приводят к значительному разложению, которое видно по потемнению продукта, который получают с выходом 80% после удаления защитной группы. При использовании для синтеза тетрагидрофуранаазольных фунгицидных средств отщепление защитной группы атома O, обычно бензильной, видимо, не является количественным. Поэтому в соответствующей фармацевтической композиции, содержащей продукт, можно обнаружить следы защищенного соединения. Кроме того, активация ароматического амина с образованием фенилкарбамата включает образование мутагенного соединения фенилхлорформиата
и значительных количеств токсичного фенола. Продолжительное нагревание в течение от 24 до 48 ч дополнительно уменьшает выход и качество продукта и очевидно требует значительного и нежелательного количества энергии.
Другой способ получения дизамещенных триазолонов в целом раскрыт в WO 93/09114. WO 95/17407 специально относится к получению позаконазола. В обоих документах описана реакция ароматического карбамата, полученного, как описано выше, с гидразином с последующим нагреванием с формамидацетатом с получением N-замещенного триазолона. Указанный триазолон удовлетворительно алкилируется алифатическими углеводородными цепями, но не O-замещенными алкильными группами, что требуется для получения позаконазола. Использование O-алкилирующих реагентов в способе, описанном в этих документах, включает большой избыток алкилирующего реагента и это приводит к смеси N-алкилированных и O-алкилированных изомеров. Вследствие этого необходима трудоемкая очистка, которая является дорогостоящей, длительной и снижает выход на этой стадии до 50% или менее, что делает способ весьма невыгодным, в частности для промышленных способов получения этих триазолонов, таких как позаконазол.
Еще один способ описан в WO 2006/007540. Аналогичная реакция описана в публикации Huang et al., Organic Letters 2004, 6(25) 4795-4798. Эта реакция включает активацию алифатического амина фосгеном и добавление незамещенного формилгидразина с последующим нагреванием в гексаметилдисилазане при температуре, равной 140°C, в течение до 30 ч с получением N-незамещенных триазолонов с выходом от низкого до среднего. Этот способ не описан для синтеза триазолонсодержащих фунгицидных соединений, таких как позаконазол, для которого необходима реакция с ароматическими аминами. В связи с этим стадия N-алкилирования с последующим образованием триазолона явно сопряжена с такими же затруднениями и ограничениями, которые описаны выше в документах предшествующего уровня техники.
В итоге следует отметить, что все известные способы синтеза триазолонов, предпочтительно позаконазола, из ароматических аминов, таких как Y3-NH2, где Y3 обозначает необязательно замещенный арильный остаток, предпочтительно из ароматических аминов формулы
требуют использования и приводят к образованию большого количества токсичных и/или загрязняющих окружающую среду реагентов, включают проведение реакций в течение длительного времени при высоких температурах и применительно к получению позаконазола включают описание только защищенного бензильной группой гидразида
.
Не содержащие защитных групп или, например, содержащие силильные защитные группы гидразиды дают сложные смеси с небольшим содержанием позаконазола. При синтезе фунгицидных триазолонов ограничения, свойственные этим способам, приводит к образованию значительного количества загрязняющих окружающую среду веществ и отходов и/или требуют больших затрат энергии, ухудшают качество продукта и приводят к сохранению следовых количеств содержащих защитные группы триазолонов, предпочтительно содержащих бензильные защитные группы триазолонов, в особенности
в полученных фунгицидных продуктах и соответствующей фармацевтической композиции.
Поэтому объектом настоящего изобретения является разработка нового способа, в котором устранено по меньшей мере одно из затруднений способов предшествующего уровня техники.
Краткое изложение сущности изобретения
Согласно изобретению неожиданно было установлено, что можно получить такие триазолоны в гораздо более мягких условиях, чем предложенные и использованные в данной области техники. Такой новый и предлагаемый в настоящем изобретении способ дополнительно позволяет получить дизамещенные триазолоны с превосходным выходом и качеством с широким выбором защитных групп и даже включает возможность проведения реакций без защитной группы. В предпочтительном варианте осуществления нового способа, предлагаемого в настоящем изобретении, возможно использование не содержащих защитных групп гидразидов для синтеза фунгицидных средств.
В частности, согласно изобретению неожиданно было установлено, что карбонилдиимидазол можно использовать для мягкой активации ароматических аминов, предпочтительно таких аминов, как Y3-NH2, где Y3 обозначает необязательно замещенный арильный остаток, предпочтительно ароматических аминов формулы
для хемоселективного ацилирования гидразидов. Вследствие этой превосходной хемоселективности согласно изобретению неожиданно было установлено, что по сравнению с предшествующим уровнем техники при чрезвычайно мягких условиях при значительно уменьшенных длительности проведения реакции и температурой можно использовать гидразиды, не содержащие защитных групп или защищенные по атому O силильной группой. Следствием нового способа, предлагаемого в настоящем изобретении, является то, что единственным побочным продуктом, образующимся в значительных количествах, является нетоксичный имидазол. Неизвестные ранее промежуточные соединения можно выделить и/или превратить в триазолоны путем нагревания в подходящих растворителях, что обеспечивает неожиданно эффективный и чистый синтез. Согласно изобретению было установлено, что необязательное добавление подходящего силилирующего реагента дополнительно повышает скорость и селективность образования триазолонового кольца.
Основным преимуществом нового способа является тот факт, что способ не зависит от конкретных защитных групп и, таким образом, не образуются соответствующие побочные продукты.
Поэтому настоящее изобретение относится к способу получения хирального соединения, включающему
(1.1) использование соединения формулы (I)
или его соли,
в которой Y3 обозначает необязательно замещенный арильный остаток;
(1.2) использование соединения формулы (IIa)
или фосгена или производного фосгена формулы (IIb)
в которой Y0 обозначает необязательно замещенный алкильный или арильный остаток, и в которой Y1N- и Y2N- обозначают одинаковые или разные необязательно замещенные азотсодержащие гетероциклические фрагменты, предпочтительно выбранные из группы, включающей имидазолил и бензимидазолил;
(1.3) использование соединения формулы (III)
или его соли,
в которой R1 обозначает алкильный остаток, предпочтительно содержащий от 1 до 6 атомов углерода, и
в которой -R обозначает -H или подходящую защитную группу гидроксигруппы, предпочтительно выбранную из группы, включающей -SiRaRbRc и необязательно замещенные алкильные, арильные или алкиларильные остатки, где Ra, Rb и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки;
(2) смешивание и введение в реакцию соединений формул (I), (IIa) и/или (IIb) и (III) в растворителе в любом порядке с получением реакционной смеси, содержащей хиральное соединение формулы (IV) и/или формулы (V)
;
.
В предпочтительном варианте осуществления настоящее изобретение относится к способу получения хирального соединения, включающему
(1.1) использование соединения формулы (I)
или его соли,
в которой Y3 обозначает необязательно замещенный арильный остаток;
(1.2) использование соединения формулы (IIa)
или фосгена или производного фосгена формулы (IIb)
в которой Y0 обозначает необязательно замещенный алкильный или арильный остаток, и
в которой Y1N- и Y2N- обозначают одинаковые или разные необязательно замещенные азотсодержащие гетероциклические фрагменты, предпочтительно выбранные из группы, включающей имидазолил и бензимидазолил;
(1.3) использование соединения формулы (III)
или его соли,
в которой R1 обозначает алкильный остаток, предпочтительно содержащий от 1 до 6 атомов углерода, и
в которой -R обозначает -H или подходящую защитную группу гидроксигруппы, предпочтительно выбранную из группы, включающей -SiRaRbRc и необязательно замещенные алкильные, арильные или алкиларильные остатки, где Ra, Rb и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки;
(2) смешивание и введение в реакцию соединений формул (I), (IIa) и/или (IIb) и (III) в растворителе в любом порядке с получением реакционной смеси, содержащей хиральное соединение формулы (IV) и/или формулы (V)
;
;
где на стадии (2),
(2.1) соединения формул (I) и (IIa) и/или (IIb) смешивают и по меньшей мере частично вводят в реакцию в растворителе и получают реакционную смесь;
(2.2) и соединение формулы (III) добавляют к реакционной смеси, полученной на стадии (2.1);
(3) нагревание смеси, полученной на стадии (2), необязательно во время и/или после замены растворителя, или нагревание смеси, полученной смешиванием выделенного хирального соединения формулы (IV) с растворителем, до температуры в диапазоне от 40 до 150°C с получением соединения формулы (V)
;
(4) экстракцию соединения формулы (V), предпочтительно с использованием водного раствора подходящей кислоты, более предпочтительно водного раствора неорганической кислоты и более предпочтительно водного раствора хлористоводородной кислоты в качестве экстрагирующего реагента;
(5) кристаллизацию соединения формулы (V) в растворителе;
(6) необязательное выделение закристаллизованного соединения формулы (V) из растворителя.
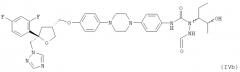
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу получения позаконазола, включающему
(1.1) использование соединения формулы (Ia)
;
(1.2) использование соединения формулы (IIc)
;
(1.3) использование соединения формулы (IIIa)
где не менее 99% молекул указанного соединения содержатся в виде соединения формулы (IIIb)
;
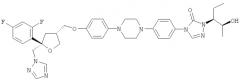
(2) смешивание и введение в реакцию соединений формул (Ia), (IIc) и (IIIa) в растворителе в любом порядке с получением реакционной смеси, содержащей хиральное соединение формулы (IVb)
где не менее 99% молекул указанного соединения содержатся в виде соединения формулы (IVd)
,
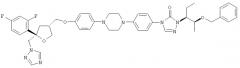
и/или формулы (Vb)
,
где не менее 99% молекул указанного соединения содержатся в виде соединения формулы (Vd)
,
где на стадии (2),
(2.1) соединения формул (Ia) и (IIc) смешивают и по меньшей мере частично вводят в реакцию в растворителе и получают реакционную смесь;
(2.2) и соединение формулы (IIIa) добавляют к реакционной смеси, полученной на стадии (2.1);
(3) нагревание смеси, полученной на стадии (2), необязательно во время и/или после замены растворителя, или нагревание смеси, полученной смешиванием выделенного хирального соединения формулы (IVb) с растворителем, до температуры в диапазоне от 40 до 150°C с получением соединения формулы (Vb);
(4) экстракцию соединения формулы (Vb) с использованием водного раствора хлористоводородной кислоты в качестве экстрагирующего реагента;
(5) кристаллизацию соединения формулы (Vb) в растворителе;
(6) необязательное выделение закристаллизованного соединения формулы (Vb) из растворителя.
Кроме того, настоящее изобретение относится к необязательно кристаллическому хиральному соединению формулы (IVa)
или его соли,
в которой R1 обозначает алкильный остаток, предпочтительно содержащий от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода, еще более предпочтительно 1 или 2 атома углерода, наиболее предпочтительно 2 атома углерода, R1 предпочтительно обозначает этил, и
в которой -R обозначает -H или подходящую защитную группу гидроксигруппы, предпочтительно выбранную из группы, включающей -SiRaRbRc и необязательно замещенные алкильные, арильные или алкиларильные остатки, где Ra, Rb и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, где -R предпочтительно обозначает -H или защитную группу гидроксигруппы, выбранную из группы, включающей -Si(CH3)3 и бензил, -R предпочтительно обозначает -H и где указанное соединение наиболее предпочтительно представляет собой соединение формулы (IVb)
.
Кроме того, настоящее изобретение относится к композиции, содержащей предпочтительно кристаллическое хиральное соединение формулы (Va)
или его соль, в которой R1 обозначает алкильный остаток, предпочтительно содержащий от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода, более предпочтительно 1 или 2 атома углерода, наиболее предпочтительно 2 атома углерода,
указанная композиция предпочтительно содержит соединение формулы (Vb)
где предпочтительно не менее 95%, более предпочтительно не менее 97%, еще более предпочтительно не менее 99% молекул указанного предпочтительно кристаллического соединения находятся в виде изомера формулы (Vc)
предпочтительно в виде изомера формулы (Vd)
,
указанная композиция содержит не более 70 мас.част./млн., предпочтительно не более 50 мас.част./млн., более предпочтительно не более 30 мас.част./млн., еще более предпочтительно не более 10 мас.част./млн., указанная композиция предпочтительно не содержит соединения формулы (Ve)
предпочтительно не содержит соединения формулы (Vf)
в которой -R обозначает -CH2-C6H5, -R предпочтительно выбран из группы, включающей -SiRaRbRc и необязательно замещенные алкильные, арильные или алкиларильные остатки, где Ra, Rb и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, -R более предпочтительно обозначает защитную группу гидроксигруппы.
Кроме того, настоящее изобретение относится к применению соединения формулы (IIc)
для получения фунгицидного средства, предпочтительно для получения предпочтительно кристаллического хирального соединения формулы (Vb)
,
наиболее предпочтительно для получения предпочтительно кристаллического соединения формулы (Vd)
.
Краткое описание чертежей
На фиг.1 приведен инфракрасный спектр (ИК) соединения формулы (IIIa), полученного в примере 3 настоящего изобретения. На фиг.1 по оси y отложено пропускание в %, а по оси x отложено волновое число в см-1. В частности, могут обнаруживаться следующие пики в ИК-спектре: 3341, 3298, 2970, 2881, 1674, 1497, 1447, 1319, 1125, 1071, 945, 910, 876, 775 и 650+/-2 см-1.
На фиг.2 приведена рентгенограмма соединения формулы (IIIa), полученного в примере 3 настоящего изобретения. На фиг.2 по оси y отложена интенсивность, измеренная в импульсах за 300 c (линейная шкала), а по оси x отложено положение, указанное в значениях 2-тета в градусах. В частности, могут обнаруживаться следующие пики ПРГ: 9,0, 13,9, 17,4, 18,1, 20,0, 20,7, 23,4, 24,6, 27,5 и 29,2+/-0,2°2-тета.
На фиг.3 приведена порошковая рентгенограмма (ПРГ) соли с HCl соединения формулы (GG), полученной в примере 1 (пример 1.h) настоящего изобретения. Отношение цис:транс, т.е. отношение соединение формулы (GGa): соединение формулы (GGb) составляет 99,2:0,8. На фиг.3 по оси x отложено положение, указанное в значениях 2-тета в градусах, а по оси y отложена интенсивность, измеренная в импульсах в секунду (линейная шкала).
На фиг.4 приведен инфракрасный спектр (ИК) соединения формулы (IVb), полученного в примере 4 настоящего изобретения. На фиг.4 по оси y отложено пропускание в %, а по оси x отложено волновое число в см-1.В частности, могут обнаруживаться следующие пики в ИК-спектре: 3416, 3118, 2870, 1671, 1618, 1498, 1415, 1380, 1227, 1135, 1072, 947, 823, 728 и 663+/-2 см-1.
На фиг.5 приведена рентгенограмма соединения формулы (IVb), полученного в примере 4 настоящего изобретения. На фиг.5 по оси у отложена интенсивность, измеренная в импульсах за 300 c (линейная шкала), а по оси x отложено положение, указанное в значениях 2-тета в градусах. В частности, могут обнаруживаться следующие пики ПРГ: 5,1, 10,5, 11,6, 14,1, 16,8, 18,9, 19,8, 21,1, 22,2 и 23,8+/-0,20°2-тета. Подробное описание изобретения
Как отмечено выше, настоящее изобретение относится к способу получения хирального соединения, указанный способ включает стадии
(1.1) использование соединения формулы (I)
или его соли,
в которой Y3 обозначает необязательно замещенный арильный остаток;
(1.2) использование соединения формулы (IIa)
или фосгена или производного фосгена формулы (IIb)
в которой Y0 обозначает необязательно замещенный алкильный или арильный остаток,и
в которой Y1N- и Y2N- обозначают одинаковые или разные необязательно замещенные азотсодержащие гетероциклические фрагменты, предпочтительно выбранные из группы, включающей имидазолил и бензимидазолил;
(1.3) использование соединения формулы (III)
или его соли,
в которой R1 обозначает алкильный остаток, предпочтительно содержащий от 1 до 6 атомов углерода, и
в которой -R обозначает -H или подходящую защитную группу гидроксигруппы, предпочтительно выбранную из группы, включающей -SiRaRbRc и необязательно замещенные алкильные, арильные или алкиларильные остатки, где Ra, Rb и Rc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки;
(2) смешивание и введение в реакцию соединений формул (I), (IIa) и/или (IIb) и (III) в растворителе в любом порядке с получением реакционной смеси, содержащей хиральное соединение формулы (IV) и/или формулы (V)
;
.
Стадия (1.1) - Использование соединения формулы (I)
На стадии (1.1) настоящего изобретения получают соединение формулы (I)
в которой Y3 обозначает необязательно замещенный арильный остаток и/или подходящую его соль. Не налагают специальных ограничений при условии, что соединение формулы (I) и/или его подходящую соль можно использовать и смешать и ввести в реакцию на стадии (2) настоящего изобретения.
Термин "необязательно замещенный арильный остаток" при использовании в контексте настоящего изобретения означает арильные остатки, которые содержат, например, до 6 или до 12 атомов углерода. Если такой арильный остаток представляет собой замещенный арильный остаток, то количество атомов углерода означает количество атомов углерода в соответствующем незамещенном арильном остатке. В предпочтительном варианте осуществления настоящего изобретения необязательно замещенные арильные остатки выбраны так, чтобы можно было получить соединения, которые можно использовать в качестве фунгицидного средства. Более предпочтительно, если Y3 обозначает подходящим образом замещенный арильный остаток, более предпочтительно подходящим образом замещенный фенильный остаток. Наиболее предпочтительно, если соединением формулы (I) является хиралыюе соединение формулы
в которой Z1 и Z2 независимо обозначают F или Cl, предпочтительно F. Еще более предпочтительно, если соединением формулы (I) является соединение формулы
в которой Z1 и Z2 независимо обозначают F или Cl, предпочтительно F, и где, в еще более предпочтительном варианте осуществления, не менее 95%, более предпочтительно не менее 97%, еще более предпочтительно не менее 99% молекул указанного соединения находятся в виде изомера формулы
Поэтому в предпочтительном варианте осуществления настоящего изобретения соединением формулы (I) является соединение формулы
где не менее 95%, более предпочтительно не менее 97%, более предпочтительно не менее 99% молекул указанного соединения находятся в виде изомера формулы (Ia)
.
Таким образом, настоящее изобретение, в частности, относится к определенному выше способу, в котором соединение формулы (I) является соединение формулы (Ia).
На получение соединения формулы (Ia) не налагают специальных ограничений. Предпочтительно, если соединение формулы (Ia) получают по реакции соединения формулы (A)
с соединением формулы (B)
.
Стадия (1.1) - Использование соединения формулы (A)
На получение соединения формулы (A) не налагают специальных ограничений. Возможный способ получения соединения формулы (A) раскрыт, например, в публикации M. Hepperle et. al Tetrahedron Lett. 2002, 43, 3359-3363, в US 6355801 B1 или в EP 1230231 B1.
Стадия (1.1) - Использование соединения формулы (B)
На получение соединения формулы (B) не налагают специальных ограничений. Возможный способ получения соединения формулы (В) раскрыт, например, в US 5403937, EP 0736030 A1 или в WO 95/17407.
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (B) получают способом, в котором соль с HCl соединения формулы (GGa)
превращают в соединение формулы (B).
На превращение соли с HCl соединения формулы (GGa) в соответствующий тозилат формулы (B) не налагают специальных ограничений. В предпочтительном варианте осуществления настоящего изобретения по меньшей мере частично кристаллическую, предпочтительно кристаллическую соль соединения формулы (GG)
получают суспендированной в подходящей жидкости, наиболее предпочтительно в дихлорметане (ДХМ). К этой суспензии добавляют предпочтительно по меньшей мере одно подходящее органическое азотистое основание, такое как триэтиламин (ТЭА) и/или 4-диметиламинопиридин (ДМАП). К полученной смеси добавляют подходящее содержащее п-толуолсульфонил соединение, такое как п-толуолсульфонилхлорид (TsCl), при предпочтительной температуре, равной от 10 до 40°C, и реакцию предпочтительно проводят в течение от 1 до 6 ч. Полученную реакционную смесь, содержащую соединение формулы (B), предпочтительно соответствующим образом экстрагируют и из полученного органического слоя, необязательно после соответствующего концентрирования, соединение формулы (B) получают в виде твердого вещества, например, с помощью кристаллизации, и это твердое вещество необязательно можно соответствующим образом высушить и затем, предпочтительно без какой-либо дополнительной обработки промежуточного продукта, использовать в качестве исходного вещества для реакции с соединением формулы (A). Использование кристаллизации для получения соединения формулы (B) позволяет эффективно провести очистку указанного соединения, а также эффективно масштабировать способы, описанные в настоящем изобретении, и использовать указанные соединения для крупномасштабного производства.
На получение соли с HCl соединения формулы (GGa) не налагают специальных ограничений. В предпочтительном варианте осуществления настоящего изобретения эту соль с HCl получают способом, в котором получают соль с HCl соединения формулы (GG), указанное соединение формулы (GG) содержит цис-изомер формулы (GGa) и транс-изомер формулы (GGb)
, .
В предпочтительном варианте осуществления настоящего изобретения указанная предпочтительно кристаллическая соль с HCl содержит не менее 97%, предпочтительно не менее 98% и более предпочтительно не менее 99% соли с HCl цис-изомера формулы (GGa) и не более 3%, предпочтительно не более 2% и более предпочтительно не более 1% соли с HCl транс-изомера формулы (GGb).
В еще более предпочтительном варианте осуществления настоящего изобретения указанное соединение формулы (GG) получают способом, включающим
(I) использование соединения формулы (GG), содержащегося в первом подходящем растворителе;
(II) обработку соединения формулы (GG), содержащегося в первом подходящем растворителе, с помощью HCl, содержащегося во втором подходящем растворителе, с получением соли с HCl соединения формулы (GG).
Предпочтительно, если способ получения соли с HCl соединения формулы (GG) в предпочтительном варианте осуществления настоящего изобретения включает стадии, соответствующие указанным ниже вариантам осуществления и соответствующим указанным их комбинациям:
1. Способ получения соли с хлоридом водорода (HCl) соединения формулы
указанное соединение формулы (GG) содержит цис-изомер формулы (GGa) и транс-изомер формулы (GGb)
, ,
способ включает
(I) использование соединения формулы (GG), содержащегося в первом подходящем растворителе;
(II) обработку соединения формулы (GG), содержащегося в первом подходящем растворителе, с помощью HCl, содержащегося во втором подходящем растворителе, с получением соли с HCl соединения формулы (GG).
2. Способ, соответствующий варианту осуществления 1, в котором соединение формулы (GG), полученное на стадии (I), содержит от 80 до 95%, предпочтительно от 85 до 95% цис-изомера формулы (GGa) и от 20 до 5%, предпочтительно от 15 до 5% транс-изомера формулы (GGb).
3. Способ, соответствующий варианту осуществления 1 или 2, в котором на стадии (I) соединение формулы (GG) получают способом, включающим
(i.1) реакцию соединения формулы (AA)
в которой L обозначает отщепляющуюся группу, предпочтительно галоген, более предпочтительно Cl, в растворителе с нуклеофильным соединением, содержащим нуклеофильный остаток RaaaRbbbRcccSi-CH2, в котором Raaa, Rbbb и Rccc являются одинаковыми или разными и выбраны из группы, включающей необязательно подходящим образом замещенные алкильные и арильные остатки, с получением реакционной смеси, содержащей в качестве промежуточного продукта бета-гидроксисилан формулы
указанную реакцию предпочтительно проводят при температуре в диапазоне от -50 до +20°C, более предпочтительно от -30 до +10°C, еще более предпочтительно от -15 до +5°C;
(i.2) обработку полученной реакционной смеси, предпочтительно без замены растворителя, реагентом, промотирующим реакцию элиминирования, с получением реакционной смеси, содержащей соединение формулы (BB)
где обработку проводят при температуре в диапазоне от -20 до +70°C и где указанным реагентом предпочтительно является кислота, более предпочтительно неорганическая кислота, еще более предпочтительно серная кислота, где, если используют серную кислоту, температура, при которой проводят указанную обработку, предпочтительно находится в диапазоне от 40 до 50°C;
(ii) реакцию соединения формулы (BB) с эфиром малоновой кислоты R11OOC-CH2-COOR22 с получением соединения формулы (CC)
,
в которой R11 и R22 независимо обозначают необязательно подходящим образом замещенную алкильную группу, содержащую от 1 до 5 атомов углерода, предпочтительно этил,
в котором после стадии (ii) и до стадии (iii) соединение формулы (CC) необязательно выделяют путем экстракции подходящим растворителем, предпочтительно циклогексаном;
(iii) восстановление соединения формулы (CC) с получением соединения формулы (DD)
,
восстановительным реагентом предпочтительно является LiBH4, который используют в количестве, составляющем не более 2 мол.экв. в пересчете на соединение формулы (CC), указанное восстановление предпочтительно проводят в подходящем растворителе, предпочтительно содержащем воду, растворитель предпочтительно выбран из группы, включающей воду, спирт и смесь воды и по меньшей мере одного спирта, более предпочтительно из группы, включающей воду, метанол, этанол, изопропанол и смесь воды и по меньшей мере одного из этих спиртов, еще более предпочтительно из группы, включающей воду, этанол, изопропанол и смесь воды и по меньшей мере одного из этих спиртов, еще более предпочтительно из группы, включающей воду, изопропанол и смесь воды и изопропанола, наиболее предпочтительно, если растворителем является смесь воды и изопропанола, где растворитель предпочтительно содержит от 1 до 20 об.%, более предпочтительно от 5 до 15 об.% воды;
(iv) ацилирование соединения формулы (DD) изомасляным ангидридом с получением соединения формулы (EE)
,
указанное ацилирование предпочтительно проводят в присутствии подходящего фермента, предпочтительно фермента Novo SP 435, в подходящем растворителе, предпочтительно в ацетонитриле или толуоле, более предпочтительно в толуоле, в котором после стадии (iv) и до стадии (v), соединение формулы (EE) предпочтительно по меньшей мере частично кристаллизуют;
(v) реакцию соединения формулы (EE) с галогеном Hal2, выбранным из группы, включающей Cl2, Br2, и I2, предпочтительно I2, в присутствии основания в растворителе с получением соединения формулы (FF)
где предпочтительно от 80 до 95%, более предпочтительно от 85 до 95% молекул соединения (FF) содержатся в виде цис-изомера формулы (FFa)
и предпочтительно от 20 до 5%, более предпочтительно от 15 до 5% молекул соединения (FF) содержатся в виде транс-изомера формулы (FFb)
;
где растворителем предпочтительно является этилацетат и где основанием предпочтительно является гидрокарбонат натрия и где температура, при которой соединение формулы (EE) вводят в реакцию, предпочтительно ниже 0°C, более предпочтительно не выше -5°C и еще более предпочтительно не выше -10°C;
(vi.1) нагревание соединения формулы (FF), предпочтительно при температуре в диапазоне от +70 до +100°C, более предпочтительно от +80 до +95°C, еще более предпочтительно от +85 до +90°C, предпочтительно при отсутствии ДМПН (1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинон), в растворителе предпочтительно в полярном апротонном растворителе, например, ДМФ (N,N-диметилформамид) и ДМСО, более предпочтительно ДМСО, с солью щелочного металла 1,2,4-триазола, предпочтительно натриевой солью, и обработку полученной реакционной смеси основанием, подходящим для промотирования омыления сложноэфирного фрагмента, таким как гидроксиды щелочных металлов, бикарбонаты щелочных металлов, карбонаты щелочных металлов, гидроксиды щелочноземельных металлов, бикарбонаты щелочноземельных металлов и карбонаты щелочноземельных металлов, предпочтительно основания щелочных металлов, указанное основание предпочтительно добавляют в водных и/или спиртовых средах, где подходящими спиртами являются спирты, содержащие от 1 до 6, предпочтительно от 1 до 4, более предпочтительно от 1 до 3, наиболее предпочтительно от 1 до 2 атомов углерода, указанным основанием еще более предпочтительно является гидроксид натрия, предпочтительно использующийся в виде водного раствора в присутствии метанола, с получен