Производные ацилбензола
Иллюстрации
Показать всеИзобретение относится к соединению, представленному общей формулой (I), и его фармацевтически приемлемым солям
где R1 представляет собой гидрокси С1-С6 алкильную группу или гидрокси С3-С6 циклоалкильную группу, каждая из которой может быть замещена 1-3 заместителями, выбранными из подгруппы заместителей α, подгруппа заместителей α является группой, состоящей из гидроксильной группы и карбамоильной группы, R2 представляет собой метильную группу или этильную группу, R3 представляет собой С1-С6 алкильную группу или С3-С6 циклоалкильную группу, каждая из которой может быть замещена 1-3 атомами галогена, и R4 представляет собой атом галогена. Изобретение также относится к индивидуальным соединениям; к фармацевтической композиции, обладающей гипогликемическим действием и/или защитным действием по отношению к β-клеткам или поджелудочной железе, содержащей, в качестве активного ингредиента, соединение изобретения; к применению соединений для приготовления фармацевтической композиции; к способу лечения диабета 1 типа или диабета 2 типа; и к способу для защиты β-клеток или поджелудочной железы. Технический результат: получены новые соединения общей формулы (I), которые обладают гипогликемическим действием и/или защитным действием по отношению к β-клеткам или поджелудочной железе. 22 н. и 13 з.п. ф-лы, 56 пр.
Реферат
Область техники
Настоящее изобретение относится к новым производным ацилбензола, проявляющим гипогликемическое действие и/или обладающим защитным действием по отношению к β-клеткам или поджелудочной железе, или к их фармацевтически приемлемой соли и к фармацевтической композиции, содержащей указанные производные в качестве активных ингредиентов.
Уровень техники
Сахарный диабет является метаболическим заболеванием, характеризующимся, главным образом, хроническим гипергликемическим состоянием, обусловленным недостаточностью действия инсулина. Лечение диабета обычно осуществляется посредством лекарственной терапии совместно с диетотерапией и лечебной физкультурой. Примеры используемых пероральных гипогликемических средств, которые представляют собой класс терапевтических лекарственных средств от диабета, включают бигуанидные агенты и тиазолидиндионовые агенты, которые уменьшают инсулинорезистентность; агенты сульфонилмочевины и глиниды, которые стимулируют секрецию инсулина из панкреатических β-клеток; и ингибиторы α-глюкозидазы, которые тормозят поглощение сахара.
Однако было показано, что бигуанидные агенты обладают вредными побочными эффектами, такими как побочные реакции со стороны пищеварительной системы и лактацидоз; тиазолидиндионовые агенты проявляют вредные побочные эффекты, такие как прибавление в весе и отек; агенты сульфонилмочевины и глиниды проявляют вредные побочные эффекты, такие как гипогликемия или вторичная резистентность из-за длительного использования; и ингибиторы α-глюкозидазы проявляют вредные побочные эффекты, такие как диарея. Поэтому разработка перорального гипогликемического средства, которое сможет разрешить такие проблемы, является желательной.
Кроме того, в последние годы были разработаны пиперидиновые соединения в качестве пероральных гипогликемических средств с новыми структурами (см., например, патентную литературу 1-4). Также, были описаны оксадиазоловые соединения (см., например, патентную литературу 5 или 6).
Перечень ссылок
Патентная литература
Патентная литература 1: WO 07/116229.
Патентная литература 2: WO 07/003960.
Патентная литература 3: WO 07/003962.
Патентная литература 4: WO 05/061489.
Патентная литература 5: WO 11/016469.
Патентная литература 6: WO 11/016470.
Сущность изобретения
Проблемы, решаемые посредством изобретения
Однако с пиперидиновыми соединениями имеются трудности, которые заключаются в том, что достаточное гипогликемическое действие и защитное действие по отношению к β-клеткам или поджелудочной железе не достигается легко. Таким образом, целью настоящего изобретения является предоставление соединений с новой структурой, которые не были описаны и не рассматривались в указанной выше патентной литературе, и которые проявляют превосходный гипогликемический эффект и защитное действие по отношению к β-клеткам или поджелудочной железе, или их фармацевтически приемлемой соли; фармацевтической композиции, проявляющей превосходный терапевтический эффект и/или профилактический эффект против диабета 1 типа, диабета 2 типа и тому подобное, которые характеризуются повышением уровня сахара в крови вследствие нарушения метаболизма сахара; и фармацевтической композиции, проявляющей защитное действие по отношению к β-клеткам или поджелудочной железе.
Способы решения проблем
Настоящее изобретение предоставляет:
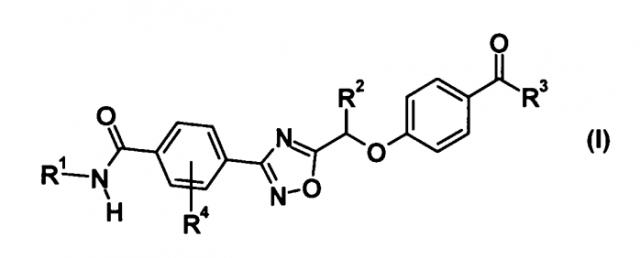
(1) Соединение, представленное общей формулой (I):
[Химическая формула 1]
где R1 представляет собой гидрокси С1-С6 алкильную группу или гидрокси С3-С6 циклоалкильную группу, каждая из которой может быть замещена 1-3 заместителями, выбранными из подгруппы заместителей α,
подгруппа заместителей α является группой, состоящей из гидроксильной группы и карбамоильной группы,
R2 представляет собой метильную группу или этильную группу,
R3 представляет собой С1-С6 алкильную группу или С3-С6 циклоалкильную группу, каждая из которой может быть замещена 1-3 атомами галогена, и
R4 представляет собой атом галогена;
или его фармацевтически приемлемую соль;
(2) соединение по пункту (1), где R1 представляет собой гидрокси С1-С3 алкильную группу или гидрокси С3-С4 циклоалкильную группу, каждая из которой может быть замещена 1-3 заместителями, выбранными из подгруппы заместителей α;
(3) соединение по пункту (1), где R1 представляет собой гидроксиэтильную группу, гидроксипропильную группу, гидроксиизопропильную группу или гидроксициклопентильную группу, каждая из которой может быть замещена одним заместителем, выбранным из подгруппы заместителей α;
(4) соединение по любому одному из пунктов (1)-(3), где R3 представляет собой С1-С4 алкильную группу или С3-С4 циклоалкильную группу, каждая из которой может быть замещена 1-3 атомами галогена;
(5) соединение по любому одному из пунктов (1)-(3), где R3 представляет собой изопропильную группу, трет-бутильную группу, циклопропильную группу или циклобутильную группу, каждая из которой может быть замещена одним атомом галогена;
(6) соединение по любому одному из пунктов (1)-(5), где R4 представляет собой атом фтора;
(7) соединение, выбранное из группы, состоящей из следующих соединений:
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]пропил}-1,2,4-оксадиазол-3-ил)-N-[(2S)-2,3-дигидроксипропил]-2-фторбензамид,
N-[(1S)-2-амино-1-(гидроксиметил)-2-оксоэтил]-4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]пропил}-1,2,4-оксадиазол-3-ил)-2-фторбензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]пропил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[(1R)-2-гидрокси-1-метилэтил]бензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]пропил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[(1S)-2-гидрокси-1-метилэтил]бензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]пропил}-1,2,4-оксадиазол-3-ил)-N-[(2R)-2,3-дигидроксипропил]-2-фторбензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]пропил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[2-гидрокси-1-(гидроксиметил)этил]бензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]этил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[2-гидрокси-1-(гидроксиметил)этил]бензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]этил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[(1S)-2-гидрокси-1-метилэтил]бензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]этил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[(1R,2R)-2-гидроксициклопентил]бензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]этил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[(1R)-2-гидрокси-1-метилэтил]бензамид,
4-(5-{(1R)-1-[4-(циклопропилкарбонил)фенокси]этил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[(1S,2S)-2-гидроксициклопентил]бензамид,
4-(5-{(1R)-1-[4-(2,2-диметилпропаноил)фенокси]пропил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[2-гидрокси-1-(гидроксиметил)этил]бензамид,
4-(5-{(1R)-1-[4-(циклобутилкарбонил)фенокси]пропил}-1,2,4-оксадиазол-3-ил)-2-фтор-N-[2-гидрокси-1-(гидроксиметил)этил]бензамид,
2-фтор-4-{5-[(1R)-1-{4-[(1-фторциклопропил)карбонил]фенокси}пропил]-1,2,4-оксадиазол-3-ил)-N-[2-гидрокси-1-(гидроксиметил)этил]бензамид,
2-фтор-N-[(1R)-2-гидрокси-1-метилэтил]-4-{5-[(1R)-1-(4-изобутирилфенокси)пропил]-1,2,4-оксадиазол-3-ил}бензамид, и
2-фтор-N-[2-гидрокси-1-(гидроксиметил)этил]-4-{5-[(1R)-1-(изобутирилфенокси)пропил]-1,2,4-оксадиазол-3-ил}бензамид;
(8) фармацевтическую композицию, содержащую, в качестве активного ингредиента, соединение по любому одному из пунктов (1)-(7) или его фармацевтически приемлемую соль;
(9) фармацевтическую композицию по пункту (8) для лечения диабета 1 типа, диабета 2 типа или ожирения;
(10) фармацевтическую композицию по пункту (8) для защиты β-клеток или поджелудочной железы;
(11) применение соединения по любому одному из пунктов (1)-(7) или его фармацевтически приемлемой соли для приготовления фармацевтической композиции;
(12) способ лечения заболевания, включающий введение млекопитающему соединения по любому одному из пунктов (1)-(7) или его фармацевтически приемлемой соли; и
(13) способ по пункту (12), где млекопитающим является человек.
Полезные эффекты изобретения
Согласно настоящему изобретению предоставлено производное ацилбензола, проявляющее превосходный гипогликемический эффект и защитное действие относительно β-клеток или поджелудочной железы, или его фармацевтически приемлемая соль, фармацевтическая композиция, имеющая превосходный терапевтический эффект и/или профилактический эффект против диабета 1 типа, диабета 2 типа и тому подобное, который характеризуется повышением в крови уровня сахара, и фармацевтическая композиция, проявляющая защитное действие относительно β-клеток или поджелудочной железы.
Наилучшие способы осуществления изобретения
“С1-С6 алкильная группа”, как используют в описании настоящего изобретения, означает линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода. Конкретные примеры включают метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, сек-бутильную группу, трет-бутильную группу, пентильную группу, 1,2-диметилпропильную группу, изопентильную группу, гексильную группу и изогексильную группу.
“С3-С6 циклоалкильная группа”, как используют в описании настоящего изобретения, означает насыщенную циклическую углеводородную группу, содержащую 3-6 атомов углерода, и примеры включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
“Гидрокси С1-С6 алкильная группа”, как используют в описании настоящего изобретения, означает группу, образованную замещением атома водорода “С1-С6 алкильной группы” гидроксильной группой. Конкретные примеры включают гидроксиметильную, 2-гидроксиэтильную, 4-гидроксибутильную, 5-гидроксипентильную и 6-гидроксигексильную группы.
“Гидрокси С3-С6 циклоалкильная группа”, как используют в описании настоящего изобретения, означает группу, образованную замещением атома водорода “С3-С6 циклоалкильной группы” гидроксильной группой. Конкретные примеры включают гидроксициклопропильную группу, гидроксициклобутильную группу, 2-гидроксициклопентильную группу и гидроксициклогексильную группу.
“Атом галогена”, как используют в описании настоящего изобретения, означает атом фтора, атом хлора, атом брома или атом йода.
“Фармацевтически приемлемая соль”, как используют в описании настоящего изобретения, означает соль, образованную при взаимодействии соединения согласно настоящему изобретению с кислотой или основанием.
Примеры соли включают соли с галогенводородными кислотами, такие как гидрофториды, гидрохлориды, гидробромиды и гидройодиды; соли с неорганическими кислотами, такие как гидрохлориды, нитраты, перхлораты, сульфаты и фосфаты; соли с низшими алкансульфокислотами, такие как метансульфонаты, трифторметансульфонаты и этансульфонаты; соли с арилсульфокислотами, такие как бензолсульфонаты и р-толуолсульфонаты; соли с органическими кислотами, такие как ацетаты, малаты, фумараты, сукцинаты, цитраты, аскорбаты, тартраты, оксалаты и малеаты; соли со щелочными металлами, такие как натриевые соли, калиевые соли и литиевые соли; соли с щелочноземельными металлами, такие как кальциевые соли и магниевые соли; соли металлов, такие как соли алюминия и соли железа; неорганические соли, такие как аммониевые соли; соли амина, включающие органические соли, такие как t-октиламинные соли, дибензиламинные соли, морфолиновые соли, глюкозаминные соли, соли фенилглициналкилового сложного эфира, этилендиаминные соли, соли N-метилглюкамина, гуанидиновые соли, диэтиламинные соли, триэтиламинные соли, дициклогексиламинные соли, N,N'-дибензилэтилендиаминные соли, хлорпрокаиновые соли, прокаиновые соли, диэтаноламинные соли, N-бензилфенэтиламинные соли, пиперазиновые соли, тетраметиламмониевые соли и трис(гидроксиметил)аминометановые соли; и соли аминокислот, такие как глициновые соли, лизиновые соли, аргининовые соли, орнитиновые соли, глутаматы и аспартаты.
Соединение согласно настоящему изобретению поглощает воду, например, при хранении в атмосфере, так что поглощенная вода может присоединиться к соединению и может образоваться гидрат. Поэтому такой гидрат также включен в представление о соли согласно настоящему изобретению.
Поскольку соединение согласно настоящему изобретению может иметь асимметрические атомы углерода в молекуле, соединение существует в виде оптических изомеров. Указанные изомеры и смеси указанных изомеров все представлены единой формулой, то есть общей формулой (I). Поэтому настоящее изобретение охватывает все оптические изомеры соединения, представленные общей формулой (I), и смеси указанных оптических изомеров при любых соотношениях. Такой оптический изомер может быть получен, например, при использовании сырых материалов с оптической активностью вместо сырых материалов, используемых в способах получения, ссылочных примерах и примерах, которые будут описаны ниже, или может быть получен путем оптического разделения, известного в данной области техники, соединения, полученного в способах получения, ссылочных примерах, примерах и тому подобном, которые будут описаны ниже, например, методом разделения диастереомеров, методом, основанном на ферментативной реакции, или методом оптического разделения, основанном на хроматографии.
Настоящее изобретение также может охватывать соединения, у которых один или более атомов, составляющих молекулу соединения, представленного общей формулой (I), были замещены изотопами атомов. Изотопы включают два класса радиоактивных изотопов и стабильных изотопов, и примеры изотопов включают, например, изотопы водорода (2Н и 3Н), изотопы углерода (11С, 13С и 14С), изотопы азота (13N и 15N), изотопы кислорода (15О, 17О и 18О) и изотопы фтора (18F). Композицию, содержащую меченое изотопом соединение, используют, например, в качестве терапевтического средства, профилактического средства, реагента для исследования, реагента для анализа, диагностического средства или in vivo средства для диагностической визуализации. Соединения, меченные изотопами, и смеси соединений, меченных изотопами при любых соотношениях, все включены в объем настоящего изобретения. Меченное изотопом соединение может быть получено способом, известным в данной области, например, при использовании сырых материалов, меченных изотопами, вместо сырых материалов, используемых в способах получения, которые будут описаны ниже.
Настоящее изобретение также может охватывать пролекарства соединения, представленного общей формулой (I). Пролекарство является производным соединения, представленного общей формулой (I), и означает соединение, которое посредством ферментативной реакции или химической реакции превращается в соединение согласно настоящему изобретению в живом организме.
Примеры пролекарства включают соединения, у которых аминогруппа в молекуле ацилирована, алкилирована или фосфорилирована; соединения, у которых карбонильная группа в молекуле этерифицирована или амидирована; и соединения, у которых гидроксильная группа в молекуле ацилирована, алкилирована или фосфорилирована (см., например, Povl Krogsgaard-Larsen, et al., “A Textbook of Drug Design and Development”, Second Edition, Harwood Academic Publishers, 1996, pp. 351-385). Такое пролекарство может быть получено из соединения, представленного общей формулой (I), способом, известным в данной области техники.
Группа R1 предпочтительно представляет собой гидрокси С1-С3 алкильную группу или С3-С4 циклоалкильную группу, каждая из которой может быть замещена 1-3 заместителями, выбранными из подгруппы заместителей α; более предпочтительно группа представляет собой гидроксиэтильную группу, гидроксипропильную группу, гидроксиизопропильную группу или гидроксициклопентильную группу, каждая из которых может быть замещена одним заместителем, выбранным из подгруппы заместителей α; и даже более предпочтительно группа представляет собой 2,3-дигидроксипропильную группу, 2-гидрокси-1-гидроксиметилэтильную группу, 1-карбамоил-2-гидроксиэтильную группу, 2-гидрокси-1-метилэтильную группу или 2-гидроксициклопентильную группу.
Группа R2 предпочтительно представляет собой этильную группу.
Группа R3 предпочтительно представляет собой С1-С4 алкильную группу или С3-С4 циклоалкильную группу, каждая из которой может быть замещена 1-3 атомами галогена; более предпочтительно группа представляет собой изопропильную группу, трет-бутильную группу, циклопропильную группу или циклобутильную группу, каждая из которых может быть замещена 1-3 атомами галогена; и даже более предпочтительно группа представляет собой изопропильную группу, трет-бутильную группу, циклопропильную группу, 1-фторциклопропильную группу или циклобутильную группу.
Группа R4 предпочтительно представляет собой атом фтора.
Предпочтительной комбинацией групп R1, R2, R3 и R4 в общей формуле (I) является комбинация, в которой R1 означает гидрокси С1-С3 алкильную группу или С3-С4 циклоалкильную группу, каждая из которой может быть замещена 1-3 заместителями, выбранными из подгруппы заместителей α; R2 означает этильную группу; R3 является С1-С4 алкильной группой или С3-С4 циклоалкильной группой, каждая из которой может быть замещена 1-3 атомами галогена, и R4 представляет собой атом фтора.
Более предпочтительной комбинацией является комбинация, в которой группа R1 представляет собой гидроксиэтильную группу, гидроксипропильную группу, гидроксиизопропильную группу или гидроксициклопентильную группу, каждая из которых может быть замещена одним заместителем, выбранным из подгруппы заместителей α; R2 является этильной группой; R3 является изопропильной группой, трет-бутильной группой, циклопропильной группой или циклобутильной группой, каждая из которых может быть замещена 1-3 атомами галогена, и R4 представляет собой атом фтора.
Даже более предпочтительной комбинацией является комбинация, в которой R1 представляет собой 2,3-дигидроксипропильную группу, 2-гидрокси-1-гидроксиметилэтильную группу, 1-карбамоил-2-гидроксиэтильную группу, 2-гидрокси-1-метилэтильную группу или 2-гидроксициклопентильную группу; R2 является этильной группой; R3 является изопропильной группой, трет-бутильной группой, циклопропильной группой, 1-фторциклопропильной группой или циклобутильной группой; и R4 представляет собой атом фтора.
Соединение согласно настоящему изобретению может быть получено, например, следующими способами.
В реакциях на различных стадиях способов, описанных ниже, когда соединение, служащее в качестве субстрата в реакции, содержит группу, которая ингибирует заданную реакцию (например, аминогруппа, гидроксильная группа или карбоксильная группа), введение защитной группы к такой группе и удаление введенной защитной группы может быть осуществлено при необходимости. Определенных ограничений на такие защитные группы не имеется, поскольку они являются обычно используемыми защитными группами, но примеры включают такие защитные группы, описанные в публикации T.H.Greene, P.G.Wuts, Protective Groups in Organic Synthesis. Third Edition, 1999, John Wiley & Sons, Inc., или тому подобное. Реакцию введения таких защитных групп и реакцию удаления защитных групп можно осуществлять обычными способами, такими как способы, описанные в упомянутой выше литературе.
[Химическая формула 2]
где R и R′ представляют собой защитную группу карбоксильной группы и защитную группу гидроксильной группы соответственно, и R1, R2, R3 и R4 соответственно имеют такие же значения, как определено выше.
Стадия A-I является стадией получения соединения (2) путем введения защитной группы R в карбоксильную группу соединения (1). Используемые в реакции растворитель, реагент, температура реакции и время реакции могут быть выбраны соответственно, например, опираясь на ссылку T.H.Greene, P.G.Wuts, Protective Groups in Organic Synthesis. Third Edition, 1999, John Wiley & Sons, Inc., или тому подобное.
Стадия A-II является стадией получения соединения (3) путем взаимодействия соединения (2) с гидроксиламином.
Примеры используемого в реакции растворителя включают метанол, этанол, бутанол, толуол, дихлорметан, диметилформамид (ДМФ), тетрагидрофуран (ТГФ) и диметилсульфоксид, и предпочтительным является этанол или ТГФ.
Примеры используемого в реакции гидроксиламина включают 50% масс./масс. водный раствор гидроксиламина и гидрохлорида гидроксиламина, и предпочтительным примером является 50% масс./масс. водный раствор гидроксиламина.
Температура реакции составляет от 0°С до 150°С и предпочтительно от 70°С до 90°С. Время реакции составляет от 30 минут до 24 часов и предпочтительно от 2 до 4 часов.
Если требуется, например, последующая обработка, то ее можно осуществлять по следующей процедуре. Реакционную смесь охлаждают до комнатной температуры, далее растворитель подвергают дистилляции при пониженном давлении и образовавшийся остаток промывают водой.
Стадия A-III является стадией получения соединения (5) путем взаимодействия соединения (4) со сложным эфиром азотистой кислоты и карбоновой кислотой.
Примеры используемого в реакции эфира азотистой кислоты включают трет-бутилнитрит и н-бутилнитрит, и предпочтительным является трет-бутилнитрит.
Примеры используемой в реакции карбоновой кислоты включают, например, уксусную кислоту и пропионовую кислоту, и предпочтительной является уксусная кислота.
Температура реакции составляет от -20°С до 100°С и предпочтительно от 0°С до 70°С. Время реакции составляет от 1 до 24 часов и предпочтительно от 2 до 4 часов.
Если требуется, например, последующая обработка, то ее можно осуществлять по следующей процедуре. Реакционную смесь охлаждают до комнатной температуры и затем растворитель подвергают дистилляции при пониженном давлении. Воду добавляют к образовавшемуся остатку и продукт экстрагируют органическим растворителем, таким как этилацетат. Полученный таким образом органический слой сушат над обезвоживающим веществом, таким как сульфат натрия. После удаления нерастворившегося вещества растворитель подвергают дистилляции при пониженном давлении.
Стадия A-IV является стадией получения соединения (6) путем взаимодействия соединения (3), полученного на стадии A-II, с соединением (5), полученным на стадии A-III, в присутствии конденсирующего реагента.
Примеры используемого в этой реакции растворителя включают, например, дихлорметан, тетрагидрофуран, 1,4-диоксан, ДМФ, диметилацетамид, предпочтительным растворителем является дихлорметан или ДМФ, и более предпочтительным является ДМФ.
Используемый в реакции конденсирующий реагент включает (i) карбодиимиды, такие как 1,3-дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид и 1-этил-3-(3-диметиламинопропил)карбодиимид (WSC) и комбинации указанных карбодиимидов и N-гидроксисоединений, таких как 1-гидроксибензотриазол, 1-гидрокси-7-азабензотриазол и N-гидроксисукцинимид, и (ii) имидазолы, такие как 1,1′-карбонилдиимидазол (CDI), и предпочтительной является комбинация WSC и 1-гидроксибензотриазола.
Температура реакции составляет от 0°С до 200°С и предпочтительно от 20°С до 120°С. Время реакции составляет от 30 минут до 24 часов и предпочтительно от 2 до 4 часов.
Если требуется, например, последующая обработка, то ее можно осуществлять по следующей процедуре. Реакционную смесь охлаждают до комнатной температуры и затем растворитель подвергают дистилляции при пониженном давлении. Воду добавляют к образовавшемуся остатку и продукт экстрагируют органическим растворителем, таким как этилацетат. Полученный таким образом органический слой сушат над обезвоживающим веществом, таким как сульфат натрия. После удаления нерастворенного вещества растворитель подвергают дистилляции при пониженном давлении и остаток очищают хроматографией на силикагеле.
Стадия A-V является стадией получения соединения (7) путем удаления защитной группы R′ из соединения (6), полученного на стадии A-IV.
Примеры используемого в реакции растворителя включают метанол, этанол, 2-пропанол и n-бутанол, и предпочтительным растворителем является этанол.
Примеры используемого в реакции реагента включают карбонат калия, карбонат натрия, гидроксид калия и гидроксид натрия, и предпочтительным является карбонат калия.
Температура реакции составляет от -30°С до 100°С и предпочтительно от -20°С до 20°С. Время реакции составляет от 10 до 120 минут и предпочтительно от 20 до 50 минут.
Если требуется, например, последующая обработка, то ее можно осуществлять по следующей процедуре. Кислоту, такую как хлористоводородная кислота, добавляют к реакционной смеси, чтобы она стала немного кислой или нейтральной, и продукт экстрагируют органическим растворителем, таким как этилацетат. Полученный таким образом органический слой сушат над обезвоживающим веществом, таким как сульфат натрия. После удаления нерастворенного вещества растворитель подвергают дистилляции при пониженном давлении и остаток очищают хроматографией на силикагеле.
Стадия A-VI является стадией получения соединения (9) путем взаимодействия соединения (7), полученного на стадии A-V, с соединением (8).
Примеры используемого в реакции растворителя включают ТГФ, дихлорметан, ацетонитрил и толуол, и предпочтительным растворителем является ТГФ.
Примеры используемого в реакции реагента включают (i) комбинации сложных эфиров азодикарбоновой кислоты, таких как диэтилазодикарбоксилат и ди-трет-бутилазодикарбоксилат, и фосфинов, таких как трифенилфосфин и трибутилфосфин, и (ii) (цианометилен)фосфораны, такие как (цианометилен)триметилфосфоран и (цианометилен)трибутилфосфоран, и предпочтительной комбинацией является комбинация ди-трет-бутилазодикарбоксилата и трифенилфосфина.
Температура реакции составляет от -20°С до 100°С и предпочтительно от 0°С до 40°С. Время реакции составляет от 10 минут до 6 часов и предпочтительно от 30 минут до 2 часов.
Если требуется, например, последующая обработка, то ее можно осуществлять по следующей процедуре. После дистилляции растворителя при пониженном давлении воду добавляют к реакционной смеси и продукт экстрагируют органическим растворителем, таким как этилацетат. Полученный таким образом органический слой сушат над обезвоживающим веществом, таким как сульфат натрия. После удаления нерастворенного вещества растворитель подвергают дистилляции при пониженном давлении и остаток очищают хроматографией на силикагеле.
Стадией A-VII является стадия получения соединения (10) путем удаления защитной группы R из соединения (9), полученного на стадии A-VI.
Примеры используемого в реакции растворителя включают дихлорметан и этилацетат, и предпочтительным растворителем является дихлорметан.
Примеры используемого в реакции реагента включают хлористый водород и трифторуксусную кислоту, и предпочтительным реагентом является трифторуксусная кислота.
Температура реакции составляет от -20°С до 60°С и предпочтительно от 10°С до 30°С. Время реакции составляет от 10 минут до 6 часов и предпочтительно от 20 минут до 2 часов.
Если требуется, например, последующая обработка, то ее можно осуществлять по следующей процедуре. Растворитель подвергают дистилляции при пониженном давлении и образовавшийся остаток промывают изопропиловым эфиром.
Стадией A-VIII является стадия получения соединения (I) согласно настоящему изобретению путем взаимодействия соединения (10), полученного на стадии A-VII, с аминосодержащим соединением (11), в присутствии конденсирующего реагента.
Примеры используемого в реакции растворителя включают дихлорметан, ТГФ, 1,4-диоксан, ДМФ и диметилацетамид, предпочтительным растворителем является дихлорметан или ДМФ, и более предпочтительным является ДМФ.
Используемый в реакции конденсирующий реагент является не очень ограниченным, поскольку он является средством, используемым в реакциях амидирования, и конденсирующие реагенты, описанные в публикации R.C. Larock, Comprehensive Organic Transformations, Second Edition, 1999, John Wiley & Sons, Inc., и тому подобное могут быть использованы. Конкретные примеры включают (i) сложные эфиры фосфорной кислоты, такие как диэтилфосфорилцианид; (ii) карбодиимиды, такие как 1,3-дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид и WSC и комбинации указанных карбодиимидов и N-гидроксисоединений, таких как 1-гидроксибензотриазол; (iii) имидазолы, такие как CDI; (iv) 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (DMT-MM); и (v) фосфаты, такие как О-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония гексафторфосфат (HATU) и О-бензотриазол-1-ил-N,N,N′,N′-тетраметилурония гексафторфосфат (HBTU). Предпочтительной является комбинация WSC и 1- гидроксибензотриазола.
Температура реакции составляет от 0°С до 100°С и предпочтительно от 0°С до 50°С. Время реакции составляет от 30 минут до 96 часов и предпочтительно от 1 до 12 часов.
Если требуется, например, последующая обработка, то ее можно осуществлять по следующей процедуре. Воду добавляют к реакционной смеси и продукт экстрагируют органическим растворителем, таким как этилацетат. Полученный таким образом органический слой промывают водой насыщенным раствором соли и тому подобное и сушат над обезвоживающим веществом, таким как сульфат натрия. Растворитель подвергают дистилляции при пониженном давлении и остаток очищают хроматографией на силикагеле.
Соединение согласно настоящему изобретению можно получать способами, описанными выше, и также можно легко получать из известных соединений согласно ссылочным примерам и примерам, которые будут описаны ниже.
Соединение согласно настоящему изобретению или его фармацевтически приемлемая соль, полученное описанными выше способами, имеет превосходный гипогликемический эффект, и поэтому оно может быть использовано в качестве активного ингредиента фармацевтической композиции, которую можно использовать в лечении и/или предотвращении диабета 1 типа, диабета 2 типа, гестационного диабета, гипергликемии, обусловленной другими факторами, нарушения толерантности к глюкозе (IGT), ожирения, ассоциированных с диабетом заболеваний (например, гиперлипидемия, гиперхолестеринемия, нарушение липидного метаболизма, гипертензия, жировой метаморфоз печени, метаболический синдром, отек, сердечная недостаточность, стенокардия, инфаркт миокарда, артериосклероз, гиперурикемия и подагра) или диабетических осложнений (например, ретиноз, почечная недостаточность, нейропатия, катаракта, гангрена нижней конечности, инфекции и кетоз).
Кроме того, соединение согласно настоящему изобретению или его фармацевтически приемлемая соль имеет превосходный защитный эффект по отношению к β-клеткам или поджелудочной железе и поэтому может быть использовано в качестве активного ингредиента фармацевтической композиции, которую можно использовать для защиты β-клеток или поджелудочной железы.
Соединение согласно настоящему изобретению также может быть использовано в комбинации с терапевтическим лекарственным средством от диабета, отличным от соединения согласно настоящему изобретению, терапевтическим лекарственным средством, применяемым против диабетических осложнений, терапевтическим лекарственным средством от гиперлипидемии, терапевтическим лекарственным средством от гипертензии и тому подобное.
Когда фармацевтическую композицию, содержащую соединение согласно настоящему изобретению или его фармацевтически приемлемую соль, вводят млекопитающему (например, человеку, лошади, корове или свинье; предпочтительно человеку), фармацевтическую композицию можно вводить системно или местно и перорально или парентерально.
Соответствующие лекарственные формы фармацевтической композиции согласно настоящему изобретению могут быть выбраны согласно способу введения. Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена способами, используемыми для приготовления различных обычно применяемых препаратов.
Примеры лекарственной формы фармацевтической композиции для перорального использования включают таблетки, пилюли, порошки, гранулы, капсулы, жидкости, суспензии, эмульсии, сиропы и эликсиры. Фармацевтические композиции таких лекарственных форм могут быть приготовлены обычными способами с использованием соответствующе выбранных, при необходимости, эксципиентов, связующих веществ, дезинтегрирующих средств, смазывающих средств, веществ, способствующих набуханию, набухающих добавок, покрывающих средств, пластификаторов, стабилизирующих средств, антисептиков, антиоксидантов, красителей, добавок, способствующих растворению, суспендирующих средств, эмульгаторов, подсластителей, консервантов, буферов, разбавителей, увлажняющих средств и тому подобное, которые обычно используют в качестве добавок.
Примеры лекарственных форм фармацевтической композиции для парентерального использования включают инъекции, мази, гели, кремы, горячие примочки, пластыри, аэрозоли, средства для ингаляции, спреи, глазные капли, капли в нос и суппозитории. Фармацевтические композиции таких лекарственных форм могут быть приготовлены обычными способами, соответствующе выбирая при необходимости стабилизирующие средства, антисептики, добавки, способствующие растворению, увлажняющие средства, консерванты, антиоксиданты, ароматизирующие вещества, гелеобразующие средства, нейтрализующие средства, буферы, изотоничные средства, поверхностно-активные вещества, красители, буферные вещества, загустители, смачивающие средства, наполнители, средства, стимулирующие всасывание, суспендирующие средства, связующие вещества и тому подобное, которые обычно применяют в качестве добавок.
Вводимое количество соединения согласно настоящему изобретению или его фармацевтически приемлемой соли может варьировать в зависимости от симптомов, возраста, массы тела или тому подобное. Однако в случае перорального введения соединение или его соль вводят один раз или несколько раз в день в количестве 1-2000 мг и предпочтительно 1-400 мг, относительно соединения, на дозу для взрослого; и в случае парентерального введения соединение или его соль вводят один раз или несколько раз в день в количестве 0,01-500 мг и предпочтительно 0,1-300 мг, относительно соединения, на дозу для взрослого.
В дальнейшем, настоящее изобретение будет описано более подробно посредством ссылочных примеров, примеров, примеров получения, примера препарата и тестовых примеров, но объем настоящего изобретения не предназначен ограничивать указанные примеры.
Примеры
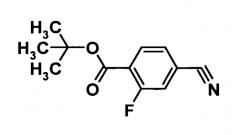
(Ссылочный пример 1)
Трет-бутил 4-циано-2-фторбензоат
[Химическая формула 3]
Ди-трет-бутил дикарбонат (145,4 г, 666 ммоль) и 4-диметиламинопиридин (7,40 г, 60,6 ммоль) добавляли к раствору 4-циано-2-фторбензоата в смеси трет-бутиловый спирт (1000 мл)-тетрагидрофуран (500 мл) и смесь перемешивали при 60°С в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и нерастворенный материал удаляли фильтрованием через целит. Растворитель отгоняли при пониженном давлении. Таким образом, был получен сырой продукт указанного в заголовке соединения.
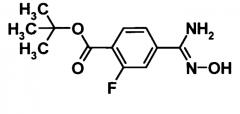
(Ссылочный пример 2)
Трет-бутил 4-амино(гидроксиимино)метил-2-фторбензоат
[Химическая формула 4]
Водный 50%-ный раствор гидроксиламина (60 мл, 100 ммоль) добавляли к раствору соединения, полученного в ссылочном примере 1 (11,0 г, 66,6 ммоль), в смеси этанол (100 мл)-тетрагидрофуран (50 мл) и смесь перемешивали при 80°С в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и затем растворитель отгоняли при пониженном давлении. Образовавшийся остаток промывали водой и сушили при 40°С в течение 2 дней при пониженном давлении. Таким образом, было получено указанное в заголовке соединение (150,0 г, выход: 98%).
1H-ЯМР (400 МГц, CDCl3) δ м.д.:
7,89 (1H, т, J=8 Гц), 7,44 (2H, дд, J=8,2 Гц), 7,39 (2H, дд. J=11,2 Гц), 4,90 (2H, с), 1,60 (9H, с).
(Ссылочный пример 3)
Циклопропил (4-гидроксифенил)метанон
[Химическая формула 5]
4-Хлорпропил (4-гидроксифенил)метанон (25,1 г, 127 ммоль) добавляли к 2 N водному раствору гидроксида натрия (283 мл, 566 ммоль) несколькими по