Способ определения наследственной предрасположенности к нарушению барьерной функции кожи
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к способу определения наследственной предрасположенности к нарушению барьерной функции кожи. Сущность способа состоит в том, что из венозной крови осуществляют выделение генетического материала. Проводят полимеразную цепную реакцию синтеза ДНК с последующим анализом полиморфизма длин рестрикционных фрагментов, определение нуклеотидной последовательности и на основании этого определение полиморфного варианта 2282del4 филаггрина. При проведении полимеразной цепной реакции используют специфические праймеры: «FLG-2 F1» 5'Biotin-TgA-CCA-gCC-TgT-CCA-Tgg-C3'; «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3', размер ампликона - 205 пар оснований, а после проведения полимеразной цепной реакции проводят реакцию пиросеквенирования в режиме реального времени с использованием специфического праймера «FLG-2 S1» 5'gAC-ATT-CAg-AAg-ACT-CAg-AC3'. Детекцию нуклеотидной последовательности осуществляют с помощью хемилюминисцентного сигнала, далее проводят сравнение полученной нуклеотидной последовательности в положении 2282 с референсными последовательностями. При выявлении на полученной пирограмме отсутствия делеции в положении 2282 гена филаггрина при воздействии на организм вредного производственного фактора раздражающего и сенсибилизирующего действия определяют низкую наследственную предрасположенность к нарушению барьерной функции кожи. При выявлении на полученной пирограмме гетерозиготного варианта ins/del в положении 2282 гена филаггрина определяют высокую наследственную предрасположенность к нарушению барьерной функции кожи. Использование заявленного способа позволяет повысить эффективность определения наследственной предрасположенности к нарушению барьерной функции кожи при воздействии на организм факторов раздражающего и сенсибилизирующего действия. 2 ил., 1 табл., 2пр.
Реферат
Изобретение относится к медицине и может быть использовано для определения наследственной предрасположенности к нарушению барьерной функции кожи.
Известен способ определения наследственной предрасположенности к нарушению барьерной функции кожи, включающий забор венозной крови, выделение генетического материала, проведение полимеразной цепной реакции синтеза ДНК с последующим анализом полиморфизма длин рестрикционных фрагментов, определение нуклеотидной последовательности и на основании этого определение полиморфного варианта 2282del4 гена филаггрина (см. Хантимерова Э.Ф., Нуртдинова Г.М., Карунас А.С., Гималова Г.Ф. Клинико-генетическая характеристика больных атопическим дерматитом и крапивницей с мутациями в гене филаггрина // Фундаментальные исследования. - 2014. - №10 (4). - С. 752-756).
Однако данный способ имеет низкую пропускную способность ввиду невысокой скорости проведения обследования пациентов (время анализа 1-2 дня), ввиду сложности, трудоемкости используемых лабораторных технологий, являющихся вредными для медицинского персонала, проводящего их. Это затрудняет определение наследственной предрасположенности к нарушению барьерной функции кожи, например, при проведении диспансеризации или периодических медицинских осмотров большого количества работающих во вредных и/или опасных условиях труда за короткие (сжатые) сроки времени.
Задачей настоящего изобретения является обеспечение возможности определения наследственной предрасположенности к нарушению барьерной функции кожи за короткие (сжатые) сроки времени (3÷5) час, например, при проведении диспансеризации или периодических медицинских осмотров большого количества работающих во вредных и/или опасных условиях труда.
Техническим результатом изобретения является повышение скорости проведения определения наследственной предрасположенности к нарушению барьерной функции кожи при воздействии на организм факторов раздражающего и сенсибилизирующего действия.
Указанная задача достигается тем, что в известном способе определения наследственной предрасположенности к нарушению барьерной функции кожи, включающем забор венозной крови, выделение генетического материала, проведение полимеразной цепной реакции синтеза ДНК с последующим анализом полиморфизма длин рестрикционных фрагментов, определение нуклеотидной последовательности и на основании этого определение полиморфного варианта 2282del4 филаггрина, при проведении полимеразной цепной реакции используют специфические праймеры: «FLG-2 F1» 5'Biotin-TgA-CCA-gCC-TgT-CCA-Tgg-C3'; «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3', размер ампликона - 205 пар оснований, а после проведения полимеразной цепной реакции проводят реакцию пиросеквенирования в режиме реального времени с использованием специфического праймера «FLG-2 S1» 5'gAC-ATT-CAg-AAg-ACT-CAg-AC3' и детекцию нуклеотидной последовательности с помощью хемилюминисцентного сигнала, далее проводят сравнение полученной нуклеотидной последовательности в положении 2282 с референсными последовательностями, после этого при выявлении на полученной пирограмме отсутствия делеции в положении 2282 гена филаггрина при воздействии на организм вредного производственного фактора раздражающего и сенсибилизирующего действия определяют низкую наследственную предрасположенность к нарушению барьерной функции кожи, при выявлении на полученной пирограмме гетерозиготного варианта ins/del в положении 2282 гена филаггрина при воздействии на организм вредного производственного фактора раздражающего и сенсибилизирующего действия определяют высокую наследственную предрасположенность к нарушению барьерной функции кожи.
Проведенные исследования по патентным и научно-техническим информационным источникам показали, что предлагаемый способ неизвестен и не следует явным образом из изученного уровня техники, т.е. соответствует критериям "новизна" и "изобретательский уровень".
Предлагаемый способ может быть применен в клинических, биохимических, молекулярно-генетических лабораториях, укомплектованных широко используемым оборудованием, выпускаемым отечественной или зарубежной промышленностью.
Следовательно, заявленный способ является доступным и практически применимым.
Таким образом, предложена совокупность приемов, позволяющих обеспечить повышение скорости проведения определения наследственной предрасположенности к нарушению барьерной функции кожи, что, в свою очередь, позволит повысить достоверность определения низкой наследственной предрасположенности к нарушению барьерной функции кожи при воздействии на организм вредных производственных факторов раздражающего и сенсибилизирующего действия, например, при проведении диспансеризации или периодических медицинских осмотров большого количества работающих во вредных и/или опасных условиях труда за короткие (сжатые) сроки времени.
В таблице 1 представлена последовательность использованных праймеров.
Предлагаемый способ пояснен на чертеже.
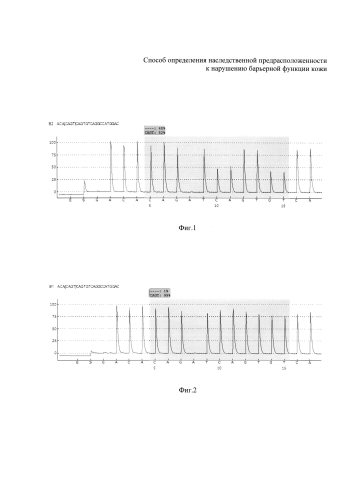
На фиг. 1 изображена пирограмма с вариантом гетерозиготного генотипа по определяемому аллельному варианту, имеющему делецию в положении 2282 (ins/del) (пример 1). На фиг. 2 изображена пирограмма с вариантом гомозиготного генотипа по определяемому аллельному варианту, не имеющему замены делеции, в положении 2282 (ins/ins) в нуклеотидной последовательности - соответствует норме (пример 2).
Предлагаемый способ осуществляют следующим образом.
У пациентов осуществляют забор венозной крови. Из 100 мкл цельной крови выделяют ДНК-сорбент однопробирочным методом с использованием комплекта для выделения "ДНК-сорб-В" (ТУ 9398-071-01897593-2008) в соответствии с инструкцией к используемому комплекту.
Из полученного препарата ДНК (объемом 50 мкл) готовят серии разведений в ТЕ-буфере до конечной концентрации 1-3 нг/мкл, добавляют 10 мкл конечного раствора ДНК в пробирку для осуществления полимеразной цепной реакции со специфическими праймерами.
Объем смеси для полимерной цепной реакции - 25 мкл, при этом используют реагенты производства ФБУН «Центрального НИИ Эпидемиологии»: «2,5×ПЦР-буфер-2-blue», «Смесь dNTPs», праймеры «FLG2-F1» и «FLG2-R1». Количество праймеров в реакцию - 7 пмоль. Для амплификации исследуемого генетического локуса используют специфические олигонуклеотидные праймеры «FLG-2 F1» 5'Biotin-TgA-CCA-gCC-TgT-CCA-Tgg-C3' и «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3', один из которых мечен биотином (последовательность используемых праймеров представлена в табл. 1). Количество праймеров «FLG-2 Fl» 5'Biotin-TgA-CCA-gCC-TgT-CCA-Tgg-C3' и «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3' в полимеразной цепной реакции - 7 пмоль.
Реакцию амплификации проводят по следующей программе.
При использовании, например, амплификатора «Т 100 Thermal Cycler» (фирма Bio Rad, США), когда температура достигнет 95°C (режим паузы), ставят пробирки в ячейки амплификатора и выдерживают их при температуре 95°C - 15 мин. Далее выдерживают пробирки 45 циклов 95°C - 15 секунд, 65°C - 15 секунд, 72°C - 20 секунд.
После проведения амплификации осуществляют пробоподготовку образцов для секвенирования. Продукт амплификации иммобилизируют с 1 мкл частиц «Streptavidin Sepharose» («GE Healthcare», Швеция) в 40 мкл «Буфера для связывания» (ФБУН «Центральный НИИ эпидемиологии»). После иммобилизации проводят серию отмывок с помощью станции для пробопродготовки «PyroMark Q24 Workstation)) («Qiagen», Германия) и набора реагентов «Пиро-преп» (ФБУН «Центральный НИИ эпидемиологии», регистрационное удостоверение № ФСР 2012/13246 от 19 марта 2012 г.). В результате пробоподготовки получают амплифицированный с биотинилированного праймера одноцепочечный ПЦР-фрагмент, который используют в качестве матрицы в реакции пиросеквенирования.
Пиросеквенирование проводят с использованием праймера «FLG2-S1» в количестве 7,5 пмоль и набора реагентов «PyroMark® Gold Q96 Reagents» («Qiagen», Германия) на приборе «PyroMark Q24» («Qiagen», Германия). Последовательность праймера для секвенирования «FLG-2 S1» следующая: 5'gAC-ATT-CAg-AAg-ACT-CAg-АС3'. Последовательность добавления нуклеотидов в реакцию пиросеквенирования: GACACAGATCAGTGTCA.
Далее проводят сравнение полученной нуклеотидной последовательности с референсными последовательностями с помощью программного обеспечения «PyroMark Q24 2.0.6» и по полученной пирограмме определяют, какой вариант мутации имеет место в нуклеотидной последовательности (см., например, фиг. 1 и 2).
При выявлении на полученной пирограмме отсутствия делеции в положении 2282 гена FLG и при воздействии на организм вредного производственного фактора раздражающего и сенсибилизирующего действия определяют низкую наследственную предрасположенность к нарушению барьерной функции кожи, при выявлении на полученной пирограмме гетерозиготного варианта ins/del в положении 2282 гена FLG и при воздействии на организм вредного производственного фактора раздражающего и сенсибилизирующего действия определяют высокую наследственную предрасположенность к нарушению барьерной функции кожи, при которой облегчается проникновение аллергенов и инфекционных агентов через эпидермис, последние инициируют развитие местной и системной аллергической реакции организма, что приводит к развитию профессиональных аллергодерматозов.
Пример 1. Больная Т., 48 лет
При анализе анамнеза и профессионального маршрута пациента было выявлено, что больная Т. работала с 1986 г. по настоящее время гальваником в контакте с соединениями хрома, никеля, кобальта. Считает себя больной с 1987 г., когда впервые появились высыпания на тыльных поверхностях кистей, сопровождавшиеся зудом. Обращалась к дерматологу по месту жительства, получала лечение с временным эффектом. В выходные дни, во время отпуска отмечает улучшение. Впервые направлена в клинику института ФГБНУ «НИИ МТ» для решения вопроса о связи заболевания кожи с профессией в 2002 г. При обследовании была выявлена повышенная чувствительность к солям хрома, никеля, кобальта и дано заключение о профессиональном характере кожного заболевания.
При биохимическом анализе крови обнаружено умеренное повышение уровня печеночных ферментов АЛТ 56 Ед/л (N 0-35 Ед/л), ACT 45 U/1 (N 0-35 U/1), превышение уровня холестерина в сыворотке крови 6,8 ммоль/л (N 3,0-6,2 ммоль/л). При иммунологическом исследовании было определено умеренное повышенное содержание Ig Е к Trichophyton rubrum 1,42 кЕд/л (N до 0,35 кЕд/л). При изучении состояния барьерной функции кожи с помощью прибора "Skin-o-mat" производства фирмы "Cosmomed GmbH", Германия показатели гидратантности были снижены 25,54 (N от 35), уровень рН повышен 6,54 (N 4,5-5,5), содержание липидов на поверхности кожи снижено 2,83 мкг/см2 (N 6,0-6,5 мкг/см2).
Кровь исследовали согласно предлагаемому способу.
Из 100 мкл цельной крови выделяли суммарную ДНК однопробирочным методом с использованием комплекта для выделения "ДНК-сорб-В" (ТУ 9398-071-01897593-2008) в соответствии с инструкцией к используемому комплекту.
Из полученного препарата ДНК (объемом 50 мкл) приготовили серии разведений в ТЕ-буфере до конечной концентрации 1÷3 нг/мкл, добавляли 10 мг конечного раствора ДНК в пробирку для полимеразной цепной реакции. Объем смеси для полимерной цепной реакции - 25 мкл, при этом использовали реагенты производства ФБУН «Центрального НИИ Эпидемиологии»: «2,5×ПЦР-буфер-2-blue», «Смесь dNTPs», праймеры «FLG2-F1» и «FLG2-R1». Количество праймеров в реакцию - 7 пмоль. Для амплификации исследуемого генетического локуса использовали специфические олигонуклеотидные праймеры «FLG-2 F1» 5'Biotin-TgA-CCA-gCC-TgT-CCA-Tgg-C3' и «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3', один из которых мечен биотином (последовательность используемых праймеров представлена в табл. 1). Количество праймеров «FLG-2 F1» 5'Biotin-TgA-CCA-gCC-TgT-CCA-Tgg-C3' и «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3' в полимеразной цепной реакции - 7 пмоль.
Реакцию амплификации проводили по следующей программе.
При использовании амплификатора «Т 100 Thermal Cycler» (фирма Bio Rad, США), когда температура достигла 95°C (режим паузы), ставят пробирки в ячейки амплификатора и выдерживают их при температуре 95°C - 15 мин. Далее выдерживали пробирки 45 циклов 95°C - 15 секунд, 65°C - 15 секунд, 72°C - 20 секунд.
После проведения амплификации осуществляли пробоподготовку образцов для секвенирования. Продукт амплификации иммобилизировали с 1 мкл частиц «Streptavidin Sepharose» («GE Healthcare», Швеция) в 40 мкл «Буфера для связывания» (ФБУН «Центральный НИИ эпидемиологии»). После иммобилизации проводили серию отмывок с помощью станции для пробопродготовки «PyroMark Q24 Workstation («Qiagen», Германия) и набора реагентов «Пиро-преп» (ФБУН «Центральный НИИ эпидемиологии», регистрационное удостоверение № ФСР 2012/13246 от 19 марта 2012 г.). В результате пробоподготовки получали амплифицированный с биотинилированного праймера одноцепочечный ПЦР-фрагмент, который использовали в качестве матрицы в реакции пиросеквенирования.
Пиросеквенирование проводили с использованием праймера «FLG2-S1» в количестве 7,5 пмоль и набора реагентов «PyroMark® Gold Q96 Reagents» («Qiagen», Германия) на приборе «PyroMark Q24» («Qiagen», Германия). Последовательность праймера для секвенирования «FLG-2 S1» следующая: 5'gAC-ATT-CAg-AAg-ACT-CAg-АС3'. Последовательность добавления нуклеотидов в реакцию пиросеквенирования: GACACAGATCAGTGTCA.
Далее провели сравнение полученной нуклеотидной последовательности с референсными последовательностями с помощью программного обеспечения «PyroMark Q24 2.0.6» и по полученной пирограмме определили делецию в гетерозиготном состоянии в положении 2282 (ins/del) гена филаггрин (см. фиг. 1), т.е. синтез белка филаггрина нарушен.
Вывод: у больной В. был выявлен гетерозиготный вариант 2282 (ins/del) гена филаггрин, имеющий делецию в гетерозиготном состоянии, свидетельствующий о нарушении синтеза белка филаггрина, что приводит к нарушению в процессе конечной дифференцировки эпидермиса, приводящего к выраженному нарушению барьерной функции кожи (снижены 25,54 (N от 35), уровень pH повышен 6,54 (N 4,5-5,5), содержание липидов на поверхности кожи снижено 2,83 мкг/см2 (N 6,0-6,5 мкг/см2)).
Это, в свою очередь, привело к развитию профессионального аллергодерматоза через 1 год от начала работы с веществами раздражающего и сенсибилизирующего действия. Время определения наследственной предрасположенности больной Т. к нарушению барьерной функции кожи составило 4,5 часа.
Пример 2. Больной К., 64 года
При анализе анамнеза и профессионального маршрута пациента было выявлено, что больной К. работал с 1969 г. по 2007 г. токарем в контакте с соединениями хрома, никеля, кобальта. Считает себя больным с 2005 г., когда впервые появились высыпания на тыльных поверхностях кистей и предплечий, сопровождавшиеся зудом, далее высыпания распространились на голени. Обращался к дерматологу по месту жительства, получал лечение с временным эффектом. В выходные дни, во время отпуска отмечал улучшение. Впервые направлен в клинику института ФГБНУ «НИИ МТ» для решения вопроса о связи заболевания кожи с профессией в 2008 г. При обследовании была выявлена повышенная чувствительность к солям хрома, никеля, кобальта и дано заключение о профессиональном характере кожного заболевания.
При биохимическом анализе крови не было обнаружено отклонений от норм.
При иммунологическом исследовании не было определено повышенное содержание Ig Е к Trichophyton rubrum 0,1 кЕд/л (N до 0,35 кЕд/л).
При изучении состояния барьерной функции кожи с помощью прибора "Skin-o-mat" производства фирмы "Cosmomed GmbH", Германия, показатели гидратантности были в норме 36,05 (N от 35), уровень pH в пределах нормы 5,3 (N 4,5-5,5), содержание липидов на поверхности кожи снижено 5,5 мкг/см2 (N 6,0-6,5 мкг/см2).
Кровь исследовали согласно предлагаемому способу.
Из 100 мкл цельной крови выделяли суммарную ДНК однопробирочным методом с использованием комплекта для выделения "ДНК-сорб-В"(ТУ 9398-071-01897593-2008) в соответствии с инструкцией к используемому комплекту.
Из полученного препарата ДНК (объемом 50 мкл) приготовили серии разведений в ТЕ-буфере до конечной концентрации 1÷3 нг/мкл, добавляли 10 мг конечного раствора ДНК в пробирку для полимеразной цепной реакции. Объем смеси для полимерной цепной реакции - 25 мкл, при этом использовали реагенты производства ФБУН «Центрального НИИ Эпидемиологии»: «2,5×ПЦР-буфер-2-blue», «Смесь dNTPs», праймеры «FLG2-F1» и «FLG2-R1». Количество праймеров в реакцию - 7 пмоль. Для амплификации исследуемого генетического локуса использовали специфические олигонуклеотидные праймеры «FLG-2 F1» 5'Biotin-TgA-CCA-gCC-TgT-CCA-Tgg-C3' и «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3', один из которых мечен биотином (последовательность используемых праймеров представлена в табл. 1). Количество праймеров «FLG-2 F1» 5'Biotin-TgA-CCA-gCC-TgT-CCA-Tgg-C3' и «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3' в полимеразной цепной реакции - 7 пмоль.
Реакцию амплификации проводили по следующей программе.
При использовании амплификатора «Т 100 Thermal Cycler» (фирма Bio Rad, США), когда температура достигла 95°C (режим паузы), ставят пробирки в ячейки амплификатора и выдерживают их при температуре 95°C - 15 мин. Далее выдерживали пробирки 45 циклов 95°C - 15 секунд, 65°C - 15 секунд, 72°C - 20 секунд.
После проведения амплификации осуществляли пробоподготовку образцов для секвенирования. Продукт амплификации иммобилизировали с 1 мкл частиц «Streptavidin Sepharose» («GE Healthcare», Швеция) в 40 мкл «Буфера для связывания» (ФБУН «Центральный НИИ эпидемиологии»). После иммобилизации проводили серию отмывок с помощью станции для пробопродготовки «PyroMark Q24 Workstation («Qiagen», Германия) и набора реагентов «Пиро-преп» (ФБУН «Центральный НИИ эпидемиологии», регистрационное удостоверение № ФСР 2012/13246 от 19 марта 2012 г.). В результате пробоподготовки получали амплифицированный с биотинилированного праймера одноцепочечный ПЦР-фрагмент, который использовали в качестве матрицы в реакции пиросеквенирования.
Пиросеквенирование проводили с использованием праймера «FLG2-S1» в количестве 7,5 пмоль и набора реагентов «PyroMark® Gold Q96 Reagents» («Qiagen», Германия) на приборе «PyroMark Q24» («Qiagen», Германия). Последовательность праймера для секвенирования «FLG-2 S1» следующая: 5'gAC-ATT-CAg-AAg-ACT-CAg-АС3'. Последовательность добавления нуклеотидов в реакцию пиросеквенирования: GACACAGATCAGTGTCA.
Далее проводили сравнение полученной нуклеотидной последовательности с референсными последовательностями с помощью программного обеспечения «PyroMark Q24 2.0.6» и по полученной пирограмме определили отсутствие делеции в положении 2282 (ins/ins) гена филаггрин (см. фиг. 2), соответствующего норме, т.е. белок филаггрин синтезируется нормально.
Вывод: у больного К. был выявлен гомозиготный вариант FLG (ins/ins) полиморфизма 2282del4, не имеющий делецию в положении 2282, свидетельствующий о нормальном синтезе этого белка, при этом наблюдали умеренное снижение барьерной функции кожи, которое проявляется лишь в снижении содержания липидов на поверхности кожи, что может быть вызвано большим стажем работы с факторами раздражающего и сенсибилизирующего действия (хром, никель, кобальт). При этом профессиональный аллергодерматоз развился через 38 лет от начала работы с факторами раздражающего и сенсибилизирующего действия (хром, никель, кобальт). Время определения наследственной предрасположенности больного К. к нарушению барьерной функции кожи составило 3,0 часа.
Предлагаемый способ прогнозирования наследственной предрасположенности к нарушению барьерной функции кожи позволяет повысить точность полученных результатов за счет снижения до минимума ошибки при интерпретации результатов путем использования компьютерной обработки полученных результатов и скорость проведения анализа (1-2 дня в известном способе и 3-5 часов в предлагаемом способе) по сравнению с прототипом за счет применения новой лабораторной технологии - метода пиросеквенирования, использование которого позволяет в единицу времени проводить большее количество анализов, по результатам которых определяют наследственную предрасположенность к нарушению барьерной функции кожи, например, при проведении диспансеризации или периодических медицинских осмотров большого количества работающих во вредных и/или опасных условиях труда за короткие (сжатые) сроки времени.
Предложенный способ определения наследственной предрасположенности к нарушению барьерной функции кожи может быть использован в клинических, биохимических, молекулярно-генетических лабораториях, укомплектованных оборудованием, выпускаемым отечественной или зарубежной промышленностью.
Способ определения наследственной предрасположенности к нарушению барьерной функции кожи, включающий забор венозной крови, выделение генетического материала, проведение полимеразной цепной реакции синтеза ДНК с последующим анализом полиморфизма длин рестрикционных фрагментов, определение нуклеотидной последовательности и на основании этого определение полиморфного варианта 2282del4 филаггрина, отличающийся тем, что при проведении полимеразной цепной реакции используют специфические праймеры: «FLG-2 F1» 5'Biotin -TgA-CCA-gCC-TgT-CCA-Tgg-C3'; «FLG-2 R1» 5'CAA-gTg-CAg-gAg-AAA-gAC-ATg-gAT3", размер ампликона - 205 пар оснований, а после проведения полимеразной цепной реакции проводят реакцию пиросеквенирования в режиме реального времени с использованием специфического праймера «FLG-2 S1» 5'gAC-ATT-CAg-AAg-ACT-CAg-АС3' и детекцию нуклеотидной последовательности с помощью хемилюминисцентного сигнала, далее проводят сравнение полученной нуклеотидной последовательности в положении 2282 с референсными последовательностями, после этого при выявлении на полученной пирограмме отсутствия делеции в положении 2282 гена филаггрина при воздействии на организм вредного производственного фактора раздражающего и сенсибилизирующего действия определяют низкую наследственную предрасположенность к нарушению барьерной функции кожи, при выявлении на полученной пирограмме гетерозиготного варианта ins/del в положении 2282 гена филаггрина при воздействии на организм вредного производственного фактора раздражающего и сенсибилизирующего действия определяют высокую наследственную предрасположенность к нарушению барьерной функции кожи.