Применение для лечения и профилактики атеросклероза белково-пептидного комплекса (далее-бпк), полученного из эмбриональной нервной ткани или из быстрозамороженного эмбрионального мозга сельскохозяйственных копытных животных, влияющего на обратный транспорт холестерина из сосудистой стенки и профиль активации моноцитов у пациентов с выраженным атеросклерозом магистральных сосудов или с предрасположенностью к сердечно-сосудистым заболеваниям и способ профилактики и лечения пациентов с атеросклерозом артериальных сосудов и с заболеваниями, вызванными атеросклерозом магистральных и периферических сосудов головного мозга, сердца, сосудов нижних конечностей и аорты (два варианта)
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к терапии, и может быть использована для лечения атеросклероза магистральных сосудов и аорты с помощью фармацевтического средства, включающего белково-пептидный терапевтический препарат (БПК). БПК получен из эмбриональной нервной ткани или из быстрозамороженного эмбрионального мозга сельскохозяйственных копытных животных. БПК включает отрицательно заряженные нейтральные белки и полипептиды с молекулярными массами от 0,5 до 200 кДа или в сочетании его с полинуклеотидами в виде Na-солей ДНК, выделенных из молок осетровых или лососевых рыб. БПК вводится в терапевтически эффективных суточных и курсовых дозах парентерально или интраназально. Группа изобретений также относится к применению БПК с общей концентрацией белка 0,05-4,2 мг/мл, определяющей его биологическую активность, с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу от 20 до 160 кДа, имеющих характерный специфический набор полос при денатурирующем гель-электрофорезе в 5%-ном полиакриламидном геле, значением изоэлектрической точки от 4,2 до 8,4 и максимумом поглощения при длине волны 215±5 нм при снятии ультрафиолетового спектра в области длин волн от 200 до 500 нм. Использование данной группы изобретений позволяет использовать БПК для профилактики и лечения пациентов с атеросклерозом, обеспечивая влияние на обратный транспорт холестерина из сосудистой стенки и профиль активации моноцитов у пациентов и регулируя метаболизм холестерина, эфиров холестерина, триглицеридов, фосфолипидов в субэндотелиальных соединительно-тканных и гладкомышечных клетках артериальных сосудов. 3 н. и 26 з.п. ф-лы, 5 табл., 8 пр.
Реферат
Изобретение относится к медицине, в частности к клинической фармакологии, кардиологии, терапии, сосудистой неврологии, сосудистой хирургии, и может быть использовано для лечения и профилактики атеросклероза магистральных сосудов (головного мозга, сердца, нижних конечностей) и аорты, с помощью фармацевтического препарата, включающего белково-полипептидный комплекс, полученный из эмбриональной ткани головного мозга копытных сельскохозяйственных животных.
Сердечно-сосудистые заболевания стоят на первом месте в качестве причины смерти в России, США и Европе, где вклад данной нозологической формы в структуру смертности составляет более 56%, что не может не отразиться на средней продолжительности жизни в России - 58,9 лет (для мужчин), в то время как в Японии этот показатель значительно выше - 87 лет[1].
Подавляющая часть сердечно-сосудистых заболеваний является следствием атеросклероза магистральных сосудов и аорты. Еще в 1947 году Н.Н. Аничковым было продемонстрировано, что накопление холестерина в интиме артерий является одним из первых проявлений атеросклероза. Транспорт холестерина в организме осуществляется липопротеидами. Источником липидов в интиме сосудов являются липопротеиды низкой плотности (далее - ЛНП). Многими исследователями (Soran H., 2011; Orsó Ε., 2011) было показано, что почти любая модификация (окисление, дегликозилирование, вортексирование, протеолиз, липолиз и др.) нативных ЛНП приводит к их усиленному захвату, как субэндотелиальными, так и другими видами клеток [2].
Термин атеросклероз происходит от 2 греческих слов: athere (кашица) и sclerosis (затвердение). Атеросклероз - заболевание, поражающее стенки сосудов, главным образом, артерий мышечного и мышечно-эластического типа, в основе которого лежат нарушения жирового и белкового обмена, и, прежде всего, обмена холестерина, проявляющееся имбибицией сосудистой стенки белками и липидами с развитием вокруг этих отложений реактивных изменений и стремительного разрастания соединительной ткани.
В целом, проявления и различные осложнения атеросклероза по праву считаются самыми частыми причинами не только инвалидности, но и смертности во многих странах мира. Атеросклероз чаще всего диагностируется у людей старше 45-55 лет, ведущих малоподвижный образ жизни, злоупотребляющих алкоголем и курением. Нельзя не отметить тот факт, что работники умственного труда страдают атеросклерозом чаще работников физического труда, причем городские жители больше подвержены этому заболеванию, чем сельские [3].
Развитие клеточной биологии и биомедицины позволяет проводить значительное число исследований влияния различных веществ на организм человека в моделях in vitro и ex vivo. Современные методы исследований показали возможность определения многих особенностей патобиохимических каскадов работы регуляторных систем клеток человека в метаболизме триглицеридов, ЛНП, холестерина и позволяют выявлять некоторые индивидуальные особенности отдельных пациентов [4-6].
На сегодняшний момент, для лечения атеросклероза используют препараты следующих групп, с преимущественным воздействием на отдельные этапы обмена холестерина:
1. Средства, снижающие всасывание холестерина и желчных кислот из кишечника ("секвестранты" желчных кислот):
- холестирамин (квестран, колестипол);
- хьюаровая смола (гуарем).
2. Средства, влияющие на транспорт холестерина:
- никотиновая кислота.
3. Ингибиторы синтеза холестерина в печени:
- ловастатин (мевакор, мевинакор, правастатин, синвастин, флувастатин);
фибраты (клофибрат, безафибрат, фенофибрат, гемфиброзил, ципрофибрат).
4. Средства, влияющие на катаболизм и выведение холестерина: - липостабил.
5. Разные гиполипидемические препараты (пробукол, полиненасыщенные жирные кислоты, комбинированные средства).
Все указанные гиполипидемические препараты назначают при атеросклерозе церебральных и коронарных сосудов, при гиперлипопротеидемии у больных со стенокардией, после инфаркта миокарда, инсульта, больным с сахарным диабетом [7].
Одной из важных задач современной фармакологии является разработка новых лекарственных препаратов, влияющих на метаболизм триглицеридов, холестерина и липопротеидов непосредственно в самой атеросклеротической бляшке, у больных с уже выявленным заболеванием на всех его стадиях или у пациентов с предрасположенностью к сердечно-сосудистым заболеваниям. Однако снижение холестерина в крови не всегда сопровождается снижением холестерина в сосудистой стенке. Поэтому особенно важным является разработка новых препаратов, непосредственно влияющих на отток холестерина из сосудистой стенки и на снижение уровня атерогенного потенциала сыворотки крови у больных атеросклерозом.
Сыворотка крови больных атеросклерозом, в отличие от сыворотки крови здоровых лиц, обладает атерогенными свойствами. «Атерогенный потенциал» или «атерогенность» - это способность сыворотки крови или ее компонентов вызывать накопление эфиров холестерина в клетках интимы аорты человека. Именно накопление внутриклеточного холестерина и его отток определяют, произойдет ли ретенция (удержание) холестерина в сосудистой стенке, поэтому стимуляция оттока холестерина не менее важна для устранения риска развития атеросклероза, чем предотвращение накопления внутриклеточного холестерина. Отток холестерина - это проявление регрессии атеросклероза на клеточном уровне. Основные точки воздействия на этот процесс:
- активация внутриклеточного метаболизма липидов с удалением накопленных липидов из клеток;
- подавление захвата модифицированных ЛНП клетками;
- подавление процессов модификации нативных ЛНП;
- устранение модифицированных ЛНП из кровотока. Интегральной оценкой эффективности различных антиатеросклеротических воздействий являются снижение скорости накопления внутриклеточных липидов и уменьшение внутриклеточного пула эфиров холестерина.
В настоящее время не существует лекарственных средств, в полной мере обладающих прямым антиатеросклеротическим действием. Известно, что регулярный прием различных препаратов может сказываться на процессах накопления холестерина в клетках артериальной стенки. Ряд лекарственных препаратов различных химических групп может способствовать снижению атерогенного потенциала сыворотки крови больных атеросклерозом.
Наиболее перспективными препаратами всей группы противоатеросклеротических средств являются:
- ингибиторы сквален-синтазы и сквален-2,3-эпоксидазы, подавляющие биосинтез холестерина и не затрагивающие синтез производных геранилпирофосфата, в том числе долихолов и коэнзима Q10;
- ингибиторы биосинтеза изопреноидов;
- ингибиторы образования частиц холестерина, такие как специфические ингибиторы микросомального транспортного белка, однако эти препараты могут вызывать повышение пула частиц холестерина в гепатоцитах и способствовать развитию ожирения печени или неалкогольного гепатита;
- ингибиторы ацилхолестерин-ацилтрансферазы - препарат авасимиб;
- ингибиторы интестинальной абсорбции липидов - маргарины типа ситостанол/ситостерол, как конкурентные ингибиторы абробции холестерина в интестинальной стенке;
- ингибиторы абсорбции холестерина - препарат эзетимиб, который воздействует на комплекс Niemann-Pick С1-подобногопротеина-1 с аннексином, 2-кавеолином и транспортером стеролов, но не влияет на уровень содержания витамина Ε и не оказывает побочных действий на желудочно-кишечный тракт;
- ингибиторы транспорта пузырных желчных кислот - препараты блоктрующие белок-транспортер пузырных желчных кислот (ΙΒΑΤ - Indicible Bile Acids Transporter), который обеспечивает поступление желчи в портальную вену печени, с индукцией фермента синтеза желчных кислот из холестерина - 7-гидроксилазы;
- фибраты (глитазоны) - агонисты рецепторов пролиферации пероксисом (PPAR - Peroxisome Proliferation Agonist Receptor) с увеличением экспрессии рецепторов инсулина в мышцах и повышением, таким образом, чувствительность к инсулину;
- агонисты Х-рецепторов печени (LXR - Liver X Receptor) - С3-жирные кислоты понижают уровень триглицеридов, не влияя на уровень ЛВП, поскольку ингибируют транспортер холестерина АВС-А1, снижают вероятность смерти от неожиданной остановки сердца;
- ингибиторы транспортного белка эфира холестерина (СЕТР) (Cholesterol Ether Transporter Protein) - этанол - ингибирует СЕТР и увеличивает уровень ЛВП, что снижает риск развития атеросклероза,
- ингибиторы окисленных форм холестерина - антиокисидант пробукол - блокирует активность макрофагов через рецепторы холестерина;
- ферменты липопротеинов высокой плотности - 20-30 белков, факторы риска развития коронарного синдрома, такие как гидролазатромбоцитактивируемый фактор (фосфолипаза А2) - является антиатеросклеротическим фактором в составе ЛВП и проатеросклеротическим фактором в составе ЛНП;
- белки и пептиды ЛВП - коррелируют с некоторыми патологическими фенотипами, такими, как амилоидоз, нефропатия и атеросклероз [8].
Известны способы лечения атеросклероза, заключающиеся в курсовом назначении таких лекарственных препаратов, как линетол, никотиновая кислота, гормоны щитовидной железы, эстрогены, эссенциальные фосфолипиды [9]. Указанные лекарственные препараты способствуют нормализации обмена жиров в организме и снижению уровня холестерина в крови.
Общий недостаток способов лечения атеросклероза с использованием упомянутых лекарственных средств состоит в относительно малом снижении концентрации холестерина в сыворотке крови. Так, ежедневный прием 12-24 г холестирамина приводит к уменьшению холестерина в сыворотке крови на 25%. При длительном введении никотиновой кислоты по 3 г ежедневно отмечено снижение холестерина в сыворотке крови на 10% и триглицеридов на 20%. Применение D-тироксина в суточной дозе от 4 до 8 мг уменьшает концентрацию липопротеидов низкой плотности на 20% без существенного изменения концентрации липопротеидов очень низкой плотности. В качестве антиатеросклеротических средств, в настоящее время так же находят применение препараты полиненасыщенных фосфолипидов соевых бобов - "Липостабил" (Германия) и "Эссенциале" (Югославия). Способы их получения не описаны в научно-технической литературе, однако имеются косвенные указания на то, что в состав этих препаратов входят соли дезоксихолевой кислоты, присутствие которых оказывает отрицательное влияние на клеточные процессы [10].
Известен способ профилактики и лечения атеросклероза путем назначения препаратов каротиноидов в суточной дозе 5-10 мг/кг массы тела зависящей, однако, от характера назначения препарата, которая обеспечивает эффективный уровень концентрации каротиноидов в сыворотке крови. Для повышения точности дозировки можно принимать во внимание тот уровень каротиноида, который обеспечивается в данном конкретном случае в сыворотке крови пациента при назначении ему той или иной дозы препарата. В частности, уровень ликопина в сыворотке крови должен быть не менее 700-800 нМ.
Поддержание эффективной концентрации каротиноида в сыворотке крови должно осуществляться с учетом того обстоятельства, что каротиноиды умеренно быстро метаболизируются и выводятся из организма человека и животных. Например, при однократном пероральном введении ликопина кроликам максимальная его концентрация в сыворотке крови наблюдается через 8 ч и возвращается к первоначальному уровню через 24 часа.
Препаратами каротиноидов могут служить индивидуальные каротиноиды, выделенные из различных источников, или суммарные фракции каротиноидов, например, каротиноид кроцетин.
Каротиноиды различной степени чистоты могут быть использованы в виде порошков или в виде масляных растворов, или дисперсий, что повышает их всасывание в желудочно-кишечном тракте.
Как лекарственные формы, могут быть использованы, например, порошки, таблетки, свечи, масляные растворы или эмульсии.
Характер введения каротиноидов не имеет решающего значения, но наиболее удобно назначать их перорально или ректально.
Допустимы и иные пути введения (внутримышечно, внутривенно), но они, видимо, не имеют особых преимуществ и практического значения в лечебной практике, хотя в некоторых случаях могут быть использованы, например, в экспериментальных работах.
Периодичность приема каротиноидов сама по себе не особенно важна. Главное должна выдерживаться рекомендованная суточная доза препарата и должен поддерживаться эффективный уровень концентрации препарата в сыворотке крови.
Было установлено при этом, что при кормлении кроликов в течение 28 дней пищей, обогащенной 1% холестерина, эластичность эндотелиальных сосудов сохраняется, если одновременно в пищу вводили 0,6 г бета-каротина на 1 кг корма, но при этом влияния бета-каротина на устойчивость липопротеидов низкой плотности к окислению не было отмечено.
Назначение гиперчувствительным крысам от 125 до 500 мг бета-каротина на 1 кг корма вместе с богатой холестерином пищей в течение 44 дней приводило к дозозависимому снижению в сыворотке крови уровня холестерина и триглицеридов.
У морских свинок, получавших с кормом 0,2% холестерина и 15-30 мг бета-каротина в день в течение 12 недель, не было найдено достоверных различий в уровне холестерина и триглицеридов в сыворотке крови, но при дозе бета-каротина 50 мг/100 г корма в течение 12 недель отмечено значительное снижение размеров склеротических бляшек в аорте.
При исследовании влияния бета-каротина на уровень липопротеидов в сыворотке крови курильщиков, относимых к группе риска, не было обнаружено заметного эффекта после приема в течение 14 недель бета-каротина в количестве 20 мг/день, хотя при этом уровень бета-каротина в сыворотке крови повысился в 15 раз [11].
Таким образом, есть серьезные основания полагать, что каротиноиды, из которых наиболее подробно исследовался бета-каротин, являются эффективным антиатеросклеротическим средством, ибо они устраняют в большинстве случаев основные биохимические нарушения, провоцируемые атеросклерозом.
Недостаток известных способов профилактики и лечения атеросклероза с применением препаратов каротиноидов состоит в недостаточной воспроизводимости результатов, о чем, в частности, свидетельствует не вполне согласующиеся между собою приведенные выше литературные данные. Одной из основных трудностей сравнения эффективности лечения экспериментального атеросклероза является использование исследователями разных принципов дозировок препаратов каротиноидов, выражающихся, в большинстве случаев, отношением дозы препарата к единице веса корма, а в остальных случаях в виде некоторых произвольных фиксированных величин назначаемых доз. Отмечаемая иногда неэффективность применения каротиноидов может объясняться, по предположению заявителя, слишком низкой дозой препарата.
Известны также способы получения и применения полипептидных препаратов, нормализующих функции кровенсных сосудов, применявшихся у больных с атеросклерозом сосудов головного мозга.
В частности, из SU №1227198, 1986 год, известен комплекс полипептидов, выделенный из кровеносных сосудов животных, снижающий содержание холестерина в крови. Комплекс получают экстрагированием измельченных кровеносных сосудов животных 3%-ным водным раствором уксусной кислоты, последующим центрифугированием, обработки надсадочной жидкости при от -3°C до -5°C, растворением осадка, фильтрованием, лиофилизацией.
Недостатком комплекса, ограничивающего его применение, является извлечение при этом большого количества веществ не пептидной природы, являющиеся примесью и не являющиеся биологически активными веществами.
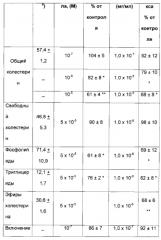
Из RU №2301072, 2007 год, известен способ получения лекарственного средства, полученного на основе биологически активного вещества, полученного из органов животных (из кровеносных сосудов). Полученный пептидный комплекс содержит низкомолекулярные фракции, содержащие от 70 до 90% пептидов с молекулярной массой от 72 до 678 Да, с концентрацией в водном растворе пептидов 2,5-2,9 мг/мл. Было исследовано применение препарата для лечения больных атеросклерозом сосудов головного мозга. Установлено, что применение препарата способствует улучшению общего самочувствия. Общий холестерин до лечения 8,4±0,6 ммоль/л, после лечения - 6,2±0,2 ммоль/л; содержание липопротеидов до лечения 1,3±0,07 ммоль/л, после лечения - 0,86±0,8 ммоль/л.
В этих патентных источниках нет данных по влиянию этих пептидных препаратов на метаболические процессы непосредственно в атеросклеротической бляшке и субэпиндемальном слое сосуда.
Итак, одним из основных факторов риска, имеющих значение при развитии этих заболеваний, является высокий уровень липидов в плазме крови, в частности, высокий уровень холестерина. Предпринималось множество попыток использовать агент, снижающий уровень холестерина, для предотвращения и лечения этих заболеваний, и было найдено много соединений, в большей или меньшей степени обладающих этим эффектом. Например, одно такое соединение, которое хорошо известно и успешно применяется, представляет правастатин, который является агентом, регулирующим липиды и ингибитором 3-гидрокси-3-метил-глутарил-карермент А редуктазы (в настоящем документе упоминается как «ингибитор ГМГ-КоА редуктазы»), и, как предполагают, он действует на этапе биосинтеза холестерина определяющий его скорость. Сообщалось о том, что у кроликов, получающих правастатин можно предотвратить коронарный артериосклероз и ксантому, однако его эффективность остается недостаточной (Biochimica at Biophysica Acta, 960, 294-302 (1988)). Эксперименты по контролю коронарного артериосклероза и ксантомы проводили, используя комбинацию двух агентов регулирующих липиды, правастатина и холестирамина, который хорошо известен как агент для снижения уровней липопротеинов, однако эффективность этой комбинации также остается недостаточной (Atherosclerosis, 83, 69-80, 1 (1990)).
В патентной заявке Японии №7-41423 предполагается, что специфический класс агентов, улучшающих резистентность к инсулину, например, троглитазон, может быть эффективным при лечении и профилактике артериосклероза, в частности атеросклероза, но и в этом случае эффективность подобных соединений не вполне удовлетворительна.
В настоящее время для лечения и профилактики атеросклероза применяют немедикаментозные средства, устраняющие или уменьшающие факторы риска, и медикаментозные средства, например различные гиполипидемические средства (холестирамин, полиспонин, линетол, гепарин, кондроитин сульфат и др.) {Машковский М.Д. Лекарственные средства, ч, 1 и 2, М. Медицина, 1987, т. 2, с. 89, 92, 73, 156).
Ни одно из существующих гиполипидемических средств не является универсальным, и почти все оказывают побочные действия. Изыскание новых антисклеротических средств ведется среди различных классов химических соединений:
- производные мочевины и тиомочевины (патенты США №№4397868, 4387105, 4623662);
- производные аминобензойной кислоты (заявка Европейского Патентного Ведомства №0170361, акцептованные заявки Япония 59-24135, 63-26729);
- бензотиазины (заявка Европейского Патентного Ведомства №0174458);
- производные индола (заявка Великобритании №2190587);
- производные гексагидронафталина (патент США №4444784).
Одним из распространенных препаратов, применяемым для лечения атеросклероза, является клофибрат (мисклерон, липомид, атромид), изобутират (Машковский М.Д. Лекарственные средства, ч. 1 и 2. М. Медицина 1987, ч. 2, с. 90).
Он снижает содержание в крови липопротеидов, богатых холестерином и триглицеридами. Применяют его при атеросклерозе с повышенным содержанием в крови этих веществ.
Однако лечение клофибратом является недостаточно эффективным, не предупреждает ишемическую болезнь сердца, вызывает ряд побочных явлений. Он способен вызывать внутрипеченочный холестаз, сопровождающийся образованием камней в желчном пузыре и желчных путях.
Из RU №2243767, приоритет 10.01.2005, известен другой способ лечения атеросклероза. Способ осуществляют на фоне медикаментозной терапии препаратами группы статинов, теветена, полиоксидония и проведения сеансов плазмафереза с удалением 800 мл плазмы 2 раза в неделю №5 путем дополнительного введения больному имунофана 0,005%-1.0 внутримышечно через день №10 и флуимуцила 300 мг внутривенно ежедневно №5-10, общий курс лечения 2 месяца. Способ обеспечивает модуляцию функциональной активности лейкоцитов в том числе опосредованно через изменение цитокинового профиля и, как следствие, дезинтеграцию белково-липидных комплексов, участвующих в образовании атеросклеротической бляшки.
Известно, что подавляющая часть сердечно-сосудистых заболеваний является следствием атеросклероза магистральных сосудов и аорты (Pranavchand R., 2013). Еще в 1947 году Н.Н. Аничковым было продемонстрировано, что накопление холестерина в интиме артерий является одним из первых проявлений атеросклероза (Аничков Н.Н., 1947; Cianciola N.L., 2011). Транспорт холестерина в организме осуществляется липопротеидами. Источником липидов в интиме сосудов являются липопротеиды низкой плотности (далее - ЛНП) (Vikovic I., 2006; Alaupovic, 1971 P.; Coocson F.В., 1971). Многими исследователями (Soran H., 2011; Orso Ε., 2011) было показано, что почти любая модификация (окисление, дегликозилирование, вортексирование, протеолиз, липолиз и др.) нативных ЛНП приводит к их усиленному захвату, как субэндотелиальными, так и другими видами клеток.
Развитие клеточной биологии и биомедицины позволяет проводить значительное число исследований влияния различных веществ на организм человека в моделях in vitro и ex vivo. Современные методы исследований показали возможность определения многих особенностей патобиохимических каскадов работы регуляторных систем клеток человека в метаболизме триглицеридов, ЛНП, холестерина и позволяют выявлять некоторые индивидуальные особенности отдельных пациентов.
Одной из важных задач современной фармакологии является разработка новых лекарственных препаратов, влияющих на метаболизм триглицеридов, холестерина и липопротеидов у пациентов с предрасположенностью к сердечно-сосудистым заболеваниям или с уже выявленным заболеванием на всех его стадиях.
За последние годы разработаны клеточные модели (клеточный культуральный тест), позволяющие оценивать отток холестерина из сосудистой стенки, как интегральный показатель обратного транспорта холестерина. Обнаружено, что снижение холестерина в крови не всегда сопровождается снижением холестерина в сосудистой стенке. Модель в варианте in vitro используется для оценки эффективности гиполипидемических препаратов различных классов фармакологических веществ на уровень снижения атерогенного потенциала сыворотки крови больных атеросклерозом.
Сыворотка крови здоровых лиц, в отличие от сыворотки крови больных атеросклерозом, не обладает атерогенными свойствами.
Отток холестерина, являющийся составной частью механизма обратного транспорта холестерина в организме - это обратная сторона накопления холестерина в артериальных клетках. Именно накопление внутриклеточного холестерина и его отток определяют, произойдет ли ретенция (удержание) холестерина в сосудистой стенке. Стимуляция оттока холестерина не менее важна для устранения риска развития атеросклероза, чем предотвращение накопления внутриклеточного холестерина. На клеточном уровне отток холестерина - это проявление регрессии атеросклероза. Существует ряд возможностей для воздействия на этот процесс, а именно: устранение модифицированных ЛНП из кровотока, подавление процессов модификации нативных ЛНП, активация внутриклеточного метаболизма липидов, подавление захвата модифицированных ЛНП клетками, удаление накопленных липидов из клеток. Интегральной оценкой эффективности различных антиатеросклеротических воздействий являются снижение скорости накопления внутриклеточных липидов и уменьшение внутриклеточного пула эфиров холестерина.
В настоящее время не существует лекарственных средств, в полной мере обладающих прямым антиатеросклеротическим действием. Известно, что регулярный прием различных препаратов может сказываться на процессах накопления холестерина в клетках артериальной стенки. Ряд лекарственных препаратов различных химических групп может способствовать снижению атерогенного потенциала сыворотки крови больных атеросклерозом.
Клеточный культуральный тест представляется наиболее оптимальным и адекватным способом моделирования ранних процессов атерогенеза на клеточном уровне. Применение модели "ex vivo" для оценки антиатерогенного потенциала лекарств сделало возможным проведение серийных испытаний, необходимых для потокового скрининга лекарственных средств.
Технической задачей заявленного изобретения является повышение эффективности лечения и профилактики атеросклероза артериальных сосудов, заболеваний, вызванных атеросклерозом магистральных и периферических сосудов головного мозга, сердца, сосудов нижних конечностей и аорты, и создание такого способа лечения и профилактики с использованием клеточного препарата, который обеспечивает отток холестерина из сосудистой стенки.
Поставленная техническая задача и получаемый технический результат достигаются заявленной группой изобретений, в которую входит применение белково-полипептидного комплекса или белково-пептидно-полинуклеотидного комплекса для лечения и профилактики атеросклероза и способ профилактики и лечения пациентов с атеросклерозом артериальных сосудов и с заболеваниями, вызванными атеросклерозом магистральных и периферических сосудов головного мозга, сердца, сосудов нижних конечностей и аорты.
Итак, одним из объектов заявленного изобретения является применение белково-пептидного комплекса (далее - ВПК), полученного из эмбриональной нервной ткани сельскохозяйственных копытных животных, или из быстрозамороженного эмбрионального мозга сельскохозяйственных копытных животных сроком гестации от середины первой трети до середины последней трети беременности, включающих отрицательно заряженные, нейтральные белки и полипептиды, с молекулярными массами от 0,5 до 200 кДа или в сочетании их с полинуклеотидами в виде Na-солей ДНК, выделенных из молок осетровых или лососевых рыб, в виде белково-пептидно-полинуклеотидного комплекса для профилактики и лечения пациентов с атеросклерозом артериальных сосудов и с заболеваниями, вызванными атеросклерозом магистральных и периферических сосудов головного мозга, сердца, сосудов нижних конечностей и аорты, вводимых в терапевтически эффективных суточных и курсовых дозах парентерально или интраназально, и регулирующих метаболизм холестерина, эфиров холестерина, триглицеридов, фосфолипидов в субэндотелиальных соединительнотканных и гладкомышечных клетках артериальных сосудов.
Белково-полипептидный комплекс (далее - БПК), и белково-пептидно-полинуклеотидный комплекс (далее - БППК), применение которого является одним из объектов изобретения, получают способами, известными из патента RU №2445106, 20.03.2012; RU №2428196, RU №2460736; RU №2477637; RU №2485133; RU №2485132.
Поставленная техническая задача и получаемый технический результат достигаются также способом профилактики и лечения пациентов с атеросклерозом артериальных сосудов и с заболеваниями, вызванными атеросклерозом магистральных и периферических сосудов головного мозга, сердца, сосудов нижних конечностей и аорты, включающий введение пациентам фармацевтического препарата, включающего белково-пептидный комплекс (далее - ВПК) в сочетании с фармацевтически приемлемым носителем парентерально или интраназально в терапевтически достаточных суточных и курсовых дозах, в качестве лекарственного препарата, регулирующего метаболизм холестерина, эфиров холестерина, триглицеридов, фосфолипидов в субэндотелиальных соединительнотканных и гладкомышечных клетках артериальных сосудов, при этом, препарат содержит белково-пептидный комплекс, полученный из гомогената, полученного из эмбриональной ткани головного мозга копытных сельскохозяйственных животных, и содержащего отрицательно заряженные, нейтральные белки и полипетиды с молекулярной массой от 5 до 200 кДа, и с содержанием фракции со средней молекулярной массой в пределах от 10 до 120 кДа не менее 80%, общей концентрацией белка 0,05-4,2 мг/мл, с максимумом поглощения ультрафиолетового спектра раствора при длине волны 280±5 нм, наличием пика при длине волны 274-284 нм в УФ-видимой области спектра, наличием специфических полос в интервале значений pI от 4,2 до 8,4 при изоэлектрофокусировке в 5%-ном полиакриламидном геле.
Поставленная техническая задача и получаемый технический результат достигаются также способом профилактики и лечения пациентов с атеросклерозом артериальных сосудов и с заболеваниями, вызванными атеросклерозом магистральных и периферических сосудов головного мозга, сердца, сосудов нижних конечностей и аорты, включающий введение пациентам терапевтического препарата, включающего белково-пептидный комплекс (далее - БПК) в сочетании с фармацевтически приемлемым носителем парентерально или интраназально в терапевтически достаточных суточных и курсовых дозах, в качестве фармацевтического препарата, регулирующего метаболизм холестерина, эфиров холестерина, триглицеридов, фосфолипидов в субэндотелиальных соединительнотканных и гладкомышечных клетках артериальных сосудов, при этом, препарат содержит белково-пептидный комплекс, полученный из гомогената из быстрозамороженной эмбриональной нервной ткани сельскохозяйственных копытных животных сроком гестации от середины первой до середины последней трети беременности, включающий тканеспецифические отрицательно заряженные, нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, определяющим биологическую и фармакологическую активность, с молекулярными массами от 0,5 до 200 кДа, причем не менее 70% от общей массы белка имеет молекулярную массу от 20 до 160 кДа, общей концентрацией белка 0,05-4,2 мг/мл, имеющих характерный специфический набор полос при денатурирующем гель-электрофорезе («SDS Page») в 5%-ном полиакриламидном геле по сравнению со стандартным набором маркерных белков с диапазоном молекулярных масс от 1 до 250 кДА, значением изоэлектрической точки от 4,2 до 8,4 и максимумом поглощения при длине волны (215±5) нм при снятии ультрафиолетового спектра в области длин волн от 200 до 500 нм.
Используемый для лечения и профилактики пациентов с атеросклерозом артериальных сосудов и с заболеваниями, вызванными атеросклерозом магистральных и периферических сосудов головного мозга, сердца, сосудов нижних конечностей и аорты терапевтический препарат, содержащий белково-пептидный комплекс (упомянутые выше) и фармацевтически приемлемый носитель, дополнительно может содержать гидролизованные полинуклеотиды в виде Na-солей ДНК, полученные из молок осетровых или лососевых рыб, представляющие собой средне- и низкомолекулярную полинуклеотидную фракцию в виде натриевой соли дезоксирабонуклеиновой кислоты, проявляющие комплексную с белково-полипептидной фракцией специфическую иммунорегулирующую активность в, по меньшей мере, равноценной концентрации с белково-полипептидным комплексом, и фармацевтически приемлемый разбавитель, причем средне- и низкомолекулярная полинуклеотидные фракции в виде натриевой соли дезоксирабонуклеиновой кислоты характеризуются молекулярной массой от 12 до 660 кДа (18-1000 пар оснований), имеющие максимальный УФ-спектр поглощения при длине волны (260±2) нм и минимальный - при (230±2) нм в области длин волн от 190 до 325 нм с соотношением В260/280 от 1,6 до 2,0, наличием характерных специфических полос в 1,85-ном агарозном геле при окрашивании бромистым этидием, в сравнении со стандартным набором маркеровс диапазоном молекулярных масс от 75 до 7000 пар оснований и синее окрашивание при постановке качественной реакции на рибозу, а также примесью белка, при определении его концентрации по Лоури не выше 0,18%.
В качестве гидролизованных полинуклеотидов совместно с белково-пептидным комплексом в заявленном изобретении, относящегося к лечению и профилактике пациентов с атеросклерозом артериальных сосудов и с заболеваниями, вызванными атеросклерозом магистральных и периферических сосудов головного мозга, сердца, сосудов нижних конечностей и аорты, могут быть использованы также (в фармацевтическом препарате) гидролизованные полинуклеотиды в виде Na-солей ДНК, полученные из молок осетровых или лососевых рыб, с длиной цепочек полинуклеотидов от примерно 1000 до примерно 7000 молекул в качестве иммуномодулирующего и стабилизирующего белки и полипептиды компонента в равноценной или необходимо достаточной терапевтической суточной и курсовой дозе. Концентрация их в данном белково-полипептидно-полинуклеотидном комплексе (далее - БППК) примерно 0,1-3,0 мг/мл (миллиграмм на миллилитр) с общей концентрацией белка в фармацевтическом препарате 0,05-4,2 мг/мл.
Концентрация Na-солей ДНК в белково-пептидно-полинуклеотидном комплексе составляет, примерно, 0,05-3,0 мг/мл с общей концентрацией белка в фармацевтическом препарате 0,05-4,2 мг/мл.
В качестве фармацевтически приемлемого носителя используют разбавитель, включающий буферный раствор и, возможно, вспомогательные вещества (ПАВ, обратимые ингибиторы протеаз и ДНК-аз).
Ниже указаны необходимо-возможные терапевтически эффективные дозы фармацевтического препарата, содержащего белково-полипептидные комплексы (далее - ВПК), указанные выше, или фармацевтический препарат, содержащий ВПК и гидролизованные полинуклеотиды в виде Na-солей полинуклеотидов (ДНК), полученные из молок осетровых или лососевых рыб (далее - фармацевтический препарат БППК).
Согласно заявленному способу осуществляют, в частности, следующие схемы (конкретные) лечения:
- в частности, за одну процедуру пациенту подкожно или внутримышечно вводят фармацевтический препарат, содержащий от 0,05 до 1,0 мг ВПК в 1,0-5,0 мл фармацевтически приемлемом носителе-разбавителе в виде 8-20 инъекций, один-два раза в сутки курсом 8-14 дней; или
- в частности, за одну процедуру пациенту подкожно или внутримышечно вводят фармацевтический препарат, содержащий от 0,05 до 1,0 мг БППК в 1,0-5,0 мл фармацевтически приемлемом носителе-разбавителе в виде 8-20 инъекций, один-два раза в сутки курсом 8-14 дней, где соотношение ВПК и полинуклеотидов из молок рыб может быть 0,1-2: 0,5-2 соответственно; или
- в частности, за одну процедуру внутривенно капельно или медленно болюсно вводят препарат, содержащий от 0,025 до 0,7 мг ВПК в 5,0-500,0 мл фармацевтически приемлемом разбавителе, один-два раза в сутки курсом 5-12 дней; или
- в частности, за одну процедуру внутривенно капельно или медленно болюсно вводят препарат, содержащий от 0,025 до 0,7 мг БППК в 5,0-500,0 мл фармацевтически приемлемом разбавителе, один-два раза в сутки курсом 5-12 дней; или
В соответствии с заявленным изобретением может осуществляться курсовое лечение, вводя пациенту подкожно ВПК 1 раз в 4 месяца в дозе 0,05-0,1 мг в 1,0-5,0 мл фармацевтически приемлемом носителе (разбавителе); далее вводят по 1 ампуле (соответствующей одной инъекции) 10 дней, и осуществляют два курса по 14 дней путем интраназального введения по две капли в каждый носовой проход утром с интервалом между курсами 2,0-2,5 недели.
В заявленном изобретении дозировка лекарственного средства, выраженная в «мг» в основном касается подкожных инъекций. И, в частности, курсовая доза для инъекционного курса составляет 10-14 инъекций с повтором через 7-10 дней. Количественное выражение «мкг» в основном относится к дозировкам для интраназального спрея, например, один впрыск -100 мкл или «мкг» (если плотность используемого раствора считать за единицу). Слизистая носа, как правило, не в состоянии принять более 2-3 впрысков в каждый носовой проход, поэтому максимальная доза при интраназальном введении по объему составляет не более 400 мкл или 400 мкг используемого раствора (в частности, 0,01%-ного раствора).
Кроме того, согласно заявленному способу осуществляют, в частности, следующие схемы (конкретные) лечения:
- в частности, за одну процедуру интраназально вводят препарат, содержащий от 0,001 до 0,1 мг БПК в 0,05-1,2 фармацевтически приемлемом растворителе- разбавителе в виде 2-3 впрыска или от 2 до 4 капель в каждый носов