Снижение внутриглазного давления при помощи внутрикамерных имплантатов биматопроста
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмологии, и может быть использовано для лечения повышенного внутриглазного давления (ВГД). Для этого в глаз нуждающегося в указанном лечении пациента помещают биоразлагаемый внутриглазной имплантат. При этом имплантат содержит простамид в количестве от 15 до 25 мас. % от массы имплантата, связанный с биоразлагаемым полимерным матриксом, который высвобождает количество простамида, эффективное для предотвращения или снижения симптома повышенного ВГД. Кроме того, имплантат помещают внутрикамерно в положении 6:00 часов для тщательного перемешивания простамида, проходящего через передний сегмент благодаря конвекционным потокам. Изобретение обеспечивает лечение пациентов с повышенным ВГД за счет расширения Шлеммова канала. 10 з.п. ф-лы, 11 ил., 4 пр., 2 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка является продолжением в части Заявки на патент СШ, Серийный номер 10/837 260, поданной 30 апреля 2004 года от имени Hughes с соавторами, здесь включено полностью посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
1. Область техники
Настоящее изобретение относится к способу лечения глазного заболевания, включающего этап помещения в глаз пациента биоразлагаемого внутриглазного имплантата, имплантат, включающий простамид и биоразлагаемый полимерный матрикс, который высвобождает препарат со скоростью, эффективной для поддержания высвобождения количества простамида из имплантата для предоставления количества простамида, эффективного для предотвращения или снижения симптома глазного заболевания, где указанным глазным заболеванием является повышенное ВГД.
2. Краткое описание материалов, использованных при подаче заявки
Передняя и задняя камеры глаза наполнены внутриглазной жидкостью, котороая постоянно выделяется ресничным телом и имеет ионный состав, подобный составу крови. Внутриглазная жидкость имеет двойную функцию: 1) снабжение питательными веществами аваскулярных структур глаза, таких как хрусталик и роговица, и 2) поддерживает внутриглазное давление ВГД в пределах своего физиологического диапазона Поддержание ВГД и снабжение питательными веществами переднего сегмента являются критическими факторами для поддержания нормальной остроты зрения. Внутриглазная жидкость в основном выделяется в заднюю камеру глаза при помощи мерцательных процессов ресничного тела, а второстепенный механизм образования внутриглазной жидкости работает посредством ультрафильтрации из артериальной крови. Внутриглазная жидкость затем достигает передней камеры, пересекая зрачок, и существуют конвекционные потоки, где течение жидкости, прилегающей к радужной оболочке, направлено вверх, а течение жидкости, прилегающей в роговице, направлено вниз. Существуют два различных пути оттока внутриглазной жидкости, оба они расположены в иридокорнеальном углу глаза. Увеосклеральный или нетрадиционный путь относится к оттоку внутриглазной жидкости из передней камеры путем диффузии через межклеточные пространства между волокнами цилиарных мышц. Хотя это представляется второстепенным путем оттока у людей, увеосклеральный или нетрадиционный путь является мишенью специфических антигипертензивных препаратов, таких как гипотензивные липиды, например, биматопрост, увеличивающих функциональность данного пути путем ремоделирования внеклеточного матрикса. В дополнение, биматопрост может улучшать отток внутриглазной жидкости через трабекулярную сеть (ТС), опосредованный рецептором простамида. В человеческом глазу основным путем оттока является трабекулярный или традиционный путь оттока. Эта ткань содержит три различных слоя. От внутренней до самой наружной части слоем ткани, наиболее близко прилегающим к наружной камере, является увеальная сеть, образованная удлинениями соединительной ткани, происходящими из стромы радужной оболочки и ресничного тела, и покрытая эндотелиальными клетками. Этот слой не обеспечивает значительного сопротивления оттоку внутриглазной жидкости из-за большого размера межклеточных пространств. Следующий слой, известный как корнеосклеральная сеть, характеризуется наличием ламелл, покрытых клетками, подобными клеткам эндотелия на базальной мембране. Ламеллы образуются гликопротеинами, коллагеном, гиалуроновой кислотой и эластичными волокнами. Более упорядоченная организация корнеосклеральной сети по сравнению с увеальной сетью, а также более узкие межклеточные пространства ответственны за повышение сопротивления потоку. Третий слой, который находится в прямом контакте с внутренней стенкой эндотелиальных клеток канала Шлемма, является юкстаканиликулярной сетью. Он образуется клетками, встроенными в плотный экстрацеллюлярный матрикс, и большая часть сопротивления ткани течению внутриглазной жидкости, как считается, обусловлена этим слоем благодаря его узким межклеточным пространствам. Слой эндотелиальных клеток из канала Шлемма имеет растяжимые поры, которые переносят внутриглазную жидкость в канал и ответственны за приблизительно 10% всей сопротивляемости. Считается, что внутриглазная жидкость пересекает эндотелий внутренней стенки Шлеммова канала посредством двух различных механизмов: парацелюллярный путь через соединения, образующиеся между эндотелиальными клетками, и трансцелюллярный путь через внутриклеточные растяжимые поры тех же клеток. После попадания в Шлеммов канал, внутриглазная жидкость просачивается прямо в коллекторные протоки и в водянистые вены, которые соединяются посредством анастомоза с эписклеральными и конъюнктивальными сосудистыми сплетениями. Отток внутриглазной жидкости через трабекулярную сеть зависим от ВГД, обычно он измеряется как активация оттока и выражается в микролитрах за минуту на миллиметр ртутного столбика. Эписклеральное венозное давление контролирует отток через коллекторные каналы и является одним фактором, вносящим вклад во внутриглазное давление. Повышение эписклерального венозного давления, такое как бывает в случае каротид-кавернозных свищевых фистул, варикозе глазниц и синдроме Стерджа-Вебера, может приводить к затруднениям при лечении глаукомы. Снижение эписклерального венозного давления при болезненных состояниях, таких как угрожающая каротид-кавернозная свищевая фистула, может нормализовать эписклеральное венозное давление и снизить внутриглазное давление. Механизмы действия современных глазных гипотензивных агентов для лечения глазной гипертонии и открытоугольной глаукомы следующие: 1 - снижение выработки внутриглазной жидкости, 2 - улучшение увеосклерального оттока, 3 - повышение миотическими агентами оттока внутриглазной жидкости через ТС путем натяжения склеральной шпоры со стимулированием мышцы ресничного тела, 4 - комбинация любых из вышеизложенных механизмов.
Краткое изложение изобретения
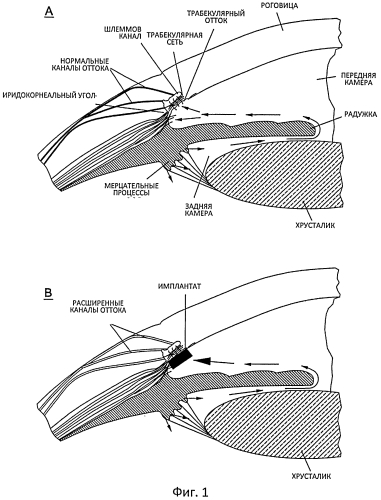
Неожиданным результатом размещения внутри камеры имплантатов с замедленным высвобождением, высвобождающих биматопрост, явилось то, что каналы оттока, истекающие из Шлеммова канала, оказались заметно расширенными (см. Фигуру 4). Это приводит к значительному снижению внутриглазного давления, то есть -60% снижению ВГД от исходного уровня (см. Фигуру 5). Данное снижение значительно больше, чем то, что обычно наблюдается с топическим биматопростом, то есть -35% по сравнению с исходным уровнем снижение ВГД. Перенаправление оттока жидкости в направлении ТС проиллюстрировано на Фигуре 1, нижнее изображение. Обычным механизмом действия простамидов является ре-моделирование как переднего ресничного тела возле ресничного пояска, так и ТС. Внутрикамерные имплантаты, расположенные вблизи от ТС, как показано на Фигуре 3, доставляют высокие концентрации препарата в каналы оттока и расширяют сосуды эписклерального и конъюнктивального венозного сплетения, что в результате приводит к новому механизму снижения ВГД. Расширение происходит на 360 градусов вокруг глаза, так как препарат, высвобождающийся из имплантата, расположенного в положении 6:00 часов, хорошо перемешивается, проходя через передний сегмент, благодаря конвекционным потокам.
Такое добавочное снижение ВГД внутрикамерными имплантатами с биматопростом является преимуществом для пациентов с глазной гипертонией и открытоугольной глаукомой, требующих непрерывного снижения ВГД для предотвращения прогрессирующей невропатии зрительного нерва. Пациенты могут избежать потребности в комбинированных глазных каплях и/или операции (включая инцизионную хирургию, такую как трабекулотомия, лазерные процедуры, такие как ALT (трабекулопластика при помощи аргонового лазера) и SLT (селективная лазерная трабекулопластика), и обходные стенты для внутриглазной жидкости), если они способны достичь значительного снижения ВГД при помощи внутрикамерного имплантата, описываемого здесь.
Краткое описание фигур
Фигура 1 (верхнее изображение) демонстрирует, что внутриглазная жидкость в основном выделяется в заднюю камеру глаза при помощи мерцательных процессов ресничного тела.
Фигура 1 (нижнее изображение) демонстрирует, что внутрикамерный имплантат биматопроста с замедленным высвобождением выделяет препарат прямо в Шлеммов канал, что в результате приводит к заметному расширению каналов оттока.
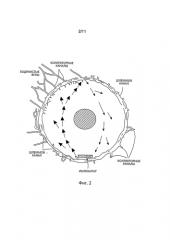
Фигура 2 демонстрирует, что внутриглазная жидкость достигает передней камеры, пересекая зрачок, и что существуют конвекционные потоки внутриглазной жидкости там, где поток внутриглазной жидкости, прилегающий к радужной оболочке, направлен вверх, и поток внутриглазной жидкости, прилегающий к роговице, направлен вниз.
Фигура 3 - это фотография, сделанная при помощи щелевой лампы через гониоскопические линзы, демонстрирующая внутрикамерный имплантат биматопроста вблизи трабекулярной сети глаза собаки.
Фигура 4 - это фотография, демонстрирующая сосуды оттока, расширенные в результате лечения собаки внутрикамерным имплантатом биматопроста с высоким высвобождением из Примера 1.
Фигура 5 демонстрирует, что ВГД собаки, которую лечили внутрикамерным имплантатом биматопроста с высоким высвобождением, описанным в Примере 1, было снижено на приблизительно -60% от исходного уровня и такое снижение поддерживалось по меньшей мере 5 месяцев.
Фигура 6 - это фотография, демонстрирующая сосуды оттока, расширенные в результате лечения собаки внутрикамерным имплантатом биматопроста с низким высвобождением из Примера 2.
Фигура 7 демонстрирует, что ВГД собаки, которую лечили внутрикамерным имплантатом биматопроста с низким высвобождением, описанным в Примере 2, было снижено на приблизительно -40% от исходного уровня и такое снижение поддерживалось по меньшей мере 42 дня.
Фигура 8 демонстрирует скорость высвобождения in vitro состава имплантата, используемого в Примере 1 (стрелка).
Фигура 9 демонстрирует скорость высвобождения in vitro состава имплантата, используемого в Примере 2 (стрелка).
Фигура 10 демонстрирует, что ВГД собаки, которую лечили одним имплантатом биматопроста, было снижено, согласно Примеру 3.
Фигура 11 демонстрирует, что ВГД собаки, которую лечили двумя имплантатами биматопроста, было снижено, согласно Примеру 3.
Детальное описание изобретения
Как раскрывается здесь, контролируемое и пролонгированное введение терапевтического агента путем использования одного или более внутриглазных имплантатов может улучшить лечение нежелательных глазных заболеваний, в частности, повышенного ВГД. Имплантаты включают фармацевтически приемлемую полимерную композицию и составлены для высвобождения одного или более фармацевтически активных агентов, таких как простамид, в течение длительного периода времени. Имплантаты эффективны для предоставления терапевтически эффективной дозировки агента или агентов непосредственно в область глаза для лечения или предотвращения одного или более нежелательных глазных заболеваний. Таким образом, путем единичного введения терапевтические агенты станут доступными в месте, где они нужны, и они будут поддерживаться в течение длительного периода времени, вместо того, чтобы подвергать пациента повторным инъекциям или повторным введениям топических капель.
Вышеуказанные имплантаты используются в способе лечения глазного заболевания, включающего этап помещения в глаз пациента биоразлагаемого внутриглазного имплантата, имплантат, включающий простамид и биоразлагаемый полимерный матрикс, который высвобождает простамид со скоростью, эффективной для поддержания количества простамида, эффективного для предотвращения или снижения симптома глазного заболевания, где указанным глазным заболеванием является повышенное ВГД и указанный имплантат размещен во внутрикамерном местоположении для расширения глазных каналов оттока, истекающих из Шлеммова канала.
Внутриглазной имплантат, в соответствии с приводимым здесь раскрытием, включает терапевтический компонент. Терапевтический компонент включает, состоит в основном, или состоит из простамида. Компонент, поддерживающий высвобождение препарата, может быть связан с терапевтическим компонентом для поддержания высвобождения эффективного количества простамида в глаз, в котором размещен имплантат. Количество простамида высвобождается в глаз в течение периода времени, большего, чем приблизительно одна неделя после помещения имплантата в глаз, и является эффективным для предотвращения или снижения симптома глазного заболевания.
Имплантат сделан из полимерных материалов для обеспечения максимальной аппроксимации имплантата к иридокорнеальному углу. В дополнение, размер имплантата, который находится в диапазоне диаметра приблизительно от 0,1 до 1 мм и длин от 0,1 до 6 мм, позволяет вводить имплантат в переднюю камеру с помощью аппликатора с иглой малого размера, находящегося в диапазоне от 22 до 30G.
ОПРЕДЕЛЕНИЯ
Для целей данного описания мы используем следующие термины, как определено в данном разделе, если только контекст слова не указывает на другое значение.
При использовании здесь термин «внутриглазной имплантат» относится к устройству или элементу, который структурирован, доведен до заданного размера, либо иным образом сконфигурирован для размещения в глазу. Внутриглазные имплантаты, в основном, биосовместимы с физиологическими условиями глаза и не вызывают нежелательных побочных эффектов. Внутриглазные имплантаты могут размещаться в глазу без нарушения зрительного восприятия глаза.
При использовании здесь термин «терапевтический компонент» относится к части внутриглазного имплантата, включающей один или более терапевтических агентов или веществ, используемых для лечения медицинского показания глаза. Терапевтический компонент может являться отдельным участком внутриглазного имплантата, или он может быть гомогенно распределен по имплантату. Терапевтические агенты терапевтического компонента обычно офтальмологически приемлемы, и они предоставляются в форме, которая не вызывает нежелательных реакций при помещении имплантата в глаз.
При использовании здесь термин «компонент, поддерживающий высвобождение препарата» относится к части внутриглазного имплантата, которая является эффективной для обеспечения пролонгированного высвобождения терапевтических агентов имплантата. Компонент, поддерживающий высвобождение препарата, может быть биоразлагаемым полимерным матриксом, или он может быть покрытием, покрывающим центральный участок имплантата, который включает терапевтический компонент.
При использовании здесь термин «связанный с» означает смешанный с, диспергированный в, соединенный с, покрывающий или окружающий.
При использовании здесь термин «область глаза» или «участок глаза» в основном относится к любой зоне глазного яблока, включая передние и задние сегменты глаза, и которая в основном включает, без ограничений, любые функциональные (например, для зрения) или структурные ткани, обнаруживаемые в глазном яблоке, или ткани либо клеточные слои, которые частично или полностью выстилают внутреннюю или наружную часть глазного яблока. Конкретные примеры зон глазного яблока в области глаза включают переднюю камеру, заднюю камеру, полость стекловидного тела, сосудистую оболочку глаза, супрахороидальное пространство, конъюнктиву, субконъюнктивальное пространство, эписклеральное пространство, интракорнельное пространство, эпикорнеальное пространство, склеру, плоскую часть ресничного тела, аваскулярные участки, образовавшиеся в результате операции, макулу и сетчатку.
При использовании здесь термин «заболевание глаз» означает заболевание, нездоровье или состояние, которое поражает или включает глаз или одну из частей или областей глаза. Говоря шире, глаз включает в себя глазное яблоко и ткани, а также жидкости, которые входят в состав глаза, окологлазные мышцы (такие как косая и прямая мышцы) и часть глазного нерва в составе глазного яблока или прилегающую к нему.
Заболевание передней части глаза - это заболевание, нездоровье или состояние, которое поражает или включает переднюю сторону (то есть переднюю часть глаза) глазной области или участка, такого как окологлазная мышца, веко или ткань глазного яблока, либо жидкость, которая расположена спереди от задней стенки капсулы хрусталика или ресничной мышцы. Таким образом, заболевание передней части глаза главным образом поражает или включает конъюнктиву, роговицу, переднюю камеру, радужку, заднюю камеру (за сетчаткой, но перед задней стенкой капсулы хрусталика), хрусталик или капсулу хрусталика и кровеносные сосуды и нервы, снабжающие кровью или иннервирующие переднюю область или участок глаза.
Таким образом, заболевание передней части глаза может включать заболевание, нездоровье или состояние, такое как, например, афакия, псевдофакия, астигматизм, блефароспазм, катаракта, заболевания конъюнктивы; конъюнктивит; заболевания роговицы; язву роговицы; синдромы сухого глаза; заболевания века; заболевания слезного аппарата; закупорка слезного протока; миопия; пресбиопия; нарушения зрачка; нарушения рефракции и страбизм. Глаукома также может считаться заболеванием передней части глаза, так как клинической целью лечения глаукомы может явиться снижение повышенного давления внутриглазной жидкости в передней камере глаза (то есть снижение внутриглазного давления).
Заболевание задней части глаза - это заболевание, нездоровье или состояние, которое первоначально поражает или включает заднюю часть глаза или участок, такой как сосудистая оболочка глаза или склера (в положении позади плоскости, проходящей через заднюю стенку капсулы хрусталика), стекловидное тело, камера стекловидного тела, сетчатая оболочка, зрительный нерв (то есть диск зрительного нерва) и кровеносные сосуды и нервы, которые снабжают кровью или иннервируют заднюю область глаза или участок.
Таким образом, заболевание задней части глаза может включать заболевание, нездоровье или состояние, такое как, например, острая макулярная нейроретинопатия; болезнь Бехчета; неоваскуляризация хороидеи; диабетический увеит; гистоплазмоз; инфекции, такие как грибковые или вирусиндуцированные; макулярная дегенерация, такая как острая макулярная дегенерация, неэкссудативная возрастная макулярная дегенерация и экссудативная возрастная макулярная дегенерация; отек, такой как макулярный отек, цистоидный макулярный отек и диабетический макулярный отек; мультифокальный хороидит; травма глаза, поражающая задний участок или область глаза; глазные опухоли; нарушения сетчатки, такие как окклюзия центральной вены сетчатки, диабетическая ретинопатия (включая пролиферативную диабетическую ретинопатию), пролиферативная витроретинопатия (ПВР), окклюзивное заболевание ретинальной артерии, отслоение сетчатки, воспаление сосудистой оболочки сетчатки; симпатическая офтальмия; синдром Фогта-Коянаги-Харада (ФКХ); увеальная диффузия; состояние задней части глаза, вызванное или связанное с лазерной терапией глаза; состояние задней части глаза, вызванное или связанное с фотодинамической терапией, фотокоагуляцией, радиационной ретинопатией, расстройства эпиретинальных мембран, закупорка боковой ретинальной вены, передняя ишемическая нейропатия глазного нерва, диабетическая ретинальная дисфункция неретинопатического происхождения; пигментная дистрофия сетчатки и глаукома. Глаукома может рассматриваться как заболевание задней части глаза, так как целью лечения является предотвращение или снижение случаев потери зрения из-за повреждения или утраты клеток сетчатки или клеток зрительного нерва (то есть нейропротекторное действие).
Термин «биоразлагаемый полимер» относится к полимеру или полимерам, которые разлагаются in vivo, и в которых со временем происходит эрозия полимера или полимеров, происходящая одновременно или последовательно с высвобождением терапевтического агента. В частности, гидрогели, такие как метилцеллюлоза, которые для высвобождения препарата действуют путем набухания полимера, конкретно исключены из термина «биоразлагаемый полимер». Использованные здесь термины «биоразлагаемый» и «биоразрушаемый» являются эквивалентными и взаимозаменяемыми. Биоразлагаемый полимер может быть гомополимером, сополимером или полимером, содержащим более двух различных полимерных единиц.
Термин «лечить», «врачевание» или «лечение» при использовании здесь относится к снижению или исцелению, или предотвращению глазного заболевания, травмирования или повреждения глаза, или к содействию исцеления травмированной или поврежденной ткани глаза. Лечение обычно эффективно для снижения по меньшей мере одного симптома глазного заболевания, травмы или повреждения глаза.
Термин «эффективный» при использовании здесь означает уровень или количество агента, необходимое для лечения заболевания глаз, или для снижения или предотвращения повреждения или нарушения глаза без индукции значительных негативных или нежелательных побочных эффектов для глаза или для глазной зоны. С учетом вышеизложенного, терапевтически эффективное количество терапевтического агента, такого как простамид - это количество, эффективное для снижения по меньшей мере одного симптома глазного заболевания.
Были разработаны внутриглазные имплантаты, способные высвобождать нагрузки препарата на протяжении различных периодов времени. Эти имплантаты, которые при введении в глаз, таком как введение в стекловидное тело глаза, предоставляют терапевтические уровни простамида в течение длительных периодов времени (например, в течение приблизительно одной недели или более). Раскрываемые имплантаты эффективны для лечения глазных заболеваний, таких как глазные заболевания, ассоциированные с повышенным внутриглазным давлением, и более конкретно, в снижении по меньшей мере одного симптома глаукомы.
В одном варианте воплощения настоящего изобретения внутриглазной имплантат содержит биоразлагаемый полимерный матрикс. Биоразлагаемый полимерный матрикс - это один тип компонента, поддерживающего высвобождение препарата. Биоразлагаемый полимерный матрикс эффективен в формировании биоразлагаемого внутриглазного имплантата. Биоразлагаемый внутриглазной имплантат содержит простамид, связанный с биоразлагаемым полимерным матриксом. Матрикс разлагается со скоростью, эффективной для поддержания высвобождения простамида в течение времени, большего, чем приблизительно одна неделя после помещения имплантата в область глаза или участок глаза, такой как стекловидное тело глаза.
Простамидный компонент имплантата включает один или более типов простамидов. В определенных имплантатах простамидный компонент включает соединение, имеющее формулу (I).
где связи, обозначенные пунктиром, представляют собой единичную или двойную связь, которая может иметь конфигурацию cis или trans, А - это алкилен или алкиленовый радикал, имеющий от двух до шести атомов углерода, этот радикал может прерываться одним или более оксидных радикалов и замещаться одной или более гидрокси-, окси-, алкилокси- или алкилкарбокси-группами, где указанный алкиловый радикал включает от одного до шести атомов углерода; В - циклоалкиловый радикал, имеющий от трех до семи атомов углерода, или ариловый радикал, отобранный из группы, состоящей из гидрокарбил ариловых и гетероариловых радикалов, имеющих от четырех до десяти атомов углерода, где гетероатом отобран из группы, состоящей из атомов азота, кислорода и серы; X - это --N(R4).2, где R4 независимо отобран из группы, состоящей из водорода и низших алкильных радикалов, имеющих от одного до шести атомов углерода,
Z=O; один из R1 и R2=O, -ОН или группе -O(CO)R6, а другой --ОН или -O(CO)R6, или R1=O и R2=Н; где R6 представляет собой насыщенную или ненасыщенную ациклическую углеводородную группу, имеющую от 1 до приблизительно 20 атомов углерода, или -(CH2)mR7, где m равно 0-10, и R7 - циклоалкильный радикал, имеющий от трех до семи атомов углерода, или гидрокарбил арил или гетероарил, как определено выше; или его фармакологически приемлемая соль.
Фармакологически приемлемые соли присоединения кислоты описанных соединений согласно изобретению - это соли, образованные из кислот, которые образуют нетоксические соли присоединения, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, малеат, фумарат, оксалат, лактат, тартрат, цитрат, глюконат, сахарат и сульфонатные соли р-толуола. Предпочтительно, простамид имеет следующую формулу (II)
где у равен 0 или 1, х равен 0 или 1 и х+у оба не равны 1, Y представляет собой радикал, отобранный из группы, состоящей из алкильной, галогеновой, нитро-, амино-, тиоловой, гидроксильной, алкилоксидной, алкилкарбоксильной групп, и также алкильной группы, замещенной галогеном, где указанный алкильный радикал включает от одного до шести атомов, n равно 0 или целому числу от 1 до 3, и R3=O, --ОН или --O(CO)R6, а заштрихованные линии указывают на альфа конфигурацию, и сплошные треугольники указывают на бета конфигурацию.
В по меньшей мере одном типе внутриглазного имплантата простамид включает соединение, где R1 R2 и R3 являются ОН, у является 1, x равен 0, n равен 0 и X является N(H)(C2H5), например, циклопентан N-этил гептенамид-5-cis-2-(3α.-гидрокси-5-фенил-1-trans-пентенил)-3,5-дигидрокси, [1α.,2β.,3α,5α].
Соединение циклопентан N-этил гептенамид-5-cis-2-(3α.-гидрокси-5-фенил-trans-пентенил)-3, 5-дигидрокси, [1α.,2β.,3α,5α.] также известно как биматопрост и общедоступно в качестве топического офтальмологического раствора под торговым названием Lumigan. RTM. (Allergan, Inc., СА).
Альтернативно, простамид может быть одним из простамидов, раскрываемых в Патенте США №6395787, который сюда включен посредством ссылки.
Таким образом, имплантат может включать терапевтический компонент, который включает, состоит, в основном, или состоит из биматопроста, его соли, или их смесей.
Простамид может быть в виде частиц или порошка, и он может быть заключен в биоразлагаемый полимерный матрикс. Обычно частицы простамида имеют эффективный средний размер менее чем приблизительно 3000 нанометров. В определенных имплантатах частицы могут иметь эффективный средний размер приблизительно на порядок меньше чем 3000 нанометров. Например, частицы могут иметь эффективный средний размер менее чем приблизительно 500 нанометров. В дополнительных имплантатах частицы могут иметь эффективный средний размер менее чем приблизительно 400 нанометров и еще в других вариантах воплощения средний размер менее чем приблизительно 200 нанометров.
Простамид имплантата составляет предпочтительно от приблизительно 10% до 90% веса имплантата. Более предпочтительно, простамид составляет от приблизительно 20% до приблизительно 80% веса имплантата. В предпочтительном варианте воплощения простамид составляет приблизительно 20% от веса имплантата (например, 15%-25%). В другом варианте воплощения простамид составляет приблизительно 50% от веса имплантата.
Подходящие полимерные материалы или композиции для использования в имплантатах включают те материалы, которые обладают совместимостью, то есть биосовместимостью с глазом, так, что они не вызывают значительной помехи для функционирования или для физиологии глаза. Такие материалы, предпочтительно, по меньшей мере частично, и, что более предпочтительно, в значительной степени подвержены биоразложению или биоразрушению. Примеры пригодных полимерных материалов включают, без ограничений, такие материалы, получаемые из органических сложных и простых эфиров и/или включающие органические сложные и простые эфиры, которые при разложении дают физиологически приемлемые продукты разложения, включая мономеры. Также могут найти применение полимерные материалы, полученные из ангидридов, амидов, ортоэфиров и тому подобных, и/или включающие их самих по себе или в комбинации с другими мономерами. Полимерными материалами могут быть ступенчатополимеризованные или конденсационные полимеры, предпочтительнее, конденсационные полимеры. Полимерные материалы могут быть поперечно-сшитыми и не поперечно-сшитыми, например, не более, чем слегка поперечно-сшитыми, так, например, менее чем приблизительно 5% или менее чем приблизительно 1% поперечно-сшитого полимерного материала. В основном, кроме углерода и водорода, полимеры будут включать по меньшей мере один кислород и азот, предпочтительнее, кислород. Кислород может быть представлен в форме окси, например, гидрокси или эфира, карбонила, например, нон-оксо-карбонила, такого как эфир карбоновой кислоты, и тому подобные. Азот может присутствовать как амид, циано и амино. Полимеры, изложенные в Heller, Biodegradable Polymers in Controlled Drug Delivery, In: CRC Critical Reviews in Therapeutic Drug Carrier Systems, Vol.1, CRC Press, Boca Raton, Fla. 1987, pp 39-90, где описана инкапсуляция для контролируемой доставки препарата, могут найти применение в настоящих имплантатах.
Дополнительный интерес представляют полимеры гидрокси-алифатических карбоновых кислот, гомополимеры или сополимеры, и полисахариды. Представляющие интерес полиэфиры могут включать полимеры D-молочной кислоты, L-молочной кислоты, рацемической молочной кислоты, гликолевой кислоты, поликапролактона и их комбинации. В общем, с использованием L-лактата или D-лактата достигается медленное разрушение полимера или полимерного материала, в то время как разрушение значительно ускоряется с добавлением лактата рацемата.
Среди пригодных полисахаров, без ограничений, можно назвать кальция альгинат и функционализированные целлюлозы, особенно эфиры карбоксиметил целлюлозы, характеризующиеся нерастворимостью в воде и имеющие молекулярный вес от приблизительно 5 кД до 500 кД, например.
Другие представляющие интерес полимеры включают, без ограничений, поливиниловый спирт, сложные полиэфиры, простые полиэфиры и их комбинации, которые являются биосовместимыми и могут быть биоразлагаемыми и/или биоразрушаемыми.
Некоторые предпочтительные характеристики полимеров или полимерных материалов для использования в настоящем изобретении могут включать биосовместимость, совместимость с терапевтическим компонентом, легкость в использовании полимера при изготовлении систем доставки препарата настоящего изобретения, полупериод жизни в физиологической среде по меньшей мере приблизительно 6 часов, предпочтительно, более чем приблизительно один день, без существенного увеличения вязкости стекловидного тела, и нерастворимость в воде.
Биоразлагаемые полимерные материалы, которые включаются для формирования полимерного матрикса имплантата, предпочтительно, подвержены энзиматической или гидролитической нестабильности. Водорастворимые полимеры могут быть поперечно-связанными с гидролизируемыми или биоразлагаемыми поперечными связями для обеспечения пригодными водонерастворимыми полимерами. Уровень стабильности может широко варьироваться в зависимости от выбора мономера, использования гомополимера или сополимера, от применения смесей полимеров и от того, включает ли полимер концевые кислотные группы.
Одинаково важно контролировать биоразложение полимера, и поэтому профиль длительного высвобождения имплантата зависит от относительного среднего молекулярного веса полимерной композиции, использованной в имплантате. В имплантат могут быть включены различные молекулярные веса одной и той же или различных полимерных композиций для модуляции профиля высвобождения. В определенных имплантатах относительный средний молекулярный вес полимера будет находиться в диапазоне от приблизительно 9 до приблизительно 64 кД, обычно от приблизительно 10 до приблизительно 54 кД и, более обычно, от приблизительно 12 до приблизительно 45 кД.
В некоторых имплантатах используются сополимеры гликолевой кислоты и молочной кислоты, где скорость биоразложения контролируется соотношением гликолевой кислоты и молочной кислоты. Сополимер с наиболее быстрым разложением имеет приближенно равные количества гликолевой кислоты и молочной кислоты. Гомополимеры или сополимеры, имеющие соотношение, отличающееся от равного, более устойчивы к деградации. Соотношение гликолевой кислоты и молочной кислоты также будет влиять на уязвимость имплантата, где для больших геометрий желательным является более гибкий имплантат. Процент полимолочной кислоты в сополимере полимолочная кислота - полигликолевая кислота (PLGA) может быть 0-100%, предпочтительно, приблизительно 15-85%, более предпочтительно, приблизительно 35-65%. В некоторых имплантатах используется сополимер 50/50 PLGA.
Биоразлагаемый полимерный матрикс внутриглазного имплантата может включать смесь двух или более биоразлагаемых полимеров. Например, имплантат может включать смесь первого биоразлагаемого полимера и другой второй биоразлагаемый полимер. Один или более биоразлагаемых полимеров могут иметь концевые кислотные группы.
Высвобождение препарата из разрушаемого полимера является следствием нескольких механизмов или комбинаций механизмов. Некоторые из этих механизмов включают десорбцию из поверхности имплантата, растворение, диффузию через пористые каналы гидратированного полимера и эрозию.
Эрозия может быть объемной или поверхностной, или их комбинацией. Как обсуждается здесь, матрикс внутриглазного имплантата может высвобождать препарат со скоростью, эффективной для поддержания высвобождения количества простамидного компонента больше одной недели после имплантации в глаз. В некоторых имплантатах терапевтические количества простамидного компонента высвобождаются в течение периода времени не большего, чем приблизительно 30-35 дней после имплантации. Например, имплантат может включать биматопрост, и матрикс имплантата разлагается со скоростью, эффективной для поддержания высвобождения терапевтически эффективного количества биматопроста в течение приблизительно одного месяца после помещения в глаз. В качестве другого примера, имплантат может включать биматопрост, и матрикс высвобождает препарат со скоростью, эффективной для поддержания высвобождения терапевтически эффективного количества биматопроста в период времени больше сорока дней, такой, как приблизительно шесть месяцев.
Один пример биоразлагаемого внутриглазного имплантата включает простамид, связанный с биоразлагаемым полимерным матриксом, который включает смесь различных биоразлагаемых полимеров. По меньшей мере один из биоразлагаемых полимеров является полилактидом, имеющим молекулярный вес приблизительно 63,3 кД. Вторым биоразлагаемым полимером является полилактид, имеющий молекулярный вес приблизительно 14 кД. Такая смесь эффективна в поддержании высвобождения терапевтически эффективного количества простамида в течение периода времени больше приблизительно одного месяца со времени помещения имплантата в глаз.
Другой пример биоразлагаемого внутриглазного имплантата включает простамид, связанный с биоразлагаемым полимерным матриксом, который включает смесь различных биоразлагаемых полимеров, где каждый биоразлагаемый полимер имеет собственную вязкость от приблизительно 0,16 дл/г до приблизительно 1,0 дл/г. Например, один из биоразлагаемых полимеров может иметь собственную вязкость приблизительно 0,3 дл/г. Второй биоразлагаемый полимер может иметь собственную вязкость приблизительно 1,0 дл/г. Дополнительные имплантаты могут включать биоразлагаемые полимеры, которые имеют собственную вязкость между приблизительно 0,2 дл/г и 0,5 дл/г. Собственные вязкости, обозначенные выше, можно определить в 0,1% хлороформе при 25 градусах С.
Один конкретный имплантат содержит биматопрост, связанный с комбинацией двух различных полилактидных полимеров. Биматопрост присутствует в приблизительно 20% от веса имплантата. Один полилактидный поли