Клонирование и использование функционального r-гена из solanum chacoense
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу придания, по меньшей мере, частичной устойчивости или повышения устойчивости растения против заражения Phytophthora infestans, к нуклеиновой кислоте, способной обеспечить устойчивость к Phytophthora infestans, а также к экспрессионной конструкции, клетке и вектору, содержащим вышеуказанную нуклеиновую кислоту. Также раскрыт способ получения тетраплоидного растения, представляющего собой растение из семейства Solanaceae, устойчивого к Phytophthora infestans с использованием вышеуказанной нуклеиновой кислоты. Изобретение также относится к растению, устойчивому к Phytophthora infestans и его части. Также раскрыт белок, способный усиливать устойчивость к Phytophthora infestans. Изобретение позволяет эффективно придавать или повышать устойчивость растения против заражения Phytophthora infestans. 11 н. и 6 з.п. ф-лы, 14 ил., 9 табл., 2 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к гену устойчивости, выделенному из S.chacoense. Кроме того, изобретение относится к использованию указанного гена устойчивости, например, для клонирования функциональных гомологов, и к использованию указанного(ых) гена(ов) устойчивости в способе повышения или придания, по меньшей мере, частичной устойчивости растениям к заражению оомицетами. Конкретнее, изобретение относится к гену устойчивости, который способен повышать или придавать, по меньшей мере, частичную устойчивость к Phytophtora sp.(например, Phytophtora infestans) посредством методов генной инженерии или маркер-опосредованных методов селекции.
Уровень техники
Фитофтороз, вызываемый оомицетом Phytophtora infestans, является одним из наиболее серьезных заболеваний в мировом производстве картофеля. Он ответственен за Ирландский картофельный голод в середине 19-го века, приведший к гибели одного миллиона людей. Хотя много усилий в исследованиях приложено в борьбе с этим болезнетворным организмом, химическая борьба с Р.infestans все еще является основной стратегией ухода за культурой, но безопасность окружающей среды становится более важной, и патоген иногда способен вырабатывать устойчивость к обработке фунгицидами. Поэтому внедрение устойчивости в современные сорта картофеля является наиболее желательной стратегией борьбы с заболеванием.
В прошлом веке Solanum demissum, который представляет собой гексаплоидный мексиканский вид, широко использовался при выведении картофеля, устойчивого к фитофторозу. Сначала был описан ряд генов 11R, полученных из S. demissum. Из них R1, R2, R3a/b, R6 и R7 локализованы на генетических картах картофеля (Solanum tuberosum). Однако указанные R-гены придают специфическую устойчивость к патогенным вариантам, и гены, которые были интрогрессированы в сорта картофеля, главным образом, R1, R2, R3, R4 и R10, быстро преодолевались патогеном. Следовательно, требуются новые источники для устойчивости, и в настоящее время имеются сообщения о нескольких других диких видах Solanum как потенциальных источниках устойчивости, многие из которых генетически охарактеризованы (таблица 6).
Последние усилия по идентификации устойчивости к фитофторозу сосредоточены на основных R-генах, придающих устойчивость широкого спектра, полученных из различных диких видов Solanum. Сообщается о других, кроме S.demissum, диких видах Solanum как новых источниках для устойчивости к фитофторозу, таких как S.acaule, S.chacoense, S.berthaultii, S.brevidens, S.bulbocastanum, S.microdontum, S.sparsipilum, S.spegazzinii, S.,stolonifemm, S.sucrense, S.toralapanum, S.vemei и S.verrucosum (обзор в (Jansky, 2000)).
S.chacoense представляет собой самонесовместимый диплоидный вид из Южной Америки и, как полагают, является источником для устойчивости к фитофторозу. Последняя таксономическая перестановка в отделе Petota выявила его родство с видами, подобными S.berthaultii и S.tarijense. Некоторые образцы S.chacoense (CHC543-1), S. berthaultii (BER481-3, BER94-2031) и S.tarijense (TAR852-5) испытаны в анализе отделенного листа (DLA) со многими изолятами (таблица 5) и в повторных полевых испытаниях с изолятом IPO-C. Во всех испытаниях CHC543-1, BER94-2031, BER481-3 и TAR852-5 оставались непораженными, что подчеркивает релевантность экспрессированных R-генов для улучшения устойчивости.
Молекулярное клонирование генов, ответственных за устойчивость, и последующее введение генов в сорта картофеля составляют третий способ, который обходит многие из проблем, с которыми сталкиваются в двух предшествующих стратегиях.
На сегодняшний день клонированы многие R-гены фитофтороза, подобные аллельным генам RB и Rpi-blb1 на хромосоме 8 и Rpi-blb2 на хромосоме 6 (таблица 6). Недавно также выделен ген устойчивости Rpi-blb3 (WO 2008/091153). Хотя первые результаты, полученные с RB и Rpi-blb1, -2 и -3 являются многообещающими, все еще остается потребность в других R-генах.
Сущность изобретения
Настоящее изобретение относится к способу придания, по меньшей мере, частичной устойчивости или повышения устойчивости растения против заражения оомицетом, включающему предоставление растению или его части нуклеиновой кислоты, кодирующей аминокислотную последовательность Rpi-che1 с фигуры 4, или ее функциональный фрагмент или функциональный гомолог, предпочтительно, при этом указанное растение представляет собой растение из семейства Solanaceae, предпочтительнее, Solanum tuberosum. Предпочтительно, указанный оомицет включает Phytophtora, предпочтительнее, Phytophtora infestans. В конкретном воплощении вышеуказанный функциональный гомолог выбирают из группы аминокислотных последовательностей, состоящей из 493-7_G12, 543-5_С2, 849-1_М8_М18_М20, 487-1_I4_I6_I8, 94-2031_L4_L7_18, 561-2_K4_K14_K22, 324-2_J1_J3_J8, 852-5_E14_E23, 852-5_Е28, 493-9_Н5_Н30, 493-7_G14_G22, 561-2_K6_K30_K31 и 493-7_G21. В других конкретных воплощениях нуклеотидная последовательность, определенная выше, включает нуклеотидную последовательность, отображенную на фигуре 7, или нуклеотидную последовательность, кодирующую аминокислотные последовательности 493-7_G12, 543-5_С2, 849-1_М8_М18_М20, 487-1_I4_I6_I8, 94-2031_L4_L7_18, 561-2_К4_К14_К22, 324-2_J1_J3_J8, 852-5_Е14_Е23, 852-5_Е28, 493-9_Н5_Н30, 493-7_G14_G22, 561-2_К6_К30_К31 и 493-7_G21, отображенные на фиг.13.
Изобретение также включает способ выведения тетраплоидного растения, устойчивого к оомицету, предпочтительно, Phytophtora, включающий
a) повышение уровня плоидности гамет диплоидного растения, которое уже содержит нуклеотидную последовательность, определенную выше;
b) использование указанных гамет в скрещивании с гаметами тетраплоидного растения; и
c) отбор потомства указанного скрещивания по наличию указанной нуклеотидной последовательности. Предпочтительно, в указанном способе диплоидное растение на стадии а) представляет собой растение из рода S.chacoense, S.berthaultii, S.sucrense или S.tarijense.
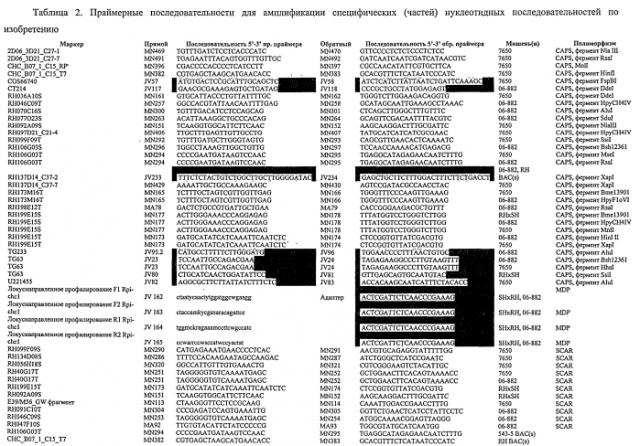
Изобретение также относится к способу отбора растения или растительного материала или его потомства по его подверженности или устойчивости к заражению оомицетом, причем указанный способ включает стадии испытания, по меньшей мере, части указанного растения или растительного материала или его потомства на присутствие или отсутствие нуклеиновой кислоты, определенной выше. Конкретно в таком способе испытание включает обнаружение наличия одного или нескольких маркеров из таблиц 2 и 8, и его выполняют с праймером или зондом, которые специфически связываются с указанной нуклеиновой кислотой.
Следовательно, изобретение также относится к маркеру для маркер-опосредованной селекции для выведения растений, устойчивых против оомицетов, при этом указанный маркер выбирают из маркеров, представленных в таблицах 2 и 8.
В другом воплощении изобретение также относится к изолированной или рекомбинантной нуклеотидной последовательности, включающей нуклеотидную последовательность, кодирующую аминокислотную последовательность Rpi-che1 с фигуры 4, или ее функциональный фрагмент, или нуклеотидную последовательность, кодирующую аминокислотную последовательность из 493-7_G12, 543-5_C2, 849-1_M8_M18_M20, 487-1J4J6J8, 94-2031_L4_L7_18, 561-2_K4_K14_K22, 324-2_J1_J3_J8, 852-5_Е14_Е23, 852-5_Е28, 493-9_Н5_Н30, 493-7_G14_G22, 5б1-2_К6_К30_К31 и 493-7_G21 или ее функциональный фрагмент. Предпочтительно указанный фрагмент включает, по меньшей мере, домен LRR аминокислотной последовательности. Также предпочтительным является воплощение, где изолированная или рекомбинантная нуклеотидная последовательность по п.10 включает нуклеотидную последовательность, отображенную на фигуре 7 или на фигуре 13.
Изобретение также относится к трансгенной или тетраплоидной клетке, включающей нуклеиновую кислоту по изобретению.
Также частью изобретения является вектор, включающий нуклеотидную последовательность по изобретению. Предпочтительно указанный вектор также включает промотор и/или терминатор, с которым ген естественно ассоциируется, предпочтительнее, укороченный промотор, имеющий менее 1000 нуклеотидов вверх от последовательности гена.
Изобретение также относится к трансгенной или тетраплоидной клетке-хозяину, включающей нуклеиновую кислоту по изобретению или вектор по изобретению, предпочтительно, при этом такой клеткой-хозяином является клетка Agrobacterium или растительная клетка.
Изобретение также относится к трансгенной или тетраплоидной растительной клетке, включающей нуклеиновую кислоту по изобретению или вектор по изобретению, предпочтительно, при этом такой растительной клеткой является клетка из Solanaceae, предпочтительнее, Solanum tuberosum, предпочтительнее, тетраплоидного Solanum tuberosum. В другом предпочтительном воплощении изобретение относится к трансгенному или тетраплоидному растению, включающему такую клетку, и также части растения, полученной от такого растения, при этом такой частью предпочтительно является клубень.
В настоящее изобретение также включается белок, кодированный изолированной или рекомбинантной нуклеиновой кислотой по изобретению, или его функциональный фрагмент, при этом указанный белок имеет аминокислотную последовательность Rpi-chc1, отображенную на фигуре 4.
Изобретение также относится к антителу, которое (специфически) связывается с белком по п.20.
Пояснения к фигурам
Фигура 1. Генетические и физические карты локусов Rpi-chc1 (А) и Rpi-ber (В) (популяции 7650 и 06-882, соответственно). Указаны относительные позиции маркеров, число рекомбинантов, идентифицированных между маркерами, перекрывающиеся клоны ВАС, которые охватывают R-локусы, и относительные позиции RGA на физических картах СНС543-5 и RH89-039-16.
Фигура 2. Аннотация последовательности Chr10 ВАС.
Секвенированы и аннотированы два перекрывания по типу черепичной кровли (Tiling path), состоящих из 3 и 4 перекрывающихся ВАС из RH89-039-16 (RH106G038, RH137D014, RH009D021 и RH122B15, RH77023, RH04G12, RH199E15) и двух перекрывающихся ВАС из СНС543-5. Позиции маркеров и концевых последовательностей ВАС у перекрывающихся ВАС указаны остриями стрелок. Позиции контигов последовательностей показаны горизонтальными стрелками. Позиции генов, предсказанные алгоритмом FGENESH, указаны заштрихованными прямоугольниками. Гомология последовательностей белков, обнаруженная поиском BlastP в базе данных NR, показана вертикальными стрелками. RGA нумеруются соответственно - A: RH106G03, В: RH137D14, С: RH97D21, D: RH122B15, Е: RH77023, F: CHC B1 (В07-1-05), G: CHC B2 (2-D06_3-D21).
Фигура 3. Временная комплементация чувствительности к Phytophtora в листьях Nicotiana benthamiana. Через 2 дня после агроинфильтрации листья заражают инокуляцией суспензии зооспор изолята 90128 Р.infestances (авирулентного на СНС543-5) в анализе отделенного листа. Типичные фенотипы заболевания развиваются через 6 дней после инокуляции контрольных растений, которые агрофильтрованы pBINplus без вставки. Полную устойчивость наблюдают у контрольных растений, агрофильтрованных pBINplus:Rpi-blb1. Агроинфильтрация pBINplus:CHCB2-3 - одним из трех RGA из интервала картирования Rpi-chc1, также придает полную устойчивость к заражению Р.infestances, в то время как листья, инфильтрованные pBINplus:CHCB2-l и pBINplus:CHCB2-2, остаются чувствительными.
Фигура 4. Выравнивание аминокислотной последовательности RGA из S. chacoense (CHC B1-1, CHC B1-2, CHC B2-1, CHC B2-2 и CHC B2-3 = Rpi-chc1) и из родственных последовательностей, происходящих из образцов S.tuberosum RH89-039-16 (77023 с5794, 77023 с5795, 77023 с671, 77023 с7063, 77023 с7064, 122 В15С88, 122 В15С247, 137D14c131, и 137D14c132).
Белок ABF81421 с неизвестной функцией кодирован геном из Populus trichocarpa.
Фигура 5. Организация белкового домена Rpi-chc1
N-Концевой СС-домен включает аминокислоты 1-231. Для аминокислот, показанных затемненными, с использованием алгоритма «спираль» с размером окна 14 прогнозирована укладка в спиральную структуру. Центральный домен NB-ARC включает аминокислоты 232-557. Домены в затемненных участках демонстрирует сходство с описанными ранее доменами Kinase 1a, Kinase 2, kinase 3а, GLPL, RNBS-D и MHD, соответственно. С-Концевой LRR-домен состоит из 20 несовершенных повторов, богатых лейцином. Консервативные гидрофобные аминокислоты (А, V, L и F) в данном случае отмечены затемнением. Консенсус показан внизу.
Фигура 6. Позиции на генетической карте родственных последовательностей Rpi-chc1 и генов устойчивости к фитофторозу на хромосоме 10.
Карты UHD хромосом SH и RH показаны слева (van Os et al., 2006). 06-882 и 7677, полученные в данном исследовании, показаны в середине. Позиции Rpi-ber (Rauscher et al., 2006), Rpi-ber1 и Rpi-ber2 (Park et al., 2008) показаны справа. Красные линии показывают расположение генов устойчивости к фитофторозу.
Фигура 7. Нуклеотидная последовательность клона СНС В2-3 (7907 п.о.), содержащая Rpi-chc1-кодирующую и регуляторную последовательности. Кодирующий Rpi-chc1 участок в 4550 п.о. выделен затемнением (3358-7266). Вышерасположенные 3357 нуклеотидов (1-3357) и нижерасположенные 641 нуклеотид (7267-7907) содержат регуляторные последовательности.
Фигура 8. Функциональная комплементация чувствительности к Phytophtora infestsns (Pi) в трансгенных растениях сорта Дезире. Сорт Дезире, трансформированный кандидатами в гены Rpi-chc1 (RGC-1, -2 и -3), заражают изолятом Pi 90128 в анализе отделенного листа. Учитывают картину через 6 дней после инокуляции. Устойчивость наблюдают только в трансгенах, содержащих RGC-3.
Фигура 9. Скрининг набора РЕХ с использованием совместной инфильтрации. Клоны РЕХ инфильтруют в листья N. benthamiana одни или инфильтруют совместно с Rpi-chc1. Оценивают картину через одну неделю после инфильтрации. Лист А-РЕХ1=RD31, РЕХ2=RD36. Лист В-РЕХ1=RD12-1, РЕХ2=RD12-2. Лист С-РЕХ1=INF1, РЕХ2=pGR106. На каждом листе пятно на листе внизу слева инфильтровано R3a+avr3a. Пятна внизу справа инфильтрованы Rpi-chc1. Лист А не показывает идентификации соответствующего эффектора. В показывает некроз в случае взаимодействия Rpi-chc1 и RD12. С показывает аутонекроз в случае INF1.
Фигура 10. Регуляторные элементы, управляющие экспрессией Rpi-chc1.
ORF Rpi-chc1 клонируют в промежутке между одной из четырех промоторных/терминаторных последовательностей - ее собственным промотором в 3 т.п.о. и терминатором в 0,5 т.п.о. (p-chc1-long), ее собственным промотором в 0,9 т.п.о. и терминатором в 0,5 т.п.о. (p-chc1-short), двойным промотором 35S в pMDC32 или комбинацией промотор/терминатор Rpi-blb3 (Lokosson et al., 2009). Совместную агорофильтрацию с PEX-RD12 выполняют при пяти серийных разведениях (OD600=2,0, 1,0, 0,5, 0,2, 0,1) как указано. R3a, смешанный с Avr3a, используют в качестве положительного контроля (+), и Rpi-chc1 используют в качестве отрицательного контроля (-). Изображения получают через 6 дней после инокуляции.
Фигура 11. Отбор пар Rpi-chc1-специфических праймеров, используемых для скринига зародышевой плазмы.
А. Отбор пар Rpi-chc1-специфических праймеров. Комбинации праймеров а: 581+582, b: 585+587, с: 585+589, d: 586+587, e: 586+589, f: 588+589 относятся к таблице 8. Используемые матрицы: 1-chc543-5 (растение-донор для Rpi-chc1), 2-chc544-5 (чувствительный родитель популяции картирования), 3-RH89-39-16 (чувствительное растение, донор гомологичных последовательностей Rpi-chc1), 4-СНС ВАС-1 (клон ВАС, содержащий три неактивных RGA), 5-СНС ВАС-2 (клон ВАС, содержащий Rpi-chc1), 6-MQ.B. 225 генотипов из таксономических групп 10-12 до 10-17, перечисленных в таблице 7, скринированы с комбинацией праймеров D. Светлые стрелки показывают фрагменты ожидаемого размера в 6 генотипах.
Фигура 12. Филогенетический анализ гомологов Rpi-chc1.
Зеленый цвет-последовательности, выделенные ПЦР гомологов Rpi-chc1 (пример 2).
Черный цвет-гомологи Rpi-chc1, идентифицированные во время клонирования на основе картирования (пример 1).
Фигура 13. Нуклеотидные последовательности 21 упомянутого гомолога Rpi-chc1.
Фигура 14. Выравнивание по Clustal W последовательностей белков, кодированных гомологами Rpi-chc1 с фигуры 11, и последовательностей гомологов Rpi-chc1, описанных в примере 1.
Подробное описание
Используемый в данном описании термин «растение или его часть» обозначает любое целое или нецелое растение, отдельные клетки и клетки тканей, такие как растительные клетки, которые являются интактными в растениях, скопления клеток и тканевые культуры, из которых могут быть регенерированы растения картофеля. Примеры частей растения включают, но не ограничиваются указанным, отдельные клетки и ткани из пыльцы, семяпочек, листьев, зародышей, корней, кончиков корней, пыльников, цветков, плодов, боковых побегов, клубней, в том числе, клубней картофеля для потребления или «семенных клубней» для выращивания или кленового размножения, и семян; а также пыльцу, семяпочки, листья, зародыши, корни, кончики корней, пыльники, цветки, плоды, стебли, побеги, отпрыски, корневые побеги, семена, протопласты, каллюс и т.п.
Используемый в данном описании термин «популяция» обозначает генетически неоднородное собрание растений, имеющих общее генетическое происхождение.
Используемый в данном описании термин «сорт» определяется соглашением UPOV и относится к любой группировке растений в пределах одного ботанического таксона наименьшего известного ранга, которая может (а) определяться проявлением признаков, которые обусловлены данным генотипом или комбинацией генотипов, (b) отличаться от любой другой группировки растений за счет проявления, по меньшей мере, одного из указанных признаков, и (с) рассматриваться как единица в отношении ее способности не изменяться при размножении.
Термин «культивар» (для культивируемого сорта), используемый в данном описании, определяется как сорт, который обычно не обнаруживается в природе, но который выращен людьми, т.е. имеет биологический статус иной, чем «дикий» статус, где «дикий» статус показывает исходное некультивированное или природное состояние растения или образца. Термин «культивар» конкретно относится к растению картофеля, имеющему уровень плоидности, который соответствует тетраплоидному. Термин «культивар» также включает, но не ограничивается указанным, полунатуральный, полудикий, сорный традиционный культивар, ландрас, селекционный материал, исследовательский материал, селекционную линию, синтетическую популяцию, гибрид, семенную/основную популяцию, инбредную линию (родителя гибридного культивара), расщепляющуюся популяцию, мутантный/генетический материал и прогрессивный/улучшенный культивар.
Используемый в данном описании термин «скрещивание» обозначает оплодотворение женских растений (или гамет) мужскими растениями (или гаметами). Термин «гамета» относится к гаплоидной или диплоидной половой клетке (яйцеклетке или спермии), вырабатываемой в растениях путем мейоза или путем первой или второй реституции или двойной реституции из гаметофита, и вовлеченной в половое размножение, во время которого две гаметы противоположного пола сливаются с образованием диплоидной или полиплоидной зиготы. Термин обычно включает отсылку к пыльце (включающей сперматогенную клетку) и семяпочке (включающей яйцеклетку). Поэтому термин «скрещивание» обычно относится к оплодотворению семяпочки одной особи пыльцой другой особи, в то время как термин «самоопыление» относится к оплодотворению семяпочек особи пыльцой генетически той же особи.
Термин «обратное скрещивание», используемый в данном описании, обозначает процесс, в котором растение, полученное от скрещивания между двумя родительскими линиями, скрещивают с одной из его родительских линий, при этом родительскую линию, используемую при обратном скрещивании, называют рекуррентным родителем. Повторное обратное скрещивание приводит к геному, становящемуся все более и более похожим на рекуррентного родителя, насколько это может быть достигнуто для данного уровня гомо- или гетерозиготности указанного родителя.
Используемый в данном описании термин «самоопыление» определяется как относящийся к самооплодотворению, при этом особь опыляется или оплодотворяется своей собственной пыльцой.
Термин «маркер», используемый в данном описании, обозначает любой индикатор, который используется в способах для обнаружения различий в характеристиках геномных последовательностей. Примерами таких индикаторов являются маркеры полиморфизма длин рестрикционных фрагментов (RFLP), маркеры полиморфизма длин амплифицированных фрагментов (AFLP), однонуклеотидного полиморфизма (SNP), инсерционных мутаций, микросателлитные маркеры (SSR), амплифицированные участки с охарактеризованной последовательностью (SCAR), маркеры рестрикционного полиморфизма амплифицированной последовательности (CAPS) или изозимные маркеры или комбинации маркеров, описанных в данном описании, которые определяют специфическую генетическую и хромосомную локацию.
Используемый в данном описании термин «локус» определяется как генетическая или физическая позиция, которую данный ген занимает на хромосоме растения.
Термин «аллель(и)», используемый в данном описании, обозначает любую одну или несколько альтернативных форм гена, и все аллели соотносятся с присутствием или отсутствием определенного фенотипического признака или свойства у растения. В диплоидной клетке или организме два аллеля данного гена занимают соответствующие локусы на паре гомологичных хромосом. В некоторых случаях вместо «аллеля» это точнее можно назвать «гаплотипами» (т.е. аллелем хромосомного сегмента), однако в таких случаях термин «аллель» следует понимать как включающий термин «гаплотип».
Термин «гетерозиготный», используемый в данном описании, только в отношении диплоидов обозначает генетическое состояние, существующее в том случае, когда в соответствующих локусах на гомологичных хромосомах находятся различные аллели.
Используемый в данном описании только в отношении диплоидов термин «гомозиготный» определяется как генетическое состояние, существующее в том случае, когда в соответствующих локусах на гомологичных хромосомах находятся идентичные аллели.
Используемый в данном описании только в отношении тетраплоидов термин «нуллиплекс», «симплекс», «дуплекс», «триплекс» и «квадруплекс» определяется как генетическое состояние, существующее в том случае, когда в соответствующем локусе на соответствующих гомологичных хромосомах специфический аллель присутствует 0, 1, 2, 3 или 4 раза, соответственно. На тетраплоидном уровне фенотипический признак, ассоциированный с рецессивным аллелем, наблюдают только тогда, когда аллель присутствует в состоянии квадруплекса, в то время как фенотипический признак, ассоциированный с доминантным аллелем, наблюдают уже тогда, когда аллель присутствует в состоянии симплекса или более высоком состоянии.
Термины «гаплоид», «диплоид» и «тетраплоид», используемые в данном описании, определяются как наличие соответственно одной, двух и четырех пар каждой хромосомы в каждой клетке (исключая половые клетки).
Термин «гаплотип», используемый в данном описании, обозначает комбинацию аллелей в нескольких локусах, которые передаются вместе в составе одной хромосомы. Включаются гаплотипы, относящиеся всего к двум локусам, и гаплотипы, относящиеся ко всей хромосоме, в зависимости от числа событий рекомбинации, которые происходят между данным набором локусов.
Используемый в данном описании термин «делать вывод» или «заключение» в отношении оценки присутствия устойчивости к грибам связанной с экспрессией гена Rpi-chc1, обозначает формулирование вывода о присутствии указанного гена в растении или его части с использованием способа анализа встречаемости отдельного нуклеотида или сочетания нуклеотидов указанного гена в образце нуклеиновой кислоты растения или его части. Как раскрывается в данном описании, встречаемость нуклеотидов можно идентифицировать непосредственно путем проверки качественных различий или количественных различий в уровнях экспрессии молекул нуклеиновой кислоты или косвенно путем проверки (уровня экспрессии) белка Rpi-chc1.
Термин «праймер», используемый в данном описании, относится к олигонуклеотиду, который способен к отжигу с мишенью амплификации, давая возможность ДНК-полимеразе присоединяться, причем посредством этого служит в качестве точки инициации синтеза ДНК, когда помещен в условия, в которых вызывается синтез продукта удлинения праймера, который комплементарен цепочке нуклеиновой кислоты, т.е. в присутствии нуклеотидов и агента полимеризации, такого как ДНК-полимераза, и при подходящих температуре и рН. Праймер (амплификации) предпочтительно является одноцепочечным для максимальной эффективности амплификации. Предпочтительно прайме представляет собой олигодезоксирибонуклеотид. Праймер должен быть достаточно длинным для инициирования синтеза продуктов удлинения в присутствии агента полимеризации. Точная длина праймеров будет зависеть от многих факторов, включая температуру и источник праймера. Термин «пара двунаправленных праймеров», используемый в данном описании, относится к одному прямому и одному обратному праймеру, как это обычно используется в технике амплификации ДНК, такой как ПЦР амплификация.
Используемый в данном описании термин «зонд» обозначает последовательность одноцепочечного нуклеотида, которая будет узнавать и образовывать через водородную связь дуплекс с комплементарной последовательностью в аналите нуклеотидной последовательности-мишени или ее к ДНК-производного.
Термины «жесткость» или «жесткие условия гибридизации» относятся к условиям гибридизации, которые влияют на устойчивость гибридов, например, температуре, концентрации соли, рН, концентрации формамида и т.п. Такие условия эмпирически оптимизированы для максимизации специфического связывания и минимизации неспецифического связывания праймера или зонда с его нуклеотидной последовательностью-мишенью. Используемые термины включают обращение к условиям, в которых зонд или праймер будут гибридизировать с последовательностью-мишенью в большей степени, чем с другими последовательностями, что поддается обнаружению (например, по меньшей мере, в 2 раза больше, чем фон). Жесткие условия зависят от последовательности и будут различаться в различных обстоятельствах. Более длинные последовательности гибридизируют специфически при более высоких температурах. Как правило, жесткие условия выбирают такими, что температура примерно на 5°С ниже, чем температура плавления (Тпл (Тm)) специфической последовательности при определенных ионной силе и рН. Тпл является температурой (при определенных ионной силе и рН), при которой 50% комплементарной последовательности-мишени гибридизирует с полностью соответствующим зондом или праймером.
Типично жесткие условия будут такими, когда концентрация соли меньше примерно 1,0 М иона Na+, типично, концентрация иона Na+ (или других солей) примерно 0,01-1,0 М, при рН 7,0-8,3 и температура составляет, по меньшей мере, примерно 30°С для коротких зондов или праймеров (например, в 10-50 нуклеотидов) и, по меньшей мере, примерно 60°С для длинных зондов или праймеров (например, свыше 50 нуклеотидов). Жестких условий также можно достичь добавлением дестабилизирующих агентов, таких как формамид. Примеры условий низкой жесткости или «условий пониженной жесткости» включают гибридизацию с буферным раствором с 30% формамида, 1 М NaCl, 1% SDS при 37°С и промывку в 2х SSC при 40°С. Примеры жестких условий включают гибридизацию с 50% формамида, 1 М NaCl, 1% SDS при 37°С и промывку в 0,1х SSC при 60°С. Процедуры гибридизации хорошо известны в технике и описаны, например, в Ausubel F.M., Brent R., Kingston R.E., Moore D.D., Seidman J.G., Smith J.A., Struhl K., eds. (1998), Current protocols in molecular biology. V.B.Chanda, series ed. New York: John Wiley & Sons.
В настоящем изобретении описывается клонирование гена Rpi-chc1. Rpi-chc1 был картирован в новом локусе R-гена на хромосоме 10 с использованием картирования популяций S. chacoense. Маркеры, прочно соединенные с Rpi-chc1, используют для получения физической карты локуса R. Три аналога R-гена (RGA), присутствующие на одном из двух клонов ВАС, которые охватывают локус Rpi-chc1, намечают для анализа комплементации, из которых один, как оказывается, является функциональным геном Rpi-chc1. Вне кластеров R-гена, описанных в данном изобретении, Rpi-chc1 имеет наибольшую идентичность аминокислотных последовательностей (40%). с белком, кодированным геном из тополя (Populas trichocarpa) с неизвестной функцией, обозначенным ABF81421. Более низкий процент гомологии (<30%) обнаруживают с R-белками, идентифицированными ранее в Solanaceae (таблица 3).
В первом воплощении изобретение относится к изолированной или рекомбинантной нуклеотидной последовательности, включающей нуклеотидную последовательность, кодирующую аминокислотную последовательность Rpi-chc1 (=СНС_В2-3), представленную на фигуре 4, или ее функциональный фрагмент или функциональный гомолог, т.е. функциональный фрагмент или функциональный гомолог аминокислотной последовательности, показанной на фигуре 4.
Термин «нуклеиновая кислота» обозначает молекулу одно- или двухцепочечной ДНК или РНК.
Также включены последовательности, комплементарные описанным здесь нуклеотидным последовательностям.
Термин «его функциональный фрагмент» типично используют для обозначения фрагмента белка Rpi-chc1, который способен придавать, по меньшей мере, частичную устойчивость или возрастающую устойчивость растения семейства Solanaceae против заражения оомицетами. Такой фрагмент представляет собой, например, укороченный вариант белка Rpi-chc1, представленного на фигуре 4. Укороченный вариант/фрагмент белка Rpi-chc1 представляет собой фрагмент, который включает меньше 1302 аминокислот и, предпочтительно, включает часть домена LRR (т.е. часть домена из богатых лейцином повторов, который простирается примерно от аминокислоты 557 до аминокислоты 1302 Rpi-chc1) и/или N-концевые части белка Rpi-chc1.
Термин «функциональный гомолог» типично используют для обозначения последовательности белка, которая высокогомологична или имеет высокую идентичность с описанным здесь белком Rpi-chc1, который способен придавать, по меньшей мере, частичную устойчивость или возрастающую устойчивость растения семейства Solanaceae против заражения оомицетами. Включаются искусственные изменения или замены аминокислотных остатков, которые, по меньшей мере, частично сохраняют действие белка Rpi-chc1. Например, некоторые аминокислотные остатки могут быть традиционно заменены на другие остатки сравнимой природы, например, основной остаток на другой основной остаток, кислый остаток на другой кислый остаток, гидрофобный остаток на другой гидрофобный остаток и т.д. Примерами гидрофобных аминокислот являются валин, лейцин и изолейцин. Фенилаланин, тирозин и триптофан являются примерами аминокислот с ароматической боковой цепью, и цистеин, а также метионин являются примерами аминокислот с серосодержащими боковыми цепями. Серин и треонин содержат алифатические гидроксильные группы и рассматриваются как гидрофильные. Аспарагиновая кислота и глутаминовая кислота являются примерами аминокислот с кислой боковой цепью. Коротко, термин «его функциональный гомолог» включает варианты белка Rpi-chc1, в которых аминокислоты встроены, заменены или делегированы, и которые, по меньшей мере, частично, сохраняют действие белка Rpi-chc1 (т.е. по меньшей мере, частичное придание или возрастание устойчивости растения семейства Solanaceae против заражения оомицетами). Предпочтительными вариантами являются варианты, которые содержат только традиционные замены, описанные выше. Высокая идентичность, упомянутая выше, означает идентичность, по меньшей мере, на 80, 85 или 90%. Даже более предпочтительными являются аминокислоты, которые имеют идентичность 91, 92, 93, 94 или 95%. Наиболее предпочтительными являются аминокислоты, которые имеют идентичность с аминокислотной последовательностью Rpi-chc1 96, 97, 98 или 99%. Гомологичные белки, например, представляют собой последовательности, выровненные с CHC_B2-3 на фиг.5 и с ORF Rpi-chc1 на фиг.14.
Функциональная гомологичная нуклеотидная последовательность представляет собой нуклеотидную последовательность, которая кодирует функциональный гомологичный белок, описанный выше.
Процент гомологии и/или идентичности можно определить, например, с использованием компьютерных программ, таких как BLAST, ClustalW или ClustalX.
Многие нуклеотидные последовательности кодируют белок, который на 100% идентичен белку Rpi-chc1, представленному на фигуре 4. Это так, поскольку нуклеотиды в нуклеотидном триплете могут изменяться без изменения соответствующей аминокислоты (неоднозначность в нуклеотидных триплетах). Таким образом, нуклеотидная последовательность, кодирующая такой белок, может быть изменена не повлияв на аминокислотную последовательность белка. Однако в предпочтительном воплощении изобретение относится к изолированной или рекомбинантной нуклеотидной последовательности, отображенной на фигуре 7. В предпочтительном воплощении изобретение относится к изолированной, синтетической или рекомбинантной нуклеиновой кислоте, которая представляет собой кодирующую последовательность (CDS) белка Rpi-chc1, т.е. нуклеотиды 3358-7266 на фигуре 7 (затемненные), или его функционального гомолога. Нуклеотидные последовательности гомологов представлены на фиг.13, и соответствующие аминокислотные последовательности приводятся в выравнивании на фиг.14.
Фрагменты, а также гомологи описанного в данном описании гена и белка Rpi-chc1 можно проверить, например, на их функциональность с использованием анализов временной трансформации Agrobacterium tumefaciens (агрофильтрация) и/или с использованием анализа отделенного листа.
В экспериментальной части, например, описывается функциональный скрининг для испытания кандидатов в гены с использованием агроинфильтрации, в соответствии с чем 4-недельные растения Nicotiana benthamiana дикого типа инфильтруют штаммами Agrobacterium, содержащими кандидаты в гомологи Rpi-chc1. Затем в анализе отделенного листа инфильтрованные листья через одни сутки после инфильтрации заражают штаммом Р. infestans, который является вирулентным для N. benthamiana, например, IPO-C или 90128. Такая система в равной степени подходит для испытания фрагментов кандидатов в гомологи Rpi-chc1. Специалист в данной области техники таким образом может легко определить, можно или нет гомолог или фрагмент Rpi-chc1 рассматривать как функциональный гомолог или фрагмент.
Временная экспрессия гена, которая достигается через агрофильтрацию, является быстрым, гибким и воспроизводимым подходом к экспрессии полезных белков на высоком уровне. В растениях рекомбинантные штаммы Agrobacterium tumefaciens можно использовать для временной экспрессии генов, которые встраивают в участок Т-ДНК бактериальной Ti-плазмиды. Бактериальную культуру инфильтруют в листья, и после переноса Т-ДНК в клетках растения происходит эктопическая экспрессия интересующего гена. Однако применимость системы ограничена, поскольку эктопическая экспрессия РНК прекращается через 2-3 дня. Показано, что основной причиной такой потери эффективности является посттраскрипционный сайленсинг гена (PTGS). Система, основанная на коэкспрессии кодированного вирусом супрессора сайленсинга гена белка р19 вируса кустистой карликовости томата (TBSV), предотвращает начало PTGS в инфильтрованных тканях и создает возможность для высокого уровня временной экспрессии. Экспрессия ряда белков в присутствии р19 усиливается в 50 раз или больше, так что очистки белка можно достичь из такого небольшого количества материала инфильтрованного листа как 100 мг. Хотя ясно, что использование р19 имеет преимущества, агроинфильтрацию без р19 также можно использовать для испытания функциональности предполагаемых фрагментов и функциональных гомологов.
С другой стороны, каждый кандидат в генную конструкцию (например, являющуюся фрагментом или гомологом) является мишенью для трансформации в восприимчивый культивар картофеля, например Дезире. Первичные трансформанты заражают в анализах отделенного листа с использованием, например, изолятов IPO-O, IPO-C или 90128. Трансформанты, которые устойчивы к таким изолятам, содержат, например, функциональные фрагменты или гомологи Rpi-chc1.
В еще одном воплощении изобретение относится к вектору, включающему нуклеиновую кислоту, предлагаемую в данном описании, т.е. нуклеиновую кислоту, способную придавать, по меньшей мере, частичную устойчивость или повышенную устойчивость растения семейства Solanaceae против заражения оомицетами. Более определенно, изобретение относится к вектору, включающему изолированную, синтетическую или рекомбинантную нуклеотидную последовательность, включающую нуклеотидную последовательность, кодирующую аминокислотную последовательность Rpi-chc1 на фигуре 4 или ее функциональный фрагмент или функциональный гомолог. Изобретение также относится к вектору, включающему нуклеотидную последовательность, отображенную на фигуре 7.
Примерами подходящего вектора являются pBeloBACII, pBINplus, pKGW-MG или любой коммерчески доступный клонирующий вектор.
Как будет отмечено ниже, существует несколько путей, которыми нуклеиновую кислоту по изобретению можно перенести в растение. Один подходящий способ переноса опосредуется Agrobacterium, ког