Способ получения гликопептида, имеющего сиалированную сахарную цепь, и способ получения производного сиалилгликоаспарагина
Иллюстрации
Показать всеГруппа изобретений относится к способам синтеза гликопептида, имеющего сиалированную сахарную цепь. Путем реакции этерификации осуществляют связывание смолы, имеющей гидроксильную группу с аминокислотой, у которой азот аминогруппы защищен Вос-группой. Отсоединяют Вос-группу с образованием свободной аминогруппы. Осуществляют элонгацию аминокислоты, связанной со смолой, путем дополнительного связывания другой аминокислоты, у которой азот аминогруппы защищен Вос-группой. Отсоединяют Вос-группу с образованием свободной аминогруппы. Осуществляют гидролиз смолы с помощью кислоты. Указанные аминокислоты по меньшей мере единожды являются сиалированными, причем карбоксильная группа сиаловой кислоты защищена фенацильной группой. Также получают производное сиалилгликоаспарагина. Изобретения позволяют получать сиалированные гликопептиды, в которых присутствует лабильная к щелочам неприродная аминокислота, а также предотвратить деградацию сиаловой кислоты. 2 н. и 20 з.п. ф-лы, 11 ил., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу синтеза гликопептида, имеющего сиалированную сахарную цепь, который может быть использован, например, в эталонных стандартах, например для фармацевтических агентов, или в качестве аналитических инструментов и реактивов для академических целей.
Предшествующий уровень техники
В последние годы гликомолекулы привлекают внимание как третья из биологических молекул, образующих цепи, после нуклеиновых кислот (ДНК) и белков. Человеческий организм является одним большим сообществом клеток, состоящим из около 60 триллионов клеток, и все поверхности клеток покрыты гликомолекулами. Например, группа крови по системе АВО определяется по различию сахарных цепей на клеточной поверхности.
Функция сахарных цепей связана с межклеточным распознаванием и взаимодействием, и они действуют в качестве краеугольного камня в формировании клеточного сообщества. Беспорядок в клеточном сообществе приводит, например, к злокачественному новообразованию, хроническому заболеванию, инфекции и старению. Например, известно, что, когда клетки становятся злокачественными, на клеточной поверхности происходит структурное изменение сахарных цепей.
Кроме того, известно, что Vibrio cholerae или вирус гриппа и т.д. захватывают клетку и вызывают инфекцию путем распознавания и связывания конкретной сахарной цепи.
Выявление таких функций сахарных цепей приведет, например, к разработке фармацевтических агентов или пищевых продуктов, основанных на новом принципе, для которых ожидают широкий круг применения, таких как профилактика заболеваемости или применение при лечении.
По сравнению со структурами нуклеиновых кислот или белков сахарные цепи имеют очень сложные структуры из-за разнообразия, например, последовательности моносахаридов, способа и участка связывания, длины цепи и вида ветвления и общей структуры высшего порядка. Соответственно, биологическая информация, полученная из структуры сахарной цепи, широко варьирует по сравнению с той, что получена из структуры нуклеиновых кислот или белков. Хотя важность исследования сахарных цепей является признанной, скорость исследований замедлена по сравнению с исследованиями нуклеиновых кислот или белков, из-за сложности и разнообразия структур сахарных цепей.
К множеству белков, присутствующих на поверхности клеточной мембраны или в сыворотке и т.п., прикреплены сахарные цепи. Молекулы, в которых сахарные цепи ковалентно связаны с белком, называются гликопротеинами, и могут быть разделены на две группы, согласно различию по способу связывания сахара и белка. В одной сахарная цепь связана с аспарагином (N-гликозидная связь) через аминогруппу на боковой цепи аспарагина (Asn). В другой сахарная цепь связана с муцином (O-гликозидная связь), где сахарная цепь связана со спиртовой группой серина (Ser) или треонина (Thr). Все сахарные цепи, связанные с аспарагином, имеют основной остов, состоящий из 5 остатков сахара, и классифицируются на подгруппы с высоким содержанием маннозы, комплексного типа и гибридного типа в соответствии с сахарным остатком на невосстанавливающем конце прикрепленной сахарной цепи. С другой стороны, муцин-связанные сахарные цепи классифицируются на четыре группы согласно различию основного остова (ядра).
Хотя белки с сахарной цепью уже использовались в качестве гликопротеиновых составов, существуют проблемы, суть которых в том, что эти гликопротеины могут быть получены только способами, в основном использующими биотехнологию, и в том, что гликопротеины, изготовленные таким образом, загрязнены. Соответственно, необходим способ химического синтеза, который позволяет эффективно получать представляющий интерес гликопротеин с высокой степенью чистоты. В частности, при синтезе гликопептида, имеющего неприродную аминокислоту, биологические способы не позволяют обеспечить прямое получение.
Способ синтеза на твердой фазе, разработанный R. В. Merrifield в 1963 году, в настоящее время широко используется в качестве способа синтеза пептидов. Способ синтеза на твердой фазе является способом, в котором аминокислотные строительные блоки присоединяются к твердой фазе, называемой смолой, а пептидная цепь удлиняется. Если удлинение пептидной цепи закончено, пептидная цепь отщепляется от твердой фазы для получения целевого объекта.
Когда применяют данный подход для синтеза цепи гликопептида, то при удлинении пептидной цепи в нее включают аминокислоту, связанную с сахарной цепью.
В способе твердофазного синтеза аминогруппы аминокислот, которые будут строительными блоками, защищаются, например, флуоренилметоксикарбонильной (Fmoc) группой, трет-бутоксикарбонильной (Boc) группой или бензилоксикарбонильной (Cbz или Z) группой.
В способе твердофазного синтеза, использующем Boc-группу, для снятия защитной группы с боковой цепи пептида и отщепления пептида от смолы используются очень сильная кислота, такая как фторводородная кислота, и проблема заключается в том, что когда в части целевого объекта имеется сахарная цепь, то в результате обработки фтороводородной кислотой часть сахарной цепи, особенно сиаловая кислота, присутствующая на не восстанавливающем конце сахарной цепи, может легко деградировать. Таким образом, трудно изготовить представляющий интерес гликопротеин, имеющий сиалированную сахарную цепь, с помощью Boc-способа твердофазного синтеза.
В способе твердофазного синтеза, использующем Fmoc-группу, Fmoc-группа может быть отсоединена от аминогруппы аминокислоты в щелочных условиях. С другой стороны, поскольку Boc-группа может быть снята с аминогруппы аминокислоты в кислых условиях, Boc-способ твердофазного синтеза необходим, когда способом твердофазного синтеза синтезируется пептид или гликопептид, в котором присутствует лабильная к щелочам неприродная аминокислота.
Неприродные аминокислоты являются аминокислотами, которые не входят в состав белков, но некоторые из них существуют в природе и могут быть получены химическим синтезом. Неприродн аминокислоты имеют чрезвычайно высокое разнообразие структуры или гибкость выбора заместителя. При использовании такой неприродной аминокислоты в синтезе пептида можно ожидать улучшение стабильности in vivo, улучшение активности, улучшение эффективности абсорбции, улучшение распределения по ткани, изменение трехмерной структуры пептида и т.п., и неприродные аминокислоты привлекают внимание как позволяющие спроектировать вещества кандидаты для новых пептидных лекарств и функциональных материалов.
Сообщалось о способе, в котором пептид, полученный отщеплением пептида от смолы, преобразуется в тиоэфирную форму (например, Документ Непатентной Литературы 1). Поскольку получается пептид в тиоэфирной форме, он может быть связан с другими пептидными цепями, с использованием, например, способа Природного Химического Лигирования (NCL) или способа Кинетически Контролируемого Лигирования (KCL), что позволяет изготовить представляющий интерес белок большего размера (Документ Патентной Литературы 1 и Документ Непатентной Литературы 2).
Способ NCL является способом получения пептидной цепи большего размера путем связывания пептидного фрагмента, имеющего Cys в качестве N-концевой аминокислоты, и пептидного фрагмента, имеющего тиоэфир на С-конце. Гликопротеин может быть синтезирован с использованием в качестве такого фрагмента гликозилированного пептида. Каждый фрагмент может быть синтезирован, например, вышеуказанным способом твердофазного синтеза, а гликозилированные фрагменты, имеющие единообразные аминокислотную последовательность и структуру сахарной цепи, могут быть получены в ходе синтеза присоединением вместо аминокислоты гликозилированного аспарагина, имеющего единообразные сахарные цепи (Документ Патентной Литературы 2). Кроме того, способ KCL является способом получения представляющего интерес гликопротеина в относительно больших количествах путем использования различия в скорости реакции, когда оба связываемых пептидных фрагмента имеют тиоэфир на С-конце.
Соответственно, при осуществлении способа NCL или KCL с гликозилированным фрагментом могут быть получены единообразные гликопротеины, которые не варьируют в зависимости от партии выработки и которые также могут быть использованы в качестве фармацевтического агента.
Список процитированной литературы
Патентные документы
[Патентный Документ 1] Международная публикация № 96/34878
[Патентный Документ 2] Международная публикация № 2011/007747
Непатентная литература
[Непатентная литература 1] Xianzhang Bu. et al.: Tetrahedron Letters (2002) 43:2419-2422
[Непатентная литература 2] HutloffA. et al.: Nature (1999) 397:263-266
Сущность изобретения
Техническая проблема
Как указано выше, необходим способ синтеза, в котором возможно предотвратить деградацию сиаловой кислоты на сахарной цепи в Boc-способе твердофазного синтеза. Авторы настоящего изобретения нашли способ синтеза гликопептида, имеющего сиалированную сахарную цепь, путем защиты карбоксильной группы сиаловой кислоты на сахарной цепи с помощью определенного соединения в процессе твердофазного синтеза. Однако если в Boc-способе твердофазного синтеза используется сверхсильная кислота, сиаловая кислота на сахарной цепи невосстанавливающего конца не может быть полностью сохранена, даже когда используются эти защитные группы, а гликопептид, имеющий сиалированную сахарную цепь, не может быть получен с желаемым выходом.
Соответственно, в настоящем изобретении предлагается способ синтеза гликопептида, имеющего представляющую интерес сиалированную сахарную цепь, с высоким выходом в способе твердофазного синтеза гликопептида, с использованием Вос-группы, без деградации сиаловой кислоты на невосстанавливающем конце сахарной цепи.
Кроме того, в настоящем изобретении предлагается способ изготовления гликопептида в тиоэфирной форме в способе твердофазного синтеза с использованием Вос-группы гликопептида, имеющего сиалированную сахарную цепь.
Решение проблемы
В результате интенсивных исследований, проведенных авторами настоящего изобретения для решения указанных выше проблем, стало возможным значительно улучшить выход гликопептида, имеющего сиалированную сахарную цепь, даже в Boc-способе твердофазного синтеза путем применения фенацильной группы в качестве защитной группы карбоксильной группы сиаловой кислоты на невосстанавливающем конце сахарной цепи.
Другими словами, настоящее изобретение относится к способу изготовления гликопептида, имеющего сиалированную сахарную цепь, который включает следующие стадии:
(1) связывания смолы, имеющей гидроксильную группу, с аминокислотой, у которой азот аминогруппы защищен Вос-группой;
где указанная стадия связывания является стадией связывания гидроксильной группы указанной смолы с карбоксильной группой указанной аминокислоты путем реакции этерификации;
(2) образования свободной аминогруппы путем отсоединения Вос-группы;
(3) повтор, по меньшей мере, однократно, следующих стадий (i) и (ii):
(i) элонгации аминокислоты, связанной со смолой, путем дополнительного связывания другой аминокислоты, у которой азот аминогруппы защищена Вос-группой, где указанная стадия элонгации является стадией связывания карбоксильной группы указанной другой аминокислоты с указанной свободной аминогруппой аминокислоты, связанной с указанной смолой.
(ii) образования свободной аминогруппы путем отсоединения указанной в (i) Вос-группы; и
(4) гидролиза смолы с помощью кислоты;
где указанная аминокислота в стадии (1) и/или указанная другая аминокислота, по меньшей мере, единожды в (i) стадии (3) является гликозилированной аминокислотой, где указанная гликозилированная аминокислота имеет сиаловую кислоту, по меньшей мере, на одном из невосстанавливающих концов сахарной цепи, а карбоксильная группа указанной сиаловой кислоты защищена с помощью фенацильной группы.
Одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что указанная гликозилированная аминокислота имеет сахарную цепь, связанную с аспарагином, или сахарную цепь, муцинового типа.
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что указанная кислота в указанной стадии (4) является смешанной кислотой, трифторуксусной кислотой/трифторметансульфоновой кислотой/диметилсульфидом/m-крезолом.
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что указанная аминокислота в указанной стадии (1) и/или указанная другая аминокислота, по меньшей мере, однажды в (i) указанной стадии (3) является лабильной к щелочи еприродной аминокислотой.
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что, по меньшей мере, одна из указанных гликозилированных аминокислот является сиалилгликоаспарагином, а указанный сиалилгликоаспарагин имеет 6 или большее количество сахарных остатков.
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что, по меньшей мере, одна из указанных гликозилированных аминокислот является сиалилгликоаспарагином, а указанный сиалилгликоаспарагин имеет от 9 до 11 сахарных остатков.
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению, характеризуется тем, что, по меньшей мере, указанные гликозилированные аминокислоты являются сиалилгликоаспарагином, а указанный гликоаспарагин имеет 6 или большее количество сахарных остатков и имеет биантенарную сахарную цепь, присоединенную к нему.
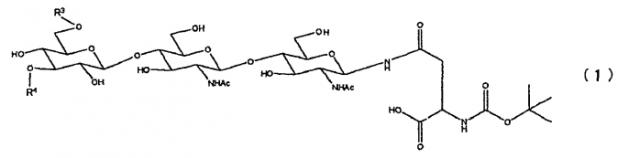
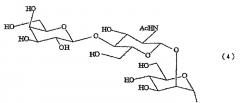
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что указанная гликозилированная аминокислота представлена формулой (I):
Химическая формула 1
где один из R3 и R4 является (2), а другой является группой, выбранной из группы, состоящей из атома водорода и групп, показанных в формулах (2)-(6).
Химическая формула 2
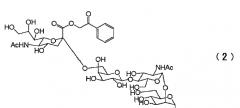
Химическая формула 3
Химическая формула 4
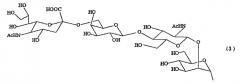
Химическая формула 5
Химическая формула 6
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется дополнительным включением стадии связывания тиольного соединения со смолой перед указанной стадией (1).
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется дополнительным включением стадии (5) связывания тиоэфирной формы гликопептида, имеющего сиалированную сахарную цепь, с пептидным фрагментом или гликопептидным фрагментом.
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется дополнительным включением стадии, позволяющей метящему агенту вступить в реакцию перед гидролизом смолы с помощью кислоты в указанной стадии (4).
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что метящим агентом является дансилгалид.
Кроме того одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что для реакции конденсации указанной аминокислоты и/или реакции отсоединения Bac-группы, по меньшей мере, в одной из указанных стадий (1)-(3) осуществляется воздействие микроволнами.
Кроме того, одно воплощение способа изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению характеризуется тем, что дополнительно содержит стадию снятия защиты фенацильной группы, защищающей карбоксильную группу указанной сиаловой кислоты, после указанной стадии (4).
Кроме того, другой аспект настоящего изобретения относится к гликопептиду, имеющему сиалированную сахарную цепь, полученному с помощью вышеуказанного способа изготовления.
Кроме того, другой аспект настоящего изобретения относится к способу изготовления производного сиалилгликоаспарагина, в котором аминогруппа сиалилгликоаспарагина защищена Вос-группой, а карбоксильная группа сиаловой кислоты на невосстанавливающем конце сахарной цепи защищена фенацильной группой, включающему стадии: введения фенацильной группы в производное сиалилгликоаспаспарагина, имеющего аминогруппу аспарагина, защищенную липофильной защитной группой, отщепления липофильной защитной группы сиалилгликоаспарагина, имеющего введенную фенацильную группу, и введение Вос-группы, в сиалилгликоаспарагин, от которого отщеплена липофильная защитная группа.
Кроме того, одно воплощение способа изготовления производного сиалилгликоаспарагина по настоящему изобретению характеризуется тем, что указанной липофильной защитной группой является Fmoc.
Кроме того, в одном воплощении настоящего изобретения гликопептид, изготовленный способом настоящего изобретения для изготовления гликопептида, имеющего сиалированную сахарную цепь, является гликопептидом, имеющим аминоксилотную последовательность, эквивалентную аминокислотной последовательности эритропоэтина и имеющего, по меньшей мере, одну или несколько сиалированных сахарных цепей в любом положении. Кроме того, в одном воплощении настоящего изобретения гликопептид, изготовленный способом настоящего изобретения для изготовления гликопептида, имеющего сиалированную сахарную цепь, является частью гликопептида (т.е. гликопептидного фрагмента), имеющего аминокислотную последовательность, эквивалентную аминокислотной последовательности эритропоэтина, и имеющего, по меньшей мере, одну или несколько сиалированных сахарных цепей в любом положении.
Аминокислотная последовательность, эквивалентная аминокислотной последовательности эритропоэтина, в данном документе относится к аминокислотной последовательности, которая имеет функцию эритропоэтина после сворачивания и имеет делецию, замену или вставку одной или нескольких аминокислот в аминокислотную последовательность эритропоэтина.
Преимущество изобретения
Согласно способу изготовления гликопептида, имеющего сиалированную сахарную цепь, по настоящему изобретению, гликопептид, имеющий сиаловую кислоту на невосстанавливающем конце сахарной цепи, может быть прямо получен Вос-способом твердофазного синтеза. Более того, из-за того, что Вос-группа используется в качестве защитной группы для аминогрупп аминокислот, также возможно получить гликопептид с лабильной к щелочам неприродной аминокислотой.
Гликопептиды, имеющие фактически единообразную структуру сахарной цепи, могут быть синтезированы в больших количествах химическим синтезом, таким как твердофазный синтез с Boc. Такой гликопептид, имеющий единообразную структуру сахарной цепи, является постоянным по качеству и особенно предпочтителен в областях, таких как изготовление фармацевтических агентов и тестов.
Краткое описание чертежей
Фигура 1 является схематическим чертежом, демонстрирующим технологическую схему аспекта одного воплощения настоящего изобретения, который является способом получения аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин (TN(дифенацил-дисиало сахарная цепь)YSVTDLNY) с помощью Вос-способа твердофазного синтеза с использованием интерферона гамма (INFγ) в качестве модельного пептида.
Фигура 2 демонстрирует профиль ВЭЖХ, в аспекте одного воплощения настоящего изобретения, которое является получением аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин (TN(дифенацил-дисиало сахарная цепь)YSVTDLNY) с помощью Вос-способа твердофазного синтеза с использованием интерферона гамма (INFγ) в качестве модельного пептида.
Фигура 3 является схематическим чертежом, демонстрирующим технологическую схему аспекта одного воплощения настоящего изобретения, которая является способом получения аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин (SLQN(дифенацил-дисиало сахарная цепь)ASAIES) с помощью Вос-способа твердофазного синтеза с использованием интерлейкина 3 (IL-3) в качестве модельного пептида.
Фигура 4 демонстрирует профиль ВЭЖХ, в аспекте одного воплощения настоящего изобретения, которое является получением аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин (SLQN(дифенацил-дисиало сахарная цепь)ASAIES) с помощью Вос-способа твердофазного синтеза с использованием интерлейкина 3 (IL-3) в качестве модельного пептида.
Фигура 5 является схематическим чертежом, демонстрирующим одно воплощение настоящего изобретения, которое является частью стадии способа изготовления аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин, с использованием эритропоэтина в качестве модельного пептида. В частности, она является схематическим чертежом, демонстрирующим стадию связывания фрагмента А, имеющего аминокислотную последовательность 1-21 аминокислот эритропоэтина, с фрагментом В, имеющим аминокислотную последовательность 22-49 аминокислот эритропоэтина для получения фрагмента (А+В).
Фигура 6 является схематическим чертежом, демонстрирующим одно воплощение настоящего изобретения, которое является частью способа изготовления аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин, с использованием эритропоэтина в качестве модельного пептида. В частности, она является схематическим чертежом, демонстрирующим стадию связывания фрагмента Е, имеющего аминокислотную последовательность 98-127 аминокислот эритропоэтина с фрагментом F, имеющим аминокислотную последовательность 128-166 аминокислот эритропоэтина, для получения фрагмента (E+F), и стадии преобразования N-концевого тиазолидинового производного цистеина фрагмента (E+F) в цистеин.
Фигура 7 является схематическим чертежом, демонстрирующим одно воплощение настоящего изобретения, которое является частью стадии способа изготовления аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин, с использованием эритропоэтина в качестве модельного пептида. В частности она является схематическим чертежом, демонстрирующим стадию связывания фрагмента (Е+F), имеющего аминокислотную последовательность 98-166 аминокислот эритропоэтина с фрагментом D, имеющим аминокислотную последовательность 79-97 аминокислот эритропоэтина, для получения фрагмента (D+Е+F), стадию преобразования N-концевого тиазолидинового производного цистеина фрагмента (D+Е+F) в цистеин, и стадию удаления фенацильной группы на сиаловой кислоте сахарной цепи и формильной группы (СНО), которая является защитной группой Trp.
Фигура 8 является схематическим чертежом, демонстрирующим одно воплощение настоящего изобретения, которое является частью стадии способа изготовления аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин, с использованием эритропоэтина в качестве модельного пептида. В частности, она является схематическим чертежом, демонстрирующим стадию связывания фрагмента (D+Е+F) имеющего аминокислотную последовательность 79-166 аминокислот эритропоэтина с фрагментом С, имеющим аминокислотную последовательность 50-78 аминокислот эритропоэтина для получения фрагмента (С+D+Е+F), стадию восстановления цистеина, использованную для лигирования в аланин, и стадию преобразования N-концевого тиазолидинового производного-цистеина фрагмента (С+D+Е+F) в цистеин.
Фигура 9 является схематическим чертежом, демонстрирующим одно воплощение настоящего изобретения, которое является частью стадии способа изготовления аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин с использованием эритропоэтина в качестве модельного пептида. В частности, она является схематическим чертежом, демонстрирующим стадию связывания фрагмента (С+D+Е+F), имеющего аминокислотную последовательность 50-166 аминокислот эритропоэтина с фрагментом (А+В), имеющим аминокислотную последовательность аминокислот 1-49 эритропоэтина для получения фрагмента (А+В+С+D+Е+F).
Фигура 10 является схематическим чертежом, демонстрирующим одно воплощение настоящего изобретения, которое является частью стадии способа изготовления аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин с помощью эритропоэтина в качестве модельного пептида. В частности, она является схематическим чертежом, демонстрирующим стадию преобразования цистеина, использованную для лигирования в аланин в фрагменте (А+В+С+D+Е+F), имеющем аминокислотную последовательность 1-166 аминокислот эритропоэтина.
Фигура 11 является схематическим чертежом, демонстрирующим одно воплощение настоящего изобретения, которое является частью стадии способа изготовления аминокислотной последовательности, имеющей биантенарный дисиалогликоаспарагин, с использованием эритропоэтина в качестве модельного пептида. В частности она является схематическим чертежом, демонстрирующим стадию снятия защитной группы цистеина в фрагменте (А+В+С+D+Е+F), имеющем аминокислотную последовательность 1-166 аминокислот эритропоэтина.
Описание воплощений
«Аминокислота» в данном документе используется в наиболее широком значении, и включает не только природные аминокислоты, но также неприродные аминокислоты, такие как варианты или производные аминокислот. Специалисты в данной области учтут данное широкое определение для понимания примеров аминокислот в данном документе, включая естественные протеиногенные L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как варианты и производные аминокислот; природные непротеиногенные аминокислоты, такие как норлейцин, β-аланин и орнитин; и химически синтезированные соединения, имеющие свойства, хорошо известные в данной области, которые являются характерной особенностью аминокислот. Примеры неприродных аминокислот в данном документе включают α-метиламинокислоты (такие как α-метилаланин), D-аминокислоты, гистидин-подобные аминокислоты (такие как 2-амино-гистидин, β-гидроксигистидин, гомогистидин, α-фторметил-гистидин и α-метил-гистидин), аминокислоты, имеющие экстраметилен на боковой цепи («гомо» аминокислоты), и аминокислоты, в которых функциональная группа карбоновой кислоты в боковой цепи замена на группу сульфоновой кислоты (такой как цистеиновая кислота). В предпочтительном аспекте аминокислота, содержащаяся в соединении настоящего изобретения, включает неприродную аминокислоту.
«Сахарная цепь» в данном документе относится к соединению, состоящему из одной или нескольких сахарных единиц (моносахарида и/или его производного), расположенных в ряд. Когда в ряду два или большее количество сахаров, связь между каждой сахарной единицей образуется в результате конденсации с дегидратацией с образованием гликозидной связи. Примеры такой сахарной цепи, включают, без ограничения перечисленным, широкий спектр, такой как моносахариды и полисахариды, встречающиеся in vivo (глюкоза, галактоза, манноза, фукоза, ксилоза, N-ацетилглюкозамин, N-ацетилгалактозамин, сиаловая кислота а также их комплексы и производные), деградированные полисахариды, гликопротеины, протеогликаны, глюкозаминогликаны и сахарные цепи, деградированные или индуцированные из комплексных биомолекул, таких как гликолипиды. Сахарная цепь может быть линейного или разветвленного типа.
«Сахарная цепь» в данном документе также включает производное сахарной цепи, а примеры производного сахарной цепи включают, без ограничения перечисленным, сахарные цепи, в которых сахар, составляющий сахарную цепь, является сахаром, имеющим карбоксильную группу (например, альдоновую кислоту, в которой положение С-1 окислено до карбоновой кислоты (например, D-глюконовой кислоты, которая является окисленной D-глюкозой) и уроновой кислоты, в которой концевой атом С включен в карбоновую кислоту (D-глюкуроновая кислота, которая является окисленной D-глюкозой)), сахара, имеющие аминогруппу или производное аминогруппы (например, ацетилированную аминогруппу) (например, N-ацетил-D-глюкозамин, и N-ацетил-D-галактозамин), сахара, имеющие как аминогруппу и карбоксильную группу (например, N-ацетилнейраминовая кислота (сиаловая кислота) и N-ацетилмураминовая кислота), восстановленные сахара (например, 2-деокси-D-рибоза), сульфатированные сахара, содержащие сульфатную группу, и фосфорилированные сахара, содержащие фосфатную группу.
Производное сахарной цепи в данном документе также включает соединения, в которых другие соединения были связаны с восстановливающим концом сахарной цепи конденсацией с дегидратацией и т.п. Пример может включать структуру, в которой соединение дополнительно связано с N-ацетилглюкозамином на восстанавливающем конце сахарной цепи в аспарагин-связанной сахарной цепи. Соединение может быть просто добавлено к восстанавливающему концу также в случае других производных сахарной цепи.
Производные сахарной цепи включают те, в которых аминокислота добавлена на восстанавливающем конце сахарной цепи (гликозилированная аминокислота), а также те, в которых добавлены пептид, белок, линкер, флуоресцентная группа, липид, низкомолекулярное соединение, радиоактивное соединение или т.п. Аминокислота включает не только природные аминокислоты, но также неестественные аминокислоты, такие как варианты и производные аминокислот. Аминокислоты, пептиды, белки и т.п., могут быть теми, в которых часть или все функциональные группы, содержащиеся в них, такие как гидроксильная группа, аминогруппа и карбоксильная группа, защищены посредством защитной группы. Примеры защитных групп для гидроксильной группы могут включать метильную группу, бензильную группу, бензоильную группу, ацетильную группу, триметилсилильную (TMS) группу, триэтилсилильную (TES) группу, и трет-бутилдиметилсилильную (TBS или TBDMS) группу. Примеры аминозащитной группы могут включать, в качестве липофильной защитной группы, карбонатную или амидную защитную группу, такую как 9-флуоренилметоксикарбонильная (Fmoc) группа, t-бутилоксикарбонильную (Boc) группу, бензильную группу, аллилоксикарбонильную группу, ацетильную группу.
В данном документе при изготовлении гликопротеинов, становящихся фармацевтическими агентами, предпочтительными сахарными цепями являются сахарные цепи, которые присутствуют in vivo в гликоконъюгатах (таких как гликопептиды (или гликопротеины), протеогликанах, или гликолипидах), предпочтительно сахарные цепи, которые связаны in vivo с пептидами (или белками) в гликопептидах (или гликопротеинах), таких как N-связанные сахарные цепи и O-связанные сахарные цепи. N-связанная сахарная цепь является общим термином формата связывания, в котором сахарная цепь связана с белком, и относится к сахарной цепи, в которой аномерная гидроксильная группа в N-ацетилглюкозамин на восстанавливающем конце сахарной цепи конденсируется и связывается с аминогруппой (-NH2) боковой цепи аспарагина, а O-связанная сахарная цепь является общим термином формата связывания, в котором сахарная цепь связывается с белком и относится к сахарной цепи, в которой аномерная гидроксильная группа на восстанавливающем конце сахарной цепи конденсируется и связывается с гидроксильной группой (-ОН) боковой цепи серина или треонина.
N-связанная сахарная цепь также иногда называется аспарагин-связанная сахарная цепь, гликоаспарагин или сахарная цепь N-типа и т.п. N-связанная сахарная цепь является группой сахарной цепи, имеющей Man(β1-4)GlcNac(β1-4)GlcNac в качестве ядра основного остова. Более того, сильноразветвленные структуры, такие как биантенарные, триантенарные и тетраантенарные также известны как разветвленные структуры сахарной цепи и сахарной цепи, имеющей такие разветвленные структуры, также включены. Эти структуры сахарных цепей также описаны, например, в Словаре Биохимии (Seikagaku Jiten) (3rd Ed., Published by Tokyo Kagaku Dojin).
Кроме того, также включено соединение, существующее в виде N-связанной сахарной цепи комплексного типа, в котором Fuc (фукоза) или Gn (N-ацетилглюкозамин) связаны с вышеуказанной сахарной цепью также. Более конкретно, известно, что Fuc образует α1,6 связь с Gn на восстанавливающем конце, Gn образует β1,4 связь в положение 4 Man, связанной с Gn на восстанавливающем конце, а Fuc образует α1,3 или α1,4 связь с Gn в разветвленной части. Кроме того, также включены сахарные цепи, имеющие различные виды связывания гликозидной связи, такие как соединение, в котором видом связывания вышеуказанной сахарной цепи в ветвящейся части является Gn(β1,4)Man или Gn(β1,2)Man вместо Gn(β1,6)Man, или является Gn(β1,2)Man вместо Gn(β1,4)Man, соединение, в котором часть Sia(α2,6)Gal в участке связывания сиаловой кислоты является Sia(α2,3)Gal вместо Sia(α2,6)Gal, соединение, в котором часть Sia(α2,3)Gal является Sia(α2,6)Gal вместо Sia(α2,3)Gal.
В данном документе Gn или GlcNAc обозначают N-ацетилглюкозамин, Man обозначает маннозу, a Gal обозначает галактозу.
«Гликозилированная аминокислота» в данном документе обозначает аминокислоту, имеющую связанную с ней сахарную цепь, примеры которой могут включать N-связанные и O-связанные сахарные цепи, описанные выше. Сахарная цепь и аминокислота могут быть связаны через линкер. КУчасток связывания между сахарной цепью и аминокислотой никак конкретно не огрнаеичивается, но предпочтительно, если аминокислота связана с восстанавливающим концом сахарной цепи.
Тип аминокислоты, с которой связана сахарная цепь, никак конкретно не ограничен, примеры включают предпочтительно Asn, Ser, Cys, и Lys, более предпочтительно - Asn.
Если сахарная цепь и аминокислота связаны через линкер, то тип линкера никак конкретно не ограничен, примеры могут включать NH-(CO)-(CH2)a-CH2- (где а обозначает число, которое не ограничено при условии, что оно не затрудняет основную функцию линкера, предпочтительно число от 0 до 4), C1-10 полиметилен, и -CH2-R- (где R является группой, полученную из группы, от которой отсоединен водород, которая выбрана из групп, включающих алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, карбоциклическую группу, замещенную карбоклическую группу, гетероциклическую группу и замещенную гетероциклическую группу).
«Сиалированная сахарная цепь» в данном документе обозначает сахарную цепь, имеющую сиаловую кислоту, по меньшей мере, на одном из невосстанавливающих концов вышеуказанной сахарной цепи. Соответственно, например, в случае тетраантенарной аспарагин-связанной сахарной цепи, она содержит тетрасиало, трисиало, дисиало или моносиало форму, имеющую одну или большее количество сиаловых кислот на невосстанавливающем конце, в случае триантенарной аспарагин-связанной сахарной цепи, она содержит трисиало, дисиало или моносиало форму, имеющую одну или большее количество сиаловых кислот на невосстанавливающем конце, а в случае биантенарной аспарагин-связанной сахарной цепи, она содержит дисиало или моносиало форму, имеющую одну или большее количество сиаловых кислот на невосстанавливающем конце. Более того, положение невосстанавливающего конца, на котором находится сиаловая кислота, не ограничено.
«Сиаловая кислота» в данном документе является названием семейства, которое, в общем, относится к веществу, в котором замещена амино или гидроксигруппа нейраминовой кислоты. Кроме того, «нейраминовая кислота» являет