Фармацевтическая композиция для ингибирования апоптоза нейронов или нейродегенерации
Иллюстрации
Показать всеИзобретение относится к применению соединения формулы I
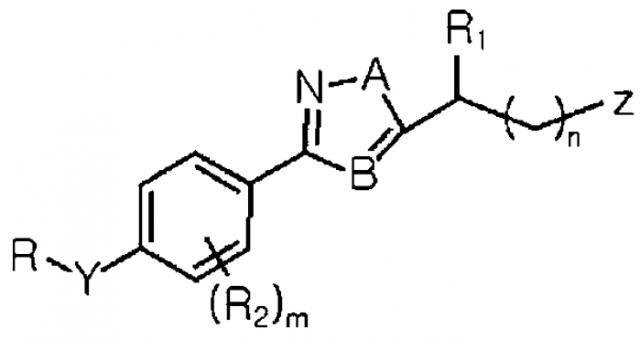
Формула I
где R представляет собой С7-С15 фенилалкильную группу; Y является О; R1 и R2 являются Н; А является О; В является С; Z является -OC(=O)NR3R4; каждый из R3 и R4 является Н; m и n являются 0, его фармацевтически приемлемой соли, изомера, сольвата или гидрата или любой их комбинации для изготовления лекарственного средства для предупреждения или лечения заболеваний, выбранных из группы, состоящей из удара, болезни Альцгеймера, болезни Хантингтона, болезни Пика, болезни Крейтцфельда-Якоба, комплекса Паркинсон-БАС-слабоумие, болезни Уилсона, рассеянного склероза, прогрессирующего надъядерного паралича, биполярных расстройств, связанных с невропатической болью, кортико-базальной дегенерации, шизофрении, синдрома гиперактивности с дефицитом внимания (ADHD), слабоумия, амиотрофического латерального склероза, болезни сетчатки, эпилепсии, апоплексии, преходящего нарушения мозгового кровообращения, ишемии миокарда, мышечной ишемии, ишемии, вызванной хирургическим вмешательством, требующим длительного прекращения подачи крови к мозгу, повреждения головы, повреждения спинного мозга, гипоксии и депрессии. 2 н. и 1 з.п. ф-лы, 12 пр., 1 табл., 24 ил.
Реферат
Область техники
В данной заявке заявлен приоритет заявки на патент Кореи № 10-2010-0041436, поданной 3 мая 2010, в Korean Intellectual Property Office, описание которой включено в настоящее описание в качестве ссылки.
Данное изобретение относится к фармацевтической композиции для ингибирования апоптоза нейронов или нейродегенерации.
Уровень техники
Апоптоз нейронов может быть вызван при обычных физиологических функциях, таких как развитие нервной системы, или при патологических процессах, таких как заболевания. Во время процесса развития нейронов избыток нейронов удаляют посредством апоптоза для оптимальной точной связи между пресинапсом и постсинапсом (Neuron, 40:401-413(2003); Neuron, 20:633-647(1998)). Широкий спектр апоптоза нейронов наблюдают при нейродегенеративных заболеваниях, таких как амиотрофический латеральный склероз, болезнь Альцгеймера и болезнь Паркинсона, удар и внешние повреждения. Прямые причины этих заболеваний еще не найдены, однако они связаны с апоптозом, и на апоптоз влияют различные факторы, такие как окислительный стресс, дисрегулирование гомеостаза кальция, дисфункция митохондрий, повышение образования реакционно-способных видов кислорода, эксайтотоксичность, активация каспазы и трофические поражения (Nature Reviews Molecular Cell Biology, 1:120-130(2000), Neurotoxicology and Teratology, 24:675-682(2002)).
При болезни Паркинсона описано, что дисфункция митохондрии повышает секрецию кальция и дегенерацию реакционно-способных видов кислорода, тем самым вызывая окислительный стресс для снижения активности антиокислительных систем. Кроме того, имеется доклад, касающийся связи между эксайтотоксичностью глутаматом и болезнью Паркинсона (Neurotoxicology and Teratology, 24:675-682(2002)).
При болезни Альцгеймера описано, что апоптоз нейронов связан с окислительным стрессом, дисрегулированием гомеостаза ионов, депривацией фактора роста, аккумуляцией амилоида Aβ, ухудшением метаболизма, дисфункцией митохондрии и агрегацией белка (Nat. Rev. Neurosci., 7:278-294(2006); Cerebellum, 2:270-278(2003)).
В настоящее время предложены различные типы нейропротекторных агентов, применяемых для защиты нейронов от апоптоза, вызванного различными механизмами (Neurotoxicology and Teratology, 24:675-682(2002)). Примеры нейропротекторных агентов включают антиоксиданты, хелатирующие ион агенты, ловушки свободных радикалов, нейротрофические факторы, возбуждающие антагонисты аминокислоты, биоэнергетические добавки, иммунодепрессанты и композиции, предотвращающие агрегацию или аккумуляцию белка. Однако лекарственные средства, которые эффективно ингибируют апоптоз нейронов или нейродегенерацию, все еще не являются коммерчески доступными, и таким образом, все еще сохраняется необходимость в разработке фармацевтической композиции для ингибирования апоптоза нейронов или нейродегенерации.
Описание изобретения
Техническая проблема
В данном изобретении представлена фармацевтическая композиция для ингибирования апоптоза нейронов или нейродегенерации.
В данном изобретении также представлена фармацевтическая композиция для нейропротекции или восстановления функции нервной ткани.
Дополнительные аспекты представлены частично в описании, представленном ниже, и частично будут очевидны из описания или могут быть изучены при практическом осуществлении представленных вариантов.
Решение проблемы
Далее данное изобретение подробно описано со ссылкой на приложенные чертежи.
В данном изобретении представлена фармацевтическая композиция для ингибирования апоптоза нейронов или нейродегенерации, включающая терапевтически эффективное количество соединения, выбранного из группы, состоящей из замещенного производного азола, представленного формулой 1 ниже, его фармацевтически приемлемых солей, изомеров замещенного производного азола, сольватов замещенного производного азола, и их сочетания; и фармацевтически приемлемый носитель.
В данном изобретении также представлена фармацевтическая композиция для нейропротекции, включающая терапевтически эффективное количество соединения, выбранного из группы, состоящей из замещенного производного азола, представленного формулой 1 ниже, его фармацевтически приемлемых солей, изомеров замещенного производного азола, сольватов замещенного производного азола, и их сочетания; и фармацевтически приемлемый носитель.
В данном изобретении также представлена фармацевтическая композиция для восстановления функций нервной ткани, включающая терапевтически эффективное количество соединения, выбранного из группы, состоящей из замещенного производного азола, представленного формулой 1 ниже, его фармацевтически приемлемых солей, изомеров замещенного производного азола, сольватов замещенного производного азола, и их сочетания; и фармацевтически приемлемый носитель.
В данном изобретении также представлена фармацевтическая композиция для предупреждения или лечения нейродегенеративных заболеваний или заболеваний, связанных с ишемией или реперфузией, где композиция включает терапевтически эффективное количество соединения, выбранного из группы, состоящей из замещенного производного азола, представленного формулой 1 ниже, его фармацевтически приемлемых солей, изомеров замещенного производного азола, сольватов замещенного производного азола, и их сочетания; и фармацевтически приемлемый носитель.
В данном изобретении также представлена фармацевтическая композиция для предупреждения или лечения заболеваний, выбранных из группы, состоящей из удара, болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона, болезни Пика, болезни Крейтцфельда-Якоба, комплекса Паркинсон-БАС-слабоумие, болезни Уилсона, рассеянного склероза, прогрессирующего надъядерного паралича, биполярных расстройств, связанных с невропатической болью, кортико-базальной дегенерации, шизофрении, синдрома гиперактивности с дефицитом внимания (ADHD), слабоумия, амиотрофического латерального склероза, болезни сетчатки, эпилепсии, апоплексии, преходящего нарушения мозгового кровообращения, ишемии миокарда, мышечной ишемии, ишемии, вызванной хирургическим вмешательством, требующим длительного прекращения подачи крови к мозгу, повреждения головы, повреждения спинного мозга, гипоксии и депрессии, где композиция включает терапевтически эффективное количество соединения, выбранного из группы, состоящей из замещенного производного азола, представленного формулой 1 ниже, его фармацевтически приемлемых солей, изомеров замещенного производного азола, сольватов замещенного производного азола, и их сочетания; и фармацевтически приемлемый носитель.
Формула I
где R выбран из группы, состоящей из замещенной или незамещенной C1-C15 арилалкильной группу, замещенной или незамещенной C1-C10 гетероарилалкильной группу и замещенной или незамещенной, линейной, разветвленной или циклической C1-C10 алкильной группы;
Y выбран из группы, состоящей из O и -N-R1;
R1 является, по меньшей мере, одним, выбранным из группы, состоящей из H и линейной или разветвленной C1-C3 алкильной группы;
R2 выбран из группы, состоящей из H и галогена;
A выбран из группы, состоящей из N, O и S;
B является C или N;
Z выбран из группы, состоящей из замещенной или незамещенной гетероциклической группы, карбамата, -OC(=O)NR3R4, NH2, NR5R6, NC(=NH)NH2 и -NC(=O)NH2;
каждый из R3 и R4 независимо выбран из группы, состоящей из H; C1-C5 алкила, незамещенного или замещенного, по меньшей мере, одним заместителем, выбранным из группы, состоящей из NH2 и NR7R8; гетероциклического кольца, незамещенного или замещенного C1-C3 алкилом; или R3 и R4 вместе могут образовывать 5- или 7-членное гетероциклическое кольцо, незамещенное или замещенное C1-C3 алкилом;
каждый из R5 и R6 независимо выбран из группы, состоящей из H; C2-C3 алкена; C2-C3 алкина; и линейного или разветвленного C1-C7 алкила, незамещенного или замещенного, по меньшей мере, одним заместителем, выбранным из группы, состоящей из -OH, -C(O)NH2, C1-C3 алкокси и карбамата, или R5 и R6 вместе могут образовывать замещенный или незамещенный алифатический циклический амин или ароматический циклический амин;
каждый из R7 и R8 независимо является, по меньшей мере, одним, выбранным из группы, состоящей из H и линейной или разветвленной C1-C3 алкильной группы;
m является целым числом в интервале от 0 до 4; и
n является целым числом в интервале от 0 до 5.
Фармацевтическая композиция может включать терапевтически эффективное количество соединения, выбранного из группы, состоящей из замещенного производного азола, представленного формулой 1 ниже, его фармацевтически приемлемых солей, изомеров замещенного производного азола, сольватов замещенного производного азола, и их сочетания.
Термин "лечение" в данном описании включает, у животных, у которых никогда не диагностировали заболевания, расстройства или состояния, вызванные апоптозом нейронов или нейродегенерацией, но у которых имеется риск развития таких заболеваний, расстройств или состояний, предупреждение развития таких болезней, расстройств или состояний, ингибирование развития заболеваний, расстройств или состояний, то есть ингибирование развития заболеваний, расстройств или состояний, и облегчение заболеваний, расстройств или состояний, то есть дегенерацию заболеваний, расстройств или состояний. Поэтому термин "терапевтически эффективное количество" в данном описании относится к достаточному количеству, применяемому для достижения фармакологического действия, описанного выше.
Замещенное производное азола формулы I может быть получено с применением известных соединений или соединений, которые могут быть легко получены из них специалистами в области синтеза соединения в области, к которой относится данное изобретение. Поэтому способ получения замещенного производного азола формулы I, который описан ниже, является примерным вариантом, данным в иллюстративных целях, и порядок стадий в нем может быть селективно изменен, при необходимости, не ограничивая объем данного изобретения.
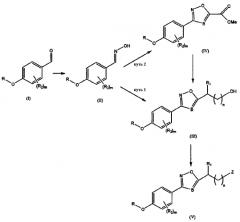
Схема 1: Синтез азола
R может быть бензильной группой, и R2, Z, B, m и n такие, как определены выше. Общий способ синтеза азола может проводиться следующим образом: оксим (II) получают из альдегида (I), применяемого в качестве исходного материала, полученный оксим подвергают [3+2] циклоприсоединению с алкинами или нитрилами в присутствии NaOCl с получением соединения азола (III или IV), и затем желаемые функциональные группы вводят в соединение азола с получением конечного соединения (V).
Схема 2: Синтез тиазола
R может быть бензильной группой и R2, Z, B и m такие, как определены выше. Общий способ синтеза тиазола может проводиться следующим образом: оксатиазолон (VII) получают из амида (VI), применяемого в качестве исходного материала, полученное соединение подвергают [3+2] циклоприсоединению с алкинами или нитрилами в присутствии NaOCl с получением соединения тиазола (VIII), и соединение тиазола восстанавливают (IX), и желаемые функциональные группы вводят туда с получением конечного соединения (X).
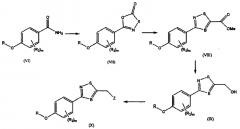
Схема 3:
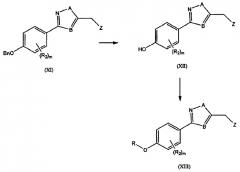
R, R2, Z, A, m и B такие, как определены выше. Общий способ синтеза конечного соединения (XIII) может проводиться следующим образом: производное гидроксифенила (XII) получают дебензилированием соединения (XI), применяемого в качестве исходного материала, и желаемые функциональные группы вводят туда с получением конечного соединения (XIII).
Схема 4:
R, R1, R2, Z, A, m и B такие, как определены выше. Общий способ синтеза конечного соединения (XVI) может проводиться следующим образом: производное аминофенила (XV) синтезируют восстановлением производного нитрофенила (XIV), применяемого в качестве исходного материала, и синтезированное соединение затем подвергают восстановительному аминированию с желаемым альдегидом с получением конечного соединения (XVI).
Производное азола включает, в дополнение к производному азота формулы 1, его фармацевтически приемлемые соли, то есть аддитивные соли кислоты или основания, и их стереохимические изомеры, и солями могут быть любые соли, которые сохраняют активность исходного соединения у пациента, которому их вводят, без нежелательных эффектов. Такими солями могут быть неорганические или органические соли. Примеры солей включают соли уксусной кислоты, азотной кислоты, аспартиновой кислоты, сульфоновой кислоты, серной кислоты, малеиновой кислоты, глутаминовой кислоты, муравьиной кислоты, янтарной кислоты, фосфорной кислоты, фталевой кислоты, дубильной кислоты, винной кислоты, бромистоводородной кислоты, пропионовой кислоты, бензолсульфоновой кислоты, бензойной кислоты, стеариновой кислоты, эзилат, молочной кислоты, бикарбоновой кислоты, бисерной кислоты, бивинной кислоты, щавелевой кислоты, масляной кислоты, эдетат кальция, камзиловой кислоты, карбоновой кислоты, хлорбензойной кислоты, лимонной кислоты, эдетиновой кислоты, толуолсульфоновой кислоты, эдизиловой кислоты, эзиловой кислоты, фумаровой кислоты, глуцептиновой кислоты, памоат, глюконовой кислоты, гликоллиларсанилиновой кислоты, метилазотной кислоты, полигалактуроновой кислоты, гексилрезорциновой кислоты, малоновой кислоты, гидрабаминовой кислоты, хлористоводородной кислоты, йодистоводородной кислоты, гидроксинафтокислоты, изетионовой кислоты, лактобионовой кислоты, миндальной кислоты, эстолевой кислоты, слизевой кислоты, напсиловой кислоты, муконовой кислоты, п-нитрометансульфоновой кислоты, гексамовой кислоты, пантотеновой кислоты, моногидрофосфорной кислоты, дигидрофосфорной кислоты, салициловой кислоты, сульфаминовой кислоты, сульфанилиновой кислоты, метансульфоновой кислоты и теоклиновой кислоты. Также форма щелочной соли включает, например, аммониевую соль, соли щелочных металлов и соли щелочноземельных металлов, такие как соли лития, натрия, калия, магния и кальция, соли органических оснований, такие как соли бензатина, N-метил-D-глюкамина и гидрабамина, и соли, содержащие аминокислоты, такие как аргинин и лизин. Также формы солей могут быть превращены в свободные формы обработкой подходящими основаниями или кислотами. Термин "аддитивная соль" в данном описании означает соли, которые включают сольваты, которые могут образовывать замещенные производные азота формулы 1 или их соли. Сольваты могут быть гидратами или алкоголятами.
В данном описании термин "стереохимические изомеры замещенного производного азола формулы I" относится ко всем возможным формам, которые может иметь замещенное производное азола формулы I. Если не определено или указано иное, химические наименования замещенного производного азола формулы I указывают на смеси всех возможных стереохимических изомеров, включая все диастереомеры и энантиомеры основных молекулярных структур. В частности, каждый хиральный центр может иметь либо R-, либо S-конфигурацию, и заместители на двухвалентных циклических (частично) насыщенных радикалах может иметь цис- или транс-конфигурацию. Соединения, имеющие двойные связи, могут иметь E- или Z-стереохимию. Все стереохимические изомеры замещенного производного азола формулы I включены в объем данного изобретения.
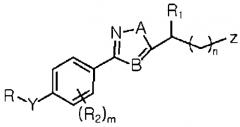
Согласно определению формулы I выше, примеры замещенных производных азола могут включать 3-(4-бензилоксифенил)изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-(4-бензилоксифенил)-[1,2,4]оксадиазол-5-илметиловый эфир карбаминовой кислоты, 3-(4-бензилоксифенил)изотиазол-5-илметиловый эфир карбаминовой кислоты, 3-(4-бензилоксифенил)-[1,2,4]тиадиазол-5-илметиловый эфир карбаминовой кислоты, 3-(4-бензилокси-2-хлорфенил)изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-(4-бензилокси-3-хлорфенил)изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-(4-бензилокси-3-бромфенил)изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-(4-бензилокси-3-фторфенил)изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-(4-бензилокси-3,5-диметилфенил)изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(1-фенилэтокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2-фторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(3-фторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(4-фторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2,6-дифторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2,3-дифторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(3,5-дифторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(3,4-дифторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2,4,6-трифторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(3-трифторметилбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(3-хлорбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2-хлорбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(4-хлорбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2,6-дихлорбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2,5-дихлорбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2-хлор-5-фторбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(3-нитробензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, метиловый эфир 4-[4-(5-карбамоилоксиметилизоксазол-3-ил)феноксиметил]бензойной кислоты, 3-[4-(4-метилбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(2-метилбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты, 3-[4-(3-метоксибензилокси)фенил]изоксазол-5-ил метиловый эфир карбаминовой кислоты, 3-[4-(3-трифторметилбензилокси)фенил]изоксазол-5-илметиловый эфир, 3-[4-(4-изопропилбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты и 3-[4-(4-трет-бутилбензилокси)фенил]изоксазол-5-илметиловый эфир карбаминовой кислоты. Способы получения этих производных азола описаны в заявке на патент Кореи № 2009-15856, поданной авторами данного изобретения, описание которой включено в настоящее описание в качестве ссылки полностью.
Согласно одному из вариантов данного изобретения, замещенным производным азота формулы I может быть 3-(4-бензилоксифенил)изоксазол-5-илметиловый эфир карбаминовой кислоты (CBI), представленный формулой II ниже:
Формула II
Фармацевтическая композиция в соответствии с вариантом данного изобретения может включать фармацевтически приемлемый носитель.
Фармацевтически приемлемый носитель в фармацевтической композиции, который обычно используют в композиции, может включать лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, аравийскую камедь, фосфат кальция, альгинаты, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло, но не ограничены ими. Фармацевтическая композиция также может включать смазывающий агент, смачивающий агент, подсластитель, усилитель вкуса, эмульгирующий агент, суспендирующий агент и консервант. Подходящие фармацевтически приемлемые носители и композиции описаны в Remington's Pharmaceutical Sciences (19th ed., 1995).
Фармацевтическая композиция в соответствии с одним из вариантов данного изобретения может вводиться перорально или парентерально. Парентеральное введение может включать внутривенные инъекции, подкожные инъекции, внутримышечные инъекции, внутрибрюшинные инъекции, эндотелиальное введение, местное введение, интраназальное введение, внутрилегочное введение и ректальное введение. Для перорального введения активное лекарственное средство, сформированное из фармацевтической композиции, может быть покрыто оболочкой, или фармацевтическая композиция может быть составлена для предотвращения переваривания. Кроме того, фармацевтическая композиция может вводиться устройством, способным переносить активное вещество в целевую клетку.
Подходящая доза фармацевтической композиции в соответствии с одним вариантом данного изобретения может зависеть от множества факторов, таких как способы составления композиции, способы введения, возраст пациента, масса тела, пол, патологическое состояние, режим питания, время введения, способ введения, скорость выведения и чувствительность, и доза фармацевтической композиции, которая является эффективной для желаемого лечения или предупреждения, может быть легко определена и прописана обычным лечащим врачом.
Фармацевтическая композиция может быть составлена с применением фармацевтически приемлемого носителя и/или добавки хорошо известным в данной области техники способом, и получена в стандартной лекарственной форме или в многоразовом контейнере. В связи с этим композиция может быть раствором в масле или водной среде, суспензией, эмульгирующим раствором, экстрактом, порошком, гранулами, таблеткой или капсулой, и может также включать диспергирующий или стабилизирующий агент. Кроме того, фармацевтическая композиция может вводиться в виде отдельного лекарственного средства или вместе с другими лекарственными средствами, или может вводиться последовательно или одновременно с ранее существующими лекарственными средствами.
Фармацевтическую композицию применяют для ингибирования смерти нейронов или нейродегенерации.
Термин "нейрон" в данном описании относится к животной клетке, состоящей из клеточного тела, одного из ответвлений, которые выходят из клеточного тела, т.е. аксона или нейрита, и нескольких дендритов, и примеры нейрона могут включать сенсорные нейроны, мотонейроны и интерейроны. Кроме того, нейрон может включать нейроны, составляющие центральную нервную систему, мозг, ствол мозга, спинной мозг и синаптические области центральной нервной системы и периферийной нервной системы, нейроподдерживающие клетки, нейроглию и шванновские клетки.
Термин "смерть нейрона" в данном описании включает смерть нейронов посредством апоптоза. Кроме того, термин "нейродегенерация" в данном описании означает частичную дегенерацию структуры или функций нейронов, включая смерть нейронов.
Тот факт, что апоптоз нейронов или нейродегенерация вызывает различные заболевания мозга, такие как боковой амиотрофический склероз, болезнь Альцгеймера и болезнь Паркинсона, хорошо известен в данной области техники, и проводятся исследования, касающиеся механизма апоптоза нейронов для предупреждения или лечения этих заболеваний. В Nature Reviews Molecular Cell Biology 1:120-130 (2000) и Journal of Cellular and Molecular Medicine,12:2263-2280(2008) описано, что апоптоз нейронов является причиной различных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, ишемия, удар и склероз, и через исследования, касающиеся механизма апоптоза нейронов, вызывающего окислительный стресс и дисфункцию митохондрий, был обнаружен способ предупреждения или лечения нейродегенеративных заболеваний. Таким образом, специалисту в области медицины понятно, что фармацевтическая композиция, включающая соединение, обладающее ингибирующим апоптоз нейронов или нейродегенерацию действием, может применяться для предупреждения или лечения описанных выше заболеваний.
Фармацевтическая композиция согласно одному из вариантов данного изобретения может применяться для нейропротекции.
Термин "нейропротекция" в данном описании означает механизмы в нервной системе, которые защищают нейроны от апоптоза или дегенерации, и в частности, означает снижение, ингибирование или облегчение нервных повреждений, а также означает защиту, восстановление или регенерацию нейронов в нервной ткани, поврежденной нервными повреждениями. Кроме того, термин "нейропротекция" является стандартным термином, который обычно применяется специалистами в области техники, к которой относится данное изобретение (Neuro Report, 9:3955-3959(1998); Chen, J-F., J. Neurosci., 21:RC143(2001)). Термин "защита нервной клетки" в данном описании означает механизмы снижения или облегчения нервного поражения, или механизмы защиты или восстановления нейронов, поврежденных нервным поражением. Кроме того, термин "нервное повреждение" в данном описании означает повреждение нейронов или нервной ткани, вызванное различными факторами (например, метаболическим фактором, токсическим фактором, нейротоксическим фактором и химическим фактором). Примеры нервного повреждения могут включать окислительный стресс, дисрегулирование гомеостаза кальция, дисфункцию митохондрии, эксайтотоксичность, активацию каспазы и алиментарную депривацию (Nature Reviews Molecular Cell Biology 1:120-130(2000), Neurotoxicology and Teratology 24:675-682(2002)). Фармацевтическая композиция обладает действием ингибирования апоптоза нейронов или нейродегенерации такими различными нервными повреждениями, или действием защиты нейронов от нервных повреждений. Например, среди нервных повреждений, описанных выше, окислительный стресс представляет собой заболевание, связанное с апоптозом или дегенерацией нейронов, и может вызывать различные заболевания, такие как болезнь Альцгеймера, боковой амиотрофический склероз, демиелинизирующие заболевания, диабетическая полиневропатия, синдром Дауна, ВИЧ невропатия, болезнь Хантингтона, множественная системная атрофия, болезнь Паркинсона, удар и ишемически-реперфузионное повреждение, таупатия и травматическое повреждение мозга. Также известно, что повышение активности антиокислительного фермента против реакционно-способных видов кислорода является одним из механизмов нейропротекции (Free radical Biology & Medicine, 33(2):182-191(2002)). Поэтому фармацевтическая композиция ингибирует окислительный стресс, вызывая снижение реакционно-способных видов кислорода, тем самым предотвращая апоптоз нейрона, и поэтому может применяться для предупреждения или лечения различных описанных здесь заболеваний.
Следовательно, фармацевтическая композиция может применяться в качестве нейропротекторных терапевтических средств, которые являются лекарственными или химическими средствами, предназначенными для защиты мозга или спинного мозга от повреждения вследствие ишемии, эпилептического припадка, конвульсий или травматических повреждений.
Фармацевтическая композиция в соответствии с данным изобретением может применяться для восстановления функций нервной ткани.
Термин "восстановление функций нервной ткани" в данном описании относится к восстановлению поврежденной нервной системы усилением образования новых синаптических соединений от нейронов. Восстановление функций нервной системы может означать восстановление дисфункции, вызванной поврежденными нейронами. Например, восстановление функций нервной системы может означать образование и рост нейритов из нервной клетки, которые необходимы для коммуникации с окружающими клетками, или повышение количества спинов.
Тот факт, что различные заболевания нервной системы могут быть предотвращены или лечиться восстановлением функций нервной ткани, хорошо известен в данной области. В Neurotoxicity Research, 2:71-84(2000) описана возможность предупреждения или лечения конкретных заболеваний, таких как болезнь Хантингтона, болезнь Паркинсона, боковой амиотрофический склероз и болезнь Альцгеймера, лекарственными средствами, применяемыми для восстановления функций нервной системы, и в WO 07/022182 описано, что заболевания, такие как болезнь Хантингтона и подобные, могут лечиться восстановлением функций центральной нервной системы.
Как описано выше, апоптоз нейронов или нейродегенерация вызывается различными нервными повреждениями и связан с различными нейродегенеративными заболеваниями, и таким образом, фармацевтическая композиция в соответствии с данным изобретением может предотвращать или лечить нейродегенеративные заболевания посредством ингибирования различных нервных повреждений.
Фармацевтическая композиция в соответствии с данным изобретением может применяться для предупреждения или лечения нейродегенеративных заболеваний или заболеваний, связанных с ишемией или реперфузией.
Примеры нейродегенеративных заболеваний, которые могут лечиться фармацевтической композицией, могут включать слабоумие, Болезнь Хантингтона, Болезнь Паркинсона и боковой амиотрофический склероз, но не ограничены ими. Кроме того, примеры заболеваний, связанных с ишемией или реперфузией, которые могут лечиться фармацевтической композицией, могут включать ишемический удар, преходящее нарушение мозгового кровообращения, ишемию миокарда, мышечную ишемию и ишемию, вызванную хирургическими вмешательствами, требующими длительного перекрытия потока крови к мозгу, но не ограничены ими.
Фармацевтическая композиция в соответствии с данным изобретением может применяться для предупреждения или лечения заболеваний, выбранных из группы, состоящей из удара, болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона, болезни Пика, болезни Крейтцфельда-Якоба, комплекса Паркинсон-БАС-слабоумие, болезни Уилсона, рассеянного склероза, прогрессирующего надъядерного паралича, биполярных расстройств, связанных с невропатической болью, кортико-базальной дегенерации, шизофрении, синдрома гиперактивности с дефицитом внимания (ADHD), слабоумия, бокового амиотрофического склероза, болезни сетчатки, эпилепсии, апоплексии, преходящего нарушения мозгового кровообращения, ишемии миокарда, мышечной ишемии, ишемии, вызванной хирургическими вмешательствами, требующими длительного перекрытия потока крови к мозгу, повреждения головы, повреждения спинного мозга, гипоксии и депрессии.
Согласно одному из вариантов данного изобретения, представлен способ лечения заболеваний, связанных с апоптозом нейронов или нейродегенерацией, где способ включает введение субъекту фармацевтической композиции. Способ может включать способ ингибирования апоптоза нейронов или нейродегенерации, включающий введение субъекту фармацевтической композиции. Заболевания могут быть выбраны из группы, состоящей из удара, болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона, болезни Пика, болезни Крейтцфельда-Якоба, комплекса Паркинсон-БАС-слабоумие, болезни Уилсона, рассеянного склероза, прогрессирующего надъядерного паралича, биполярных расстройств, связанных с невропатической болью, кортико-базальной дегенерации, шизофрении, синдрома гиперактивности с дефицитом внимания (ADHD), слабоумия, бокового амиотрофического склероза, болезни сетчатки, эпилепсии, апоплексии, преходящего нарушения мозгового кровообращения, ишемии миокарда, мышечной ишемии, ишемии, вызванной хирургическими вмешательствами, требующими длительного перекрытия потока крови к мозгу, повреждения головы, повреждения спинного мозга, гипоксии и депрессии.
Контактирование может осуществляться in vitro или in vivo, и при осуществлении контактирования in vivo способ может включать введение фармацевтической композиции субъекту.
Субъектом может быть клетка, ткань, орган или индивидуум. Кроме того, введение может проводиться растворением фармацевтической композиции в подходящем буфере с последующим прямым контактированием клетки, ткани или органа с полученным раствором, или парентеральным введением индивидууму. Подробное описание фармацевтической композиции и способа ее введения, применяемых в способе лечения, описанном выше, также представлены выше, и поэтому не представлены здесь во избежании усложнения описания.
Субъекты, которым вводят фармацевтическую композицию, могут включать всех животных. Например, животными могут быть человек, собака, кошка или мышь.
Один или более вариантов данного изобретения более подробно описаны в представленных ниже примерах. Эти примеры представлены только в иллюстративных целях и не ограничивают объем одного или более вариантов данного изобретения.
Краткое описание чертежей
Представленные выше и другие признаки и преимущества данного изобретения станут более очевидными при подробном описании примерных вариантов осуществления со ссылкой на прилагаемые чертежи, в которых:
На ФИГ.1 представлен график, показывающий степень болезни Паркинсона у индуцированных MPTP обезьян, которым вводят CBI, согласно одному из вариантов данного изобретения;
На ФИГ.2 представлены микроскопические изображения, показывающие, существует или нет допаминовый транспортер в центральном полосатом теле и хвостовом полосатом теле у индуцированных MPTP обезьян, которым вводят CBI, согласно одному из вариантов данного изобретения;
На ФИГ.3 представлен график, показывающий результаты теста подвешивания за хвост у индуцированных MPTP обезьян, которым вводят CBI, согласно одному из вариантов данного изобретения;
На ФИГ.4 представлен график, показывающий концентрацию допамина в полосатом теле у индуцированных MPTP мышей, которым вводят CBI, согласно одному из вариантов данного изобретения;
На ФИГ.5 представлен график, показывающий степень снижения нейронов в черной субстанции у индуцированных MPTP мышей, которым вводят CBI, согласно одному из вариантов данного изобретения;
На ФИГ.6 представлен график, показывающий степень снижения нейронов в компактной черной субстанции у индуцированных 6-OHDA крыс, которым вводят CBI, полученный иммуностереохимическим окрашиванием с применением тирозингидроксилазы в качестве антитела, и окрашиванием крезил-виолетом, согласно одному из вариантов данного изобретения;
На ФИГ.7 представлены изображения, показывающие, восстанавливается или нет после повреждения полосатое тело у мышей, индуцированных малонатом, которым вводят CBI, согласно одному из вариантов данного изобретения;
На ФИГ.8 представлен график, показывающий степень восстановления после повреждения поврежденного полосатого тела у мышей, индуцированных малонатом, которым вводят CBI, согласно одному из вариантов данного изобретения;
На ФИГ.9 представлен график, показывающий степень апоптоза в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI, согласно одному из вариантов данного изобретения;
На ФИГ.10 представлен график, показывающий результаты измерения количества мРНК Bcl-2 в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI, согласно одному из вариантов данного изобретения;
На ФИГ.11 представлены изображения, показывающие результаты измерения количества белков Bcl-2 и Bcl-xL в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI, согласно одному из вариантов данного изобретения;
На ФИГ.12 представлен график, показывающий результаты измерения количества мРНК BDNF в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI, согласно одному из вариантов данного изобретения;
На ФИГ.13 представлен график, показывающий результаты измерения количества мРНК GDNF в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI, согласно одному из вариантов данного изобретения;
На ФИГ.14 представлен график, показывающий результаты измерения количества мРНК NGF в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI, согласно одному из вариантов данного изобретения;
На ФИГ.15 представлен график, показывающий результаты измерения количества мРНК NGF у мышей, которым вводят CBI, согласно одному из вариантов данного изобретения;
На ФИГ.16 представлен график, показывающий потенциал мембраны митохондрии в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI и MPP+, согласно одному из вариантов данного изобретения;
На ФИГ.17 представлены изображения, показывающие результаты измерения количества цитоплазмического цитохрома c в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI и MPP+, согласно одному из вариантов данного изобретения;
На ФИГ.18 представлен график, показывающий результаты измерения активности каспазы-3 в SH-SY5Y клетках с дефицитом MAO-B, обработанных CBI и MPP+, согласно одному из вариантов данного изобретения;
На ФИГ.19 пр