Иммунотерапевтический способ лечения рака простаты
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, а именно онкологии, и может быть использовано для лечения рака предстательной железы. Для этого источник полипептида, содержащего ограниченный классом I МНС- и/или классом II МНС Т-клеточный эпитоп нативной блестящей оболочки (zona pellucida) 3 (ZP3) используют для изготовления лекарственного средства для лечения рака предстательной железы. Использование данного изобретения позволяет проводить иммунотерапию с использованием опухоль-ассоциированных антигенов у пациентов, страдающих раком предстательной железы, у которых раковые клетки предстательной железы экспрессируют ZP3. 13 з.п. ф-лы, 6 ил., 2 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с областью лечения рака предстательной железы и его метастазов. Более конкретно, настоящее изобретение связано с иммуногенными полипептидами, содержащими по меньшей мере часть ассоциированного с клетками опухоли предстательной железы (глико)протеина или его иммунологически активных вариантов, а также с нуклеиновыми кислотами, кодирующими такие полипептиды. Последовательности таких полипептидов и нуклеиновых кислот могут быть использованы в вакцинах и фармацевтических композициях для терапевтического и профилактического лечения рака предстательной железы и его метастазов.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак предстательной железы является четвертым по счету из самых распространенных видов рака у мужчин. В Северной Америке и Северной Европе он на сегодняшний день является наиболее распространенной формой рака у мужчин и является второй по счету причиной смерти от видов рака среди мужчин. В одних только Соединенных Штатах более 40000 человек ежегодно умирают от этой болезни, уступая только раку легких. Несмотря на масштабы этих цифр, до сих пор нет эффективного лечения метастазирующего рака предстательной железы. Подавляющее количество клинических данных показывает, что рак предстательной железы человека имеет склонность к метастазированию в кость и обнаруживается неизбежное прогрессирование заболевания от андрогензависимого статуса к невосприимчивому к андрогенам состоянию, что приводит к повышенной смертности пациентов.
Несмотря на значительные исследования в области терапии данного заболевания, рак предстательной железы остается трудно поддающимся лечению. Хирургическая простатэктомия, лучевая терапия, гормональная абляционная терапия, хирургическая кастрация и химиотерапия по-прежнему являются основными способами лечения. К сожалению, эти способы неэффективны в значительном проценте случаев. Возраст и исходное состояние здоровья человека, степень метастазирования, картина, которая видна под микроскопом, и реакция рака на начальную стадию лечения играют важную роль в определении исхода заболевания и потенциальной возможности его лечения. Решение о том, лечить или не лечить локализованный рак предстательной железы (опухоль, которая заключена внутри предстательной железы) с помощью лекарственных средств, связано для пациентов с принятием компромиссных решений между ожидаемыми полезным и вредным последствиями в плане выживаемости пациентов и качества их жизни.
Идентификация новых терапевтических мишеней имеет важное значение для улучшения текущего лечения людей, больных видами рака предстательной железы. Современные достижения в области молекулярной медицины привели к возросшему интересу к опухолеспецифическим антигенам клеточной поверхности, которые могут служить мишенями для различных иммунотерапевтических стратегий или стратегий применения низкомолекулярных соединений.
Среди различных элементов иммунной системы Т-лимфоциты являются, по-видимому, наиболее способными распознавать и устранять клетки, экспрессирующие чужеродные или ассоциированные с опухолью антигены. Цитотоксические Т-лимфоциты (ЦТЛ) экспрессируют маркер CD8 клеточной поверхности и специализированы в отношении индукции лизиса клеток-мишеней, с которыми они реагируют, посредством перфорин/гранзимного и/или Fas/Fas-L-путей. T-клеточный рецептор (TCR) для антигена на клетках ЦТЛ связывается с молекулярным комплексом на поверхности клетки-мишени, образованным низкомолекулярными пептидами (8-11 остатков), полученными из подвергнутых процессингу чужеродных или опухолеассоциированных антигенов, который ассоциирован с молекулами класса I главного комплекса гистосовместимости (MHC).
Другая важнейшая T-клеточная субпопуляция, хелперные T-лимфоциты (T-хелперы, или T-клетки-хелперы), характеризуется экспрессией поверхностного маркера CD4. T-клетки-хелперы распознают несколько более крупные пептиды (11-20 остатков), также полученные из чужеродных или опухолеассоциированных антигенов, но в контексте молекул MHC класса II, которые экспрессируются только специализированными антиген-представляющими клетками (АПК), такими как B-лимфоциты, макрофаги и дендритные клетки (ДК).
Вследствие стимуляции TCR наивных ЦТЛ и T-хелперов комплексами пептид/МНС на клетках АПК, ЦТЛ созревают в эффекторные клетки-киллеры, способные лизировать (опухолевые) клетки, которые экспрессируют соответствующий комплекс пептид/МНС класса I. Активированные T-хелперы усиливают ответы ЦТЛ, делая АПК более эффективными в стимуляции наивных ЦТЛ и в продуцировании лимфокинов, которые стимулируют созревание и пролиферацию ЦТЛ.
Потенцирующий эффект T-клеток-хелперов проявляется как во вторичных лимфоидных органах, в которых инициирован иммунный ответ, так и в опухоли, где ответы ЦТЛ должны быть устойчивыми, пока удаляются опухолевые клетки. Таким образом, можно предсказать, что для выработки эффективного противоопухолевого иммунитета вакцины должны стимулировать как опухолереактивные ЦТЛ, так и Т-хелперы.
Антигены, подходящие для иммунотерапевтических стратегий против рака, должны быть в высокой степени экспрессированы в тканях рака и, в идеале, не должны экспрессироваться в нормальных тканях взрослого человека. При этом, однако, может быть приемлема экспрессия в тканях, которые не являются необходимыми для жизни.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения неожиданно обнаружили, что антигены, подходящие для иммунотерапевтических стратегий при лечении рака предстательной железы и его метастазов, обеспечиваются (глико)протеинами блестящей оболочки (zona pellucida). В соответствии с настоящим изобретением, антигены zona pellucida (ZP-антигены), которые способны индуцировать ответ CD8+ и/или CD4+ T-клеток, также как и последовательности нуклеиновых кислот, кодирующие указанные антигены, могут, соответственно, быть использованы в иммунотерапевтической стратегии для терапевтического и/или профилактического лечения рака предстательной железы.
Настоящее изобретение состоит в обнаружении того, что клетки опухоли предстательной железы характеризуются значительной экспрессией ZP-(глико)протеинов, в такой степени, что указанные клетки являются мишенью для эффективного иммунного ответа, вызванного введением антигенов, полученных из ZP-(глико)протеина, что приводит к снижению роста или даже уменьшению размера первичной опухоли предстательной железы, а также метастазов, источником которых она является. Данная стратегия в равной степени подходит для предотвращения образования метастазов опухоли предстательной железы, а также для предотвращения рецидива опухолей предстательной железы у подвергнутых лечению пациентов.
ZP3 обычно обнаруживаются в так называемой “блестящей оболочке” («zona pellucida»), которая образует внеклеточный матрикс, окружающий развивающийся и овулировавший ооцит и предимплантационный эмбрион. Указанная блестящая оболочка вызывает акросомную реакцию спермы, определяет видоспецифичность при оплодотворении и предотвращает полиспермию у млекопитающих. Блестящая оболочка содержит четыре основных гликопротеина, ZP1, ZP2, ZP3 и ZP4.
Экспрессия (глико)протеина ZP в опухолевых клетках, (полученных) из предстательной железы, никогда прежде не была установлена. Таким образом, в предшествующем уровне техники нет никаких указаний на то, что клетки опухоли предстательной железы фактически могут стать мишенью клеточного иммунного ответа, развивающегося в ответ на введение (полученных из) ZP антигенов.
Таким образом, в настоящем изобретении впервые предложены способы лечения опухолей предстательной железы у человека, включающие в себя иммунизацию указанного человека источником полипептида, содержащего Т-клеточный эпитоп нативной блестящей оболочки, ограниченный классом I MHC или классом II MHC, или его иммунологически активные варианты, а также композициями, подходящими для применения в таких способах лечения. Более подробно настоящее изобретение будет описано ниже.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Первый аспект настоящего изобретения относится к способу лечения рака предстательной железы и его метастазов у субъекта путем индукции первичного иммунного ответа на ZP-(глико)протеины, при этом указанный способ включает в себя стадию введения указанному человеку источника полипептида, причем указанный полипептид содержит Т-клеточный эпитоп нативной блестящей оболочки, ограниченный классом I MHC или классом II MHC, который способен вызвать T-клеточно-опосредованный иммунный ответ in vivo, или его иммунологически активный вариант. В особенно предпочтительном воплощении настоящего изобретения указанный здесь способ является способом терапевтического лечения.
Информация, связанная с названными ZP-гликопротеиновыми компонентами, была весьма противоречива на протяжении многих лет в связи с использованием нескольких критериев, включая молекулярную массу, сравнение длины последовательности белка и идентичности последовательности, которое привело к запутанной номенклатуре. Harris с соавт. [(1994) ДНК seq. 96: 829-834] предложили единую систему номенклатуры, при которой ZP-гены были названы в соответствии с длиной кодируемой ими белковой последовательности, от самой длинной до самой короткой. Поскольку в соответствии с такими критериями мышиные гены ZP располагаются в порядке ZP2, затем ZP1, а потом уже ZP3, была введена новая система, в которой ZP2 обозначен как ZPA, ZP1 обозначен как ZPB, а ZP3 обозначен как ZPC. Позднее Hughes с соавт. [(1999) BBA-Gene Structure and Expression 1447: 303-306], помимо прочих, опубликовали сообщение, согласно которому истинный человеческий ортолог известного мышиного гена ZP1 представляет собой не ZPB, а является особым человеческим геном ZP1. В настоящее время, в общем, принято, что существует четыре (человеческих) семейства ZP-гликопротеинов, ZP1, ZP2, ZP3 и ZPB [ср. Lefievre с соавт. (2004) Hum. Reprod. 19: 1580-1586]. Согласно указанной номенклатуре, гликопротеин ZPB обозначают также ZP4. Такая номенклатура используется, например, в таких базах данных, как Uniprot/SWISSprot, ensEMBL, BLAST (NCBI), SOURCE, SMART, STRING, PSORT2, CD ART, UniGene и SOSUI, все из которых используются в системе Bioinformatic Harvester (http://harvester.embl.de).
В соответствии с этим, используемые здесь термины ZP1, ZP2, ZP3 и ZP4 означают четыре семейства ZP-гликопротеинов, где ZP2, ZP3 и ZP4 соответствуют ZPA, ZPC и ZPB, согласно номенклатуре, предложенной Harris с соавт. Более конкретно, используемые здесь термины hZP1, hZP2, hZP3 и hZP4 относятся к (глико)протеинам, имеющим, соответственно, полипептидные остовы последовательностей SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4, а также их аллельным вариантам.
Таким образом, аллельные варианты последовательностей ZP1, ZP2, ZP3 и ZP4, которые могут встречаться у человека, также охвачены соответствующими терминами, (h)ZP1, (h)ZP2, (h)ZP3 и (h)ZP4. Аллельные варианты включают в себя, в частности, варианты, полученные в результате однонуклеотидных полиморфизмов (ОНП). ОНП могут попадать в число кодирующих последовательностей генов, некодирующих областей генов или межгенных областей между генами. ОНП в пределах кодирующей последовательности необязательно будет вызывать изменение аминокислотной последовательности продуцируемого белка. ОНП, при котором обе формы приводят к образованию одной и той же полипептидной последовательности, называют синонимичным (иногда их называют молчащей мутацией), а если продуцируются разные полипептидные последовательности, их называют несинонимичными. Для того чтобы вариант относился к разряду ОНП, он должен возникать по меньшей мере в 1% случаев в популяции. В контексте настоящего изобретения «аллельные варианты» также могут включать в себя варианты полипептидных последовательностей, происходящие в результате (несинонимичных) мутаций, то есть варианты полипептидов, происходящие в результате точечных мутаций, вставок, делеций, и т.д., возникающих менее чем в 1% случаев в популяции.
Таким образом, в соответствии с настоящим изобретением, используемые здесь термины (h)ZPl, (h)ZP2, (h)ZP3 и (h)ZP4 включают в себя ZP-(глико)протеины, которые отличаются, соответственно, от SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4 минорными модификациями последовательности. Такие модификации включают в себя, но не ограничены изменениями на уровне одной или нескольких аминокислот, включая делеции (например, укороченная версия пептида), вставки и/или замены. Обычно при оптимальном выравнивании, таком как выравнивание с помощью программ GAP или BESTFIT, в которых используются значения параметров по умолчанию, аллельный вариант содержит по меньшей мере определенный процент идентичности последовательности по отношению к указанным выше последовательностям. Использование пробелов и алгоритма глобального выравнивания Needleman и Wunsch для выравнивания двух последовательностей по полной их длине максимизирует число совпадений и минимизирует число пробелов. Обычно используют параметры по умолчанию за пробелы, штраф за создание пробела=8, а штраф за расширение пробела=2. Для белков матрицей подсчета по умолчанию является Blosum62 (Henikoff & Henikoff, 1992, PNAS 89, 915-919). Выравнивание последовательности и оценки степени идентичности последовательностей могут быть определены с помощью компьютерных программ, таких как GCG Wisconsin Package, версия 10.3, доступных в Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752, USA. Альтернативно, процент сходства или идентичности может быть определен путем поиска в базах данных, таких как FASTA, BLAST, и т.д. Здесь под «аллельным вариантом» подразумевается по меньшей мере 90%, предпочтительно, по меньшей мере 95%, более предпочтительно, по меньшей мере 98%, еще более предпочтительно, по меньшей мере 98%, еще более предпочтительно, по меньшей мере 99%, еще более предпочтительно, по меньшей мере 99,5%, и наиболее предпочтительно, по меньшей мере 99,9% идентичность последовательности аминокислот последовательностям SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4.
В данном документе и в формуле изобретения глагол "содержать" и его сочетания используются в неограничивающем смысле, чтобы указать, что элементы, следующие после данного глагола, включены, но при этом элементы, которые не упомянуты, не должны быть исключены. Кроме того, если какой-нибудь элемент указан в единственном числе, это не исключает возможности того, что это относится и к множественному числу, если в контексте специально не указано, что имеется в виду один и только один из таких элементов. Поэтому использование единственного числа обычно означает "по меньшей мере один".
Используемый здесь термин «рак предстательной железы» относится как к первичным опухолям предстательной железы, так и к метастазам указанных первичных опухолей предстательной железы, которые могут возникнуть в любой части организма.
Обычно в целях, преследуемых в настоящем изобретении, используемые здесь термины «рак предстательной железы» или «опухоль предстательной железы» являются синонимичными «неопластическому заболеванию предстательной железы» или «неоплазме предстательной железы». Указанные термины являются полностью взаимозаменяемыми, хотя и следует отметить, что в случае заболеваний определенных тканей, отличных от предстательной железы, используемые здесь термины «неоплазма» и «опухоль» могут считаться не полностью совпадающими. В соответствии с настоящим изобретением, используемый здесь термин «рак предстательной железы», обычно не включает в себя пред-неопластические состояния, такие как гиперплазия, метаплазия, дисплазия или т.п.
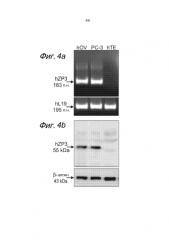
Важным аспектом настоящего изобретения является обнаружение экспрессии ZP-(глико)протеина на (опухолевой) клетке предстательной железы, что позволяет вызвать иммунный ответ против указанных клеток. Тем не менее, как будет понятно специалистам в данной области, поскольку разные опухоли могут иметь различный или измененный характер экспрессии генов, могут возникать также и определенные опухоли предстательной железы, не экспрессирующие в сколько-нибудь значительной степени ZP-(глико)протеины. Следовательно, обычно настоящее изобретение относится к лечению видов рака предстательной железы или их метастазов, экспрессирующих ZP-(глико)протеины, предпочтительно, ZP3.
Способ согласно настоящему изобретению может составлять первичное лечение или же может быть использован в качестве дополнительной терапии в процессе или после лечения пациентов с использованием любых общепринятых способов, включая, например, хирургический, криохирургический способы, лучевую терапию, включая брахитерапию и дистанционную лучевую терапию, высокоинтенсивное сфокусированное ультразвуковое воздействие (HIFU), гормональную терапию или химиотерапию, или же некоторые их комбинации. Однако общеизвестно, что многие из обычно используемых противораковых терапевтических воздействий, в частности химиотерапия и рентгенотерапия, могут вызывать высокую степень иммуносупрессии. Таким образом, специалистам в данной области должно быть понятно, что эффективность описанного здесь способа может быть снижена, если его использовать после указанных терапевтических воздействий.
В настоящем изобретении предложены способы, которые целесообразно использовать для лечения первичного рака предстательной железы и его метастазов, что считается здесь составляющим «терапевтическое воздействие» или «лечебное воздействие», а также для предотвращения метастазов и/или рецидива рака предстательной железы, необязательно после или в сочетании с другими способами лечения, такими как описанные ранее, что считается здесь составляющим «профилактическое воздействие». В особенно предпочтительном воплощении настоящего изобретения способ согласно настоящему изобретению применим в сочетании с хирургическим вмешательством, гормональной терапией и/или с лечением с помощью лекарственного средства, выбранного из доцетаксела, бевацизумаба, талидома, кабзитаксела, абиратерона, темозоломида.
В способах согласно настоящему изобретению субъектом, подвергающимся лечению, предпочтительно является мужчина.
В соответствии с настоящим изобретением, «источником полипептида», который вводят человеку, в соответствии со способом согласно настоящему изобретению, может служить, или же он может включать в себя, белок или гликопротеин, гидролизат такого белка или гликопротеина и/или их фрагментов, которые могут быть представлены в очищенной форме или могут входить в состав неочищенной композиции, предпочтительно, биологической природы, такой как лизаты, гомогенаты, полученные из клеток при воздействии ультразвука, или фиксаты прокариотических или эукариотических клеточных линий. Альтернативно, указанным источником полипептида может быть, или же он может включать в себя, синтезированные химическим путем (поли)пептиды или (поли)пептиды, которые получены энзиматическим путем in vitro, которые могут быть представлены в очищенной форме или могут входить в состав неочищенной композиции. Источником полипептида может также быть, или же он может включать в себя, нуклеиновая кислота, кодирующая указанный полипептид, из РНК- или ДНК-матрицы. Молекулы РНК или ДНК могут быть «голой» ДНК, предпочтительно, содержащейся в везикулах или липосомах, или могут быть в составе вектора. Вектором может быть любой (рекомбинантный) ДНК- или РНК-вектор, известный в данной области, и предпочтительно, чтобы он являлся плазмидой, в которой гены, кодирующие латентные антигены, были оперативно связаны с регуляторными последовательностями, придающими кодируемым посредникам способность к экспрессии и трансляции. Указанным вектором может быть любой ДНК- или РНК-вирус, такой, без ограничения, как аденовирус, адено-ассоциированный вирус (AAV), ретровирус, лентивирус, модифицированный вирус коровьей оспы Ankara (MVA) или вирус оспы птиц, или же любой другой вирусный вектор, способный обеспечивать экспрессию полипептидов, содержащих латентные эпитопы, хозяину. ДНК-векторы могут быть не интегрирующими, такими как эписомно реплицирующиеся векторы, или же могут быть векторами, интегрирующимися в хозяйский геном путем случайной интеграции или в результате гомологической рекомбинации. Пример плазмидной конструкции, в которую встроена человеческая кДНК ZP2, где указанная плазмида может быть подходящим образом использована в соответствии с настоящим изобретением, можно найти в публикации Martinez с соавт. [(1996) Journal of Reproduction and Fertility Supplement 50: 35-41], которая включена в настоящее описание в виде ссылки.
Молекулы ДНК, содержащие гены, кодирующие полипептиды согласно настоящему изобретению, необязательно встроенные в векторы, такие как вирусы или плазмиды, могут быть интегрированы в хозяйский геном. В предпочтительном воплощении настоящего изобретения таким хозяином может быть микроорганизм. Предпочтительно, чтобы таким рекомбинантным микроорганизмом была Mycobacterium, например, вида M. tuberculosis или M. Bovis, и наиболее предпочтительно, бацилла M. bovis Кальметта-Герена (БЦЖ), способная доставлять хозяину полипептиды или их фрагменты согласно настоящему изобретению. Рекомбинантная БЦЖ и способы рекомбинации известны в данной области, например, см. WO 2004094469. Такие рекомбинантные микроорганизмы могут быть получены в виде живой рекомбинантной и/или живой аттенуированной вакцины, как описано, например, у Jacobs с соавт., 1987, Nature, 327(6122): 532-5). Такой вектор может также находиться в организме хозяина бактериальной природы, таком как, без ограничения, живая аттенуированная и/или рекомбинантная бактерия Shigella или Salmonella.
Используемый здесь термин "эпитоп" относится к части антигена, обычно определяемой полипептидом, который способен вызвать клеточный или гуморальный иммунный ответ, когда он представлен в физиологически соответствующем контексте in vivo. "Т-клеточный эпитоп" относится к пептиду или его части, которая связывается с молекулой MHC и распознается T-клетками, когда представлена [совместно с] молекулами MHC. Т-клеточный эпитоп способен индуцировать клеточно-опосредованный иммунный ответ в результате прямого или опосредованного представления в виде гетеродимерных мембранных молекул MHC. Вкратце, молекулы MHC преимущественно связываются с конкретными аминокислотными остатками, известными как "заякоривающие" остатки (K. Falk с соавт., Nature 351: 290-96 (1991)). Такое свойство позволяет идентифицировать распознающие эпитопы молекул класса I и II MHC внутри любой известной пептидной последовательности. В данном контексте, используемые здесь термины "MHC-ограниченный эпитоп" является синонимом Т-клеточного эпитопа. Используемый здесь термин "эпитоп, ограниченный классом I MHC", относится к пептидной последовательности, распознаваемой цитотоксическими Т-лимфоцитами (также называемыми CD8+ клетками или ЦТЛ) в сочетании с молекулами класса I MHC. Используемый здесь термин "эпитоп, ограниченный классом II MHC" относится к пептиду, распознаваемому хелперными T-клетками (также называемыми CD4+ клетками или T-хелперами). "B-клеточный эпитоп" представляет собой часть антигена, обычно пептид, способный связываться с антиген-связывающим участком иммуноглобулина, а следовательно, способный стимулировать гуморальный ответ без презентации в сочетании с молекулой MHC. Объясняемый здесь ранее полипептид, применимый в настоящем изобретении, или нуклеиновая кислота, кодирующая указанный полипептид, содержит по меньшей мере один Т-клеточный эпитоп. Однако применение полипептидов, которые содержат также и B-клеточный эпитоп, не исключено в данном изобретении. Описанные здесь иммуногенные полипептиды могут включать в себя также множество Т-клеточных эпитопов и, необязательно, B-клеточный эпитоп. Когда в пептиде присутствует множество эпитопов, указанные эпитопы могут быть ориентированы в виде тандема или в виде разветвленной (гнездовой) пространственной структуры, или могут иметь перекрывающуюся конфигурацию, в которой по меньшей мере один аминокислотный остаток может быть общим для двух или более эпитопов.
Полипептид согласно настоящему изобретению предпочтительно включает в себя один или несколько эпитопов, связывающихся с молекулами класса I MHC. Как известно специалистам в данной области, антиген, содержащий один пептидный эпитоп, будет полезен при лечении только (малой) части пациентов, у которых экспрессируется аллельный продукт MHC, который способен связываться с конкретным пептидом. Было подсчитано, что у людей вакцины, содержащие эпитопы ЦТЛ, ограниченные HLA-A1,-А2,-A3, A24- и -B7, будут охватывать около 80% индивидов большинства этнических групп. Следовательно, если данное изобретение использовать для лечения мужской половины человечества, особенно предпочтительно, чтобы настоящий источник полипептида содержал эффективное количество одного или нескольких различных полипептидов, включающих в себя один, более предпочтительно, два, и наиболее предпочтительно, три связывающих молекулы MHC класса I нативных ZP-эпитопа, выбранные из числа эпитопов, ограниченных молекулами HLA-A1, HLA-A2, HLA-A3, HLA-A24 и HLA-B7; или их гомологов, или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные один или несколько полипептидов или их гомологов.
В соответствии с другим воплощением, полипептид согласно настоящему изобретению предпочтительно включает в себя один или несколько эпитопов, связывающихся с молекулами MHC класса II. Наиболее часто обнаруживаемые у человека аллельные продукты MHC класса II включают в себя HLA-DR1, -DR3, -DR4 и -DR7. Соответственно, предпочтительно, чтобы настоящий источник полипептида содержал эффективное количество одного или нескольких различных полипептидов, где указанные один или несколько различных полипептидов включают в себя один, более предпочтительно, два, и наиболее предпочтительно, три связывающих молекулы MHC класса II нативных ZP-эпитопа, выбранных из числа эпитопов, ограниченных молекулами HLA-DR1, HLA-DR3, HLA-DR4 и HLA-DR7; или их гомологов или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные один или несколько полипептидов или их гомологов.
В еще одном воплощении настоящий источник полипептида содержит эффективное количество одного или нескольких полипептидов, где указанные один или несколько полипептидов включают в себя один или несколько эпитопов, связывающихся с молекулами MHC класса I, и один или несколько эпитопов, связывающихся с молекулами MHC класса II, как описано здесь выше; их гомологов или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные полипептиды или их гомологи. Даже более предпочтительно, чтобы указанный источник содержал эффективное количество одного или нескольких различных полипептидов, которые вместе включают в себя в основном все из эпитопов, связывающихся с молекулами MHC класса I и MHC класса II, содержащихся в одном из нативных ZP-гликопротеинов; или гомологов указанных одного или нескольких полипептидов, или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные полипептиды или их гомологи.
В одном из воплощений настоящий источник полипептида содержит эффективное количество одного или нескольких различных иммуногенных полипептидов, где один или несколько различных полипептидов вместе включают в себя по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, и наиболее предпочтительно, по меньшей мере 95% связывающихся эпитопов, ограниченных молекулами MHC класса I и MHC класса II, и содержащихся в нативном ZP-гликопротеине; или гомологов указанных одного или нескольких полипептидов, или одной или нескольких кодирующих их последовательностей нуклеиновых кислот.
В предпочтительным воплощении настоящий источник полипептида содержит эффективное количество иммуногенного полипептида, где указанный полипептид содержит по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, и наиболее предпочтительно, по меньшей мере 95% полного аминокислотного остова ZP-гликопротеина, предпочтительно, hZP; или гомолога указанного полипептида, или последовательности нуклеиновой кислоты, кодирующей указанный полипептид или его гомолог.
В другом особенно предпочтительном воплощении, источник полипептида содержит эффективное количество множества различных перекрывающихся полипептидных фрагментов ZP-гликопротеина, предпочтительно, hZP, где указанные различные перекрывающиеся полипептидные фрагменты составляют в длину 18-60 аминокислот, предпочтительно, 18-45 аминокислот, которые вместе содержат по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, и наиболее предпочтительно, по меньшей мере 95% полного аминокислотного остова указанных ZP-гликопротеинов; гомологов указанных полипептидов или одной или нескольких последовательностей нуклеиновых кислот, кодирующих указанные полипептиды или их гомологи. Обычно аминокислотное перекрывание между различными последовательными 16-80-членными полипептидными фрагментами составляет по меньшей мере 7 аминокислот, предпочтительно, по меньшей мере 8, более предпочтительно, по меньшей мере 9, и наиболее предпочтительно, по меньшей мере 10 аминокислот.
Описаны MHC-связывающие мотивы для большинства общих аллелей MHC класса I и класса II. Указанные мотивы уточняют аминокислотные остатки, которые служат в качестве MHC-связывающих якорей для специфических в отношении MHC класса I и класса II аллелей. Усовершенствованные алгоритмы, созданные на основе компьютеров, в которых учитываются MHC-связывающиеся якоря, а также аминокислотная последовательность пептида, используются для предсказания и количественной оценки аффинности связывания взаимодействия пептид/MHC. Таким образом, из введенной известной аминокислотной последовательности (глико)протеинов блестящей оболочки указанные алгоритмы создают список всех потенциальных T-клеточных эпитопов, каждого с его соответствующей предсказываемой оценкой связывания. Общеизвестный инструментарий по биоинформатике для подобных целей включает в себя HLA BIND, SYFPEITHI, NetMHC и TEPITOPE 2000 [см. ссылки 1-6]. Альтернативно, специалисты в данной области должны уметь определять экспериментально связывающие эпитопы T-хелперных лимфоцитов и ЦТЛ путем стандартных приемов экспериментирования (Current Protocols in Immunology, Wiley Interscience 2004).
В некоторых случаях наблюдалось, что один и тот же пептид может связываться с несколькими аллельными продуктами MHC класса I или класса II. В одном из воплощений применение таких «смешанных» MHC-связывающих пептидов в способе согласно изобретению является особенно предпочтительным.
В одном из воплощений в настоящем изобретении предложен способ индукции у человека мужского пола первичного иммунного ответа на гликопротеины нативной блестящей оболочки, при этом указанный способ включает в себя стадию введения указанному человеку источника полипептида, где указанный полипептид содержит ограниченный классом I MHC и/или классом II MHC Т-клеточный эпитоп нативной блестящей оболочки или его иммунологически активный вариант, причем указанный источник полипептида содержит эффективное количество иммуногенного полипептида, выбранного из (глико)протеинов блестящей оболочки, их гомологов, а также иммунологически активных фрагментов указанных (глико)протеинов и их гомологов; или последовательности нуклеиновой кислоты, кодирующей указанный иммуногенный полипептид. В соответствии с предпочтительным воплощением, указанный (глико)протеин блестящей оболочки выбран из группы ZP1, ZP2, ZP3 и ZP4, более предпочтительно, ZP2 и ZP3, и наиболее предпочтительно, ZP3.
В соответствии с особенно предпочтительным воплощением, указанный источник полипептида содержит эффективное количество иммуногенного полипептида, выбранного из (глико)протеинов блестящей оболочки человека, их гомологов, а также из иммунологически активных фрагментов указанных (глико)протеинов и их гомологов, или последовательности нуклеиновой кислоты, кодирующей указанный иммуногенный полипептид. Предпочтительно, чтобы указанный (глико)протеин блестящей оболочки человека ((глико)протеин hZP) был выбран из группы hZPl, hZP2, hZP3 и hZP4. В соответствии с еще более предпочтительным воплощением, указанный (глико)протеин выбран из группы hZP2 и hZP3, более предпочтительно, чтобы указанным (глико)протеином был hZP3.
Под термином «их иммунологически активные фрагменты» обычно в данной области подразумевается фрагмент полипептидного антигена, содержащего по меньшей мере эпитоп, что означает, что такой фрагмент по меньшей мере содержит 4, 5, 6, 7 или 8 смежных аминокислот из последовательности полипептидного антигена. В соответствии с настоящим изобретением, указанный фрагмент содержит по меньшей мере Т-клеточный эпитоп. Таким образом, «иммунологически активный фрагмент» согласно настоящему изобретению содержит по меньшей мере 8, 9, 10, 11, 12, 13 или 14 смежных аминокислот из последовательности ZP-(глико)протеинового антигена или его гомолога или аналога. Еще более предпочтительно, чтобы указанный фрагмент содержал как ЦТЛ-, так и T-хелперный эпитоп. Наиболее предпочтительно, однако, чтобы указанный фрагмент являлся пептидом, который требует процессинга со стороны антигенпредставляющей клетки, то есть указанный фрагмент имеет в длину по меньшей мере приблизительно 18 аминокислот, и при этом непрерывная последовательность из 18 аминокислот указанного полипептидного антигена не является необходимой.
Используемые здесь термины «их гомологи» относятся к полипептидам, которые отличаются от образующихся природным путем полипептидов в результате минорных модификаций, но в которых сохраняется структура основного полипептида и боковых цепей той формы, которая образуется природным путем. Такие изменения включают в себя, но не ограничены изменениями в одной или нескольких боковых цепях аминокислот; изменениями в одной или нескольких аминокислотах, включая делеции (например, укороченная версия пептида), вставки и/или замены; изменениями в стереохимии одного или нескольких атомов; дополнительные N- или C-концевые аминокислоты; и/или минорные дериватизации, включая, но не ограничиваясь метилированием, гликозилированием, фосфорилированием, ацетилированием, миристоилированием, пренилированием, пальмитированием, амидированием и/или добавлением гликозилфосфатидилинозита. Используемые здесь гомолог или аналог имеют либо повышенную, либо по существу сходную функциональную активность по сравнению с образующимся природным путем полипептидом.
Здесь подразумевается, что гомолог содержит иммуногенный полипептид, имеющий аминокислотную последовательность, по меньшей мере на 70%, предпочтительно, по меньшей мере на 80%, более предпочтительно, по меньшей мере на 90%, еще более предпочтительно, по меньшей мере на 95%, еще более предпочтительно, по меньшей мере на 98%, и наиболее предпочтительно, по меньшей мере на 99% идентичную аминокислотной последовательности образующихся природным путем полипептидов ZP3 согласно настоящему изобретению, при их оптимальном выравнивании, например, с помощью программ GAP или BESTFIT, в которых используются параметры по умолчанию, но при этом все еще способный вызывать по меньшей мере достижимый иммунный ответ. Обычно используются параметры по умолчанию за пробелы, со штрафом за создание пробела=8 и штрафом за расширение пробела=2. В случае белков матрицей подсчета по умолчанию является Blosum62 (Henikoff & Henikoff, 1992, PNAS 89, 915-919). Выравнивание последовательностей и оценки степени идентичности последовательностей могут быть определены с помощью компьютерных программ, таких как GCG Wisconsin Package, версия 10.3, доступных в Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752, USA. Альтернативно, процент сходства или идентичности может быть определен путем поиска в базах данных, таких как FASTA, BLAST, и т.д.
В соответствии с одним из воплощений настоящего изобретения, настоящие иммуногенные полипептиды, определяемые здесь выше, являются гликозилированными. Не желая ограничивать себя какой бы то ни было теорией, авторы изобретения, тем не менее, предполагают, что в результате гликозилирования указанных полипептидов их иммуногенность повышается. Следовательно, в соответствии с предпочтительным воплощением, указанный выше иммуногенный поли