Способ лечения печеночной недостаточности
Иллюстрации
Показать всеИзобретение относятся к медицине, хирургии, трансплантологии. Матрикс из децеллюляризированной донорской печени млекопитающего в объеме 1:1, в течение 8-12 часов, при температуре 4°C инкубируют в растворе с рН 7,4. Состав раствора: 138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, фибронектин и ламинин по 10 мкг/мл, дистиллированная вода до 1л. Проводят сокультивирование клеток печени и стволовых клеток костного мозга в течение 2-4 суток количестве 2×106-15×106 на 1 см матрикса. Матрикс с клетками объемом не менее 0,05 см3 смешивают с коллагенсодержащим гидрогелем в объеме 3:1. Размеры частиц матрикса от 200 до 700 мкм, пор не более 50 мкм, пористость 70-85%. В паренхиму печени имплантируют полученную клеточно-инженерную конструкцию. Антикоагулянты применяют в профилактической дозе. Способ позволяет улучшить результаты лечения пациента с печеночной недостаточностью за счет активизации двухсторонних взаимодействий между имплантированной клеточно-инженерной конструкции и паренхимой поврежденной печени реципиента. 3 з.п. ф-лы, 3 ил.
Реферат
Изобретение относятся к регенеративной медицине, трансплантологии, а именно к клеточной трансплантологии, и может быть использовано при коррекции и лечении печеночной недостаточности. Предлагаемый способ может быть использован в специализированных отделениях, занимающихся лечением и коррекцией печеночной недостаточности.
В настоящее время известно, что для повышения эффективности лечения поврежденной печени следует использовать приемы тканевой инженерии, предполагающие создание имплантируемых клеточно-инженерных конструкций (КИК).
Известны способы лечения печеночной недостаточности, основанные на использовании КИК, состоящих из изолированных аутологичных клеток печени и аутологичных мезенхимальных стволовых клеток костного мозга, адгезированных на биосовместимом биодеградируемом трехмерном матриксе из биодеградируемого бактериального сополимера β-оксибутирата и β-оксивалерата и полиэфира (Эластопоб) либо на биосовместимом биодеградируемом биополимерном гетерогенном коллагенсодержащем гидрогеле (Сферогель) (Патенты РФ на изобретение №2425648 C1, №2425645, C1), которые имплантируют в ткань печени или в брыжейку тонкой кишки.
Также известны способы лечения печеночной недостаточности с помощью КИК, в которых для иммобилизации клеточного материала и пролонгирования выживания заключенных в них клеток использованы биосинтетические или синтетические матриксы [Kulig К.М.&Vacanti J.P. Hepatic tissue engineering. // Transpl. Immunol. - 2004. - Vol. 12, - p. 303-310].
В качестве прототипа нами выбран известный способ лечения печеночной недостаточности, в котором использовались трансплантаты, содержащие изолированные гепатоциты и мезенхимальные стволовые клетки костного мозга (МСК КМ) на биополимерном гетерогенном коллагенсодержащем гидрогеле (Сферогель) для вспомогательной поддержки КИК печени и восполнения дезинтоксикационной и биорегуляторной функции поврежденной печени, а также для активизации восстановительных процессов в ней (Патент РФ на изобретение №2425645 C1).
К недостаткам использования известных способов, в том числе и прототипа, предполагающих внутрипеченочную имплантацию КИК на основе биоматрикса, относят недостаточный объем регуляторных возможностей используемых матриксов и, следовательно, недостаточную выраженность процессов регуляции восстановительных процессов в печени с использованием предложенных КИК.
Используемые в КИК матриксы:
- не обладают тканеспецифичностью и биоидентичностью, которые необходимы для активного взаимодействия адгезированных клеток с самим матриксом, так как он не представляет собой активной живой регуляторной структуры;
- не участвуют в неогенезе гепатоподобных структур;
- имеют низкую (не оптимальную) плотность прикрепления клеток;
- не предотвращают гибель большого количества изолированных гепатоцитов;
- не оптимизируют сроки жизнедеятельности КИК и эффективность их регуляторного воздействия на поврежденную печень.
Задачей изобретения является разработка способа, повышающего эффективность лечения печеночной недостаточности за счет пролонгирования сроков выживания и большей плотности прикрепления клеток печени (КП) и МСК КМ в составе имплантируемых КИК, а также повышения ими регенераторной (восстановительной) активности ткани поврежденной печени (клетки печени и ее внеклеточный матрикс) путем имплантации КИК, в которых клетки в виде ассоциатов адгезированы на предварительно инкубированном тканеспецифическом мелкодисперсном матриксе из децеллюляризированной донорской печени млекопитающих.
Технический результат, достигаемый при осуществлении заявляемого способа, заключается в:
- более интенсивном и эффективном лечении печеночной недостаточности путем активизации: детоксикационных, синтетических и регенерационных (восстановительных) процессов в поврежденной печени, за счет более активно функционирующих КИК, имплантированных в поврежденную печень;
- создании тканеспецифического каркаса, предназначенного для прикрепления клеток и формирования в КИК тканеподобных структур (ассоциаты клеток печени на тканеспецифическом матриксе), обеспечивающих физиологичные условия функционирования и взаимодействия находящихся в них клеток с матриксом;
- активизации процессов прикрепления и повышения плотности прикрепления клеток на тканеспецифическом матриксе, за счет предварительного инкубирования (подготовки) этого матрикса in vitro в среде, содержащей растворимые компоненты внеклеточного (нативного) матрикса;
- пролонгировании сроков выживания клеточного материала в составе КИК с активизацией пролиферации в них клеток печени за счет активизации взаимодействия клеток печени и МСК КМ в результате их предварительного сокультивирования in vitro на тканеспецифическом матриксе с образованием клеточных ассоциатов;
- пролонгировании жизнеспособности КИК после имплантации, но до иинтеграции ее тканями печени за счет погружения КИК в биополимерный гетерогенный коллагенсодержащий гидрогель, являющийся эквивалентом внутри и внеклеточного матрикса;
- создании условий для прорастания в тканеспецифический каркас сосудов, диффузии питательных веществ, кислорода и факторов тканевой дифференцировки к иммобилизированным печеночным клеткам и МСК КМ, обеспечивающих образование в зонах имплантации КИК новых дополнительных центров устойчивой регенерации печени, повышающих терапевтический эффект;
- отсутствии отторжения имплантата (используемый нативный матрикс тканеспецифичен, но видонеспецифичен).
Достоинствами предложенного способа и имплантата для лечения печеночной недостаточности являются:
- создание с помощью предварительно подготовленного тканеспецифического матрикса культуральных условий для прикрепления и пролиферации клеток в пространстве КИК и формирования в нем дополнительной «тканеподобной» длительно функционирующей структуры (ассоциаты клеток печени, МСК КМ и нативного матрикса);
- создание физиологических условий для диффузии оксигенированной межтканевой жидкости и прорастания сосудов через тканеспецифический матрикс, что пролонгирует адекватные условия жизнеобеспечения и взаимодействия адгезированных клеток, матрикса и окружающей ткани печени;
- формирование КИК с длительно функционирующей тканеподобной структурой, что создает в поврежденной печени центры для ее устойчивой восстановительной регенерации, обеспечивающей выраженный лечебный эффект;
- использование в составе КИК аутологичных клеток предотвращает активацию иммунной системы после имплантации КИК и позволяет этой системе не участвовать в иммунном ответе, но оказывать длительное биорегуляторное воздействие на регенераторные процессы в поврежденной печени.
В предлагаемом изобретении не используются ткани и/или клеточный материал эмбрионов человека. Использован клеточный материал взрослых доноров.
Сокультивирование клеток печени и МСК КМ на предварительно подготовленном in vitro тканеспецифическом матриксе перед имплантацией позволяет активизировать трехсторонние взаимодействия (клетки печени, МСК КМ и тканеспецифический матрикс) и дополнительно повышать функциональную активность гепатоцитов и МСК КМ, способствуя формированию сосудов и прорастанию их в матрикс за счет дифференцировки МСК КМ в эндотелиоциты.
Это процедура сокультивирования клеток печени и МСК КМ на предварительно подготовленном тканеспецифическом матриксе способствует более быстрой интеграции имплантата (КИК печени) в систему кровообращения поврежденной печени и доставки в нее по вновь образованным и проросшим сосудам кислорода и питательных веществ, создающих более адекватные условия для жизнеобеспечения клеток в составе КИК.
Предлагаемый способ позволяют пролонгировано и более интенсивно лечить хроническую печеночную недостаточность за счет более эффективного и пролонгированного функционирования КИК, которое достигается путем обеспечения физиологичного взаимодействия, предварительно инкубированного тканеспецифического матрикса с гликопротеинами (фибронектин, ламинин) и последующей посадки на этот матрикс и сокультивирования на нем клеток печени и МСК КМ с образованием ассоциатов, а также их индукционного воздействия на ткань поврежденной печени. Имплантация аутологичных клеток в составе КИК позволяет исключить осложнения, связанные с реакцией отторжения. Предлагаемое изобретение позволяет также:
1. Создавать условия не только для прикрепления клеток печени и МСК КМ к трехмерному биосовместимому тканеспецифическому матриксу печени, но и создавать условия для их трехстороннего контактного и метаболического взаимодействия, которое активизирует пролиферацию и регуляторную активность клеток в составе КИК. Последнее поддерживается диффузией через тканеспецифический матрикс питательных веществ и кислорода, а так же различных регуляторных пептидов и факторов, которые поддерживают в КИК метаболизм и функцию не только клеток, но так же и самого матрикса.
2. Создать каркас на основе трехмерного биосовместимого тканеспецифического матрикса печени, полностью повторяющего пространственную структуру архитектоники печени для тканеобусловленного прикрепления аутологичных клеток печени и МСК КМ и формирования в КИК гепатоподобных структурных единиц.
3. Создать условия для формирования и прорастания в этот нативный тканеспецифический каркас сосудов для питания прикрепленных клеток и ускоренной интеграции КИК с тканями поврежденной печени.
4. Создать условия, препятствующие клеточной инфильтрации имплантата и поддерживающие сформированные клеточные ассоциаты в жизнеспособном состоянии за счет использования антикоагулянтов и антиагрегантов.
5. Ускорить процесс реализации биорегуляторного и восстановительного воздействия КИК на поврежденную печень после имплантации за счет предварительного in vitro сокультивирования клеток печени и МСК КМ на мелкодисперсных частицах тканеспецифического матрикса, что позволяет имплантировать КИК в виде готовых жизнеспособных конструкций клеточных ассоциатов.
Предварительная обработка тканеспецифического матрикса гликопротеинами нативного внеклеточного матрикса повышает его адгезивные свойства, способствует повышению плотности посадки клеток и обеспечивает восстановление межклеточных и клеточно-матриксных взаимодействий, необходимых для интеграции КИК в поврежденную ткань печени.
Сущность изобретения заключается в следующем.
Способ лечения печеночной недостаточности включает имплантацию в паренхиму печени клеточно-инженерной конструкци (КИК) с последующим назначением антикоагулянтов и антиагрегентов в профилактической дозе. При этом сначала в течение 8-12 часов при температуре 4°C инкубируют матрикс из децеллюляризированной донорской печени млекопитающего в физиологическом растворе, забуференном фосфатами. Физиологический раствор, забуференный фосфатами, имеет следующий состав: 138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, дистиллированная вода до 1 л и содержит гликопротеины - фибронектин и ламинин по 10 мкг/мл, имеет рН 7,4. Соотношение объемов матрикса и забуференного фосфатами физиологического раствора составляет 1:1. Затем на подготовленном матриксе в течение 2-4 суток проводят сокультивирование свежевыделенных аутологичных клеток печени и предварительно культивированных аутологичных мезенхимальных стволовых клеток костного мозга при соотношении клеток костного мозга к клеткам печени - от 1:1 до 1:10, обеспечивая прикрепление клеток в количестве 2×106-15×106 на 1 см3 матрикса в виде ассоциатов. При этом общий объем матрикса с прикрепленными клетками составляет не менее 0,05 см3. Перед имплантацией получают КИК, смешивая матрикс с прикрепленными к нему клетками и биополимерный гетерогенный коллагенсодержащий гидрогель в объемном соотношении 3:1.
В частном случае матрикс получают из децеллюляризированной донорской печени человека.
В частном случае матрикс имеет размеры частиц от 200 до 700 мкм, размеры пор не более 50 мкм и суммарную пористость 70-85%.
В качестве биополимерного гетерогенного коллагенсодержащего гидрогеля может быть использован Сферогель.
Способ осуществляют следующим образом, и включает в себя несколько последовательных этапов:
1). Выделение аутологичных мезенхимальных стволовых клеток костного мозга.
Выделение мезенхимальных стволовых клеток костного мозга осуществляют по традиционной методике (Шумаков В.И., Онищенко Н.А., Крашенинников М.Е. и др. Костный мозг как источник получения мезенхимальных клеток для восстановления терапии поврежденных органов. // Вестник трансплантологии и иск. органов 2002, 4, с. 3-6; Шумаков В.И., Онищенко Н.А. и соавт. Биологические резервы клеток костного мозга и коррекция органных дисфункций. //Москва, Лавр. 2009. - С. 61-67). За 4-7 дней до основного оперативного вмешательства под местным обезболиванием пунктируют подвздошную кость пациента и забирают костный мозг в объеме 40-150 мл в стерильную емкость с раствором Хенкса, содержащим: 200 мкг/мл гентамицина; 10,0 мкг/мл инсулина; 0,25 мкМ дексамезатона; 250 ед/мл гепарина. Суспензию клеток центрифугируют 5 мин при 1500 об/мин, осадок клеток ресуспендируют в лизирующем растворе (114 мМ NH4Cl; 7,5 мМ KHCO3; 100 мкМ EDTA), в соотношении 1:4 от исходного объема аспирата, в течение 5-10 мин и центрифугируют 3 мин при 1500 об/мин при комнатной температуре. Гемолизированный суспернатант полностью удаляют отсасыванием. Добиваются полного лизиса эритроцитов, для чего процедуру лизирования проводят трижды с последующим отмыванием клеток центрифугированием. Клеточный осадок, свободный от эритроидных и тромбоцитарных форм, ресуспендируют в ростовой среде.
2). Культивирование аутологичных мезенхимальных стволовых клеток костного мозга in vitro.
Культивирование мезенхимальных стволовых клеток костного мозга осуществляют по традиционной методике (Шумаков В.И., Онищенко Н.А., Крашенинников М.Е. и др. Костный мозг как источник получения мезенхимальных клеток для восстановления терапии поврежденных органов. //Вестник трансплантологии и иск. органов. 2002, 4, с. 3-6; Шумаков В.И., Онищенко Н.А. и соавт. Биологические резервы клеток костного мозга и коррекция органных дисфункций. // Москва, Лавр. 2009. - С. 77-100). Частично очищенные мезенхимальные стволовые клетки костного мозга высевают для культивирования на чашки Петри d=60 мм в количестве 1,5-2,0 млн. клеток/мл. Культивируют при 37°C в CO2-инкубаторе, атмосфера 5% CO2 и 95% влажности в течение 7 суток с однократной сменой среды на третьи сутки. Через неделю, культура клеток костного мозга содержала до 10% прикрепившихся к пластику распластанных фибробластоподобных и моноцитарных клеток и до 90% свободно плавающих в суспензии, округлых не прикрепившихся клеток (гемопоэтические клетки). Не прикрепившиеся к пластику мезенхимальные стволовые клетки костного мозга отбирали и затем использовали для иммобилизации на мелкодисперсный тканеспецифический матрикс вместе со свежевыделенными клетками печени.
3). Предварительная подготовка мелкодисперсного тканеспецифического матрикса для посадки клеток.
Мелкодисперсный тканеспецифический матрикс из децеллюляризированной донорской печени млекопитающих, изготовленный по патенту РФ №2539918 от 27.01.2015 г. «Способ получения тканеспецифического матрикса для тканевой инженерии паренхиматозного органа», инкубируют in vitro в течение 8-12 часов при температуре 4°C в физиологическом растворе, забуференном фосфатами. Фосфатный буфер имеет следующий состав: 138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, дистиллированная вода до 1 л, рН 7,4 с добавлением в него гликопротеинов (например, фибронектина и ламинина по 10 мкг/мл), причем матрикс и физиологический раствор, забуференный фосфатами, используется для инкубации в равных объемах, соотношении 1:1.
4). Выделение аутологичных клеток печени.
Производят резекцию 2-4×2-4×1-2 см ткани печени у пациентов с печеночной недостаточностью для получения клеток печени. Выделение аутологичных клеток печени осуществляют по традиционной методике (Fontaine М, Schloo В, Jenkins R, Uyama S, Hansen L, Vacanti J.P. Human hepatocyte isolation and transplantation into an athymic rat, using prevascularized cell polymer constructs. // Pediatr. Surg. -1995. - vol. 30 (l). - P. 56-60; Hang H, Shi X, Gu G, Wu Y, Ding Y. A simple isolation and cryopreservation method for adult human hepatocytes // Int J Artif Organs. 2009 Oct; 32 (10). - P. 720-7; Lehec S.C, Hughes RD, Mitry R.R, Graver M.A, Verma A, Wade J.J, Dhawan A. Experience of microbiological screening of human hepatocytes for clinical transplantation. // Cell Transplant. 2009; 18 (8). - P. 941-947; Seglen O. Preparation of isolated rat liver cells. // Methods. Cell. Biol. 1976. - vol. 13. - P. 29-83).
Выделение аутологичных клеток печени производят из резецированного участка печени путем 3-кратной отмывки кусочка печени от крови и измельчения его на холоду (t=4°C) в чашке Петри, с 3-кратной отмывкой образовавшейся взвеси буферным раствором без кальция [1000 мл дистиллированной воды, 8.3 г NaCl, 0.5 г KCl, 2.38 г HEPES, рН 7,4, 37°C] в течение 7 минут. После этого мелкие кусочки печени инкубируются 3 раза раствором коллагеназы [1000 мл дистиллированной воды, 8.3 г NaCl, 0.5 г KCl, 0.7 г CaCl2, 2.38 г HEPES, 7.5 мг ингибитор трипсина и 500 мг коллагеназы Тип IV-S (>125 CDU/mg), рН 7,3; 37°C] в течение 6-8 минут с последующей заменой ферментного раствора с использованием центрифугирования 500 об/мин в течение 1 минуты при t=37°C. Полученный материал переносят на сито с ячейками 200 мкм и фильтруют промыванием питательной средой William′s Е с 10% фетальной бычьей сыворотки, после чего суспензию отдельных клеток и небольших агрегатов переносят в центрифужную пробирку и центрифугируют при 500 об/мин при 4°C в течение 1 минуты. Супернатант удаляют, осадок ресуспендируют в такой же свежей среде и опять центрифугируют. Процедуру повторяют 3 раза. Жизнеспособность клеток оценивают методом окрашивания трипановым синим. Добиваются получения количества клеток в пределах от 3,0×108 до 4,0×108 гепатоцитов на 12-15 г веса ткани печени. Клеточная суспензия должна содержать: гепатоциты, непаренхиматозные клетки печени, которые определяют при световой микроскопии. Разделение паренхиматозных и непаренхиматозных клеток не выполняют. Взвесь клеток печени концентрируют в 1-2 мл физиологического раствора.
5). Посадка (иммобилизация) аутологичных клеток печени и аутологичных мезенхимальных стволовых клеток костного мозга на мелкодисперсный тканеспецифический, предварительно подготовленный матрикс печени для создания КИК печени.
Посадку (иммобилизацию) клеточного материала осуществляют по традиционной методике (Mooney D.J., Sano K., Kaufmann P.M., Majahod K., Schloo В., Vacanti J.P., Langer R. Long-term engraftment of hepatocytes transplanted о biodegradable polymer sponges // J. Biomed. Mater. Res. - 1997. - Vol .5. - P. 413-420).
Аутологичные клетки печени и аутологичные мезенхимальные стволовые клетки костного мозга клетки костного мозга ресуспендировали в ростовой среде [William′s Е с заменой аргинина на орнитин, с добавлением фетальной бычьей сыворотки, фактора роста гепатоцитов, эпидермального фактора роста, β-субъединицы холерного токсина, дексамезатона, этаноламина, селенита натрия, глюкагона, инсулина, инсулино-подобного фактора роста-I, аскорбиновой кислоты, линолеивой и линоливой жирных кислот] в концентрации 2,0-4,0×106 клеток печени/мл и 2,0-4,0×106 мезенхимальных стволовых клеток костного мозга клеток клеток костного мозга/мл. Суммарную клеточную суспензию наносили на предварительно подготовленный матрикс в концентрации 2×106-15×106 на 1 см3.
В качестве матрикса может быть использован, например, биоматериал, созданный из децеллюляризированной печени млекопитающих - трехмерный биосовместимый тканеспецифический матрикс печени (Готье С.В. и соавт. патент на изобретение №2539918 от 21.01.2015 г.), предварительно подготовленный по вышеописанному способу (пункт №3).
6). Сокультивирование in vitro аутологичных мезенхимальных стволовых клеток костного мозга и аутологичных клеток печени на предварительно подготовленном мелкодисперсном матриксе из децеллюляризированной печени млекопитающих.
Выполняли сокультивирование аутологичных клеток печени и мезенхимальных стволовых клеток костного мозга по общепринятой методике (Kaufmann P.M., Sano K., Uyama S., Breuer C.K., Organ G.M., Schloo B.L., Kluth D., Vacanti J.P. Evaluation of Methods of Hepatotrophic Stimulation in Rat Heterotopic Hepatocyte Transplantation Using Polymers // J. of Pediatric Surgeru. - 1999. - Vol. 34. - P.1118-1123; Uyama S., Kaufmann P.M., Takeda Т., Vacanti J.P. Delivery of whole liver equivalent hepatocyte mass using polymer devices and hepatotrophic stimulation 935), используя соотношение клеток печени к МСК КМ от 1:1 до 1:10.
Это позволяло обеспечить возникновение трехсторонних взаимодействий (клетки печени, МСК КМ и предварительно подготовленный матрикс из децеллюляризированной печени млекопитающих) и до имплантации КИК в печень повысить жизнеспособность в них клеток печени и мезенхимальных стволовых клеток костного мозга и способность их к формированию печеночноподобных структур, способных выполнять не только специфические функции, но и способствовать формированию из МСК КМ (эндотелиоцитов) сосудов и желчных протоков и их прорастанию как в КИК, так и в ткань печени.
Тканеспецифический матрикс печени с клетками помещали в стерильную камеру для инкубации in vitro в ростовой среде [William′s Е с заменой аргинина на орнитин, с добавлением фетальной бычьей сыворотки, фактора роста гепатоцитов, эпидермального фактора роста, Р-субъединицы холерного токсина, дексамезатона, этаноламина, селенита натрия, глюкагона, инсулина, инсулино-подобного фактора роста-I, аскорбиновой кислоты, линолиевой и линоленовой жирных кислот] на 2-4 суток.
7). Подготовка КИК печени для имплантации.
Полученные КИК (предварительно подготовленный тканеспецифический матрикс печени с иммобилизированными аутологичными клетками печени и мезенхимальными стволовыми клетками костного мозга с образованием клеточных ассоциатов) ресуспендировали из ростовой среды и смешивали с коллагенсодержащим гидрогелем, например, с биополимерным гетерогенным коллагенсодержащим гидрогелем - Сферогель(СфероГЕЛЬ®) в соотношении объемов 3:1 для оптимизации массобмена между КИК и тканью печени до ее интеграции после имплантации.
8). Имплантация КИК печени (предварительно подготовленный тканеспецифический матрикс печени с предварительно иммобилизированными аутологичными клетками печени и мезенхимальными стволовыми клетками костного мозга в паренхиму поврежденной печени).
Имплантацию КИК печени (тканеспецифичный матрикс с иммобилизированными аутологичными клетками печени и аутологичными мезенхимальными стволовыми клетками костного мозга в виде ассоциатов) осуществляют пациентам с печеночной недостаточностью в поврежденную печень.
9). Использование антикоагулянтов и антиагрегантов.
После имплантации КИК печени (предварительно подготовленный тканеспецифический матрикс с иммобилизированными аутологичными клетками печени и аутологичными мезенхимальными стволовыми клетками костного мозга в виде ассоциатов пациентам назначают антикоагулянты в профилактической дозе, например: гепарин 5000 ME каждые 12 часов в течение 7-10 дней под контролем свертывающей системы крови и антиагреганты, например, трентал из расчета 45 мг/м2 поверхности тела каждые 12 часов в течение 30-90 дней.
Предложенный имплантат (КИК печени) для лечения печеночной недостаточности, состоит из предварительно подготовленного тканеспецифического матрикса печени млекопитающих и посаженых на него аутологичных мезенхимальных стволовых клеток костного мозга и аутологичных клеток печени с образованием ассоциатов до имплантации.
Для доказательства возможности достижения заявленного назначения и достижения указанного технического результата приводим следующие данные.
Пример осуществления предлагаемого способа с использованием предлагаемого имплантата в эксперименте.
Моделирование хронической печеночной недостаточности у животных (крысы) осуществляли по признанной и адекватной модели (Фишер А. Физиология и экспериментальная патология печени. // А. Фишер. - Будапешт, 1961, - 230 с; Колпащикова И.Ф. Влияние трансплантации клеток тимуса, костного мозга и селезенки на восстановительные процессы в патологически измененной печени. // Бюл. эксперим. биол. и мед., - 1979, №10. - С. 477-480; Колпащикова И.Ф. Общие и местные изменения в организме при экспериментальном повреждении печени и ее регенерация. // Автореф. докт. дисс - 1982, Казань. - 41 с.) путем введения 60% раствора CCl4, первые два введения по 0,5 мл на 100 г массы, последующие по 0,3 мл на 100 г массы тела. Курс введения 6 недель с частотой - 2 введения в неделю.
1). Осуществляли по традиционной методике выделение аутологичных мезенхимальных стволовых клеток костного мозга.
Получали клеточный аспират из костномозгового канала большеберцовых костей (крысы) путем промывания полости фосфатно-буферным раствором, содержащим 50 ед/мл гепарина и 0,25 мг/л гентамицина с помощью иглы 18G, насаженной на шприц. Суспензию клеток центрифугировали, осадок клеток ресуспендировали в лизирующем растворе при комнатной температуре в течение 3 мин и снова центрифугировали 3-5 мин при 1500 об/мин. Гемолизированный супернатант полностью удаляли отсасыванием, а клеточный осадок, содержащий мезенхимальные стволовые клетки костного мозга ресуспендировали в ростовой среде. Интерфазу с мононуклеарными клетками собирали с поверхности эритроидного осадка и ресуспендировали в лизирующем растворе, в соотношении 1:4, в течение 5-8 мин и центрифугировали 5 мин при 1500 об/мин при комнатной температуре. Гемолизированный супернатант полностью удаляли. Добивались полного лизиса эритроцитов, для чего процедуру лизирования проводили дважды или трижды с последующим отмыванием клеток центрифугированием. Клеточный осадок, свободный от эритроидных и тромбоцитарных форм, в количестве 60-150×106 клеток объединяли с осадком клеток, полученным из плазмы, и далее ресуспендировали в ростовой среде для стимуляции роста клеток.
2). Осуществляли по традиционной методике культивирование мезенхимальных стволовых клеток костного мозга.
Частично очищенные мезенхимальные стволовые клетки костного мозга высевали для культивирования в количестве 1,5-2,0 млн. клеток/мл. Культивировали при 37°C в CO2-инкубаторе, атмосфере 5% CO2 и 95% влажности в течение 7 суток с однократной сменой среды на третьи сутки.
3). Мелкодисперсный тканеспецифический матрикс из децеллюляризированной донорской печени крысы, изготовленный по патенту №2539918 от 21.01.2015 г. «Способ получения тканеспецифического матрикса для тканевой инженерии паренхиматозного органа», инкубируется in vitro в течение 8-12 часов при температуре 4°C в физиологическом растворе, забуференном фосфатами, который имеет следующий состав: 138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, дистиллированная вода до 1 л, рН 7,4 с добавлением в него гликопротеинов (например, фибронектина и ламинина по 10 мкг/мл), причем матрикс и физиологический раствор, забуференный фосфатами, используется для инкубации в равных объемах, например в соотношении 1:1.
4). Выделение аутологичных клеток печени осуществляли по традиционной методике.
Выделение аутологичных клеток печени из резецированного участка печени (1×1×0,5 см у крыс) производилось путем 3-кратной отмывки от крови и измельчения его на холоду (t=4°C), с 3-кратной отмывкой образовавшейся взвеси буферным раствором без кальция в течение 7 минут. После этого мелкие кусочки печени были проинкубированы 3 раза раствором коллагеназы в течение 6-8 минут с последующей заменой ферментного раствора с использованием центрифугирования 500 об/мин в течение 1 минуты при t=37°C. Полученный материал переносился на сито с ячейками 200 мкм и фильтровался промыванием питательной средой William′s Е с 10% фетальной бычьей сыворотки, после чего суспензию клеток центрифугировали при 500 об/мин при 4°C в течение 1 минуты. Супернатант удаляли, осадок ресуспендировали в такой же свежей среде и опять центрифугировали. Процедуру повторяли 3 раза. Жизнеспособность клеток, колебавшуюся в пределах от 83 до 95%, оценивали методом окрашивания трипановым синим. Количество клеток колебалось в пределах от 3,0×108 до 4,0×108 гепатоцитов на 15 г веса ткани печени. Клеточная суспензия содержала: гепатоциты ~95÷98%, и ~5÷2% непаренхиматозных клеток печени, которые были определены при световой микроскопии. Разделение паренхиматозных и непаренхиматозных клеток не выполнялось. Взвесь клеток печени концентрировали в 1-2 мл физиологического раствора.
5). Аутологичные клетки печени и аутологичные мезенхимальные стволовые клетки костного мозга ресуспендировали в ростовой среде [William′s Е с заменой аргинина на орнитин, с добавлением фетальной бычьей сыворотки, фактора роста гепатоцитов, эпидермального фактора роста, β-субъединицы холерного токсина, дексамезатона, этаноламина, селенита натрия, глюкагона, инсулина, инсулино-подобного фактора роста-I, аскорбиновой кислоты, линоленовой и линолиевой жирных кислот] в концентрации 2,0-4,0×106 клеток печени/мл и 2,0-4,0×106 мезенхимальных стволовых клеток костного мозга клеток костного мозга/мл. Суммарную клеточную суспензию наносили на предварительно подготовленный матрикс в концентрации 2×106-15×106 на 1 см3.
6). Выполняли in vitro сокультивирование аутологичных клеток печени и мезенхимальных стволовых клеток костного мозга. Для этого предварительно подготовленный тканеспецифический матрикс печени с клетками помещали в стерильную камеру для инкубации in vitro в ростовой среде [William′s Е с заменой аргинина на орнитин, с добавлением фетальной бычьей сыворотки, фактора роста гепатоцитов, эпидермального фактора роста, β-субъединицы холерного токсина, дексамезатона, этаноламина, селенита натрия, глюкагона, инсулина, инсулино-подобного фактора роста-1, аскорбиновой кислоты, линоленовой и линолиевой жирных кислот] на 2-4 суток для формирования КИК (предварительно подготовленный тканеспецифический матрикс с адгезированными клетками в виде ассоциатов).
В качестве матрикса был использован, например, предварительно подготовленный тканеспецифический матрикс печени крысы.
7). Полученные КИК (предварительно подготовленный тканеспецифический матрикс печени с иммобилизированными аутологичными клетками печени и мезенхимальными стволовыми клетками костного мозга с образованием клеточных ассоциатов) ресуспендировали из ростовой среды и смешивали с коллагенсодержащим гидрогелем, например, с гетерогенным биосовместимым биодеградируемым гидрогелем - Сферогель в соотношении объемов 3:1.
8). Имплантацию КИК печени (предварительно подготовленный тканеспецифичный матрикс с иммобилизированными аутологичными клетками печени и аутологичными мезенхимальными стволовыми клетками костного мозга в виде ассоциатов) осуществляли крысам с печеночной недостаточностью в поврежденную печень на 7 сутки после окончания затравки ССl4 (затравка в течении 42 суток).
9). После имплантации КИК печени (предварительно подготовленный тканеспецифический матрикс с иммобилизированными аутологичными клетками печени и аутологичными мезенхимальными стволовыми клетками костного мозга в виде ассоциатов крысам назначали антикоагулянты в профилактической дозе, например: гепарин 500 ME каждые 12 часов в течение 7-10 дней под контролем свертывающей системы крови и антиагреганты, например, трентал из расчета 45 мг/м2 поверхности тела каждые 12 часов в течение 30-90 дней.
По предложенному способу для коррекции и лечения хронической печеночной недостаточности нами проведено 25 экспериментов на крысах.
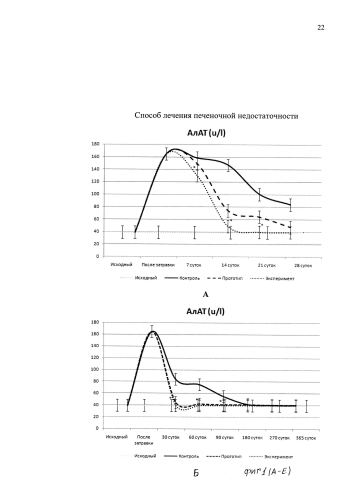
На фиг. 1 изображена динамика показателей цитолиза при моделированной хронической печеночной недостаточности в контроле и при лечении по способу прототипу и по предлагаемому способу, где: А-Б: аланинаминотрансфераза (АлАТ), В-Г: аспартатаминотрансфераза (АсАТ), Д-Е: щелочная фосфатаза (ЩФ). После завершения моделирования хронической печеночной недостаточности (на 42-е сутки от начала затравки) во всех группах нами было выявлено повышение уровня цитолитических ферментов - гипертрансфераземию. Так, уровень АлАТ и АсАТ повышался в 3-4,5 раза, а ЩФ в 5 раз. Из представленных данных следует, что в контрольной и экспериментальных группах динамика биохимических показателей, характеризующих печеночную недостаточность, на этапе затравки была сходной. В дальнейшем эти показатели постепенно начинали снижаться во всех исследуемых группах, но темп снижения в контрольной и исследуемых группах (по способу прототипу и по предлагаемому способу) был разным. Наиболее длительно гипертрансфераземия сохранялась в контрольной группе, где клеточный материал не применялся. Лечение хронической печеночной недостаточности с помощью КИК печени, содержащих КП и МСК КМ, по способу прототипу и по предлагаемому способу также сопровождалось цитолитическими процессами в паренхиматозных клетках печени. Однако эти показатели достигали нормальных значений уже к 30 суткам после имплантации КИК печени, тогда как в контроле нормализация показателей цитолитического синдрома наступала к 180 суткам исследования, а затем показатель АсАТ вновь повышался и не достигал нормальных значений вплоть до конца наблюдения. Динамика нормализации биохимических показателей уровня АлАТ, АсАТ и ЩФ в сыворотке крови крыс при лечении по способу прототипу и по предлагаемому способу достоверно различалась между собой на отдельных сроках наблюдения (более высокий темп нормализации показателей по предлагаемому способу), что свидетельствовало о более высокой степени активности клеток в составе КИК, изготовленному по предлагаемому способу. На фиг. 1. А, В, Д - срок наблюдения 28 суток; Б, Г, Е - срок наблюдения 365 суток; АлАТ для здоровых животных - до 40 ед/л; АсАТ для здоровых животных - до 60 ед/л; ЩФ для здоровых животных - до 350 ед/л.
* - Различие достоверно по сравнению с уровнем ферментов в контроле; p<0,05.
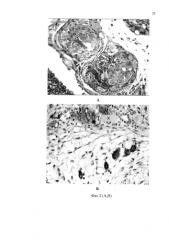
На фиг. 2. представлены гистологические препараты печени в зоне имплантации КИК (КП: МСК КМ=5:1) в паренхиму поврежденной печени на сроке 90 суток после моделирования хронической печеночной недостаточности. Имплантированные КИК изготовлены по предлагаемому способу:
А - аутологичные клетки печени и мезенхимальные стволовые клетки костного мозга на тканеспецифическом матриксе из децеллюляризированной печени в составе КИК печени. Продукция желчи пересаженными гепатоцитами. Окраска гематоксилином и эозином. Увеличение микроскопа ×400.
Б - Жизнеспособные гепатоциты в структуре КИК печени. Иммуногистохимическое исследование с гепатоцитспецифическими антигенами (ОСН1ЕБ) - положительное гранулярное цитоплазматическое окрашивание. Увеличение микроскопа ×400.
На фиг. 3. представлены гистологические препараты печени в зоне имплантации КИК (КП: МСК КМ=5:1) в паренхиму поврежденной печени на сроке 180 суток после моделирования хронической печеночной недостаточности: - аутологичные клетки печени и мезенхимальные стволовые клетки костного мозга на тканеспецифическом матриксе из децеллюляризированной печени сохраняются в составе КИК печени. Окраска по Массону. Увеличение микроскопа ×400.
На этом сроке аутологичные клетки печени, сокультивированные с мезенхимальными стволовыми клетками костного мозга и имплантированные в печень в виде КИК (ассоциаты клеток в составе тканеспецифического матрикса из децеллюляризированной печени), сохраняли свою жизнеспособность и функциональную активность в составе имплантированных КИК печени. Воспалительная реакция и признаки отторжения отсутствовали. Высокая степень сохранения жизнеспособности и функциональной активности клеток в КИК, адгезированных на тканеспецифическом матриксе из децеллюляризированной печени, а также отсутствие в ней выраженных признаков воспаления и отторжения на сроке 180 суток после имплантации, позволяет прийти к заключению, что состав КИК печени является оптимальным.
Во всех случаях был достигнут желаемый результат, а именно были получены данные, свидетельствующие о более эффективном лечении печеночной недостаточности с использованием КИК, изготовленных по предлагаемому способу. Способ позволяет улучшить результаты лечения печеночной недостаточности путем активизации двухсторонних взаимодействий между имплантированными КИК - готовыми гепатоподобными структурами (адгезированные клетки печени, МСК КМ на предварительно подготовл