Фармацевтическая композиция, содержащая биофармацевтическое лекарственное средство
Иллюстрации
Показать всеГруппа изобретений относится к области фармакологии и медицины и касается стабильной фармацевтической композиции, содержащей антитело против TNF-альфа и адипиновую кислоту или адипат, а также применения указанной композиции для лечения, по меньшей мере, одного патологического состояния, выбранного из группы, включающей аутоиммунные заболевания, инфекционные болезни, неопластические заболевания, болезни нервной системы. Группа изобретений обеспечивает снижение агрегации антитела в водных растворах и повышение стабильности при хранении. 2 н. и 7 з.п. ф-лы, 13 табл., 4 ил.
Реферат
Настоящее изобретение относится к фармацевтической композиции, содержащей биофармацевтическое лекарственное средство.
Предпосылки создания изобретения
Биофармацевтические лекарственные средства, такие как белки, являются потенциальным сырьем для изготовления галенова препарата. Поскольку пероральный путь не доступен для большинства биофармацевтических лекарственных средств, композиция должна быть применима для парентерального применения, что предопределяет выбор водных композиций, а также по соображениям стабильности растворимых в воде порошков.
Такая композиция должна выполнять разнообразные задачи. Она должна обладать переносимостью после введения, в случае экстраваскулярного введения обеспечивать соответствующее всасывание биофармацевтического вещества в кровоток, если только место приложения действия не находится в месте введения, и создавать среду, которая гарантирует стабильность биофармацевтического лекарственного средства в терапевтически эффективной концентрации. Кроме того, композиция должна обеспечивать срок годности лекарственного средства по меньшей мере два года.
Обычно композиция биофармацевтического лекарственного средства содержит один или несколько буферов, изотонирующих веществ и воду для инъекций в качестве растворителя. Кроме того, часто добавляют стабилизаторы, такие как, например, криопротектор. Помимо этого, может добавляться один или несколько хелатообразующих агентов и поверхностно-активное вещество. Некоторые вещества могут выполнять двойную функцию, например, некоторые сахара или сахарные спирты могут служить криопротектором и изотонирующим веществом.
В следующей далее таблице приведен один из примеров водной композиции, которая используется для включения в ее состав человеческого моноклонального антитела.
| Соединение | мг | Функция |
| Человеческое моноклональное антитело | 40 | Действующее соединение |
| Хлорид натрия | 4,93 | Изотонирующее вещество |
| Дигидрофосфат натрия × 2 Н2О | 0,69 | Буфер |
| Вторичный кислый фосфат натрия × 2 H2O | 1,22 | Буфер |
| Трехзамещенный цитрат натрия | 0,24 | Буфер |
| Лимонная кислота | 1,04 | Буфер |
| Манит | 9,6 | Изотонирующее вещество |
| Полисорбат 80 ("Tween 80") | 0,8 | Поверхностно-активное вещество |
| Гидроокись натрия | Уравновешивание рН | |
| Вода | До 0,8 мл | Растворитель |
В следующей далее таблице приведен один из примеров лиофилизированной композиции, которая используется для включения в нее химерного моноклонального антитела.
| Соединение | мг на пробирку | Функция |
| Химерное моноклонального антитела | 100 | Действующее соединение |
| Дигидрофосфат натрия × 1 Н2О | 2,2 | Буфер |
| Вторичный кислый фосфат натрия × 1 H2O | 6,1 | Криопротектор |
| Сахароза | 500 | Изотонирующее вещество, криопротектор |
| Полисорбат 80 ("Tween 80") | 0,5 | Поверхностно-активное вещество |
Композиции описанного рода отвечают приведенным выше требованиям переносимости после введения, стабильности биофармацевтического лекарственного средства и срока годности.
Тем не менее, указанные композиции имеют ряд недостатков. Одним из недостатков является то, что многие биофармацевтические лекарственные средства имеют тенденцию к агрегации, что неизбежно изменяет их физиологические свойства. В худшем случае такая агрегация приводит не только к снижению заданной эффективности лекарства, но также к повышению его иммуногенности, что может вызывать серьезные отрицательные последствия. Соответственно, предпочтительная композиция способствует уменьшению агрегации лекарственных средств.
Кроме того, ведутся споры по поводу переносимости некоторых из ингредиентов, используемых в существующих композициях. Это влечет необходимость замены таких ингредиентов.
Соответственно, в основу настоящего изобретения положена задача создания фармацевтических композиций биофармацевтических лекарственных средств, которые могут применяться в качестве альтернативы известных из уровня техники композиций.
Другой задачей настоящего изобретения является создание фармацевтических композиций биофармацевтических лекарственных средств, которые обладают преимуществами по сравнению с известными из уровня техники композициями.
Еще одной задачей настоящего изобретения является создание фармацевтических композиций биофармацевтических лекарственных средств, которые вызывают меньшую агрегацию лекарственных средств, чем известные из уровня техники композиции.
Решение этих задач обеспечивается за счет способов и средств согласно независимым пунктам формулы изобретения. В зависимых пунктах заявлены предпочтительные варианты осуществления. Подразумевается, что в диапазоны значений, ограниченные цифровыми величинами, включены эти предельные величины.
Краткое изложение сущности изобретения
Перед тем, как перейти к подробному описанию изобретения, следует отметить, что настоящее изобретение не ограничено конкретными компонентами описанных или стадия описанных способов, поскольку такие устройства и способы могут изменяться. Также подразумевается, что используемая терминология имеет целью лишь описание частных вариантов осуществления, а не ограничение изобретения. Следует отметить, что используемые в описании и прилагаемой формуле изобретения формы единственного числа имеют значение единственного и/или множественного числа, если контекстом в прямой форме не диктуется иное. Кроме того, подразумевается, что при использовании диапазонов значений, ограниченных цифровыми величинами, в них включены эти предельные величины.
Согласно первой особенности настоящего изобретения предложена фармацевтическая композиция, содержащая биофармацевтическое лекарственное средство и дополнительно содержащая по меньшей мере одну моно- или дикарбоновую кислоту с основной цепью из 2-6 атомов углерода или по меньшей мере одну ее соль. Моно- или дикарбоновая кислота с основной цепью из 2-6 атомов углерода или ее соль также именуется "буфером" в контексте настоящего изобретения.
В соответствии с известным уровнем техники фармацевтические композиции содержат биофармацевтическое лекарственное средство, неорганический буфер или его соль, такой как фосфатный буфер или трикарбоновую кислоту или ее соль, например, лимонную кислоту/цитрат. Она является трикарбоновой кислотой, которая, разумеется, эффективно выполняет функцию буфера. Тем не менее, авторами было обнаружено, что такой буфер может вызывать агрегацию лекарственных веществ.
В ходе исследований авторы неожиданно обнаружили, что композиция, содержащая лимонную кислоту (2-гидроксипропан-1,2,3-трикарбоновую кислоту; С6Н8О7) или цитрат, является менее предпочтительной с точки зрения образования агрегатов, чем композиции, содержащие моно- или дикарбоновую кислоту или ее соль (смотри раздел "Результаты"). Лимонная кислота является разветвленной трикарбоновой кислотой с основной цепью из 5 атомов углерода. Вне связи с какой-либо теорией причиной низкой эффективности лимонной кислоты, возможно, является потенциальное хелатирующее действие, которое три карбоксильные группы такой трикарбоновой кислоты оказывают на заряженные белки, такие как моноклональные антитела.
Подразумевается, что термин "из 2-6 атома углерода" относится ко всем соединениям, имеющим основную цепь 2, 3, 4, 5 или 6 атома углерода.
Используемый в описании термин "биофармацевтическое лекарственное средство" означает любое терапевтическое соединение, полученное из биологического или биотехнологического источника или синтезированное химическим путем и эквивалентное продукту, полученному из упомянутого источника, например, белок, пептид, вакцину, нуклеиновую кислоту, иммуноглобулин, полисахарид, клеточный препарат, растительный экстракт, животный экстракт, рекомбинантный белок или их сочетания. Обычно биофармацевтическое лекарственное средство является действующим ингредиентом биофармацевтического вещества.
Используемый в описании термин "стабилизатор" означает вещество, способствующее сохранению структурной целостности биофармацевтического лекарственного средства, в частности, при замораживании и/или лиофилизация и/или хранении. Такие вещества в контексте настоящего изобретения также именуются "криопротектором" или "лиопротектором".
Используемый в описании термин "моно- или дикарбоновая кислота с основной цепью из n атомов углерода" означает моно- или дикарбоновые кислоты, имеющие прямую алкильную или алкиленовую основную цепь из n атомов углерода. Разумеется, что основная цепь может иметь боковые цепи (например, метиловые группы); тем не менее, атомы углерода, содержащиеся в этих цепях, не учитываются при подсчете атомов углерода основной цепи. Согласно этому определению циклические сахарные кислоты, такие как, например, аскорбиновая кислота, не считаются "моно- или дикарбоновой кислотой с основной цепью из n атомов углерода", поскольку они не имеют прямой алкильной или алкиленовой основной цепи.
В одном из предпочтительных вариантов осуществления изобретения композиция находится в форме, выбранной из группы, включающей
а) водную форму,
б) лиофилизированную форму и/или
в) суспензию.
Композиция в водной форме может являться готовой к введению, а композиция в лиофилизированной форме может быть преобразована в жидкую форму до введения, например, путем добавления воды для инъекций, которая необязательно может содержать консервант, такой как бензиловый спирт, ингибиторы окисления, такие как витамин А, витамин Е, витамин С, ретинил пальмитат и селен, аминокислоты цистеин и метионин, лимонную кислоту и цитрат натрия, синтетические консерванты, такие как эфиры параоксибензойной кислоты, например, метиловый эфир параоксибензойной кислоты и пропиловый эфир параоксибензойной кислоты.
В одном из предпочтительных вариантов осуществления первой особенности настоящего изобретения композиция обеспечивает уменьшение агрегации биофармацевтического лекарственного средства в водном растворе по сравнению с известными из уровня техники композициями.
Используемый в описании термин "агрегация белка" означает образование белковых форм с более высокой молекулярной массой, таких как олигомеры или мультимеры, вместо желаемых заданных форм биофармацевтического лекарственного средства (например, мономера). Соответственно термин агрегация белка является универсальным и обозначает образование дополнительно не указанных мультимерных форм всевозможного рода, которые образуются посредством ковалентных связей или нековалентных взаимодействий.
С целью обнаружения агрегации белка может быть измерен коэффициент полидисперсности (PdI) и средний радиус белка (Z-Ave), например, описанным далее методом динамического рассеяния света (DLS). Агрегаты также могут измеряться описанным далее способом эксклюзионной хроматографии (SE-HPLC или SEC). Агрегаты и частицы в целом также могут измеряться описанным далее методом визуализации микропотоков (MFI).
Моно- или дикарбоновые кислоты, подпадающие под приведенное определение, приведены в следующей далее таблице.
| Таблица 1 | |||
| Общепринятое название | Соль | Научное название | Общая формула |
| Адипиновая кислота | Адипат | Гександикислота | C6H10O4 |
| Яблочная кислота | Малат | Оксибутандикислота | C4H6O5 |
| Винная кислота | Тартрат | 2,3-Диоксибутандикислота | С4Н6О6 |
| Янтарная кислота | Сукцинат | Бутандикислота | C4H6O4 |
| Уксусная кислота | Ацетат | Этановая кислота | C2H4O2 |
| Глутаминовая кислота | Глутамат | 2-аминопентандикислота | C5H9NO4 |
| Щавелево-уксусная кислота | Оксалоацетат | Охобутандикислота | C4H4O5 |
| Глутаровая кислота | Глутарат | Пентандикислота | C5H8O4 |
| α-Кетоглутаровая кислота | α-Кетоглутарат | 2-Оксопентандикислота | C5H6O5 |
| Малеиновая кислота | Малеат | Цис-бутендикислота | C4H4O4 |
| Фумаровая кислота | Фумарат | Транс-бутендикислота | C4H4O4 |
В одном из особо предпочтительных вариантов осуществления моно- или дикарбоновой кислотой или ее солью является дикарбоновая кислота с неразветвленной (т.е. без содержащих атомы углерода боковых цепей) основной цепью из 4, 5 или 6 атомов углерода или ее соль. В одном из особо предпочтительных вариантов осуществления моно- или дикарбоновой кислотой или ее солью является монокарбоновая кислота с неразветвленной основной цепью из 2 атома углерода или ее соль.
Моно- или дикарбоновой кислотой или ее солью особо предпочтительно является по меньшей мере одно из следующего, выбранного из группы, включающей:
уксусную кислоту или ацетат,
глутаминовую кислоту или глутамат,
адипиновую кислоту или адипат,
яблочную кислоту или малат,
винную кислоту или тартрат и/или
янтарную кислоту или сукцинат.
Особо предпочтительной карбоновой кислотой или солью из них является уксусная кислота или ацетат. Предпочтительно она используется в качестве единственной карбоновой кислоты или соли или даже в качестве единственного буфера в фармацевтической композиции согласно настоящему изобретению. Другой особо предпочтительной карбоновой кислотой или солью является адипиновая кислота или адипат. Предпочтительно она используется в качестве единственной карбоновой кислоты или соли или даже в качестве единственного буфера в фармацевтической композиции согласно настоящему изобретению.
Особо предпочтительно, чтобы моно- или дикарбоновая кислота присутствовала водной форме фармацевтической композиции в концентрации от ≥1 до ≤100 мМ, предпочтительно от ≥2 до ≤50 мМ, более предпочтительно от ≥5 до ≤25 мМ.
Кроме того, помимо моно- или дикарбоновой кислоты фармацевтическая композиция также может предпочтительно содержать фосфат натрия (далее - также "NaP") и/или лимонную кислоту или цитрат. Подразумевается, что термин "фосфат натрия" охватывает дигидрофосфат натрия, вторичный кислый фосфат натрия и все их возможные соли и/или гидраты.
Упомянутая водная форма фармацевтической композиции предпочтительно имеет рН от ≥3 до ≤9, предпочтительно от ≥4 до ≤8, более предпочтительно от ≥5 до ≤7.
В еще одном предпочтительном варианте осуществления агрегация белка стимулируется взбалтыванием, напряжением сдвига, множеством циклов замораживания-оттаивания и/или длительным хранением и/или хранением при высоких температурах.
Используемый в описании термин "высокая температура" означает температуру хранения выше -18°С. Предпочтительно высокая температура, превышает температуру, выбранную из группы, включающей 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50°С или даже выше. Тем не менее, одним из ограничений температуры хранения является температура денатурации, которая находится в диапазоне 45-80°С в зависимости от природы соответствующего белка и условий среды.
Используемый в описании термин "длительное хранение" означает хранение фармацевтической композиции в течение более 1 месяца, предпочтительно более 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или даже 24 месяцев.
В другом предпочтительном варианте осуществления настоящего изобретения биофармацевтическим лекарственным средством является белок. Белком может являться природный белок, модифицированный белок (т.е. белок, который был модифицирован относительно его природного аналога, также именуемого шаблоном или матрицей) или полностью синтетический белок (т.е. белок, который не имеет природного аналога).
Белок может быть выделен из природного организма или может быть получен путем ферментации культивированного организма.
Кроме того, белком может являться белок, гомологичный или гетерологичный белку, выделенному из организма.
Особо предпочтительно, чтобы белок присутствовал в водной форме фармацевтической композиции в концентрации от ≥0,1 до ≤500 мг на мл-1, предпочтительно от ≥20 до ≤200 мг на мл-1.
Особо предпочтительно, чтобы белок являлся моноклональным антителом или его фрагментом или производным.
Используемый в описании термин "моноклональное антитело (mAb)" означает композицию антитела, содержащую гомогенную популяцию антитела, т.е. гомогенную популяцию, состоящую из цельного иммуноглобулина или его фрагмента или производного. Такое антитело особо предпочтительно выбирают из группы, включающей IgG, IgD, IgE, IgA и/или IgM или их фрагмент или производное.
Используемый в описании термин "фрагмент" означает фрагменты такого антитела, сохраняющие в некоторых случаях способность связывать мишень, например, CDR (участок, определяющий комплементарность), гипервариабельный участок, вариабельную область (Fv), тяжелую цепь IgG (состоящую из VH, CH1, шарнира, участков СН2 и СН3), легкую цепь IgG (состоящую из участков VL и CL) и/или Fab и/или F(ab)2.
Используемый в описании термин "производное" означает конструктивные элементы белка, отличающиеся по структуре от общего концептуального антитела, но при этом имеющие определенную конструктивную связь с ним, например, scFv, Fab и/или F(ab)2, а также биспецифические, триспецифические или более высокоспецифические конструктивные элементы антител. Все они будут пояснены далее.
Другими производными антител, известными специалистам, являются димерные антитела, верблюжьи антитела, доменные антитела, двухвалентные гомодимеры с двумя цепями, состоящими из scFvs, IgAs (двух структур IgG, соединенных соединительным пептидом и секреторным компонентом), акульи антитела, антитела приматов Нового Света плюс CDR приматов не Нового Света, димеризованные конструктивные элементы, содержащие CH3+VL+VH и конъюгаты антител (например, антитело или фрагменты или производные, связывающие токсин, цитокин, радиоизотоп или метку).
Способы получения и/или выбора химерных, гуманизированных и/или человеческих моноклональных антител известны из техники. Например, в патенте US 6331415 на имя Genentech описано получение химерных антител, в патенте US 6548640 на имя Medical Research Council описаны методы пересадки CDR, а в патенте US 5859205 на имя Celltech описано получение гуманизированных антител. Библиотеки антител in vitro описаны, в частности, в патентах US 6300064 на имя MorphoSys и US 6248516 на имя MRC/Scripps/Stratagene. Методы фагового отображения описаны, например, в патенте US 5223409 на имя Dyax. Платформы трансгенных млекопитающих описаны, например, в патенте US 200302048621 на имя TaconicArtemis.
IgG, scFv, Fab и/или F(ab)2 являются антителами хорошо известных специалистам форматов. Сопутствующие высокоэффективные технологии известны соответствующей справочной литературы.
Используемый в описании термин "Fab" означает фрагмент IgG, содержащий антигенсвязывающий участок и состоящий из одной постоянной области и одной вариабельной области каждой тяжелой и легкой цепи антитела.
Используемый в описании термин "F(ab)2" означает фрагмент IgG, состоящий из двух фрагментов Fab, связанных друг с другом дисульфидным мостиком.
Используемый в описании термин "scFv" означает вариабельный фрагмент с одиночной цепью, представляющий собой результат слияния вариабельных участков тяжелых и легких цепей иммуноглобулинов, связанных друг с другом коротким линкером, обычно серином (S) или глицином (G). Эта химерная молекула сохраняет специфичность исходного иммуноглобулина, несмотря на удаление постоянных участков и введения линкерного пептида.
Антителами модифицированных форматов являются, би- или триспецифические конструктивные элементы антител, слитые белки на основе антител, иммуноконъюгаты и т.п.
В одном из особо предпочтительных вариантов осуществления настоящего изобретения белком является по меньшей мере одно антитело или его фрагмент или производное, выбранное из группы, включающей:
полученное из гибридомы антитело,
химеризованное антитело,
гуманизированное антитело и/или
человеческое антитело.
В другом предпочтительном варианте осуществления настоящего изобретения антителом или его фрагментом или производным является антитело против TNFα.
Один из примеров антитела к TNFα приведен в перечне последовательностей, прилагаемом к настоящей заявке. В нем SEQ ID 1 означает кодирующую последовательность нуклеиновых кислот тяжелой цепи IgG, SEQ ID 2 означает кодирующую последовательность нуклеиновых кислот легкой цепи IgG, а SEQ ID 3 и 4 означают аминокислотные последовательности тяжелой цепи и легкой цепи, соответственно.
SEQ ID 5, 7 и 9 означают аминокислотные последовательности участков, определяющих комплементарность (CDR) легкой цепи (т.е. LC CDR 3, LC CDR 2 и LC CDR 1). SEQ ID 6, 8 и 10 означают аминокислотные последовательности участков, определяющих комплементарность тяжелой цепи (т.е. НС CDR 3, НС CDR 2 и НС CDR 1).
Следует отметить, что SEQ ID 1 и 2 или их части могут быть эквивалентно заменены последовательностями нуклеиновых кислот, кодирующими те же белки или белковые цепи, которые кодируют SEQ ID 1 и 2, но содержащими нуклеотидные замещения, приемлемые при дегенерации генетического кода, последовательностями, кодирующими часть, вариант, гомолог или производное белков или белковых цепей, кодированных SEQ ID 1 и 2, последовательностями нуклеиновых кислот, код которых оптимизирован для заданного экспрессирующего хозяина, и/или молекулой нуклеиновой кислоты, последовательность которой по меньшей мере на 70%, предпочтительно на 95% идентична SEQ ID 1 или 2.
Следует отметить, что SEQ ID 3-10 или их части могут быть эквивалентно заменены аминокислотными последовательностями, содержащими одно или несколько консервативных аминокислотных замещений, т.е. одно или несколько замещений, которые не влияют на существенные признаки белков, такие как сродство к связыванию мишени, иммуногенность, ADCC, время полувыведения из сыворотки и т.д.
Другими предпочтительными антителами являются антитела, которые распознают любой белок или сочетание белков, включающих без ограничения любые из перечисленных белков и/или следующие антигены: CD2, CD3, CD4, CDS, CD11a, CD14, CD18, CD20, CD22, CD23, CD25, CD33, CD40, CD44, CD52, CD80 (В7.1), CD86 (В7.2), CD147, IL-1a, IL-1, IL-2, IL-3, IL-7, IL-4, IL-5, IL-8, IL-10, рецептор IL-2, рецептор IL-4, рецептор IL-6, рецептор IL-13, рецепторные субъединицы IL-18, PDGF-B и их аналоги, PLGF, VEGF, TGF, TGF-β2, TGF-p1, рецептор EGF, рецептор PLGF, рецептор VEGF, фактор роста гепатоцитов, остеопротегерин-лиганд, гамма-интерферон, стимулятор В-лимфоцита, комплемент С5, IgE, опухолеспецифический антиген СА125, опухолеспецифический антиген MUC1, антиген РЕМ, ErbB2/HER-2, опухолеассоциированные эпитопы, повышенные уровни которых присутствуют в сыворотке пациентов, онкоассоциированные эпитопы или белки, экспрессирующие в клетках рака молочной железы, толстой кишки, плоскоклеточного рака, рака простаты, поджелудочной железы, легкого и/или почек и/или в клетках меланомы, глиомы или нейробластомы, в центральной массе некротизированной опухоли, интегрин-альфа-4-бета-7, интегрин VLA-4, интегрины В2, рецепторы TRAIL 1, 2, 3 и 4, RANK, RANK-линанд, TNF-α, адгезивную молекулы VAP-1, молекулу адгезии эпителиальных клеток (ЕрСАМ), молекулу-3 межклеточной адгезии (ICAM-3), адгезин лейкоинтегрин, тромбоцитарный гликобелок gp IIb/IIIa, тяжелую цепь сердечного миозина, паратиреоидный гормон, МНС I, карциноэмбриональный антиген (СЕА), альфа-фетопротеин (AFP), фактор некроза опухолей (TNF), рецептор Fc-y-1, HLA-DR 10-бета, антиген HLA-DR, L-селектин и IFN-γ.
Особо предпочтительно, чтобы антителом являлся IgG.
В качестве альтернативы, биофармацевтическим лекарственным средством является антитело-миметик, т.е. молекула связывающего мишень белка не на основе иммуноглобулина. Многие из упомянутых методов также применимы в отношении этих молекул. Такие антитела-миметики получают, например, из белков с анкириновым повтором, лектинов типа С, А-доменных белков Staphylococcus aureus, трансферринов, липокалинов, фибронектинов, домена Куница ингибиторов протеаз, убиквитина, цистеиновых узлов или ноттинсов, тиоредоксина А и т.д., и они известны специалистам в данной области техники из соответствующей литературы.
В качестве другой альтернативы, биофармацевтическим лекарственным средством является рекомбинантный слитый белок, содержащий любой из упомянутых выше белков или преимущественно сходных белков. Например, биофармацевтическим лекарственным средством, содержащимся в композиции согласно настоящему изобретению, могут являться рекомбинантные слитые белки, содержащие один из упомянутых выше белков плюс домен мультимеризации, такой как лейциновая "молния", двойная спираль, Fc-часть антитела, или преимущественно сходный белок. В частности, такие рекомбинантные слитые белки включают белки, в которых по меньшей мере TNFR- или RANK-часть слита с Fc-частью антитела. Рекомбинантные слитые белки особо предпочтительно содержат связывающий мишень домен и Fc-домен IgG (так называемые молекулы - цент).
В еще одном предпочтительном варианте осуществления настоящего изобретения композиция дополнительно содержит по меньшей мере один стабилизатор, выбранный из группы, включающей аминокислоту, сахарный полиол, дисахарид и/или полисахарид.
Дисахаридом предпочтительно является вещество, выбранное из группы, включающей сахарозу, трегалозу, мальтозу и/или лактозу.
Сахарным полиолом также предпочтительно является вещество, выбранное из группы, включающей маннит и/или сорбит. Из них особо предпочтительным сахарным полиолом является маннит. Он предпочтительно используется в качестве единственного сахарного полиола или даже единственного стабилизатора в фармацевтической композиции согласно настоящему изобретению.
Стабилизаторы, подпадающие под указанное определение, приведены в следующей таблице.
| Таблица 2 | ||
| Общепринятое название | Научное название | Общая формула |
| Аргинин | (S)-2-Амино-5-гуанидинпентановая кислота | C6H14N4O2 |
| Глицин | Аминоуксусная кислота | C2H5NO2 |
| Маннит | (2R,3R,4R,5R)-Гексан-1,2,3,4,5,6-гексол | C6H14O6 |
| Сорбит | (2S,3R,4R,5R)-Гексан-1,2,3,4,5,6-гексол | С6Н14О6 |
| Ксилит | (2R,3R,4S)-Пентан-1,2,3,4,5-пентол | C5H12O5 |
| Сахароза | β-D-Фруктофуранозил-(2→1)-α-D-глюкопиранозид | C12H22O11 |
| Трегалоза | A-D-Глюкопиранозил α-D-глюкопиранозид | C12H22O11 |
| Лактоза | 4-O-β-D-Галактопиранозил-D-глюкоза | C12H22O11 |
| Мальтоза | 4-O-α-D-Глюкопиранозил-D-глюкоза | C12H22O11 |
| Декстран | Полисахарид | Н(C6H10O5)xOH |
Особо предпочтительно, чтобы стабилизатор присутствовал в водной форме фармацевтической композиции в концентрации от ≥1 мМ до ≤300 мМ, предпочтительно от ≥2 мМ до ≤200 мМ, более предпочтительно от ≥5 мМ до ≤150 мМ.
В еще одном предпочтительном варианте осуществления настоящего изобретения композицией является композиция, применимая для парентерального введения, предпочтительно внутривенного, внутримышечного и/или подкожного введения.
В еще одном предпочтительном варианте осуществления настоящего изобретения композиция дополнительно содержит по меньшей мере одно вещество, выбранное из группы, включающей:
поверхностно-активное вещество,
изотонирующее вещество и/или
комплексен металлических ионов.
Поверхностно-активное вещество усиливает смачиваемость компонентов и способствует их растворимости. Это в особенности важно, поскольку биофармацевтические лекарственные средства часто содержатся в высоких концентрациях (например, >100 мг в 1-10 мл).
Применимыми поверхностно-активными веществами являются, например, лецитин и другие неионные поверхностно-активные вещества, такие как полисорбаты ("Tween") или полоксамеры. Особо предпочтительными поверхностно-активными веществами являются полисорбат 80 ("Tween 80") и полоксамер 188.
Изотонирующее вещество служит для установления осмотического давления композиции согласно изобретению на физиологически приемлемом уровне, например, на уровне осмолярности крови.
Изотонирующее вещество является физиологически приемлемым компонентом и не ограничено конкретным веществом. Типичными примерами изотонирующего вещества являются, например неорганическая соль, такая как хлорид натрия, хлорид калия или хлорид кальция и т.п. Они могут применяться отдельно или в смеси.
Комплексен металлических ионов служит комплексообразованию тяжелых металлов, которые в противном случае могут инактивировать биофармацевтическое лекарственное средство, содержащееся в композиции согласно изобретению. Предпочтительно комплексоном металлических ионов является EDTA и/или EGTA.
Согласно второй особенности настоящего изобретения предложено биофармацевтическое лекарственное средство, входящее в состав композиции согласно первой особенности настоящего изобретения.
Согласно еще одной (третьей) особенности настоящего изобретения предложена первичная упаковка, такая как предварительно наполненный шприц или ланцет, пробирка или инфузионный мешок, содержащий композицию согласно первой особенности изобретения и/или биофармацевтическое лекарственное средство согласно второй особенности настоящего изобретения.
Предварительно наполненный шприц или ланцет может содержать композицию в лиофилизированной форме (которая затем должна быть сделана растворимой, например, с помощью воды для инъекций до введения) или в водной форме. Шприц или ланцет часто является изделием только для одноразового применения и может иметь объем от 0,1 до 20 мл. Тем не менее, шприц или ланцет также может представлять собой шприц или ланцет многоразового использования или дозирования.
Пробирка также может содержать композицию в лиофилизированной форме или в водной форме и может служить устройством одноразового или многоразового использования. В качестве устройства многоразового использования пробирка может иметь больший объем.
Инфузионный мешок обычно содержит композицию в водной форме и может иметь объем от 20 до 5000 мл.
Согласно дополнительной (четвертой) особенности изобретения предложено применение фармацевтической композиции и/или биофармацевтического лекарственного средства и/или первичной упаковки согласно первой, второй и третьей особенностям, соответственно, настоящего изобретения для лечения по меньшей мере одного патологического состояния, выбранного из группы, включающей:
аутоиммунные болезни,
инфекционные болезни
новообразования и/или злокачественные опухоли (рак) и/или
болезни нервной системы.
Соответствующими аутоиммунными болезнями являются артрит и ревматизм, такой как псориаз, болезнь крона или ревматоидный артрит. Соответствующими инфекционными болезнями являются вирусные и/или бактериальные инфекции. Соответствующими новообразованиями и/или злокачественными опухолями являются саркомы, карциномы, лимфомы и лейкемии, предпочтительно, рак легкого, рак молочной железы, рак яичников, рак толстой кишки, рак простаты, рак шейки матки и т.п. Соответствующими болезнями нервной системы являются в том числе нейродегенеративные расстройства, такие как болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз, болезнь Хантингтона или боковой амиотрофический склероз.
Описание чертежей и экспериментов
Дополнительные подробности, признаки, характеристики и преимущества объекта изобретения заявлены в зависимых пунктах формулы изобретения и раскрыты в следующем далее описании соответствующих чертежей и примеров, в которых в проиллюстрированы предпочтительные варианты осуществления настоящего изобретения. Тем не менее, эти чертежи никоим образом не подразумевают ограничение объема изобретения.
В описанных далее экспериментах композиции согласно настоящему изобретению подвергали воздействию особо стрессовых условий, способствующих агрегации. Соответственно, эксперименты имеют целью продемонстрировать эффективное предотвращение агрегации посредством композиции согласно настоящему изобретению.
Краткое описание чертежей
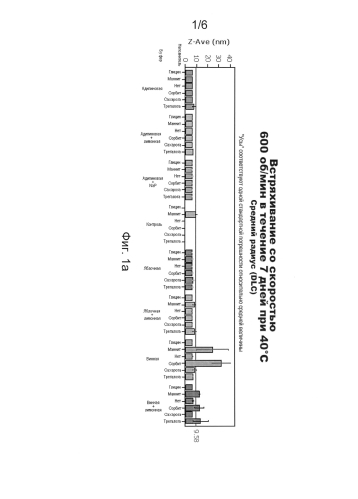
На фиг.1 показана вызванная напряжением сдвига агрегация в "жестких" условиях, измеренная методом динамического рассеяния света (DLS) и выраженная в пересчете на средний радиус белка (Z-Ave; фиг.1а) и коэффициент полидисперсности (PdI; фиг.1б). Соответствующий средний показатель контрольной композиции, содержащей лимонную кислоту и NaP, обозначен горизонтальной линией. Уровень агрегации прямо пропорционален PdI и увеличению среднего радиуса белка (Z-Ave), что означает, что композиции с величиной Z-Ave и/или PdI ниже горизонтальной линии демонстрировали лучшие свойства агрегации (т.е. меньшую агрегацию), чем контрольная композиция. Данные, лежащие в основе диаграммы на фиг.1, представлены в Таблице 6.
На фиг.2 показана вызванная замораживанием-оттаиванием (FT) агрегация в "жестких" условиях, измеренная методом DLS и выраженная в пересчете на Z-Ave (фиг.2а) и PdI (фиг.2б). Соответствующий средний показатель контрольной композиции обозначен горизонтальной линией. Уровень агрегации прямо пропорционален PdI и увеличению среднего радиуса белка (Z-Ave), что означает, что композиции с величиной Z-Ave и/или PdI ниже горизонтальной линии демонстрировали лучшие свойства агрегации (т.е. меньшую агрегацию), чем контрольная композиция. Данные, лежащие в основе диаграммы на фиг.2, представлены в Таблице 6.
На фиг.3 проиллюстрированы исследования стабильности, проведенные с использованием различных буферов в композиции, содержащей 105 мМ NaCl, 0,1% Tween 80 и 66 мМ маннита, при рН 5,2. Концентрация антитела составляла 50 мг/мл. Образцы хранили при различных температурах (5°С, 25°С и 40°С) и подвергли анализу методом эксклюзионной хроматографии с целью определения степени чистоты (фиг.3а) и уровней агрегации (АР = пики агрегации, фиг.3б). Данные, лежащие в основе диаграммы на фиг.3, представлены в Таблице 7.
На фиг.4 проиллюстрированы дальнейшие исследования стабильности, проведенные с целью обнаружения невидимых частиц методом визуализации микропотоков (MFI) в тех же условиях, что и на фиг.3. Представлены четыре различных испытания с частицами различных размеров (5-10 мкм (фиг.4а) в сравнении с >10 мкм (фиг.4б)). Данные, лежащие в основе диаграммы на фиг.4, представлены в Таблице 8.
Эксперименты
Перед тем, как перейти к подробному описанию экспериментов и их результатов, следует упомянуть, что эти эксперименты были проведены с использованием фармацевтических композиций, действующим ингредиентом которых являлось антитело против TNF-α (гуманизированный IgG с молекулярной массой около 150 килодальтон). С учетом структурного сходства антител, содержащих общий концептуальный IgG, специалист поймет, что полученные результаты могут быть непосредственно перенесены на фармацевтические композиции, содержащие мышиные, кроличьи, химерные, гуманизированные и/или человеческие антитела на основе IgG, и/или на антитела против других мишеней, например, против EGFR, против ErbB2, против CD 20, против VEGF и т.д. (смотри выше список потенциальных мишеней). Кроме того, специалист также поймет, что они также могут быть перенесены на описанные выше антитела-миметики, производные антител, модифицированные форматы антител или рекомбинантные слитые белки.
Помимо этого, хотя в прямой форме описаны некоторые сочетания буфера/стабилизатора, которые являются особо предпочтительными, специалист поймет, что на различных фигурах чертежей и в таблицах могут быть представлены конкретные сочетания буфера/стабилизатора, обладающие более высокой или такой же эффективностью, как и соответствующий контрольный буфер. Соответственно, хотя эти сочетания не описан