Новый способ пцр-секвенирования и его применение в генотипировании hla
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан способ ПЦР-секвенирования, включающий следующие стадии: получение образца; амплификация; смешивание; фрагментация; секвенирование и сплайсинг. Настоящее изобретение также относится к праймерным меткам, используемым в указанном способе, а также к способу генотипирования, в частности, в анализе HLA. Настоящее изобретение также относится к ПЦР-праймерам для HLA-A/B, HLA-C и HLA-DQB1. Изобретение позволяет повысить длину продукта ПЦР, который может быть секвенирован секвенатором, без повышения цены и/или редукции. 3 н. и 16 з.п. ф-лы, 18 ил., 13 табл., 12 пр.
Реферат
Родственные заявки
В настоящей заявке испрашивается право на приоритет заявок на патент Китая N№ 201010213717.6, 201010213719.5 и 201010213721.2, поданных 30 июня 2010 г., и право на приоритет Международных заявок N№ PCT/CN2010/002150 и PCT/CN2010/002149, поданных 24 декабря 2010 г., содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Область техники, к которой относится изобретения
Изобретение относится к области секвенирования нуклеиновых кислот, в частности к области ПЦР-секвенирования. Настоящее изобретение также относится к технике считывания штрихового кода ДНК и к стратегии неполного фрагментирования ДНК. Способ согласно изобретению может быть применен, в частности, в технологии секвенирования второго поколения, а особенно, в технологии парно-концевого секвенирования второго поколения, а также в генотипировании HLA. Более конкретно, настоящее изобретение относится к способу генотипирования HLA, а в частности, к способу генотипироавания HLA-A, HLA-B, HLA-C и HLA-DQB1, а также к парам праймеров, используемым в ПЦР-амплификации, применяемой в этом способе.
Предшествующий уровень техники
Метод ПЦР-секвенирования означает технологию, в которой ДНК-фрагменты представляющего интерес гена получают методом ПЦР, а затем полученные ДНК-фрагменты представляющего интерес гена подвергают ДНК-секвенированию с получением информации о последовательности ДНК представляющего интерес гена. Методы ПЦР-секвенирования широко применяются в таких областях, как детектирование мутации генов и генотипирование в течение длительного периода времени.
Технология ДНК-секвенирования подразделяется, главным образом, на технологию ДНК-секвенирования первого поколения, осуществляемую методом секвенирования по Сэнгеру, и на технологию ДНК-секвенирования второго поколения, осуществляемую на секвенаторе Illumina GA, Roche 454, ABI Solid, и т.п. Метод ДНК-секвенирования по Сэнгеру отличается простотой экспериментальных операций с получением визуальных и точных результатов и непродолжительностью времени проведения эксперимента, а поэтому этот метод широко применяется в таких областях, как клиническое детектирование мутации генов и генотипирование, где необходима быстрая оборачиваемость процесса, особенно, если это касается результатов детектирования. Однако из-за низкой производительности и высокой стоимости этого метода, его применение в области крупномасштабного генотипирования имеет определенные ограничения.
По сравнению с технологией ДНК-секвенирования первого поколения, технология ДНК-секвенирования второго поколения отличается тем, что она имеет высокую производительность секвенирования, низкую стоимость, высокий уровень автоматизации и возможность одномолекулярного секвенирования. Если взять в качестве примера технологию одномолекулярного секвенирования Illumina GA, то путем секвенирования по одной молекуле можно получить данные для 50G (около 50 миллиардов) оснований, то есть в среднем 5 миллиардов оснований в день, при этом средняя стоимость секвенирования основания составляет менее чем 1/1000 от стоимости секвенирования по методу Сэнгера. Кроме того, анализ результатов может быть непосредственно осуществлен на компьютере. Таким образом, технология секвенирования ДНК на секвенаторе второго поколения представляет собой технологию, наиболее подходящую для крупномасштабного секвенирования. Однако в технологии ДНК-секвенирования второго поколения, длина участка непрерывного секвенирования по всей его длине обычно невелика. В настоящее время максимальная длина двунаправленного секвенирования на секвенаторе Illumina GA составляет 200 п.н., и хотя в методе Roche 454 GS-FLX максимальная длина последовательности для секвенирования может составлять примерно до 500 п.н., однако затраты на такое секвенирование довольно велики, а производительность - низка. Если ПЦР-ампликон имеет длину, превышающую максимальную длину, которая может быть непрерывно секвенирована в данном секвенаторе, то секвенирование всего ампликона не может быть осуществлено путем прямого секвенирования, а поэтому не может быть получена информация о всей длине последовательности ДНК ампликона. Из-за короткой максимальной длины секвенирования применение технологии секвенирования второго поколения в методе ПЦР-секвенирования имеет определенные ограничения. Помимо поэтапного усовершенствования технологии секвенирования в целях увеличения максимальной длины секвенирования, крайне необходимо разработать новый способ, который позволял бы решить существующие в настоящее время проблемы, связанные с максимальной длиной ДНК-секвенирования на секвенаторе второго поколения, и который можно было бы применять в технологии ПЦР-секвенирования.
Главный комплекс гистосовместимости человека (HLA) представляет собой одну из генных систем, которые, как известно, имеют самый высокий полиморфизм. HLA представляет собой главную генную систему для модуляции специфического иммунного ответа в организме человека и определения различий в восприимчивости индивидуумов к развитию заболеваний и непосредственно ассоциируется с отторжением аллогенных органов-трансплантатов. Проведенные исследования показали, что чем выше степень соответствия генов, таких как HLA-A, B, C, DRB1 и DQB1, а также степень их разрешения при генотипировании у донора и реципиента, тем выше выживаемость трансплантата. В настоящее время перед трансплантацией гемопоэтических стволовых клеток уже проводится стандартная процедура тестирования, заключающаяся в высокопроизводительном генотипировании HLA у потенциальных доноров и реципиентов.
Современная международная стандартная технология высокоразрешающего HLA-генотипирования представляет собой метод ПЦР-секвенирования, проводимый на основе технологии секвенирования по Сэнгеру, которая включает ПЦР-амплификацию соответствующих областей гена HLA, секвенирование амплифицированного продукта, генотипирование результатов секвенирования с помощью профессиональной компьютерной программы по генотипированию и, наконец, получение информации о генотипе HLA-образца. Этот метод отличается тем, что он дает визуальные результаты, имеет высокое разрешение и позволяет детектировать новые аллели. Однако из-за высокой стоимости и низкой производительности метода секвенирования по Сэнгеру, его применение в научно-исследовательских институтах, имеющих регистрационную базу данных о добровольцах-донорах гемопоэтических стволовых клеток (банк клеток костного мозга), где требуется проведение крупномасштабного детектирования путем HLA-генотипирования, имеет определенные ограничения.
Сообщалось, что для HLA-генотипирования было применено ПЦР-секвенирование методом Roche 454 GS-FLX. Однако поскольку этот метод является довольно дорогостоящим, то он не имеет явных преимуществ в отношении производительности и стоимости секвенирования по сравнению с методом HLA-генотипирования, проводимым путем секвенирования по Сэнгеру. По сравнению с методом Roche 454 GS-FLX, метод Illumina GA оперирует с более короткой максимальной длиной непрерывного секвенирования, но имеет явные преимущества, такие как высокая производительность и низкая стоимость секвенирования. Если будет решена проблема, связанная с небольшой максимальной длиной секвенирования в методе Illumina GA, то применение этого метода для HLA-генотипирования позволит скомпенсировать недостатки современных методов HLA-генотипирования.
Описание сущности изобретения
При одновременном проведении анализов путем секвенирования последовательностей со специфическим геном в большом числе образцов с применением технологии секвенирования второго поколения обычно применяется стратегия ПЦР-секвенирования, в которой непосредственно используется комбинация индексирования праймера и технологии секвенирования второго поколения. Если максимально возможная длина непрерывного секвенирования в секвенаторе может покрывать длину всего ПЦР-продукта, то вышеуказанная стратегия удовлетворяет предъявляемым требованиям. Если максимальная длина секвенирования в секвенаторе не может покрывать длину всего ПЦР-продукта, то секвенатор Illumina GA необходимо заменить секвенатором второго поколения, имеющим большую максимальную длину секвенирования (таким как Roche 454 GS-FLX). Если максимальная длина секвенирования последовательности все еще не удовлетворяет этим требованиям, то может быть использован секвенатор первого поколения со скарификацией стоимости и производительности.
Фактически, ситуация заключается в том, что секвенатор Illumina GA отличается исключительно высокой производительностью, но его максимальная длина секвенирования составляет лишь 200 п.н.; и хотя максимальная длина секвенирования на секвенаторе Roche 454 GS-FLX может достигать примерно 500 п.н., но стоимость такого секвенирования остается относительно высокой, а производительность - относительно низкой; и кроме того, хотя максимальная длина секвенирования на секвенаторе первого поколения может достигать более чем 1000 п.н., однако его производительность и стоимость не сравнима с производительностью и стоимостью секвенатора второго поколения.
Авторам пока не известен метод, позволяющий увеличивать длину ПЦР-продуктов, которые могут быть секвенированы по всей их длине без скарификации стоимости и производительности. Комбинация индексирования праймеров, стратегии неполного фрагментирования ДНК и применения технологии секвенирования второго поколения, описанных в настоящей заявке, позволяет оперировать с ПЦР-продуктами, которые имеют длину, превышающую максимальную длину непрерывного секвенирования на секвенаторе, и при этом позволяет полностью использовать преимущества технологии секвенирования второго поколения, такие как высокая производительность и низкая стоимость, что значительно расширяет область применения такой технологии. Среди прочих технологий секвенирования второго поколения, технология секвенирования второго поколения, применяемая в настоящем изобретении, включает секвенирование с обоих концов и ПЦР-секвенирование, в котором для ПЦР-матрицы используется эталонная последовательность ДНК.
Настоящее изобретение относится к способам ПЦР-секвенирования, которые позволяют устранить ограничения, связанные с короткой максимальной длиной секвенирования на секвенаторе и расширить область применения технологии второго поколения в ПЦР-секвенировании ДНК. Так, например, при секвенировании с применением технологии второго поколения используют индексированные праймеры, имеющие индекс, добавленный к его 5'-концу, и амплифицированные ПЦР-продукты фрагментируют, после чего фрагментированные продукты репарируют по концам, и к их 3'-концам присоединяют дезоксиаденозин (A), а затем лигируют с различными адаптерами, полученными без проведения ПЦР.
Метод ПЦР-секвенирования, проводимый на основе штрихового кодирования ДНК и стратегии неполного фрагментирования ДНК, позволяет значительно увеличить число специфически меченых образцов без увеличения числа индексов праймера (фигура 5). В настоящем изобретении фактически секвенируемая длина ПЦР-продуктов превышает максимальную длину секвенирования на секвенаторе из-за добавления индексов праймера к прямому и обратному ПЦР-праймерам, и секвенирование осуществляют в комбинации со стратегией неполного фрагментирования ДНК и с технологией секвенирования второго поколения.
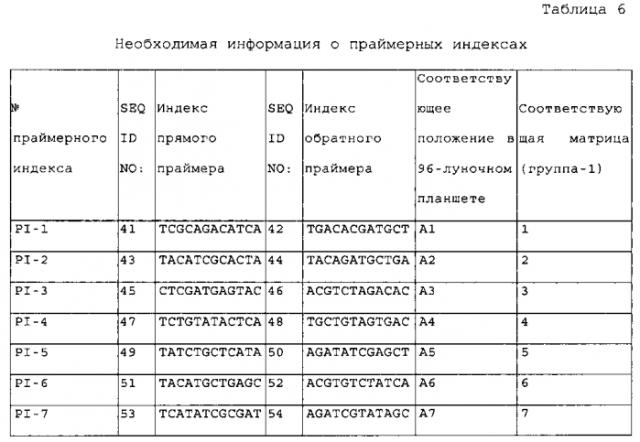
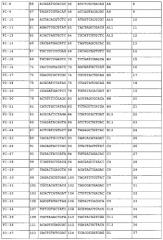
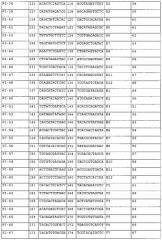
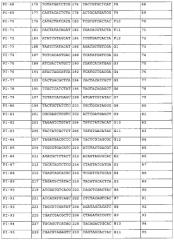
Добавление последовательности-индекса к переднему концу праймера для амплификации осуществляют в целях реализации одновременного секвенирования множества образцов. Более конкретно, уникальный индекс праймера добавляют к каждому образцу в процессе ПЦР с применением технологии ПЦР-индекса/штрих-кода в комбинации с синтезом индексированного праймера путем добавления индекса к 5'-концу ПЦР-праймера. Так, например, во время секвенирования, проводимого с применением технологии секвенирования второго поколения, образцы последовательно процессируют только в стадии ПЦР, а в остальных экспериментальных стадиях эти образцы могут быть смешаны и процессированы одновременно, и конечный результат для каждого образца может быть идентифицирован по индексу его уникального праймера.
Метод индексирования «адаптера» или «адаптера библиотеки» означает метод индексирования библиотек, включающий добавление к множеству библиотек для секвенирования различных адаптеров библиотек (различных адаптеров библиотек, состоящих из различных последовательностей и различных частей последовательностей, называемых адаптерными индексами), конструирование индексированных библиотек для секвенирования, и последующее секвенирование множества различных индексированных библиотек для секвенирования в пуле, где конечный результат секвенирования каждой индексированной библиотеки для секвенирования отличается друг от друга. Термин «адаптер PCR-FREE-библиотеки» означает сегмент, сконструированный из оснований, главная роль которых заключается в дополнительной фиксации молекулы ДНК на чипе для секвенирования и в обеспечении сайтов связывания для универсальных секвенирующих праймеров, где адаптер PCR-FREE-библиотеки может быть непосредственно лигирован с двумя концами ДНК-фрагментов в библиотеке для секвенирования. Поскольку при введении адаптера не проводят ПЦР, то такой адаптер называется здесь «адаптер PCR-FREE-библиотеки». Так, например, адаптеры PCR-FREE-библиотеки, используемые в примерах настоящего изобретения, были получены от ILLUMIA.
Метод конструирования PCR-FREE-библиотеки, где используется технология индексирования адаптера библиотеки, заключается в непосредственном лигировании адаптера библиотеки к двум концам ДНК-фрагмента в библиотеке для секвенирования. Поскольку при введении адаптера библиотеки не проводят ПЦР, то такой адаптер называется здесь «адаптер PCR-FREE-библиотеки». Для лигирования в процессе введения может быть использована ДНК-лигаза. Поскольку в процессе конструирования библиотеки не проводят ПЦР, то неточности конечных результатов ПЦР можно избежать во время конструирования библиотеки, содержащей ПЦР-продукты с большой степенью сходства последовательностей.
Методами амплификации ДНК, методами экстракции ДНК, методами очистки ДНК и методами выравнивания последовательностей ДНК, применяемыми в настоящем изобретении, могут быть методы, известные специалистам. Указанные методы могут быть выбраны самим специалистом, исходя из практических соображений. Что касается методов секвенирования ДНК, то специалист в данной области может осуществить их в соответствии со стандартными процедурами или в соответствии с инструкцией, прилагаемой к секвенатору.
Конструирование индексов праймера может быть осуществлено в зависимости от применяемой концепции эксперимента. Что касается концепции секвенирования методом Illumina GA, то в настоящем изобретении при конструировании праймерных индексов были предприняты следующие действия: 1) последовательность мононуклеотидного повтора, содержащая 3 или более основания, была удалена в последовательностях праймерных индексов, 2) общее количество оснований A и оснований C в одном и том же сайте всех праймерных индексов составляет 30%-70% от количества всех оснований, 3) содержание GC в последовательности праймерных индексов составляет 40-60%, 4) праймерные индексы отличаются друг от друга по меньшей мере 4 основаниями, 5) последовательности, имеющие высокую степень сходства с праймерами для секвенирования методом Illumina GA, были удалены из последовательностей-индексов праймеров, и 6) случаи, в которых добавление последовательностей праймерных индексов к ПЦР-праймерам приводит к образованию крупных шпилек и димеров, были сведены к минимуму.
В настоящем изобретении два праймерных индекса (которые являются либо идентичными, либо различными) добавляли к двум концам ПЦР-продукта, соответственно, так, чтобы индекс праймера у любого конца ПЦР-продукта мог служить специфической меткой, идентифицирующей образец ПЦР-продукта. Полученный ПЦР-продукт подвергали неполному фрагментированию. Так называемое «неполное фрагментирование» означает процесс получения продуктов, содержащих интактные нефрагментированные ПЦР-продукты и частично фрагментированные ПЦР-продукты. Методами фрагментирования являются, но не ограничиваются ими, методы химического фрагментирования (такие как ферментативное расщепление) и методы физического фрагментирования. Методами физического фрагментирования являются методы ультразвукового фрагментирования или методы механического фрагментирования. Фрагментированную ДНК подвергают электрофорезу в 2% агарозе, и все ДНК-полосы, имеющие длину между максимальной длиной секвенирования и максимально приемлемой длиной ДНК для секвенирования на секвенаторе, очищают и выделяют путем разрезания геля (наибольшая длина ДНК, приемлемая для секвенатора Illumina GA составляет 700 п.н., и эта длина означает исходную длину ДНК, которая не включает длину последовательности адаптера библиотеки). Методами очистки и выделения являются, но не ограничиваются ими, выделение путем электрофореза и разрезания геля, и выделение на магнитных сферах. Из выделенных ДНК-фрагментов конструируют библиотеки для секвенирования в соответствии с процедурами конструирования библиотек для секвенирования на секвенаторе второго поколения, а затем продукты подвергают секвенированию. Библиотеки для секвенирования предпочтительно конструируют в соответствии с PCR-FREE-процедурами, подходящими для конструирования библиотек для секвенирования, а методом секвенирования является метод секвенирования с обоих концов. Конструирование PCR-FREE-библиотек для секвенирования осуществляют методами, известными специалистам. При получении данных секвенирования, информация о последовательностях всех тест-образцов может быть получена исходя из последовательностей праймерных индексов. Считанные последовательности (последовательности-«риды») сопоставляют путем выравнивания с соответствующими эталонными ДНК-последовательностями ПЦР-продуктов с помощью BMA, а затем осуществляют сборку полноразмерной последовательности исходя из перекрывания и характера сцепления между последовательностями-ридами (фигура 1). Используемый здесь термин «сцепление» означает присоединение по концам, определяемое параметрами парно-концевого секвенирования.
Секвенирование на секвенаторе Illumina GA (геномный аналитический секвенатор, выпускаемый фирмой Illumina Inc., для краткости называемый здесь Illumina GA), то есть анализ последовательности ДНК, осуществляют, как в принципе и всякое секвенирование, путем синтеза. Этот анализ может быть применен в фазе гаплотипирования, и полученные данные, в конечном счете, представляют собой серию последовательностей оснований, которые могут быть непосредственно подвергнуты выравниванию с эталонными последовательностями, имеющимися в базе данных HLA. Поскольку эта программа не давала каких-либо заметных ошибок, а именно, несоответствий пиков, обычно наблюдаемых у существующих традиционных программ типирования, то желательно, чтобы эта программа типирования была автоматизирована. Секвенатор Illumina GA имеет высокую производительность секвенирования. В настоящее время один единственный раунд секвенирования позволяет получить данные о 50G (50 миллиардов) оснований, то есть, в среднем, 5 миллиардов оснований в день. Благодаря такой высокой производительности, для каждой последовательности может быть достигнута высокая процедурная мощность секвенирования, что дает гарантию надежности результатов секвенирования.
До сих пор каких-либо исследований по применению секвенирования на Illumina GA для HLA-типирования не проводилось. В настоящем изобретении впервые применяется секвенирование на Illumina GA для HLA-типирования, и такой метод HLA-типирования является не дорогостоящим и высокопроизводительным, а также имеет высокую точность и высокое разрешение, если его проводят в комбинации с применением технологии ПЦР-секвенирования и технологии считывания штрих-кода ДНК, с неполным фрагментированием ДНК и созданием PCR-FREE-библиотеки.
В настоящем изобретении с помощью метода ПЦР-секвенирования, основанного на технологии считывании штрих-кода ДНК, неполного фрагментирования ДНК и получения PCR-FREE-библиотеки, анализируемые образцы подразделяют на группы, после чего образцы каждой группы подвергают амплификации фрагментов представляющих интерес генов HLA с использованием праймеров, меченных двунаправленными праймерными индексами (максимальная длина ПЦР-продуктов зависит от максимальной длины ДНК, которая может быть использована в секвенаторе; при этом в современном секвенаторе Illumina GA максимально приемлемая длина считывания ДНК составляет 700 п.н. и такую длину имеет исходная ДНК, которая не включает последовательности адаптера библиотеки), затем ПЦР-продукты объединяют вместе в том же количестве и подвергают неполному фрагментированию с получением индексированной PCR-FREE-библиотеки для секвенирования ДНК. Различные индексированные библиотеки для секвенирования, полученные из образцов различных групп, смешивают в равном молярном объеме, а затем все ДНК-фрагменты, длина которых превышает максимальную длину секвенирования в секвенаторе, селективно выделяют и подвергают секвенированию на секвенаторе Illumina GA. Последовательности-риды ДНК для каждого образца могут быть получены путем скрининга информации о последовательностях индексов адаптеров, индексов праймеров и ПЦР-праймеров в общих данных по секвенированию. Полученные последовательности ДНК, после их сборки, сопоставляют с соответствующими данными, имеющимися в профессиональной базе данных HLA IMGT, и наконец, определяют генотип HLA образца.
В вышеописанных методах, после фрагментирования указанной ДНК, ДНК образцов различных групп лигируют с другим адаптером библиотеки во время PCR-FREE-получения индексированной библиотеки, а поэтому в нижеследующих стадиях типирования полученные данные секвенирования последовательно идентифицируют для каждого образца по индексам праймеров и индексам адаптеров, используемых в каждом образце. Последовательности каждого образца выравнивают с известной эталонной последовательностью ДНК, соответствующей ПЦР-продукту, с помощью компьютерной программы. Исходя из перекрывания последовательностей и характера их сцепления, сборку интактной последовательности для ПЦР-продукта осуществляют из последовательностей фрагментированной ДНК.
Настоящее изобретение относится к методам HLA-генотипирования высокого разрешения, осуществляемым путем секвенирования на Illumina GA, и, тем самым, к секвенированию гаплотипов, а также к автоматизации компьютерной программы типирования, к повышению производительности HLA-генотипирования и к снижению их стоимости.
Из-за требований, предъявляемых к длине ДНК-матрицы в современных методах секвенирования, и из-за небольшой длины ридов, исходные ПЦР-праймеры, используемые в методах HLA-SBT, больше не могут быть применены в HLA-типировании высокого разрешения, основанном на новых методах секвенирования. В настоящем изобретении были сконструированы новые ПЦР-праймеры с хорошей специфичностью и консервативностью, которые позволяют независимо амплифицировать экзоны 2, 3, 4 гена HLA-A, B и дают ПЦР-продукты с длиной не более чем 700 п.н., которые могут быть, в частности, использованы в секвенаторе Illumina GA (максимальная длина ДНК, подходящая для современного секвенатора Illumina GA, составляет 700 п.н.). Настоящее изобретение относится к набору ПЦР-праймеров, подходящих для широкомасштабного, высокопроизводительного и не дорогостоящего HLA-генотипирования у индивидуумов (в частности, у человека).
В техническом решении, используемом в настоящем изобретении, все наиболее поздние последовательности гена HLA-A/B загружают из web-сайта Интернета IMGT/HLA (http://www.ebi.ac.uk/imgt/hla/), а затем сохраняют на локальном диске как набор данных HLA-A; при этом все самые последние последовательности гена HLA-I, отличающиеся от последовательностей HLA-A, загружают как набор данных для сравнения. Указанные два набора данных сравнивают для поиска консервативных и специфических последовательностей для каждого генного сайта в двух концевых и внутренних частях экзонов 2, 3, 4, и сконструированную последовательность ПЦР-праймера сравнивают с полноразмерной последовательностью человеческого генома для поиска гомологии. Поскольку последовательность гена HLA-A/B имеет высокую степень сходства с последовательностями других генов, принадлежащих к молекулам HLA-I, то при конструировании ПЦР-праймеров 3'-конец праймера должен иметь, если это возможно, такую специфичность, которая гарантировала бы специфичность амплификации гена HLA-A/B с использованием этих праймеров. При этом длина ПЦР-продуктов составляет менее чем 700 п.н., а температура отжига прямого и обратного праймеров, по существу, является одинаковой.
Множество пар-кандидатов на праймеры HLA-A/B, удовлетворяющие требованиям протокола, используют для амплификации матричных ДНК, принадлежащих к общим серотипам HLA-A/B. Из этих праймеров было скринировано два набора ПЦР-праймеров HLA-A/B (по 6 пар для каждого набора) с наибольшей консервативностью и специфичностью, для их применения в целях амплификации экзонов 2, 3 и 4, соответственно.
Два набора ПЦР-праймеров (по 6 пар для каждого набора) были использованы в качестве базовых праймеров, на основе которых было сконструировано 95 наборов индексированных праймеров, используемых для амплификации 95 и 950 ДНК-матриц общих серотипов HLA-A/B (серотипами этих матриц являются все общие серотипы HLA-A/B), соответственно. Все ПЦР-продукты секвенировали по обоим концам в секвенаторе Illumina GA Pair-End 100, а затем смешивали в равных количествах, и после сборки, результаты секвенирования сравнивали с первоначальными результатами типирования для подтверждения консервативности и специфичности ПЦР-праймеров.
Праймеры HLA-A, B, сконструированные в соответствии с настоящим изобретением, то есть два набора ПЦР-праймеров HLA-A/B (по 6 пар для каждого набора) для амплификации экзонов 2, 3 и 4, соответственно, представлены в таблицах 1 и 2.
| Таблица 1ПЦР-праймеры HLA-A,B | ||||
| SEQ ID NO: | ПраймерNo. | Последовательность праймера | Применение праймера | Длина продукта |
| 1 | A-F2 | CCTCTGYGGGGAGAAGCAA | Амплификации экзона 2 гена HLA-A | 480 п.н. |
| 2 | A-R2 | ATCTCGGACCCGGAGACTG | ||
| 3 | A-F3 | CGGGGCCAGGTTCTCACAC | Амплификации экзона 3 гена HLA-A | 410 п.н. |
| 4 | A-R3 | GGYGATATTCTAGTGTTGGTCCCAA | ||
| 5 | A-F4 | GTGTCCCATGACAGATGCAAAA | Амплификации экзона 4 гена HLA-A | 430 п.н. |
| 6 | A-R4 | GGCCCTGACCCTGCTAAAGG | ||
| 7 | B-F2 | AGGAGCGAGGGGACCGCA | Амплификации экзона 2 гена HLA-B | 400 п.н. |
| 8 | B-R2 | CGGGCCGGGGTCACTCAC | ||
| 9 | B-F3 | CGGGGCCAGGGTCTCACA | Амплификации экзона 3 гена HLA-B | 370 п.н. |
| 10 | B-R3 | GAGGCCATCCCCGGCGAC | ||
| 11 | B-F4 | GCTGGTCACATGGGTGGTCCTA | Амплификации экзона 4 гена HLA-B | 380 п.н. |
| 12 | B-R4 | CTCCTTACCCCATCTCAGGGTG |
| Таблица 2ПЦР-праймеры HLA-A,B | ||||
| SEQ ID NO: | Праймер No. | Последовательность праймера | Применение праймера | Длина продукта |
| 13 | A-F2s | CCTCTGYGGGGAGAAGCAA | Амплификации экзона 2 гена HLA-A | 481 п.н.p |
| 14 | A-R2s | GGATCTCGGACCCGGAGACTGT | ||
| 15 | A-F3s | TGGGCTGACCGYGGGGTC | Амплификации экзона 3 гена HLA-A | 403 п.н. |
| 16 | A-R3s | GGYGATATTCTAGTGTTGGTCCCAA | ||
| 17 | A-F4s | GTGTCCCATKACAGATGCAAAA | Амплификации экзона 4 гена HLA-A | 405 п.н. |
| 18 | A-R4s | GGCCCTGACCCTGCTAAAGG | ||
| 19 | B-F2s | AGGAGCGAGGGGACCGCA | Амплификации экзона 2 гена HLA-B | 400 п.н. |
| 20 | B-R2s | CGGGCCGGGGTCACTCAC | ||
| 21 | B-F3s | CCAAAATCCCCGCGGGTT | Амплификации экзона 3 гена HLA-B | 405 п.н. |
| 22 | B-R3s | GAGGCCATCCCCGGCGAC | ||
| 23 | B-F4s | GCTGGTCACATGGGTGGTCCTA | Амплификации экзона 4 гена HLA-B | 374 п.н. |
| 24 | B-R4s | TGACCCCTCATCCCCCTCCT |
Вырожденность праймеров означает смесь всех возможных различных последовательностей, представляющих собой все различные основания, кодирующие одну аминокислоту. Для повышения специфичности вырожденность может быть снижена путем замены оснований, встречающихся в различных организмах, основаниями в соответствии с таблицей кодонов, где R=A/G, Y=C/T, M=A/C, K=G/T, S=C/G, W=A/T, H=A/C/T, B=C/G/T, V=A/C/G, D=A/G/T, N=A/C/G/T.
В настоящем изобретении были сконструированы 2 набора ПЦР-праймеров (по три пары для каждого набора) для амплификации экзонов 2, 3 и 4 HLA-C с применением метода конструирования ПЦР-праймеров для амплификации экзонов 2, 3 и 4 гена HLA-A/B.
В нижеследующих примерах 95 и 950 проб крови с известными HLA-генотипами подвергали ПЦР-амплификации генов HLA-C с использованием 2 отобранных наборов ПЦР-праймеров (по 3 пары для каждого набора), соответственно. Амплифицированные продукты секвенировали методом Сэнгера и методом секвенирования второго поколения. Результаты секвенирования использовали для HLA-C-типирования и сравнивали с исходными результатами типирования для подтверждения консервативности и специфичности ПЦР-праймеров.
Настоящее изобретение относится к 2 наборам ПЦР-праймеров (по три пары для каждого набора) для амплификации экзонов 2, 3 и 4 гена HLA-C, которые представляют собой SEQ ID NO: 25 и 26, 27 и 28, и 29 и 30, как показано в таблице 3, и SEQ ID NO: 31 и 32, 33 и 34, и 35 и 36, как показано в таблице 4. Указанные 6 пар ПЦР-праймеров имеют хорошую консервативность и специфичность, и могут охватывать полноразмерные последовательности экзонов 2, 3 и 4 HLA-C, где длина всех ПЦР-продуктов составляет менее чем 700 п.н., что удовлетворяет требованиям стандартного метода секвенирования Illumina Solexa. Кроме того, праймеры согласно изобретению могут быть также использованы для секвенирования методом Сэнгера.
| Таблица 3ПЦР-праймеры экзонов 2, 3 и 4 гена HLA-C | ||||
| SEQ ID NO: | No. | Последовательность праймера | Экзоны HLA-C | Длина продуктов |
| 25 | C-F2 | GACCCGGGGAGCCGCGCA | 2 | 455 п.н. |
| 26 | C-R2 | TCGAGGGTCTGGGCGGGTT | ||
| 27 | C-F3 | CCTTTACCCGGTTTCATTTTCRGTTT | 3 | 417 п.н. |
| 28 | C-R3 | CTACGGGAGATGGGGAAGGCT | ||
| 29 | C-F4 | GTGTCGCAAGAGAGATRCAAAGTGT | 4 | 451 п.н. |
| 30 | C-R4 | GCTCTGGGAAAGGAGGRGAAGG |
| Таблица 4ПЦР-праймеры экзонов 2, 3 и 4 гена HLA-C | ||||
| SEQ ID NO: | No. | Последовательность праймера | Экзоны HLA-C | Длина продуктов |
| 31 | C-F2s | GACCCGGGGAGCCGCGCA | 2 | 455 п.н. |
| 32 | C-R2s | TCGAGGGTCTGGGCGGGTT | ||
| 33 | C-F3s | GCCCAGACCCTCGRCCGGA | 3 | 443 п.н. |
| 34 | C-R3s | AGATRGGGAAGGCTCCCCACT | ||
| 35 | C-F4s | TCTCAGGATRGTCACATGGGC | 4 | 481 п.н. |
| 36 | C-R4s | GCTCTGGGAAARGAGGRGAAGG |
В соответствии с описанными выше методами, применяемыми на секвенаторе второго поколения для генотипирования HLA-DQB1, настоящее изобретение относится к ПЦР-праймерам для амплификации экзонов 2 и/или 3 HLA-DQB1, которые имеют последовательности SEQ ID NO: 37-40, представленные в таблице 5. Эти ПЦР-праймеры имеют хорошую консервативность и специфичность, и могут охватывать полноразмерные последовательности экзонов 2, 3 и 4 HLA-DQB1, где длина всех ПЦР-продуктов составляет менее чем 700 п.н., что удовлетворяет требованиям стандартного метода секвенирования Illumina Solexa. Кроме того, праймеры согласно изобретению могут быть также использованы для секвенирования по Сэнгеру.
| Таблица 5ПЦР-праймеры для амплификации соответствующих экзонов HLA-DQB1 | ||||
| SEQ ID NO: | Праймер No. | Последовательность праймера | Мишень амплификации | Длина амплифициро-ванных продуктов |
| 37 | Q-F2 | GATTCCYCGCAGAGGATTTCG | Экзон 2 HLA-DQB1 | 311 п.н. |
| 38 | Q-R2 | AGGGGCRACSACGCTCACCTC | ||
| 39 | Q-F3 | CCTGTCTGTTACTGCCCTCAGT | Экзон 3 HLA-DQB1 | 339 п.н. |
| 40 | Q-R3 | GGCCCATAGTAACAGAAACTCAATA |
Генотипирование может быть осуществлено путем амплификации экзонов 2 и/или 3 HLA-DQB1 с применением пары праймеров для амплификации, и настоящее изобретение относится к таким методам генотипирования. По сравнению с ранее применяемыми методами, в таком генотипировании используется технология Illumina Solexa, которая позволяет проводить высокоразрешающее HLA-типирование с высокой производительностью и низкими затратами.
Конкретные способы осуществления изобретения
Способ секвенирования нуклеиновой кислоты
В одном из своих аспектов настоящее изобретение относится к способу определения нуклеотидной последовательности представляющей интерес нуклеиновой кислоты в образце, где указанный способ включает:
1) получение n образцов, где n представляет собой целое число ≥1, а указанные образцы предпочтительно берут у млекопитающего, более предпочтительно у человека, в частности, такими образцами являются пробы человеческой крови; причем необязательно указанные n образцов, предназначенные для анализа, разделяют на m групп, где m представляет собой целое число, а n≥m≥1;
2) амплификацию, где пару или множество пар индексированных праймеров используют для каждого образца, если от этого образца имеются матрицы; ПЦР-амплификацию осуществляют в условиях, подходящих для амплификации представляющей интерес нуклеиновой кислоты, где каждая пара индексированных праймеров состоит из прямого индексированного праймера и обратного индексированного праймера (оба эти праймера могут быть вырожденными), содержащих праймерные индексы, где указанные праймерные индексы, присутствующие в прямом индексированном праймере и в обратном индексированном праймере, могут быть одинаковыми или различными, то есть индексы праймеров в парах индексированных праймеров, используемых для различных образцов, являются различными;
3) объединение в пул: если n>1, то ПЦР-продукты от каждого образца объединяют в один пул;
4) фрагментирование, где амплифицированные продукты подвергают неполному фрагментированию, очистке и выделению;
5) секвенирование, где выделенную ДНК-смесь подвергают секвенированию с применением технологии секвенирования второго поколения, предпочтительно парно-концевым методом (например, Illumina GA, Illumina Hiseq 2000), с получением последовательностей фрагментированной ДНК; и
6) сборку, где данные секвенирования, полученные для образцов, последовательно сопоставляют по уникальному праймерному индексу для каждого образца; каждую считанную последовательность сопоставляют путем выравнивания с эталонной последовательностью ДНК, соответствующей ПЦР-продуктам, с помощью программы выравнивания (такой как программа Blast, BWA); сборку полноразмерной последовательности представляющей интерес нуклеиновой кислоты осуществляют из последовательностей фрагментированной ДНК по перекрыванию и характеру сцепления последовательностей.
В одном из аспектов настоящего изобретения каждая пара праймерных индексов и пара ПЦР-праймеров образует пару индексированных праймеров, где прямой и обратный ПЦР-праймеры имеют индекс прямого праймера и индекс обратного праймера у 5'-конца (или, необязательно, присоединенный посредством линкерной последовательности), соответственно.
В одном из вариантов изобретения указанными ПЦР-праймерами являются ПЦР-праймеры для амплификации гена HLA, в частности ПЦР-праймеры для амплификации гена HLA-A/B, предпочтительно ПЦР-праймеры для амплификации экзонов 2, 3 и 4 HLA-A/B и экзона 2 HLA-DRB1, предпочтительно ПЦР-праймеры для амплификации экзонов 2, 3 и 4 HLA-A/B, как показано в таблице 1 или в таблице 2, или предпочтительно ПЦР-праймеры для амплификации экзона 2 HLA-DRB1, как показано в таблице 7.
В одном из вариантов изобретения указанными ПЦР-праймерами являются ПЦР-праймеры для амплификации гена HLA, в частности ПЦР-праймеры для амплификации гена HLA-С, предпочтительно ПЦР-праймеры для амплификации экзонов 2, 3 и 4 HLA-С, где предпочтительные указанные ПЦР-праймеры представлены в таблице 3 или в таблице 4.
В одном из вариантов изобретения указанными ПЦР-праймерами являются ПЦР-праймеры для амплификации гена HLA, предпочтительно ПЦР-праймеры для амплификации экзона 2