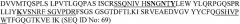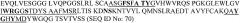Гуманизированные антитела против il-10 для лечения системной красной волчанки (sle)
Иллюстрации
Показать всеИзобретение относится к области биохимии. Представлено гуманизированное антитело или его фрагмент, способные связываться с интерлейкином-10 (IL-10). Антитело связывается с той же областью IL-10, что и α-рецептор IL-10 и не способно связываться с IL-10, когда IL-10 связан с рецептором IL-10. Кроме того, антитело связывается с IL-10 в гомодимерной форме посредством связывания с прерывистым эпитопом, содержащим остатки обоих мономеров. Перед CDR1 тяжелой цепи антитела следует аминокислотная последовательность FSXA, а за CDR2 тяжелой цепи следует аминокислотная последовательность XXXXXXXNS; указанные последовательности участвуют в связывании с прерывистым эпитопом. Антитело применяется в способах определения присутствия IL-10 в образце, диагностики, лечения или предотвращения медицинских состояний, связанных с повышенным уровнем или активностью IL-10, таких как системная красная волчанка. Изобретение позволяет связываться с функционально активным IL-10 с гораздо большей аффинностью, чем с мономерами IL-10, в которых присутствует только часть прерывистого эпитопа. 14 н. и 18 з.п. ф-лы, 16 ил., 8 табл., 8 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к интерлейкину-10 (IL-10) и специфичным к IL-10 средствам. В частности, настоящее изобретение включает гуманизированные антитела к IL-10 и их применение. Изобретение дополнительно предусматривает способ лечения системной красной волчанки (SLE).
Уровень техники
Системную красную волчанку (SLE) рассматривают как аутоиммунное заболевание, при котором ключевую роль играют аномальная гиперактивность Β-лимфоцитов и обширная аномальная продукция аутоантител к иммуноглобулину гамма (IgG). Данный патологический процесс приводит к секвестрации и разрушению покрытых Ig клеток, фиксации и расщеплению белков комплемента и высвобождению хемотаксинов, вазоактивных пептидов и разрушающих ферментов в ткани (Hahn BH. Systemic Lupus Erythematosus. In: Kasper DL, Braunwald E, Fauci AS, Hauser SL, Longo DL, Jameson, JL, editors. In: Harrison's Principles of Internal Medicine (16th edition). New York (US): McGraw-Hill; 2005. pp. 1960-1967).
SLE характеризуется разнообразными проявлениями. В течение заболевания в общей сложности 95% пациентов испытывают скелетно-мышечные нарушения, 80% демонстрируют кожные повреждения, 85% - гематологические нарушения, 60% - неврологические нарушения, 60% - сердечно-легочные нарушения, 30%-50% - почечные нарушения, 40% - желудочно-кишечные нарушения, 15% - тромбоз и 15% - офтальмологические нарушения. Подавляющее большинство пациентов (95%) также страдает системными симптомами, такими как утомляемость, недомогание, лихорадка, анорексия и потеря веса, присутствующими большую часть времени. Большинство пациентов испытывает периоды обострения заболевания, чередующиеся с периодами ремиссии. Постоянная ремиссия (отсутствие симптомов при отсутствии лечения) является очень редкой. Более 50 лет назад большинство пациентов с диагнозом SLE жили менее 5 лет. В настоящее время, более 90% проживают 10 лет, в основном благодаря ранней диагностике, симптоматическому противовоспалительному и иммуносупрессорному лечению. Общей причиной смерти является инфекция в результате иммуносупрессии (Hahn 2005).
Общепринято в лечении SLE применение противомалярийных, противовоспалительных и иммуносупрессивных лекарственных средств. Нестероидные противовоспалительные средства дополняют кортикостероидами, если симптомы становится трудно контролировать. Кроме того, активная SLE со значительным вовлечением органов требует агрессивной терапии циклофосфамидом.
До настоящего времени не существовало этиологического лечения, доступного для лечения SLE и/или для улучшения качества жизни пациентов на долговременной основе. Однако последние достижения в связанных с антителами технологиях и дальнейшая идентификация факторов, лежащих в основе данного аутоиммунного заболевания, открыли возможность использования моноклональных антител в качестве способа лечения. В частности, удобным подходом для лечения SLE будет специфическое лечение, воздействующее на патологический иммунный ответ, приводящий к обширной гиперпродукции поликлональных аутоантител, или корректирующее его. Поскольку патогенез SLE главным образом включает Β-клетки с нарушенной регуляцией, особый интерес представляют моноклональные антитела, способные воздействовать на B-клетки. Как отмечают Robak и Robak (Current Drug Targets, 2009, No. 10, pages 26-37) потенциальными мишенями среди B-клеточных поверхностных антигенов являются CD19, CD20, CD21 и CD22. Кроме того, IL-10, IL-1ra, IL-12 (Capper et al., Clin. Exp. Immunol. 2004 Nov; 138(2):348-56) и IL-6 (Chun et al., J. Clin. Immunol. 2007 Sep; 27(5):461-6) являются важными цитокинами в регуляции иммунного ответа, и их уровень значительно повышается при обострениях у пациентов SLE. Уровни IL-10 и аутоантител против двухцепочечной ДНК (дцДНК) в плазме часто отражают активность заболевания у пациентов с SLE. Повышенные уровни IL-10 коррелируют с активностью заболевания у пациентов с SLE (Park et al., Clin. Exp. Rheumatol. 1998 May-Jun; 16(3):283-8). Однако IL-10 представляет собой цитокин с плейотропными эффектами относительно иммунной системы, а также известно, что он вовлечен в снижение провоспалительных ответов.
На пациентах с SLE проводили клинические испытания с применением моноклональных антител. В частности, несколько испытаний включали антитело ритуксимаб, химерное моноклональное антитело мыши против CD20, применяемое для лечения неходжкинской лимфомы. Как отмечают Robak и Robak (2009), результаты данных испытаний демонстрируют высокую активность этого антитела у пациентов с SLE, и разработано несколько новых антител, нацеленных на CD20; офатумумаб, IMMU-106 и GA-101. Дальнейшие клинические испытания, в которых сообщали об активности моноклональных антител при SLE, проводили с антителом против CD22, эпратузумабом, антителом против TNF-α, инфликсимабом, антителом против IL-10, B-N10 (Llorente et al., Arthritis Rheum. 2000 Aug; 43(8): 1790-800), антителами против CD40L, IDEC 131 и BG 9588, ингибитором BLYS, белимумабом, антителом против рецептора IL-6, токлимумабом, и антителом против C5, экулизумабом.
Задачей настоящего изобретения является обеспечение дополнительных средств, и, в частности, антител, обладающих применимостью в этой области.
В соответствии с первым аспектом настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент, способное связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент: (i) связывается с той же областью IL-10, что и α-рецептор IL-10 (IL-10Rα) и не способно связываться с IL-10, если IL-10 связан с рецептором IL-10; и (ii) связывается с IL-10 в гомодимерной форме посредством связывания с прерывистым эпитопом, содержащим остатки обоих мономеров.
Авторы настоящего изобретения обнаружили, что антитела по настоящему изобретению обладают особенно выгодным способом связывания, так что они пригодны для лечения медицинских состояний, которые опосредованы повышенным уровнем или активностью IL-10, и, в частности, аутоиммунных заболеваний. В частности, антитела и их фрагменты по настоящему изобретению не могут запускать ADCC или CDC ответ, так как они не могут связываться с IL-10, если он связан с IL-l0Rα. Это представляет собой особенно выгодный вид связывания, потому что в результате, антитела по настоящему изобретению не могут связываться с клетками, на которых IL-10 связан с рецептором, и вследствие этого не могут индуцировать ADCC или CDC ответ. Таким путем регулируется влияние антитела на другие части иммунной системы. Кроме того, антитела и их фрагменты по настоящему изобретению могут связываться с IL-10 гомодимером с гораздо большей аффинностью, чем с IL-10 мономером. Как таковое антитело связывается предпочтительно с функционально активной формой IL-10, в большей степени, чем с мономером или продуктами деградации. Это особенно выгодно, потому что снижается количество антитела к IL-10, требуемое для получения нейтрализующего эффекта, и снижается риск побочных эффектов посредством неспецифического связывания с неактивными молекулами.
Во втором аспекте настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент, способное связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент связывается с той же областью IL-10, что и рецептор IL-10 (IL-10Rα) и не способно связываться с IL-10, если IL-10 связан с рецептором IL-10.
В третьем аспекте настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент, которое способно связываться с интерлейкином-10 (IL-10) в гомодимерной форме, где указанное антитело или его фрагмент связывается с прерывистым эпитопом, содержащим остатки обоих мономеров.
В четвертом аспекте настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент по первому аспекту, где антитело или его фрагмент содержит аминокислотные последовательности, по меньшей мере, на 80% идентичные аминокислотным последовательностям CDR1, CDR2 и CDR3 вариабельной области легкой цепи антитела B-N10 мыши и/или содержат аминокислотные последовательности, по меньшей мере, на 80% идентичные аминокислотным последовательностям CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи антитела B-N10 мыши.
В пятом аспекте настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент, способное связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент не индуцирует антитело-зависимую клеточно-опосредованную цитотоксичность и/или комплемент-зависимую цитотоксичность.
В шестом аспекте настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент, способное связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент способно предотвращать опосредованную IL-10 передачу сигнала через α-рецептор IL-10.
В седьмом аспекте настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент, способное связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент не способно связываться с экспрессирующими IL-10R клетками.
Изобретение проиллюстрировано исключительно в качестве примеров следующими чертежами, среди которых:
На фиг.1A показана аминокислотная последовательность вариабельной области легкой цепи антитела B-N10 мыши (SEQ ID NO:2). Подчеркнуты гипервариабельные определяющие комплементарность области (CDR3) (где LCDR1 является SEQ ID NO:4; LCDR2 является SEQ ID NO:5, и LCDR3 является SEQ ID NO:6).
На фиг.1B показана аминокислотная последовательность вариабельной области тяжелой цепи антитела B-N10 мыши (SEQ ID NO:3). Подчеркнуты гипервариабельные определяющие комплементарность области (CDR3) (где HCDR1 является SEQ ID NO:7; HCDR2 является SEQ ID NO:8; и HCDR3 является SEQ ID NO:9).
На фиг.2A показана нуклеотидная последовательность, кодирующая вариабельную область легкой цепи антитела B-N10 мыши (SEQ ID NO:10).
На фиг.2B показана нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи антитела B-N10 мыши (SEQ ID NO:11).
На фиг.3 показана аминокислотная последовательность вариабельной области легкой и тяжелой цепей антитела B-N10 мыши (SEQ ID NO:12 и 13, соответственно) вместе с последовательностями, взятыми из A17 (SEQ ID NO:14), JK1 (SEQ ID NO:15), 3-66+04 (SEQ ID NO:16) и JH4 (SEQ ID NO:17), и вариабельных областей hVL1-hVL12 (SEQ ID NO:18-29) и вариабельных областей hVL1-hVH29 (SEQ ID NO:30-58), полученных при гуманизации антитела B-N10 мыши.
На фиг.4 показано сравнение антигенсвязывающих свойств вариантов гуманизированного антитела и химерного антитела cB-N10 с применением ELISA с фиксированным антигеном hIL-10.
На фиг.5 показан результат определения связывающих свойств трех гуманизированных вариантов, hVH20/hVL7, hVH20/hVL8 и hVH26/hVL7, по сравнению с химерным антителом B-N10 с применением очищенных препаратов антитела.
На фиг.6 показано окрашивание лимфоцитов с применением меченых BT061 и BT-063.
На фиг.7 показана эксклюзионная хроматография BT-063 Fab (верхний ряд), мономера и димера IL-10 (средний ряд) и комплекса димера IL-10 и Fab BT-063 (нижний ряд).
На фиг.8 показана общая структура Fab фрагмента BT-063, связывающего IL-10. IL-10 и Fab-фрагмент представлены в виде ленточной модели.
На фиг.9 показан Fab-фрагмент BT-063, относящийся к тому же участку связывания на IL-10, что и рецептор IL-10. IL-10, IL-10R1 и Fab-фрагмент представлены в виде ленточной модели.
На фиг.10 показана теоретически рассчитанная зависимость дозы IL-10, связанного возрастающими общими дозами BT-063, после внутривенной инъекции здоровым добровольцам.
На фиг.11 показано теоретическое влияние различных концентраций IL-10 на кривую доза-ответ, изображенную на фиг.10. Изображены кривые для концентраций в 1000 раз выше и ниже, чем установленная в качестве стандартной (15 пг/мл). Можно отметить только незначительные различия между кривыми.
На фиг.12 показано теоретическое влияние различной аффинности BT-063 в отношении IL-10 на кривую доза-ответ, изображенную на фиг.10. Изображены кривые аффинности в 10 раз выше и ниже, как это определено с помощью BT-063 (3 нМ). Кривая доза-ответ в значительной степени зависит от аффинности BT-063 в отношении IL-10.
На фиг.13 показан график средней концентрации Cmax цитокинов в плазме после введения BT-063 здоровым добровольцам относительно дозы.
На фиг.14 показан график средней концентрации IL-10 в плазме в зависимости от времени после введения BT-063 in vivo здоровым добровольцам.
Подробное описание изобретения
Как указано выше, настоящее изобретение относится к гуманизированному или химерному антителу или его фрагменту, способному связываться с интерлейкином-10 (IL-10), и применению этого антитела или его фрагмента в лечении медицинских состояний, опосредуемых повышенным уровнем или активностью IL-10. IL-10 человека представляет собой гомодимер с молекулярной массой 37 кДа. Каждый мономер состоит из 160 аминокислот и имеет молекулярную массу 18,5 кДа. Димер IL-10 взаимодействует с α-рецептором IL-10 (IL-10Rα или IL-10R1) и затем вовлекает в комплекс β-рецептор IL-10 (IL-10Rβ или IL-10R2). Рецептор экспрессируется на множестве клеток, в частности, иммунных клетках (Asadullah et al., Pharmacol. Rev. 2003 Jun; 55(2):241-69), включая большинство гемопоэтических клеток, таких как моноциты, макрофаги и T- и В-лимфоциты, а также экспрессируется в негемопоэтических клетках, таких как клетки эпидермиса или кератиноциты. Связывание IL-10 с α-рецептором IL-10 и вовлечение β-рецептора IL-10 приводит к передаче сигнала через тирозиновые киназы Jak1 и Tyk2 и затем к активации факторов транскрипции семейства STAT. Известны различные клеточные источники IL-10, такие как T-хелперные клетки, регуляторные T-клетки, моноциты, макрофаги, В-клетки, эозинофилы, тучные клетки, кератиноциты, дендритные клетки и даже злокачественные клетки. Действие IL-10 на Β-клетки находится в диапазоне предотвращения апоптоза, усиления пролиферации, переключения класса иммуноглобулинов и дифференцировки в плазматические клетки (Asadullah et al., Pharmacol. Rev. 2003 Jun; 55(2):241-69) и ингибирования воспаления.
В первом и втором аспектах настоящего изобретения и в предпочтительных вариантах осуществления других аспектов изобретения антитело или его фрагмент связывается с той же областью IL-10, что и α-рецептор IL-10 (IL-10Rα), и не может связываться с IL-10, когда IL-10 связан с рецептором IL-10, т.е. когда IL-10 связан с антителом или фрагментом, он не может связываться с IL-10Rα.
Как описано выше, функционально активный димер IL-10 взаимодействует с IL-10Rα и затем вовлекает в комплекс IL-10Rβ, что приводит к передаче сигнала. Однако предполагают, что будут иметь место некоторые неоптимальные события передачи сигнала во время первоначального связывания IL-10 с IL-10Rα.
Антитела способные к нейтрализации эффектов IL-10 могут функционировать в соответствии с рядом механизмов. Они могут связываться с IL-10 и предотвращать связывание IL-10 с IL-10Rα посредством пространственного препятствия. В частности, так как функционально активный IL-10 представляет собой гомодимер, две молекулы антитела могут связываться с одним и тем же димером IL-10. Альтернативно, возможно, что нейтрализующее антитело связывает область IL-10, не перекрываясь с участком связывания IL-10Rα, и противодействует связыванию IL-10Rα посредством конформационно индуцированных изменений в IL-10 (Josephson et al. Structure (2002) 10; 981-987).
Альтернативно, антитела могут связываться с областью IL-10, что предотвращает взаимодействие между IL-10 и IL-10Rβ. Дополнительно, также возможно, что антитело связывается с участком IL-10, который все еще остается экспонированным после связывания цитокина с цепью рецептора с высокой аффинностью и индуцирует конформационное изменение, которое препятствует вовлечению второй цепи рецептора, необходимому для передачи сигнала.
В отличие от этого, антитела или их фрагменты по настоящему изобретению ингибируют взаимодействие IL-10 с IL-10Rα посредством связывания с той же областью IL-10, что и IL-10Rα. Соответственно, антитела по настоящему изобретению предотвращают любое связывание между IL-10 и IL-10Rα. По существу, даже неоптимальная передача сигнала, указанная выше, должна быть исключена. Соответственно, настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент, способное связываться с интерлейкином-10 (IL-10), где указанное антитело или его фрагмент способно предотвращать опосредованную IL-10 передачу сигнала через α-рецептор IL-10.
Выражение "связывается с той же областью" в используемом в данном описании значении относится к способности антитела или его фрагмента конкурировать с IL-10Rα за связывание IL-10. По эффекту антитело или его фрагмент по настоящему изобретению действует как конкурентный ингибитор. Известно, что IL-10Rα связывается с остатками от 19 до 42 и от 138 до 158 в димере IL-10. Соответственно, антитело или фрагмент по настоящему изобретению также способно связываться, по меньшей мере, с одним остатком внутри обеих этих областей, таким образом, IL-10Rα связывание эффективно блокируется.
Кроме того, выражение "когда IL-10 связан с рецептором IL-10" относится к ситуации, когда IL-10 связан с рецептором IL-10 обеими сторонами, т.е. через оба мономера.
В предпочтительном варианте осуществления антитело или его фрагмент не связываются с той же областью IL-10, что и β-рецептор IL-10 (IL-10Rβ).
Этот аспект и варианты осуществления по настоящему изобретению могут альтернативно быть определены как антитело или его фрагмент, способные предотвращать опосредованную IL-10 передачу сигнала через α-рецептор IL-10 или как не способные связываться с клетками, экспрессирующими IL-10R (т.е. через связанный IL-10).
В первом и третьем аспектах настоящего изобретения и в предпочтительных вариантах осуществления других аспектов изобретения антитело или его фрагмент связывается с прерывистым эпитопом, содержащим остатки одного из мономеров гомодимера IL-10 и остатки второго мономера гомодимера IL-10, т.е. антитело или его фрагмент связывается с прерывистым эпитопом, содержащим остатки первого мономера и остатки второго мономера, где первый мономер и второй мономер составляют гомодимер.
Термин "гомодимерная форма" относится к функционально активному IL-10, представленному симметричным гомодимером, составленным из двух альфа спиральных доменов (домен A и домен B), расположенных под углом 90 градусов по отношению друг к другу. Структурная целостность каждого домена зависит от переплетения альфа спиралей каждой пептидной цепи, так что первые четыре спирали одной цепи ассоциируются с последними двумя спиралями другой цепи. Одиночный IL-10 мономер не может связывать рецептор IL-10, так как для построения поверхности взаимодействия требуются части обеих цепей.
Антитела и их фрагменты по настоящему изобретению проявляют конкомитантное взаимодействие с обоими мономерами димера IL-10 дикого типа. По существу, они связываются с "прерывистым эпитопом", т.е. эпитопом, в котором аминокислоты находятся в непосредственной близости в уложенном белке, но находятся в отдалении в неуложенном белке. В частности, эпитоп представлен аминокислотами, присутствующими в обеих цепях димера IL-10.
В результате этого вида связывания антитела и их фрагменты связываются с функционально активным IL-10 с гораздо большей аффинностью, чем с мономерами IL-10, в которых присутствует только часть прерывистого эпитопа.
В предпочтительном варианте осуществления по настоящему изобретению антитело или его фрагмент связывается с прерывистым эпитопом, содержащим остатки спирали A одного мономера IL-10 (т.е. первого мономера) и остатки спирали F другого мономера IL-10 (т.е. второго мономера).
В особенно предпочтительном варианте осуществления настоящего изобретения гуманизированное или химерное антитело или его фрагмент связывается с прерывистым эпитопом, представленным первыми 55 аминокислотами одного мономера IL-10, более предпочтительно аминокислотами 20-55, и последними 20 аминокислотами второго мономера, и наоборот.
Из литературы известны искусственные мутантные формы IL-10 комбинированных спиралей A-D и спиралей E-F одного мономера в форме, распознаваемой IL-10R1 или BT-063.
В настоящем описании под IL-10 подразумевается IL-10 человека, аминокислотная последовательность которого может быть представлена следующим образом:
Может быть определено имеют ли антитела против IL-10 целевую активность с помощью известных технологий пептидного сканирования или с помощью эксклюзионной хроматографии.
Технологии пептидного скрининга могут состоять из скрининга возможно связывающихся с IL-10 веществ, которые полностью или фрагменты которых могут быть иммобилизованы на мембране или на подходящей поверхности. В частности, IL-10 или фрагмент IL-10 может быть синтезирован синтетически, или кодирующая нуклеотидная последовательность может быть сверхэкспрессирована в подходящем хозяине, таком как, например, E.coli или клетки насекомых. В частности, могут быть использованы области IL-10, идентифицируемые в данном описании как образующие эпитоп для антитела по настоящему изобретению.
Антитела против IL-10 могут быть идентифицированы с использованием, например, технологии фагового или рибосомного дисплея (или дисплея мРНК, полисомального дисплея, дрожжевого дисплея). С этими технологиями также можно идентифицировать связывающие вещества, распознающие прерывистые эпитопы. Как белок, так и лиганд (т.е. антитело, которое будет отобрано) могут быть иммобилизованы и инкубированы с потенциальным партнером по связыванию. Несвязанные белки удаляют, и связанные лиганды элюируют. Осуществляют несколько стадий для идентификации связывающих с высокой аффинностью веществ.
В настоящем описании термин "химерное антитело" относится к антителам, в которых часть тяжелой и/или легкой цепи идентична последовательностям антител, полученным из конкретных видов или принадлежащим конкретному классу или подклассу антител, в то время как остальная часть антитела идентична последовательностям антител, полученным из других видов, класса или подкласса антител. Особенно предпочтительно, чтобы CDR химерного антитела имели одно происхождение, в то время как остальная часть антитела имела другое происхождение. В частности, в настоящем изобретении химерное антитело может быть гуманизированным антителом, в котором антигенсвязывающие последовательности/вариабельные домены не принадлежащего человеку антитела трансплантируют в каркасные области антитела человека.
В настоящем описании термин "фрагмент" относится к фрагменту или производному антитела, сохраняющему желаемую биологическую активность. Как правило, фрагмент будет содержать антигенсвязывающую область антитела и, в частности, Fab, Fab', F(ab)'2, Fv- и scFv-фрагменты, а также производные поливалентных антител, в частности, диател или тандемных диател. Предпочтительно, фрагмент содержит, по меньшей мере, 25, более предпочтительно 50 и еще более предпочтительно 200-500 аминокислот. Альтернативно, фрагменты можно определять как обладающие размером от 30 кДа до 150 кДа. Дополнительно, фрагменты антитела могут включать две или более пептидных/полипептидных цепей. Кроме того, фрагменты антител могут включать две или более пептидных/полипептидных цепей. Например, Fab-фрагмент, содержащий две цепи от 200 до 300 аминокислот в каждой, или TandAbs® (форматы тетравалентного биспецифического антитела), содержащий две цепи от 400 до 500 аминокислот в каждой.
В четвертом аспекте настоящего изобретения и в предпочтительных вариантах осуществления других аспектов изобретения антитело или его фрагмент получают из антитела B-N10 мыши или из BT-063 (вариант hVH26/hVL7). В частности, такое антитело или его фрагмент содержит CDR, по меньшей мере, на 80% идентичные последовательностям CDR1, CDR2 и CDR3 вариабельной области легкой цепи B-N10 или BT-063 и/или содержат аминокислотные последовательности, по меньшей мере, на 80% идентичные аминокислотным последовательностям CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи B-N10 или BT-063. Аминокислотная последовательность CDR мыши показана на фиг.1. Вариабельные последовательности варианта BT-063 показаны в примере 6. Более предпочтительно последовательности будут, по меньшей мере, на 90% или, по меньшей мере, на 95% идентичны последовательностям CDR антитела B-N10 или BT-063.
Альтернативно, антитело или фрагмент по изобретению, все еще являясь производным антитела B-N10/BT-063, может содержать аминокислотную последовательность CDR1, CDR2 и CDR3 вариабельной области легкой цепи B-N10/BT-063 и/или аминокислотную последовательность CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи B-N10/BT-063, необязательно с вариацией в данных последовательностях, которая по существу не изменяет аффинности и/или специфичности антитела или его фрагмента. В частности, вариации в последовательности не снижают аффинности или специфичности антитела или фрагмента к IL-10 по сравнению с аффинностью или специфичностью антитела или фрагмента, содержащих CDR антитело B-N10 мыши или антитело BT-063 (вариант WH26/HVL7).
В конкретном варианте осуществления гуманизированное или химерное антитело или его фрагмент содержит аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельных областей легкой и/или тяжелой цепей антитела B-N10 мыши или легкой и/или тяжелой цепей варианта BT-063. Более предпочтительно, настоящее изобретение предоставляет гуманизированное или химерное антитело или его фрагмент, содержащее аминокислотные последовательности, имеющие, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 90%, наиболее предпочтительно, по меньшей мере, 100% идентичность последовательности вариабельных доменов антитела B-N10 мыши, как показано на фиг.1, или вариабельных доменов антитела BT-063, как показано в примере 6.
Кроме того, в результате рентгеноструктурных анализов, выполненных авторами настоящего изобретения, антитело или его фрагмент по настоящему изобретению может также быть определено как гуманизированное или химерное антитело или его фрагмент, способное связываться с IL-10, где указанное антитело или его фрагмент содержит вариабельную область, содержащую CDR1 и CDR2 легкой цепи BT-063 и/или вариабельную область, содержащую CDR1, CDR2 и CDR3 тяжелой цепи BT-063, необязательно, с аминокислотными заменами в последовательностях CDR, при условии, что:
(i) CDR1 легкой цепи содержит: Ser32, Asn33, Asn35, Tyr37,
(ii) CDR2 легкой цепи содержит: Lys55,
(iii) CDR2 тяжелой цепи содержит: Phe27, Ser28, Ala30, Thr31, Tyr32,
(iv) CDR2 тяжелой цепи содержит: Trp52, Arg53, Gly54, Ser56,
(v) CDR3 тяжелой цепи содержит: Tyr100, Gly101, Tyr103.
Более предпочтительно вариабельная область тяжелой цепи дополнительно содержит Asn73 и Ser74. Особенно предпочтительно, чтобы с заменами в CDR их последовательность была, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 90% идентична последовательности CDR в BT-063.
Использование типа остатка и номера было осуществлено с целью определенного идентифицирования аминокислотного остатка CDR BT-063, к которому это относится. Однако необходимо понимать, что не подразумевается, что номер остатка ограничивает нахождение остатка в этом положении в вероятном антителе или фрагменте, которые подвергаются отбору в способе. Например, в антителе этого варианта осуществления Ser32 может быть в положении 31 внутри CDR1 легкой цепи, если был удален несущественный аминокислотный остаток из участка 1-30 легкой цепи.
Последовательности тяжелой и легкой цепей BT-063 и положения CDR показаны в примере 6 ниже.
В пятом аспекте настоящего изобретения и в предпочтительных вариантах осуществления остальных аспектов изобретения гуманизированное или химерное антитело или его фрагмент, способное связываться с интерлейкином-10 (IL-10), не индуцирует антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и/или комплемент-зависимую цитотоксичность (CDC).
Как указано выше, антитело или его фрагмент не способно связываться с IL-10, если IL-10 связан с α-рецептором IL-10. Соответственно, антитело или его фрагмент может связываться только с растворимым IL-10 и не способно связываться с экспрессирующими IL-10R клетками (через IL-10). В результате, антитело или его фрагмент по настоящему изобретению не способно индуцировать ADCC или CDC, по меньшей мере, отчасти из-за свойства связывать только растворимый IL-10, а не связанный с клеткой IL-10.
Для тестирования того, индуцирует ли антитело CDC, клетки, несущие представляющий интерес антиген, могут быть инкубированы с дозами антитела в присутствии комплемента (или сыворотки, которая содержит активный комплемент, такой как C1q). В качестве параметра, описывающего количество индуцированной CDC, может быть измерена степень клеточного лизиса.
Для тестирования того, индуцирует ли антитело ADCC, клетки, несущие представляющий интерес антиген, (клетки-мишени) могут быть инкубированы с возрастающими дозами антитела в присутствии индуцирующих ADCC клеток (например, естественные киллерные клетки, эффекторные клетки). В качестве параметра, описывающего количество индуцированной ADCC, на клетках-мишенях может быть измерена степень клеточного лизиса.
Кроме того, в дополнительном аспекте настоящего изобретения и в предпочтительных вариантах осуществления остальных аспектов изобретения гуманизированное или химерное антитело или его фрагмент способно связываться с интерлейкином-10 (IL-10), таким образом, что при введении пациенту, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 60%, наиболее предпочтительно, по меньшей мере, 75% IL-10 в плазме пациента связано в комплекс с антителом или его фрагментом. В этом смысле термин “связанный в комплекс с антителом или его фрагментом” относится к удерживанию IL-10 антителом или его фрагментом после того, как оно было введено пациенту. Емкость удерживания IL-10 антитела или фрагмента может быть определена in vitro на основании объема крови 3,5 л, и с известной константой диссоциации между антителом или фрагментом и IL-10, и дополнительно, с использованием предположений и способов, представленных в примере 8 ниже.
Как правило, антитело по изобретению дополнительно содержит константную область (Fc) человека. Ее можно выбирать среди константных доменов любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE, и любых изотипов, включая IgG1, IgG2, IgG3 и IgG4. Предпочтительные константные области выбирают среди константных доменов IgG, в частности, IgG1.
Другие продукты
Настоящее изобретение дополнительно предоставляет последовательности нуклеиновой кислоты, кодирующие описанное выше антитело или фрагменты антитела. Последовательности нуклеиновой кислоты могут представлять собой ДНК или РНК, но предпочтительно ДНК. Последовательности можно использовать в экспрессирующих кассетах или векторах, и они особенно применимы в производстве описываемых в настоящем описании антител и их фрагментов.
Изобретение дополнительно предусматривает клетки-хозяева, трансформированные данными полинуклеотидами, экспрессирующими кассетами или векторами. Подходящие клетки-хозяева могут быть как прокариотическими, так и эукариотическими.
Альтернативно, клетка-хозяин может представлять собой гибридому, получаемую слиянием клетки, продуцирующей антитело по настоящему изобретению, с миеломной клеткой.
Описанные выше клетки-хозяева можно использовать в способе получения антитела или его фрагмента. В частности, такой способ может включать стадию культивирования клетки-хозяина в подходящей среде для культивирования в условиях, делающих возможной экспрессию антитела или его фрагмента, и отделение антитела или фрагмента от среды для культивирования. Способы данного типа хорошо известны и описаны в данной области.
Настоящее изобретение также предоставляет выделенный пептид, содержащий менее 50 аминокислот, содержащих один или оба набора аминокислот 27-53 и аминокислот 142-155 IL-10 человека. Такие пептиды особенно полезны в описанных ниже способах скрининга.
Медицинские применения
Описываемые в настоящем описании антитела и их фрагменты обладают применимостью в лечении заболеваний или медицинских состояний, опосредуемых повышенным уровнем или активностью IL-10. Таким образом, предоставлен способ лечения или предотвращения медицинского состояния у субъекта, где медицинское состояние опосредовано повышенным уровнем или активностью IL-10, включающий введение терапевтически эффективного количества описываемого в настоящем описании антитела или его фрагмента.
В частности, медицинское состояние, которое опосредовано повышенным уровнем или активностью IL-10, представляет собой SLE. Таким образом, настоящее изобретение также предоставляет антитело или его фрагмент, как описано в настоящем описании, для применения в лечении SLE.
Дополнительные примеры представляют собой тромбоцитопеническую пурпуру, люпус-нефрит, ВИЧ, ЦМВ и гепатит C. Другой пример представляет собой лечение опухолевых клеток, зависящих от IL-10, посредством прямой поддержки пролиферации или супрессии иммунного ответа.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую описанное выше антитело или его фрагмент, фармацевтически приемлемый носитель или разбавитель. В одном из вариантов осуществления композиция содержит липосомы, с которыми связано антитело или его фрагмент.
Такие композиции можно вводить пациенту парентерально, внутривенно или подкожно. Предпочтительно, при лечении SLE антитело или его фрагмент вводят внутривенно или подкожно.
Кроме того, антитела и их фрагменты, описанные в данном описании, могут быть применены при диагностировании медицинских состояний, которые опосредованы повышенным уровнем или активностью IL-10. В частности, антитела и их фрагменты могут быть использованы в анализах in vitro для определения наличия аномального уровня IL-10 в образцах, взятых у индивидуума. Такие способы диагностирования могут включать: (a) получение или обеспечение образцов, взятых у индивидуума; (b) приведение образца в контакт с антителом против IL-10 или его фрагментом, как описано в данном описании, и (c) определение присутствия IL-10 (например, определением присутствия антитела или его фрагмента). В частности, стадия (c) может включать определение количества IL-10, присутствующего в образце. Кроме того, способ может дополнительно содержать стадию (d) сравнения количества присутствующего IL-10 с одним или более заранее определенных значений для того, чтобы получить оценку в отношении пациента и медицинского состояния. Заранее определенные значения могут представлять эталонное значение количества IL-10, присутствующего в эквивалентном образце, взятом у здорового индивидуума.
Предпочтительно образец представляет собой образец плазмы, полученной посредством взятия крови у индивидуума. В частности, способ диагностирования может быть использован, если медицинское состояние представляет собой SLE.
Немедицинское применение
Кроме того, предоставлено меченое гуманизированное или химерное антитело или его фрагмент, включающее описываемое в настоящем описании антитело или его фрагмент и метку. Метка может быть любого подходящего типа, известного в данной области для определения наличия антитела в образце. В частности, метка может представлять собой флуоресцентную метку.
Антитело или его фрагмент по настоящему изобретению и, в частности, меченое антитело, обладает конкретной применимостью в способе определения наличия IL-10 in vitro в образце. Способ может включать стадию приведения немеченого или меченого антитела или его фрагмента в контакт с образцом, промывания образца для удаления антитела и его фрагментов, не связавшихся с образцом (т.е. не связавшегося антитела или фрагментов антител), и определения присутствия антитела (или фрагмента) в образце, например, посредством метки.
Альтернативно, немеченое антитело или фрагмент может быть использовано для способа нейтрализации IL-10 in vitro в образце. Такой способ включает стадии приведения образца в контакт с антителом или его фрагментом для связывания антитела или его фрагмента с IL-10.
Дополнительно, настоящее изобретение также предоставляет способ скрининга одной или более молекул, способных к связыванию с той же областью IL-10, что и α-рецептор IL-10 (IL-10Rα), включающий:
a) приведение одной или более молекул в контакт с пептидом, содержащим одну или более следующих областей человеческого IL-10: аминокислоты 27-53 и аминокислоты 142-155; и
b) определение того, связывается ли одна или более молекул с одной или более областями пептида.
В частности, одна или более молекул предпочтительно представляют собой пептиды и наиболее предпочтительно представляют собой антитела или фрагменты антител. Скрининг может быть выполнен посредством известных в данной области способов, таких как получение и скрининг библиотеки