Способы лечения диабета антагонистами dll4
Иллюстрации
Показать всеИзобретение относится к биохимии. Описано применение антител или их фрагментов, которые специфично связывают hDH4 и блокируют взаимодействие между Dll4 и Notch-рецептором для предупреждения, лечения или ослабления сахарного диабета 1-го типа у субъекта. Изобретение расширяет арсенал средств для лечения, предупреждения сахарного диабета 1-го типа. 2 н. и 16 з.п. ф-лы, 11 ил., 8 табл., 6 пр.
Реферат
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники
Данное изобретение относится к способам лечения заболевания, расстройства или патологического состояния, при которых положительный эффект оказывает повышение числа регуляторных Т-клеток (Трег-клеток), с использованием антагонистов дельта-подобного лиганда 4 (Dll4). Более конкретно, с помощью способов по изобретению можно предупредить, лечить или ослабить диабет путем блокирования связывания Dll4 с Notch-рецептором антагонистами Dll4, тем самым повышая число Трег-клеток. Кроме того, изобретение относится к способам снижения уровня глюкозы в крови, или снижения или блокирования продукции аутоантител, включая аутоантитела к инсулину и декарбоксилазе глутаминовой кислоты 65 (GAD65), соответственно, с помощью антагонистов Dll4.
Описание предшествующего уровня техники
Взаимодействие между Notch-рецепторами и их лигандами представляет собой эволюционно консервативный путь, важный не только для решения судьбы клеток, но также для регуляции направлений дифференцировки при гемопоэзе и в развивающемся тимусе (Artavanis-Tsakonas et al., 1999, Science 284:770-776; Skokos et al., 2007; J Exp Med 204:1525-1531; и Amsen et al., 2004, Cell 117:515-526). Недавно было показано, что ингибирование взаимодействия Dll4-Notch1 приводит к полному блокированию развития Т-клеток, сопровождаемому эктопическим появлением В-клеток и увеличением числа дендритных клеток (DC), которое может быть следствием конверсии дифференцировки предшественников Т-клеток в DC в тимусе (Hozumi et al., 2008, J Exp Med 205(11):2507-2513; Koch et al., 2008, J Exp Med 205(11):2515-2523; и Feyerabend et al., 2009, Immunity 30:1-13). Таким образом, накапливаются свидетельства того, что Notch-сигнальный путь критичен для определения направления дифференцировки клеток из гемопоэтических клеток-предшественников. Кроме того, был показан контроль по принципу обратной связи гомеостаза регуляторных Т-клеток (Tрег-клеток) дендритными клетками in vivo (Darrasse-Jeze et al., 2009, J Exp Med 206(9):1853-1862). Однако роль Notch-сигнального пути в контроле происхождения и развития дендритных клеток и, соответственно, гомеостазе Tрег-клеток еще неизвестен. Это является важным клиническим вопросом, поскольку найденные новые способы индукции размножения Tрег-клеток можно было бы использовать в качестве лечения аутоиммунных заболеваний и расстройств.
Нуклеотидные и аминокислотные последовательности Dll4 человека (hDll4) показаны, соответственно, в SEQ ID NO:1 и 2. Антагонисты Dll4 и их применение раскрыты в WO 2007/143689, WO 2007/070671, WO 2008/076379, WO 2008/042236 и WO/2008/019144.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение частично основано на наблюдении автора изобретения, что антитело, которое специфично связывает Dll4 и блокирует связывание Dll4 с Notch-рецепторами, способно полностью предупреждать развитие экспериментального аутоиммунного энцефаломиелита (ЕАЕ) у мышей, животной модели рассеянного склероза человека, в то время как контрольное антитело не предупреждает ЕАЕ. Кроме того, автором настоящего изобретения было открыто, что этот эффект анти-Dll4 антитела ассоциирован с повышением числа Трег-клеток. В дополнение, также отмечено, что анти-Dll4 антитело предупреждает повышение уровня глюкозы в крови и сохраняет число и морфологию панкреатических островков у мышей NOD/ShiLtJ, животной модели диабета 1-го типа, и такие эффекты, по меньшей мере частично, опосредованы увеличением числа Трег-клеток.
Поэтому, в первом аспекте, изобретение относится к способу увеличения числа Трег-клеток, включающему введение эффективного количества антагониста Dll4 нуждающемуся в этом субъекту, причем антагонист Dll4 блокирует взаимодействие между Dll4 и Notch-рецептором, и число Трег-клеток увеличивается.
Во втором аспекте изобретение относится к способу лечения или ослабления болезни, расстройства или патологического состояния, при которых положительный эффект оказывает повышение числа регуляторных Т-клеток (Трег-клеток), включающему введение терапевтически эффективного количества антагониста Dll4 нуждающемуся в этом субъекту. Заболеванием или расстройством, которое поддается лечению способами по изобретению, является любое заболевание, расстройство или состояние, на которое оказывает эффект (то есть улучшает, ослабляет, ингибирует или предупреждает) удаление, ингибирование или снижение активности Dll4, тем самым увеличивая число Трег-клеток у получающего лечение субъекта. Одним из таких заболеваний или расстройств, поддающихся лечению способом по изобретению, является диабет, а именно сахарный диабет 1-го и 2-го типа. Таким образом, в одном варианте осуществления изобретение относится к способу предупреждения, лечения или ослабления диабета 1-го или 2-го типа, включающему введение нуждающемуся в этом субъекту терапевтически эффективного количества антагониста Dll4.
В третьем аспекте изобретение относится к способу снижения уровня глюкозы в крови, включающему введение нуждающемуся в этом субъекту терапевтически эффективного количества антагониста Dll4.
В четвертом аспекте изобретение относится к способу снижения или блокирования продукции аутоантител, включающему введение нуждающемуся в этом субъекту терапевтически эффективного количества антагониста Dll4. Аутоантитела могут включать аутоантитела к инсулину, аутоантитела к GAD65 и т.п.
В одном варианте осуществления изобретения антагонистом для использования в любом из способов по изобретению является антитело к Dll4 или его фрагмент («анти-Dll4 АТ» или «Dll4-АТ»), которое специфично связывает Dll4 с высокой аффинностью и блокирует связывание Dll4 с Notch-рецепторами и/или блокирует сигнальные пути, активируемые взаимодействием Dll4-Notch. Антитело может быть поликлональным, моноклональным, химерным, гуманизированным или полностью антителом человека или его фрагментом. Фрагментом антитела может быть одноцепочечное антитело, Fab-фрагмент или (Fab')2-фрагмент.
В одном варианте осуществления изобретения Dll4-АТ или его антигенсвязывающий фрагмент связывают эпитоп в N-концевом домене (остатки S27-R172) или в домене Дельта/Серрат/Лаг-2 (DSL-домене) (остатки V173-C217), или в N-концевом и DSL-домене (остатки S27-C217) белка hDll4 (SEQ ID NO:2). В другом варианте осуществления изобретения Dll4-АТ или его антигенсвязывающий фрагмент связывают эпитоп в одном из EGF-доменов, то есть примерно аминокислотные остатки Q218-N251 (домен 1), E252-D282 (домен 2), D284-E322 (домен 3), E324-E360 (домен 4), S362-E400 (домен 5), K402-E438 (домен 6), H440-E476 (домен 7) или S480-E518 (домен 8) белка hDll4 (SEQ ID NO:2). В некоторых вариантах осуществления изобретения антитело или фрагмент антитела могут связывать конформационный эпитоп, включающий более одного эпитопа из перечисленных выше. Dll4-АТ или его фрагменты для использования в способах по изобретению способны связывать Dll4 человека с высокой аффинностью и имеют константу диссоциации (KD) примерно 1 нМ или меньше, примерно 500 пМ или меньше, примерно 300 пМ или меньше, примерно 200 пМ или меньше, примерно 100 или меньше или примерно 50 пМ или меньше, измеренную с помощью поверхностного плазмонного резонанса.
В одном варианте осуществления изобретения Dll4-АТ или его фрагмент включают вариабельную область тяжелой цепи (HCVR), содержащую три определяющих комплементарность области тяжелой цепи, HCDR1, HCDR2 и HCDR3, имеющие аминокислотные последовательности, соответственно, SEQ ID NO: 22, 24 и 26. В другом варианте осуществления изобретения антитело или его фрагмент включают вариабельную область легкой цепи (LCVR), содержащую три определяющих комплементарность области легкой цепи, LCDR1, LCDR2 и LCDR3, имеющие аминокислотные последовательности, соответственно, SEQ ID NO: 30, 32 и 34. В другом варианте осуществления изобретения Dll4-АТ или его фрагмент включают последовательности CDR легкой и тяжелой цепей, содержащие комбинацию последовательностей CDR из SEQ ID NO: 22, 24, 26, 30, 32 и 34. В еще одном варианте осуществления изобретения Dll4-АТ включает HCVR, содержащую аминокислотную последовательность SEQ ID NO:20 или 116, или LCVR, содержащую аминокислотную последовательность SEQ ID NO:28 или 118. В еще одном варианте осуществления изобретения Dll4-АТ включает комбинацию HCVR/LCVR из SEQ ID NO:20/28 (REGN281) или 116/118 (REGN421).
В некоторых вариантах осуществления изобретения Dll4-АТ включает комбинацию CDR1/CDR2/CDR3 тяжелой цепи и комбинацию CDR1/CDR2/CDR3 легкой цепи, выбранную из: SEQ ID NO:6/8/10 и SEQ ID NO:14/16/18, соответственно; SEQ ID NO:38/40/42 и SEQ ID NO:46/48/50, соответственно; SEQ ID NO:54/56/58 и SEQ ID NO:62/64/66, соответственно; SEQ ID NO:70/72/74 и SEQ ID NO:78/80/82, соответственно; SEQ ID NO:86/88/90 и SEQ ID NO:94/96/98, соответственно; и SEQ ID NO:102/104/106 и SEQ ID NO:110/112/114, соответственно. В другом варианте осуществления изобретения Dll4-АТ включает HCVR, содержащую аминокислотную последовательность SEQ ID NO:4, 36, 52, 68, 84 или 100, или LCVR, содержащую аминокислотную последовательность SEQ ID NO:12, 44, 60, 76, 92 или 108. В еще одном варианте осуществления изобретения Dll4-АТ включает комбинацию HCVR/LCVR, выбранную из: SEQ ID NO:4/12 (REGN279); SEQ ID NO:36/44 (REGN290); SEQ ID NO:52/60 (REGN306); SEQ ID NO:68/76 (REGN309); SEQ ID NO:84/92 (REGN310); и SEQ ID NO:100/108 (REGN289).
Нуклеотидные последовательности, кодирующие аминокислотные последовательности SEQ ID NO:4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110, 112, 114, 116 и 118, приведены в SEQ ID NO:3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 111, 113, 115 и 117, соответственно.
В другом варианте осуществления изобретения антагонистом Dll4, применимым в способах по изобретению, является слитый белок, содержащий по меньшей мере один растворимый Notch-рецептор или его фрагмент, способный связывать Dll4, слитый с мультимеризующим компонентом. В одном варианте осуществления изобретения растворимым Notch-рецептором является Notch1 или Notch4. В другом варианте осуществления изобретения антагонистом Dll4 является модифицированный белок Dll4, способный связывать Notch-рецептор(ы), но такое связывание не приводит к активации рецептора(ов). В некоторых вариантах осуществления изобретения антагонистом Dll4 по изобретению является слитый белок, содержащий внеклеточный домен Dll4, или его фрагмент, слитые с мультимеризующим компонентом, таким как иммуноглобулиновый домен, например, Fc-домен IgG человека. В некоторых вариантах осуществления изобретения антагонисты Dll4 включают низкомолекулярные соединения и другие агенты, которые могут блокировать взаимодействие между Dll4 и Notch.
В пятом аспекте изобретение относится к любому из вышеописанных способов, в которых антагонист Dll4 совместно вводят (одновременно или последовательно) по меньшей мере с одним дополнительным терапевтическим агентом, например, агентом для снижения сахара в крови (например, инсулином, аналогами инсулина и т.п.), иммуносупрессирующим агентом или иммуносупрессантом, противовоспалительным агентом, анальгетиком и т.п., многие из которых могут иметь перекрывающиеся терапевтические эффекты друг с другом. Иммуносупрессанты, подходящие для применения в комбинации с антагонистом Dll4, включают, но не ограничены этим, глюкокортикостероиды, циклоспорин, метотрексат, интерферон β (IFN-β), такролимус, сиролимус, азатиоприн, меркаптопурин, опиоиды, микофенолят, TNF-связывающие белки, такие как инфликсимаб, этернацепт, адалимумаб и т.п., цитотоксические антибиотики, такие как дактиномицин, антрациклины, митомицин С, блеомицин, митрамицин и т.п., антитела к клеткам иммунной системы, такие как анти-CD20 антитела, анти-CD3 антитела, и т.п. Противовоспалительные агенты и/или анальгетики, подходящие для комбинированных методов лечения с антагонистами Dll4, включают кортикостероиды, нестероидные противовоспалительные соединения (NSAID), такие как аспирин, ибупрофен, напроксен и т.п., антагонисты TNF-α, антагонисты IL-1, антагонисты IL-6, ацетаминофен, морфиномиметики, и т.п.
В шестом аспекте изобретение относится к фармацевтической композиции, содержащей антагонист Dll4, по меньшей мере один дополнительный терапевтический агент и фармацевтически приемлемый носитель. В одном варианте осуществления изобретения антагонистом Dll4 является Dll4-АТ или его фрагмент, которые специфично связывают Dll4 с высокой аффинностью и нейтрализуют функции Dll4, а по меньшей мере, одним дополнительным терапевтическим агентом является любой из агентов для снижения сахара в крови, иммуносупрессантов, противовоспалительных агентов, анальгетиков и т.п., описанных выше.
В седьмом аспекте изобретение относится к набору, включающему контейнер, содержащий фармацевтическую композицию по настоящему изобретению и вкладыш в упаковку с инструкцией по применению. В одном варианте осуществления изобретения набор может включать контейнер, содержащий антитело или его фрагмент, которые специфично связывают hDll4, другой контейнер, содержащий по меньшей мере один дополнительный терапевтический агент, описанный выше.
Другие задачи и преимущества изобретения будут очевидны при рассмотрении следующего подробного описания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
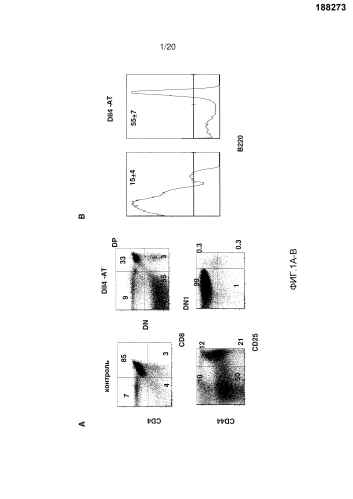
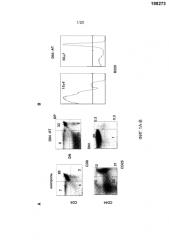
На фигурах 1A-1B показаны эффекты блокирования Dll4 на развитие Т-клеток и В-клеток. Мышам вводили с помощью инъекций анти-Dll4 антитело (REGN577) или контрольный Fc-фрагмент человека (hFc). Через четырнадцать дней собирали тимусы и анализировали Т-клеточные и В-клеточные субпопуляции проточной цитометрией. Фиг. 1А: на точечных диаграммах показано число CD4-CD8- (двойных негативных тимоцитарных предшественников или «DN»), CD4+CD8+ (двойных положительных тимоцитарных предшественников или «DP»), CD4+ или CD8+ (одиночных негативных тимоцитарных предшественников или «SP») и DN/CD44+CD25- (тимоцитарных предшественников на стадии DN1) T-клеток. Числа на точечных диаграммах представляют собой проценты (среднее ± SEM (стандартная ошибка среднего)) субпопуляций Т-клеток от общего количества клеток тимуса. Фиг. 1В: на гистограммах показаны проценты (среднее ± SD (среднеквадратичное отклонение)) В-клеток (B220+) от DN1-клеток (а именно, отбираемых как CD4-CD8-CD44+CD25-).
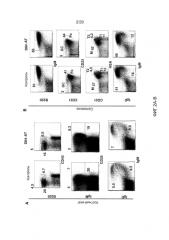
На фигурах 2А-2В показаны эффекты блокирования Dll4 на стадии развития В-клеток в костном мозге (фиг. 2А) и на гомеостаз В-клеток в селезенке (фиг. 2В). Числа на точечных диаграммах представляют собой проценты (среднее ± SEM) субпопуляций В-клеток от общего количества клеток в костном мозге или в селезенке. GC: В-клетки зародышевого центра; Т1 и Т2: субпопуляции В-клеток; М: краевые В-клетки; и Fo: фолликулярные В-клетки.
На фигурах 3A-3D показаны эффекты блокирования Dll4 на развитие дендритных клеток (DC). Фиг. 3A: на точеных диаграммах показано увеличение числа обычных DC («cDC»; B220-CD11C+) и плазмацитоидных DC («pDC»; PDCA1+B220+CD11C+) в тимусе после воздействия антител к Dll4. Числа на точечных диаграммах представляют среднее процентное содержание (среднее ± SEM) дендритных клеток относительно общего количества клеток на 14-й день. Фиг. 3В: на столбиковой диаграмме показана кинетика размножения cDC и pDC в тимусе мышей, получавших Dll4-АТ (■), и мышей, получавших контрольное антитело hFc (□). Фиг. 3C: на точечных диаграммах показаны эффекты Dll4-АТ на клетки-предшественники DC (MHCIIнизк.CD11cсредн.CD135+Sirp-αсредн.) и поздние клетки-предшественники DC (MHCIIнизк.CD11cсредн.) в тимусе. Числа на точечных диаграммах представляют среднее процентное содержание (среднее ± SEM) клеток-предшественников DC относительно общего количества клеток на 14-й день. Фиг. 3D: на точечных диаграммах показано присутствие MHCIIнизк.CD11cсредн. DC в DN1-популяции про-Т-клеток (CD4-CD8-CD44+CD25-) в тимусе мышей, получавших Dll4-АТ, но не в тимусе мышей, получавших контрольное антитело, hFc. Числа на точечных диаграммах представляют среднее число (среднее ± SEM) MHCIIнизк.CD11cсредн. DC в DN1-популяции про-Т-клеток на 3-й день.
На фигуре 4 показан эффект блокирования Dll4 на развитие в тимусе альтернативной линии дендритных клеток в незрелые DC (imDC), предшественниками которых является общий DN1-предшественник T/DC-клеток. DN1-клетки, отсортированные как CD45.1+Lin-, переносили в тимус мышей-хозяев (CD45.2+), получавших Dll4-АТ (■) или контрольное антитело, hFc (□).
На фигуре 5 показан эффект блокирования Dll4 на сывороточный уровень CSF-1 (M-CSF), ключевого цитокина, вовлеченного в развитие DC. Уровень CSF-1 в сыворотке мышей, не получавших воздействие ( ), или получавших изотипное контрольное антитело (□), или Dll4-АТ (■), измеряли с помощью твердофазного иммуноферментного анализа (ELISA).
На фиг. 6 показаны эффекты генетического удаления Dll4 после воздействия тамоксифена (ТАМ) на гомеостаз В-клеток и DC у мышей DLL4COIN, содержащих индуцируемую тамоксифеном конструкцию Cre-рекомбиназы, CreERT2. Числа на точечных диаграммах представляют средние процентные значения (среднее ± SEM) В-клеток, а также pDC и cDC, от общего количества клеток в тимусе.
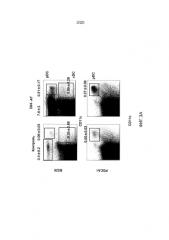
На фигурах 7А-7С показаны эффекты блокирования/удаления Dll4 на гомеостаз Трег-клеток. Фиг. 7А: на точечной диаграмме показано увеличение числа Трег-клеток в тимусе мышей, получавших Dll4-АТ в течение двух недель, по сравнению с мышами, получавшими контрольное антитело, hFc. Числа на точечных диаграммах представляют средние процентные значения (среднее ± SEM) Трег-клеток от CD3+CD4+ T-клеток в тимусе. Фиг. 7В: на столбиковой диаграмме показана кинетика развития Трег-клеток в тимусе (верхняя панель) и селезенке (нижняя панель), соответственно, мышей, которым вводили Dll4-АТ (■) и которым вводили контрольное антитело, hFc (□). Фиг. 7C: на точечной диаграмме показано увеличение числа Трег-клеток в тимусе мышей DLL4COIN, получавших тамоксифен, по сравнению с контрольными мышами DLL4COIN, получавшими кукурузное масло. Числа на точечных диаграммах представляют средние процентные значения (среднее ± SEM) Трег-клеток от CD3+CD4+ T-клеток в тимусе.
На фигурах 8A-8B показаны эффекты блокирования Dll4 на гомеостаз DC (фиг. 8A) и Трег-клетки (фиг. 8B) в тимусе мышей, экспрессирующих Dll4 человека (hDll4), наблюдаемые на 7-й и 14-й день после введения Dll4-АТ (REGN421) (1 мг/кг или 5 мг/кг) или введения hFc (5 мг/кг) по два раза в неделю в течение 2 недель и на 28-й день после отмены введения. Числа на точечных диаграммах представляют средние процентные значения (среднее ± SEM) pDC и cDC (фиг. 8A) или Трег-клеток (фиг. 8B) от общего количества клеток в тимусе.
На фиг. 9А-9В показаны эффекты блокирования Dll4 на мышиную модель экспериментального аутоиммунного энцефаломиелита (ЕАЕ). Фиг. 9А: на графике показана частота возникновения заболевания (%) на группу воздействия. Фиг. 9В: на графике показано развитие ЕАЕ по средней оценке заболевания. Воздействие проводили антителами к Dll4 (REGN577) до индукции заболевания (▼); изотипными контрольными антителами до индукции заболевания (♦); антителами REGN577 после индукции заболевания (▲); или антителами к VLA-4 (PS/2) до индукции заболевания (■).
На фиг. 10 показаны эффекты блокирования Dll4 на продукцию IL-17 и IFN-γ в лимфатических узлах EAE-мышей. Уровень IL-17 (левая панель) и IFN-γ (правая панель) в лимфатических узлах EAE-мышей, которым вводили Dll4-АТ (■) или контрольные АТ, hFc (□), измеряли на 12-й и 18-й день с помощью ELISA.
На фигурах 11А-11Е показаны эффекты антител к Dll4 на диабетическую модель мышей NOD. На фиг. 11А показан % возникновения диабета (два последовательных определения уровня глюкозы выше 250 мг/дл) у 9-недельных мышей, которые получали либо контрольное антитело, hFC (●), либо анти-Dll4 антитело (REGN577) (■). Также показан % возникновения диабета у пяти мышей, которым вводили Dll4-АТ, и после получали инъекции антитела PC61 на 20-й неделе (♦). PC61 представляет собой анти-CD25 антитело и истощает Трег-клетки. На фигуре 11В показана измеренная с помощью ELISA продукция анти-инсулинового аутоантитела (□), аутоантитела к декарбоксилазе глутаминовой кислоты 65 (GAD65) (■) у мышей NOD, получавших Dll4-АТ или контрольное антитело, hFc, по сравнению с не получавшими воздействие мышами дикого типа (WT). На фигуре 11С показаны срезы поджелудочной железы, окрашенные гематоксилином и эозином (H&E), мышей NOD, которым вводили Dll4-АТ (левая панель) или контрольное антитело, hFc (правая панель). Черные стрелки указывают на отдельные панкреатические островки, а белые стрелки указывают на клеточные инфильтраты в островках (правая панель). На фигуре 11D показано число панкреатических островков (левая панель) или % инфильтрованных панкреатических островков (правая панель) в поджелудочной железе мышей, которым вводили контрольное антитело, hFc (□), или Dll4-АТ (■). На фигуре 11Е показаны изменения уровня глюкозы в крови у мышей, получавших в начале заболевания Dll4-АТ (●) или контрольное антитело, hFc (□), через 42 дня после воздействия.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед описанием настоящих способов следует отметить, что настоящее изобретение не ограничено описанными конкретными способами и экспериментальными условиями, поскольку такие способы и условия могут изменяться. Следует также понимать, что используемая в настоящем документе терминология предназначена только для описания конкретных вариантов осуществления изобретения и не носит ограничительного характера, поскольку объем настоящего изобретения будет лимитирован только прилагаемой формулой изобретения.
Используемое в данном описании и приложенной формуле изобретения единственное число включает ссылку на множественное число, за исключением случаев, когда контекст явно указывает на обратное. Поэтому, например, ссылка на «способ» включает один или несколько способов и/или стадий описанного в настоящем документе типа, и/или которые будут очевидны специалистам в данной области при прочтении описания настоящего изобретения.
Если не указано иное, то все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое общеизвестно рядовым специалистам в области, к которой относится настоящее изобретение. Хотя на практике или при проверке настоящего изобретения можно использовать любые способы и материалы, аналогичные или идентичные описанным в настоящем документе, ниже описаны предпочтительные способы и материалы. Все указанные в настоящем документе публикации полностью включены в него путем ссылки.
Определения
Используемый в настоящем документе термин «антагонисты Dll4» включает антитела к Dll4 и их фрагменты, способные блокировать связывание Dll4 с Notch-рецептором (таким как Notch1 и Notch4) и/или блокировать активируемые взаимодействием Dll4 и Notch сигнальные пути (см., например, WO 2008/076379), слитые белки, содержащие внеклеточный домен Dll4, слитый с мультимеризующим компонентом, или их фрагменты (см., например, патентные публикации США №№ 2006/0134121 и 2008/0107648), пептиды и пептидоантитела (см., например, патент США № 7138370), и т.п., которые блокируют взаимодействие между Dll4 и Notch-рецептором. Так, в некоторых вариантах осуществления изобретения термин также охватывает антагонисты, такие как низкомолекулярные соединения, антитела или их антигенсвязывающие фрагменты и т.п., которые специфично связывают Notch-рецепторы (например, анти-Notch1 антитела, анти-Notch4 антитела ит.п.) и блокируют активируемые взаимодействием Dll4 и Notch сигнальные пути.
Используемый в настоящем документе термин «антитело» предназначен для обозначения молекул иммуноглобулина, состоящих из четырех полипептидных цепей, двух тяжелых (Н) цепей и двух легких (L) цепей, связанных друг с другом дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно называемой в настоящем документе HCVR или VH) и константной области тяжелой цепи (СН). Константная область тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в настоящем документе LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут дополнительно подразделяться на гипервариабельные области, которые называются определяющими комплементарность областями (CDR), между которыми находятся более консервативные области, называемыми каркасными областями (FR). Каждая область VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4.
Способы и методики для идентификации CDR в аминокислотных последовательностях HCVR и LCVR известны в данной области, и их можно применять для идентификации указанных аминокислотных последовательностей HCVR и/или LCVR, раскрытых в настоящем документе. Условия, которые можно использовать для идентификации границ CDR, включают определение по Кабату, определение по Чотии и AbM-определение. В общем, определение по Кабату основано на вариабельности последовательности, определение по Хотии основано на расположении областей структурных петель, а AbM-определение является компромиссом между подходами по Кабату и Чотии. См., например, Kabat, "Sequences of Proteins of Immunological Interest", National Institutes of Health, Bethesda, Md. (1991); Al-Lazikani et al., J. Mol. Biol. 273:927-948 (1997); и Martin et al., Proc. Natl. Acad. Sci. USA 86:9268-9272 (1989). Общедоступны также базы данных для идентификации последовательностей CDR в антителах.
Также возможны замена одного или нескольких остатков CDR или исключение одного или нескольких CDR. В научной литературе описаны антитела, в которых один или два CDR не критичны для связывания. Padlan и др. (1995 FASEB J. 9:133-139) проанализировали области контакта между антителами и их антигенами, исходя из опубликованных кристаллических структур, и сделали вывод, что только примерно от одной пятой до одной третьей остатков CDR действительно контактируют с антигеном. Padlan также обнаружил множество антител, у которых один или два CDR не имели аминокислот в контакте с антигеном (см. также Vajdos et al. 2002 J Mol Biol 320:415-428).
Остатки CDR, не контактирующие с антигеном, можно идентифицировать, исходя из предшествующих исследований (например, остатки H60-H65 и CDRH2 часто не требуются), в областях CDR по Кабату, расположенных вне CDR по Чотии, с помощью молекулярного моделирования и/или эмпирическим образом. Если CDR или его остаток (остатки) удаляют, то их обычно заменяют аминокислотной последовательностью, занимающей соответствующую позицию в последовательности другого антитела человека или консенсуса таких последовательностей. Позиции для замены внутри CDR и аминокислоты для замены также можно выбрать эмпирически. Эмпирическими заменами могут быть консервативные или неконсервативные замены.
Термин «антитело» также охватывает антитела с модифицированной схемой гликозилирования. В некоторых вариантах применения может оказаться полезным удалить нежелательные сайты гликозилирования, или, например, удалить остатки фукозы для усиления функции антителозависимой клеточной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277:26733). В других вариантах применения удаление участка N-гликозилирования может снизить нежелательные иммунные реакции против терапевтических антител или увеличить аффинность антител. В других вариантах применения можно осуществить модификацию галактозилирования, чтобы изменить комплемент-зависимую цитотоксичность (CDC).
Используемый в настоящем документе термин «антигенсвязывающий фрагмент» антитела (или просто «фрагмент антитела») относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфично связывать hDll4 или любые другие предполагаемые белки-мишени. Фрагмент антитела может включать: Fab-фрагмент, F(ab')2-фрагмент, Fd-фрагмент, Fv-фрагмент, одноцепочечную молекулу Fv (scFv), dAb-фрагмент, минимальные распознающие элементы, состоящие из аминокислотных остатков, которые имитируют гипервариабельную область антитела (например, фрагмент, содержащий CDR, или выделенный CDR). Другие сконструированные молекулы, такие как диантитела, триантитела, тетраантитела и миниантитела также определяются выражением «антигенсвязывающий фрагмент», используемым в настоящем документе. В некоторых вариантах осуществления изобретения антитело или фрагменты антитела по изобретению можно конъюгировать с терапевтической молекулой («иммуноконъюгат»), такой как цитотоксин, химиотерапевтическое соединение, иммуносупрессант или радиоактивный изотоп.
Антигенсвязывающий фрагмент антитела обычно будет содержать по меньшей мере один вариабельный домен. Вариабельный домен может иметь любой размер или аминокислотный состав и обычно будет содержать по меньшей мере одну CDR, смежную или с сохранением рамки считывания с одной или несколькими каркасными последовательностями. В антигенсвязывающих фрагментах, имеющих VH-домен, ассоциированный с VL-доменом, VH- и VL-домены могут быть расположены относительно друг друга в любом подходящем порядке. Например, вариабельная область может быть димерной и содержать димеры VH-VH, VH-VL или VL-VL. В альтернативном варианте, антигенсвязывающий фрагмент антитела может содержать мономерный VH- или VL-домен.
В некоторых вариантах осуществления изобретения антигенсвязывающий фрагмент антитела может содержать по меньшей мере один вариабельный домен, ковалентно соединенный по меньшей мере с одним константным доменом. Неограничивающие примеры конфигураций вариабельных и константных доменов, которые можно найти среди антигенсвязывающих фрагментов антител по настоящему изобретению, включают: (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3 и (xiv) VL-CL. В любой конфигурации вариабельных и константных доменов, включая любые из примеров конфигураций, перечисленных выше, вариабельные и константные домены могут быть либо напрямую соединены друг с другом, либо могут быть соединены через полноразмерную или частичную шарнирную или линкерную область. Шарнирная область может состоять по меньшей мере из 2 (например, из 5, 10, 15, 20, 40, 60 или большего числа) аминокислот, что приводит к гибкому или полужесткому соединению между соседними вариабельными и/или константными доменами в одной молекуле полипептида. Более того, антигенсвязывающий фрагмент антитела по настоящему изобретению может включать гомодимер или гетеродимер (или другой мультимер) любых конфигураций вариабельных и константных доменов, перечисленных выше, в нековалентной ассоциации друг с другом и/или с одним или несколькими VH- или VL-доменами (например, посредством дисульфидной(ых) связи(ей)).
Как и в случае с полноразмерными молекулами антител, антигенсвязывающие фрагменты могут быть моноспецифичными или полиспецифичными (например, биспецифичными). Полиспецифичный антигенсвязывающий фрагмент антитела обычно будет содержать по меньшей мере два различных вариабельных домена, причем каждый вариабельный домен способен специфично связывать отдельный антиген или другой эпитоп на одном антигене. Любой формат полиспецифичного антитела можно адаптировать для применения в контексте антигенсвязывающего фрагмента антитела по настоящему изобретению, используя рутинные методики, имеющиеся в данной области.
Используемый в настоящем документе термин «антитело человека» предназначен для включения антител с вариабельной и константной областями, полученными из иммуноглобулиновых последовательностей зародышевой линии человека. Моноклональные антитела человека по изобретению могут включать аминокислотные остатки, не кодируемые иммуноглобулиновыми последовательностями зародышевой линии человека (например, мутации, вызванные случайным или сайт-специфичным мутагенезом in vitro или соматическими мутациями in vivo), например, в CDR, особенно в CDR3. Однако используемый в настоящем документе термин «антитело человека» не подразумевает включение моноклональных антител, в которых в FR-последовательности человека встроены CDR последовательности, полученные из зародышевой линии млекопитающего другого вида (например, мыши).
Раскрытые в настоящем документе полностью антитела человека к Dll4 могут содержать одну или несколько аминокислотных замен, вставок и/или делеций в каркасных и/или CDR областях вариабельных доменов тяжелой и легкой цепей по сравнению с соответствующими последовательностями зародышевой линии. Такие мутации можно легко выявить, сравнивая аминокислотные последовательности, раскрытые в настоящем документе, с последовательностями зародышевой линии, доступными, например, в открытых базах данных последовательностей антител. Настоящее изобретение включает антитела и их антигенсвязывающие фрагменты, которые получены из любых аминокислотных последовательностей, раскрытых в настоящем документе, в которых одна или несколько аминокислот в одной или нескольких каркасных и/или CDR областях мутированы в соответствующий(е) остаток(ки) зародышевой линии, из которой получено антитело, или в соответствующий(е) остаток(ки) другой зародышевой линии человека, или в консервативную(ые) аминокислотную(ые) замену(ы) соответствующего(их) остатка(ов) зародышевой линии (такие изменения последовательности собирательно именуются в настоящем документе «мутациями зародышевой линии»). Рядовой специалист в данной области, начиная с последовательностей вариабельных областей тяжелой и легкой цепей, раскрытых в настоящем документе, может легко получить множество антител и антигенсвязывающих фрагментов, которые содержат одну или несколько обратных мутаций относительно индивидуальной зародышевой линии или их комбинации. В некоторых вариантах осуществления изобретения все каркасные и/или CDR остатки в VH и/или VL-доменах мутированы обратно до остатков, найденных в исходной последовательности зародышевой линии, из которой было получено антитело. В других вариантах осуществления изобретения только некоторые остатки мутированы обратно до исходной последовательности зародышевой линии, например, только мутированные остатки, найденные в первых 8 аминокислотах FR1 или в последних 8 аминокислотах FR4, или только мутированные остатки, найденные в CDR1, CDR2 или CDR3. В других вариантах осуществления изобретения один или несколько каркасных и/или CDR-остатков мутированы в соответствующие остатки последовательности другой зародышевой линии (то есть, последовательности зародышевой линии, которая отличается от последовательности зародышевой линии, из которой исходно было получено антитело). Кроме того, антитела по настоящему изобретению могут содержать любую комбинацию двух или нескольких мутаций зародышевой линии в каркасной и/или CDR-областях, например, в которых некоторые индивидуальные остатки мутированы в соответствующие остатки в последовательности конкретной зародышевой линии, в то время как некоторые другие остатки, которые отличаются от последовательности исходной зародышевой линии, сохраняются или мутированы в соответствующие остатки другой зародышевой линии. После получения, антитела и антигенсвязывающие фрагменты, которые содержат одну или несколько мутаций зародышевой линии, можно легко проверить по одному или нескольким желательным свойствам, таким как увеличенная специфичность связывания, увеличенная аффинность связывания, увеличенные или улучшенные антагонистические или агонистические биологические свойства (в зависимости от обстоятельств), сниженная иммуногенность и т.п. Антитела и антигенсвязывающие фрагменты, полученные по этому общему принципу, входят в объем настоящего изобретения.
Настоящее изобретение также включает анти-Dll4 антитела, содержащие варианты любых аминокислотных последовательностей HCVR, LCVR и/или CDR, раскрытых в настоящем документе, имеющие одну или несколько консервативных замен. Например, настоящее изобретение включает анти-Dll4 антитела, имеющие аминокислотные последовательности HCVR, LCVR и/или CDR, например, с 10 или меньше, 8 или меньше, 6 или меньше, 4 или меньше, 2 или 1 консервативными аминокислотными заменами относительно любых аминокислотных последовательностей HCVR, LCVR и/или CDR, раскрытых в настоящем изобретении. В одном варианте осуществления изобретения HCVR содержит аминокислотную последовательность SEQ ID NO:116 с 10 или меньше консервативными заменами в ней. В другом варианте осуществления изобретения HCVR содержит аминокислотную последовательность SEQ ID NO:116 с 8 или меньше консервативными заменами в ней. В другом варианте осуществлени