Комплекс рекомбинантных полипептидов, обладающий протективными свойствами в отношении streptococcus agalactiae и streptococcus pyogenes
Иллюстрации
Показать всеИзобретение относится к области микробиологии и молекулярной генетики. Предложен комплекс рекомбинантных полипептидов для профилактики и лечения бактериальных инфекций, вызванных Streptococcus agalactiae и/или Streptococcus pyogenes. Комплекс содержит в равных долях рекомбинантные полипептиды Р6, recScaAB, StV, РВ1 и Csp1a, имеющее аминокислотные последовательности SEQ ID No: 1-5 соответственно. Комплекс не обладает токсическим действием на организм млекопитающих. Вызывает синергетический эффект в ходе синтеза специфических антител анти-P6, анти-recScaAB, анти-StV, анти-PB1 и анти-Csp1a, которые обладают протективным действием в отношении Streptococcus agalactiae и Streptococcus pyogenes, проявляя синергетический эффект в отношении Streptococcus agalactiae. 5 табл., 19 пр., 21 ил.
Реферат
Изобретение относится к области иммунологии, микробиологии и молекулярной генетики и может быть использовано в медицинской промышленности при производстве вакцин против Streptococcus agalactiae (стрептококков группы В (СГВ)) и Streptococcus pyogenes (стрептококков группы А (СГА)).
Streptococcus agalactiae (СГВ) является основной причиной серьезных перинатальных инфекций, чаще всего протекающих в виде пневмоний, сепсиса и менингита. Заражение ребенка происходит во время родов от матери с носительством СГВ или еще антенатально в случае бессимптомного носительства СГВ у матери. У детей старшего возраста стрептококковая инфекция проявляется в форме остеомиелита, артрита, поражения глаз, кожи и мочевого пузыря. У взрослых стрептококки группы В также могут вызывать ряд тяжелых заболеваний, таких как пиелонефрит, артрит, офтальмит, эндокардит, септицемия и др. Streptococcus pyogenes (СГА) являются широко распространенным патогеном для человека и приматов, инфицируя, главным образом, назофарингеальную слизистую и кожу. Стрептококки, инфицирующие слизистую человека, вызывают острую ангину, скарлатину, хронический тонзиллит и фарингит, которые часто сопровождаются серьезными осложнениями, такими как отит, ревматизм и гломерулонефрит. К кожным заболеваниям, вызываемым СГА, относятся импетиго, васкулиты, гнойные посттравматические и постожоговые поражения тканей, рожистое воспаление. В ряде случаев инфекции, вызванные СГА, переходят в более генерализованные формы: некротический фасцит, стрептококковый сепсис и токсический шоковый синдром. Эти заболевания характеризуются высоким процентом летальных исходов вследствие быстрого развития шока на фоне общей недостаточности работы органов человеческого организма.
Заболевания, вызываемые стрептококками групп А и В, рассматриваются как важная социально-экономическая и медицинская проблема во всех странах мира.
Общепризнанным методом лечения бактериальных инфекций, вызванных стрептококками групп А и В, является антибиотикотерапия. Широкое использование антибиотикотерапии выявило целый ряд недостатков. Установлено, что побочные эффекты применения антибиотиков связаны с изменением биохимических характеристик крови человека, развитием аллергических реакций, дисбактериоза, иммуносупрессии, угнетения кроветворения и рядом других нарушений. Существенным недостатком является также неизбежная селекция антибиотикорезистентных вариантов микроорганизмов, связанная с широким, часто бесконтрольным применением антибиотиков. Это приводит к снижению оперативности антибактериальной терапии и необходимости постоянного поиска новых эффективных вариантов антибиотиков.
При лечении СГВ и СГА инфекций препаратами выбора являются беталактамы: бензилпенициллин, ампициллин [Семина Н.А., Сидоренко C.B. и др., Клин. Микробиол. Антимикроб. Химиотер. 6 (4): 306-359 (2004)], ампициллин + сульбактам [Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 332 (2003)]; макролиды: эритромицин, кларитромицин, рокситромицин, азитромицин; ванкомицин [Зуева Л.П., Поляк М.С. и др., Микробиологический мониторинг, СПб: Медицинский информационно-аналитический центр, 1-72 (2004)].
В целях профилактики СГА и СГВ инфекций используют такие антибиотики, как бензатин бензилпенициллин [Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 323-324 (2003)], эритромицин [Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 352 (2003)], ампициллин + сульбактам [Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 332 (2003)].
Альтернативой антибиотикотерапии стали разработки вакцинных препаратов, что продолжает оставаться перспективным направлением на протяжении последних десятилетий. В русле этой тенденции проводятся интенсивные исследования по созданию эффективных вакцин против стрептококка групп А и В.
Вакцины, специфичные в отношении стрептококка группы В, создаются на основе:
а) полисахаридов бактериальной капсулы;
б) конъюгатов капсульных полисахаридов с белками;
в) поверхностных бактериальных белков.
Недостатком полисахаридных вакцин является низкая эффективность вследствие недостаточной иммуногенности самой полисахаридной капсулы, Т-независимого характера иммунного ответа и узкой типовой специфичности антител, поскольку существует одиннадцать различных серотипов СГВ [Lindahl G. и др. Clin Microbiol Rev. 18(1): 102-127 (2005); Slotved H.C., Kong F., и др. J Clin Microbiol. 45(9): 2929-36 (2007)].
Расширение пределов специфичности полисахаридных вакцин достигается за счет включения в вакцинный препарат полисахаридов, принадлежащих всем наиболее распространенным серотипам СГВ, что существенно удорожает стоимость вакцины. Наиболее хорошо разработаны и доведены до этапа клинических испытаний конъюгированные вакцины, представляющие собой комплекс полисахаридов СГВ и бактериальных токсинов и токсоидов, используемых в качестве адъювантов. Препятствием на пути применения препаратов подобного типа у людей является наличие иммунитета к адъювантным компонентам вакцины, что ощутимо снижает иммунный ответ на специфический полисахарид [Burrage M., Robinson А. и др., Infect Immun. 70: 4948-54 (2002)].
Наиболее востребованными вакцинами, специфичными в отношении СГА, являются вакцины на основе различных производных антифагоцитарного M белка. В литературе описаны вакцинные препараты на основе консервативного эпитопа пептида Ρ 145, локализованного в области С повторов и расположенного проксимально по отношению к клеточной стенке бактерии; на основе полипептида, соответствующего полноразмерному участку С-повторов; а также рекомбинантного полипептида, составленного из N-терминальных последовательностей M белков, принадлежащих 26 различным М-серотипам СГА [Good M., Cleary Р. и др. New generation vaccines, M.M. Levine (ed.), NY, 695-710 (2004); (Fischetti V.A. ASM News 62: 405-410 (1996); Hu M.C., M.A. Walls и др. Infect. Immun. 70: 2171-2177 (2002)].
Вакцины на основе M белка СГА являются средством борьбы с инфекциями, вызываемыми стрептококком группы А, и не эффективны для профилактики СГВ инфекций.
Вакцинные препараты на основе других поверхностных белков СГА, в том числе общих для стрептококков групп А и В, находятся на начальных стадиях разработки [Hae-Sun Park H.S., Cleary P.P. Infect. Immun. 73(12): 7878-7886 (2005); Schulze Kai, Eva Medina и др. Vaccine 21(17-18): 1958-1964 (2003)].
Аналогами заявляемого изобретения являются разработки СГВ вакцин на основе рекомбинантных белков. В состав подобных разработок входят рекомбинантные полипептиды, полученные на основе хорошо изученных поверхностных белков стрептококка группы В: Вас, Sip, Rib, С5а пептидазы, LrrP [Yang H.H., Madoff L.C. Inf Immun. 75: 3455-61 (2007); Martin D., Rioux S. и др., Infect Immin. 70(9): 4897-4901 (2002); Stålhammar-Carlemalm M. и др., J Exp Med. 177(6): 159301603; Cleary P.P., Matsuka Y.V. и др., Vaccine 22(31032): 4332-41 (2004); Seepersaud R., Hanniffy S.B. Infect Immun. 73(3): 1671-83 (2005)].
Недостатком рекомбинантных моновакцин против стрептококков группы В является дифференциальная экспрессия различных поверхностных белков бактерий в зависимости от фазы роста, а также существование антигенной вариабельности белков среди бактериальных штаммов одного вида.
Другим недостатком рекомбинантных моновакцин является отсутствие экспрессии поверхностного белка, на основе которого была создана моновакцина, некоторыми стрептококковыми штаммами. Следствием этого станет неэффективность такой моновакцины в отношении определенных стрептококковых штаммов. Примером может служить Вас белок, который не продуцируется СГА штаммами.
Аналогом заявляемого изобретения является четырехкомпонентный комплекс рекомбинантных полипептидов, полученных на основе четырех консервативных белков СГВ [Maione D., Margarit I. и др. Science 309 (5731): 148-150 (2005)]. Три из этих белков входят в состав пилей СГВ, четвертый белок был идентифицирован как Sip.
К недостаткам этого комплекса можно отнести использование в ходе иммунизации лабораторных животных адъюванта Фрейнда, который как было продемонстрировано еще в 1993 г. является токсически активным веществом [Gupta R.k, Relyveld Е.Н. и др. Vaccine 11: 293-306 (1993)].
К недостаткам этого комплекса относится отсутствие данных о синергетическом эффекте комплекса по отношению к синтезу специфических антител, а также высокая вариабельность белков пилей у штаммов СГВ.
Также недостатком комплекса является продемонстрированная протективность специфических антител только по отношению к стрептококку группе В.
В представленном изобретении заявляется комплекс рекомбинантных полипептидов К5РП, полученных на основе пяти поверхностных белков СГВ: Вас, С5а пептидазы, ScaAB, CspA и SspB1.
Вас белок, молекулярная масса которого была определена равной 131 кДа, продуцируется большинством СГВ Ib, II серотипов, реже Ia и V серотипов Отличительной особенностью Вас белка является способность связывать Fc-часть IgA человека [Jerlstrom p.G., Talay S.R. и др. Infect. Immun. 64: 2787-2793 (1991)].
Биологическое значение неиммунного IgA-связывания до сих пор дискуссируется, но преобладает мнение, что это свойство СГВ относится к мимикрии и помогает микробу избегать защитной реакции со стороны макроорганизма. Известно, что Вас белок взаимодействует с компонентом комплемента H и, как следствие этого, препятствует активации системы комплемента по альтернативному пути [Areschoug Т. и др. J. Biol. Chem. 277: 12642-12648 (2002)]. Новые экспериментальные данные указывают на то, что Вас белок посредством связывания с рецепторами лейкоцитов человека противодействует фагоцитозу [Carlin A.F., Chang Y.C. и др. J. Exp. Med. 206 (8): 1691-1699 (2009)].
Важным доводом в пользу выбора этого белка стало свидетельство о протективных свойствах антител, полученных к Вас белку [Bevanger L., Naess A.I. Acta Pathol. Microbiol. Immunol. Scand. Sect. B. 93: 121-124 (1985)].
Другим белком, на основе которого был создан один из компонентов вакцинного комплекса, является С5а пептидаза. Практически все штаммы СГА и СГВ продуцируют на поверхности клетки практически идентичную по аминокислотному составу С5а пептидазу - фермент молекулярной массы 125 кДа, относящийся к сериновым протеазам и расщепляющий С5а компонент комплемента человека, обезьяны и коровы. С5а компонент комплемента обладает свойствами анафилатоксина и участвует в привлечении полиморфноядерных лейкоцитов в очаг инфекции [Wexler D.E., and P.P. Cleary. Infect. Immun. 39: 239-246 (1983); Wexler D.E., and P.P. Cleary. Infect. Immun. 50: 757-764 (1985)]. К настоящему времени установлено, что С5а пептидаза обладает способностью связывать фибронектин, а также непосредственно участвует в адгезии и инвазии эпителиальных клеток [Beckmann С и др. Infect. Immun. 70: 2869-2876 (2002)].
Протективная активность антител, полученных к С5а пептидазе обеих стрептококковых групп, была продемонстрирована на мышиной модели в ряде исследований 2004-2005 гг. [Park H.S., Cleary P.P. Infect. Immun. 73(12): 7878-7886 (2005); Cleary P.P., Matsuka Y.V. и др. Vaccine 22 (31-32): 4332-4341 (2004)].
C5a пептидазу рассматривают в качестве потенциального компонента для создания вакцины против СГА и СГВ, так как она обладает такими преимуществами, как высокая распространенность среди этих групп стрептококка и консервативность. Более того, при сравнении генов scpA и scpB, кодирующих С5а пептидазу стрептококка групп А и В, была выявлена 95-98% гомология их нуклеотидных последовательностей [Chmouryguina I., Suvorov А. и др. Infect. Immun. Jul: 2387-2390 (1996)].
Поверхностная сериновая протеаза CspA (153 кДа), на 38% гомологичная С5а пептидазе, также является фактором патогенности СГВ. Протеаза CspA способна специфически расщеплять альфа цепь фибриногена, участвуя, таким образом, в распространении микроорганизма в крови организма хозяина. Недавно было продемонстрировано, что протеаза CspA способна расщеплять хемокины подсемейства СХС (GRO-α, GRO-β, GRO-γ, NAP-2 (пептид, активирующий нейтрофилы), GCP-2 (гранулоцитарный хемотаксический белок 2). Хемокины подсемейства СХС, также как и С5а компонент комплемента, обладают свойствами анафилотоксина и стимулируют привлечение в очаг инфекции нейтрофилов. Протеаза CspA посредством расщепления хемокинов подсемейства СХС препятствует активации и миграции нейтрофилов, и тем самым участвует в подавлении иммунного ответа организма хозяина [Bryan J.D., Shelver D.W. J Bacteriol. 191(6): 1847-1854 (2009)].
На поверхности СГА была обнаружена сериновая протеаза ScpC с высокой степенью гомологии протеазе CspA. Ген scpC присутствует во всех 12 геномах СГА (M1, М3, М5, М6, M18, М28 и М49 серотипов), представленных в GenBank. Протеаза ScpC расщепляет IL-8, KC ((keratinocyte-derived chemokine), MIP-2 ((macrophage inflammatory protein-2), (GCP-2) и (GRO-α) [Hanski E. и др. EMBO Journal, (2006); Musser J.M. и др. Infect. Immun. (2008)].
ScaAB белок - поверхностный белок СГВ молекулярной массы 37 кДа, который относят к липопротеинам LraI семейства. Основной функцией стрептококковых липопротеинов LraI семейства является связывание ионов Mn2+ и транспорт их в бактериальную клетку [Novak R., Braun J.S. и др. Mol. Microbiol. 29: 1285-1296 (1998); Oetien J., Fives-Taylor P. и др. Infect. Immun. 70 (10): 5706-5714 (2002)]. Липопротеины LraI семейства также необходимы для выживания бактерий в организме хозяина [Tseng H.J., McEwav A.G. и др. Infect. Immun. 70: 1635-1639 (2002)]. Известно, что большинство стрептококковых LraI липопротеинов являются факторами адгезии и коагрегации [Lowe A.M., Lambert Р.А., and Smith A.W. Infect. Immun. 63 (2): 703-706 (1995)]. Сравнительный анализ аминокислотных последовательностей LraI липопротеинов стрептококка различных групп выявил 75-90% гомологию, что свидетельствует о высокой консервативности этих белков [Sutcliffe I.C., and Harrington D.J. Microbiol. 148: 2065-2077 (2002)].
Впервые ген, кодирующий белок ScaAB, был изучен Воробьевой Е.И. и Суворовым А.Н. [Воробьева Е.И. и др., Молекулярная генетика, микробиология и вирусология 3:9-11 (2005)]. В последующих исследованиях Воробьевой Е.И. с соавторами было продемонстрировано, что ScaAB белок участвует в процессах адгезии СГВ к клеткам эпителия человека и коагрегации СГВ [Vorobieva E.I., Meringova L.F. и др. Folia Microbiol. 50: 172-176 (2005)]. Известно, что адгезия бактериальных клеток к клеткам организма человека играет ведущую роль в колонизации стрептококков. Этот факт учитывали при выборе адгезина ScaAB, в качестве основы для создания рекомбинантного полипептида, входящего в вакцинный комплекс.
Поверхностный адгезии SspB1 (180 кДа) также был отобран для создания пятивалентной вакцины. Доводами в пользу этого выбора стали данные о корреляции тяжелых клинических случаев СГВ инфекций с наличием генов, кодирующих белки данного семейства [Суворов А.Н., Савичева A.M. и др, Ж. Акушерства и женских болезней: 50-56 (2005)]. Необходимо отметить, что в настоящее время описана группа поверхностных СГВ белков, высоко гомологичная SspB1 и обозначенная как SspB2. SspB1 и SspB2 относят к адгезинам системы секреции V типа [Suvorov A.N., Ferretti J.J. J. Basic Microbiol.: 64-74 (2004)].
Прототипом заявляемого изобретения является двухкомпонентный комплекс Р6-ScaAB, включающий в себя рекомбинантные полипептиды Р6 и ScaAB [Грабовская К.Б., Г.Ф. Леонтьева и др. Ж. Микробиол., Эпидемиол. и Иммунобиол. 5: 44-50 (2007)]. Авторами были продемонстрированы хорошие иммуногенные свойства этого комплекса и протективная активность специфических антител. К недостаткам комплекса Р6-ScaAB относится использование адъюванта Фрейнда в ходе иммунизации лабораторных животных. К недостаткам комплекса Р6-ScaAB также относится отсутствие синергетического эффекта при совместной циркуляции анти-Р6 и анти-ScaAB антител в опытах по изучению развития генерализованной СГВ инфекции у мышей, предварительно иммунизированных комплексом P6-ScaAB.
Прототипом заявляемого изобретения также является трехкомпонентный комплекс Р6-ScaAB-ScpB, включающий в себя рекомбинантные полипептиды Р6, ScaAB и ScpB [Суворов А.Н., Леонтьева Л.Ф., и др. Медицинский академический журнал. 10 (2): 32-39 (2010)]. В данном исследовании было продемонстрировано, что применение комплекса Р6-ScaAB-ScpB приводит в ходе иммунизации мышей к индукции специфических антител, обладающих протективными свойствами.
Задачей данного изобретения стало получение комплекса, состоящего из пяти рекомбинантных полипептидов Р6, recScaAB, StV, РВ1 и Csp1a, получившего обозначение К5РП (P6-recScaAB-StV-PB1-Csp1a), обладающего иммуногенными свойствами, причем с синергетическим эффектом в ходе синтеза специфических антител, и выраженными протективными свойствами с синергетическим эффектом комплекса анти-К5РП антител. Получение перечисленных рекомбинантных полипептидов необходимо на основе Вас, ScaAB, С5а пептидазы, SspB1 и CspA СГВ Ia и II серотипов. Комплекс рекомбинантных полипептидов К5РП используют в качестве вакцинного препарата против Streptococcus agalactiae и Streptococcus pyogenes.
Поставленная задача решалась:
а) получением монопрепаратов Р6, recScaAB, StV, РВ1 согласно патентам №2387715, №2378374, Воробьевой Е.И. и др. Молекулярная генетика, микробиология и вирусология 3: 9-11 (2005), патенту №2542483; получением штамма-продуцента recScaAB и рекомбинантного полипептида recScaAB;
б) получением штамма-продуцента Csp1a и рекомбинантного полипептида Csp1a;
в) объединением монопрепаратов в определенном соотношении в комплекс P6-recScaAB-StV-PB1-Csp1a, получивший обозначение К5РП.
Сущностью предлагаемого изобретения является создание уникального комплекса рекомбинантных полипептидов К5РП, обладающего выраженным иммуногенным и протективным эффектами.
Авторами заявляемого изобретения были определены анти-Р6, анти-recScaAB, анти-StV, анти-PB1 и анти-Csp1a антитела при подкожном введении К5РП млекопитающим (мышам и кроликам).
Авторами заявляемого изобретения изучены:
1) синергетический эффект индукции специфических антител мыши при применении трехкомпонентного комплекса К3РП (Р6-recScaAB-PB1) по сравнению с монопрепаратами Р6, recScaAB, РВ1;
2) синергетический эффект индукции анти-recScaAB, анти-PB1 и анти-Csp1a антител мыши при применении К5РП по сравнению с двухкомпонентными комплексами К2РП (РВ1-Csp1a) или К′2РП (recScaAB-Csp1a);
3) протективные свойства комплекса анти-Р6, анти-recScaAB и анти-PB1 антител мыши в отношении СГВ и СГА in vivo;
4) протективные свойства комплекса анти-Р6, анти-recScaAB, анти-PB1 и анти-StV антител кролика в отношении СГВ in vivo;
5) протективные свойства комплекса анти-Р6, анти-recScaAB, анти-StV, анти-PB1 и анти-Csp1a антител мыши в отношении СГВ и СГА in vivo, а также в защите новорожденных мышей от генерализованной СГВ инфекции;
В дополнительных экспериментах также была продемонстрирована безопасность применения рекомбинантных полипептидов Р6, recScaAB и РВ1, входящих в комплекс К5РП, на мышиной модели.
Новый комплекс рекомбинантных полипептидов К5РП имеет высокую физиологическую стабильность, не обладает какой-либо ферментативной активностью, не токсичен, вызывает синтез анти-Р6, анти-recScaAB, анти-StV, анти-PB1 и анти-Csp1a антител с проявлением синергетического эффекта в отношении Streptococcus agalactiae, причем синтезируемые специфические антитела обладают протективными свойствами против Streptococcus agalactiae и Streptococcus pyogenes.
Новый комплекс К5РП полезен в качестве поливалентного вакцинного препарата для профилактики и лечения бактериальных инфекций, вызванных Streptococcus agalactia и/или Streptococcus pyogenes.
Получение комплекса рекомбинантных полипептидов К5РП
Результатом заявленного изобретения является создание комплекса К5РП, состоящего из рекомбинантных полипептидов: Р6, recScaAB, StV, РВ1 и Csp1a.
Рекомбинантные полипептиды Р6, recScaAB, StV, РВ1 и Csp1a получали с использованием генно-инженерных методов. В качестве генетической матрицы для получения фрагментов ДНК (р6, recscaAB, stV, рВ1 и csp1a), кодирующих соответственно Р6, recScaAB, StV, РВ1 и Csp1a, использовали ДНК СГВ штамма 090R Ia (для рВ1 и csp1a) или 219/4849 Ib серотипа (для р6), или 78/471 II серотипа (для recscaAB). Фрагменты ДНК получали с помощью полимеразной цепной реакции (ПЦР) и специфических праймеров. Затем фрагменты ДНК разделяли с помощью горизонтального электрофореза в 1% или 1,5% агарозном геле и выделяли из агарозы с помощью набора «The QIAquick Gel Extraction Kit» (Qiagen, США). Выделенные фрагменты ДНК клонировали с использованием экспрессионных плазмид pQE-30-32 («The QIAexpress System», Qiagen, США). Полученными в результате клонирования рекомбинантными плазмидами затем трансформировали клетки Е.coli M15 или Ε.coli JM 109 (для p6) («The QIAexpress System», Qiagen, США) с помощью «кальциевого метода». Отбор клонов-трансформантов проводили через 18 часов роста клеток при 37°С на плотной среде с 1% L-агаром (Difco, США), содержащей ампициллин (100 мкг/мл) и канамицин (25 мкг/мл). В результате клонирования были получены рекомбинантные клоны, несущие рекомбинантные плазмиды, наличие которых определяли с помощью ПЦР с использованием исходных праймеров.
Для получения чистых препаратов рекомбинантных полипептидов клетки штаммов-продуцентов Е.coli культивировали на L-бульоне (Difco, США) с добавлением антибиотиков до поздней логарифмической фазы роста (OD600=0,7÷0,9). Затем продукцию рекомбинантных полипептидов индуцировали добавлением изопропил-бета-D-тиогалактопиранозида (IPTG), и клетки культивировали еще от 4 до 4,5 часа в зависимости от конкретного полипептида. После этого клетки осаждали центрифугированием, отмывали лизирующим буфером А (20 мМ Na2HPO4, 20 мМ NaH2PO4, 500 мМ NaCl, 20 мМ имидазола, рН=7.4) и суспендировали в том же буфере. Суспензию клеток вскрывали ультразвуком. Очистку рекомбинантных полипептидов проводили с использованием Ni-сефарозы (Amersham, США). Полученные после аффинной хроматографии рекомбинантные полипептиды диализовали против 20 мМ Na2HPO4, 20 мМ NaH2PO4, рН=7,8 с добавлением 500 мМ NaCl. Чистоту и молекулярную массу рекомбинантных полипептидов определяли с помощью 12% или 14% SDS-PAGE, сравнивая пробег полипептидов с пробегом белков известной молекулярной массы (Precision Plus Protein standards (№161-0373), Bio-Rad, США). Молекулярная масса рекомбинантных полипептидов оказалась равной: Р6=(35±0,5) кДа, recScaAB=(37±0,5) кДа, StV=(130±0,5) кДа, РВ1=(43,0±0,5) кДа, Csp1a=(12,0±0,5) кДа.
Результатом изобретения является комплекс рекомбинантных полипептидов К5РП, который представляет собой смесь Р6, recScaAB, StV, РВ1 и Csp1a в равных долях.
Комплекс К5РП обладает следующими свойствами:
а) при введении в организм млекопитающим (мышам и кроликам) вызывает синтез анти-Р6, анти-recScaAB, анти-StV, анти-PB1 и анти-Csp1a антител;
б) при введении в организм млекопитающим (мышам) вызывает повышенный синтез анти-Р6, анти-recScaAB и анти-PB1 антител по сравнению с введением монопрепаратов Р6, recScaAB и РВ1, а также повышенный синтез анти-recScaAB, анти-PB1 и анти-Csp1a антител по сравнению с введением двухкомпонентных комплексов К2РП (РВ1-Csp1a) или К′2РП (recScaAB-Csp1a);
в) при введении в организм млекопитающих (мышей) не вызывает токсического действия;
г) синтезируемые специфические антитела по п. (а) обладают протективными свойствами в отношении Streptococcus agalactiae и Streptococcus pyogenes;
д) синтезируемые специфические антитела по п. (а) проявляют синергетический протективный эффект на организм млекопитающих (мышей) в отношении Streptococcus agalactiae.
Ниже приводятся конкретные примеры, иллюстрирующие некоторые варианты изобретения, но не ограничивающие его.
Пример 1. Выделение и очистка рекомбинантного полипептида Р6.
Выделение и очистку рекомбинантного полипептида Р6 проводили согласно патенту №2387715 от 07.06.2008 г. Аминокислотная последовательность, состоящая из 294 аминокислотных остатков, приведена в Перечне последовательностей под номером SEQ ID NO: 1.
Пример 2. Получение и очистка рекомбинантного полипептида recScaAB. На основе геномной ДНК, выделенной из СГВ 78/471 II серотипа, методом ПЦР был получен ДНК-фрагмент recscaAB (864 п.н.), с использованием специфических праймеров: прямого Sca5 (5′-gctaacaagcaggatcaagc) и обратного Sca2 (5′-aagtcagtttttagattaggatttc). Фрагмент recscaAB был проклонирован с использованием плазмиды pGEM-T Easy (Promega, США). Далее ДНК-фрагмент recscaAB был переклонирован из плазмиды pGEM-Teasy в три экспрессионных вектора pQE-30, pQE-31, pQE-32 («The QIAexpress System», Qiagen, США) с использованием рестриктаз SphI и PstI.
Рекомбинантные плазмидные ДНК pQE30-scaAB, pQE31-scaAB, pQE32-scaAB, несущие фрагмет recscaAB, трансформировали в гетерологичную систему Е. coli M15. Генетическим маркером плазмид pQE-30, pQE-31, pQE-32 был ген amp, кодирующий бета-лактамазу, что обеспечивало устойчивость к ампициллину клеток, несущих данную плазмиду. Трансформацию осуществляли как описано в примере 3. Отбор клонов-трансформантов проводили через 18 часов роста клеток при 37°C на плотной среде с 1% L-агаром (Difco, США), содержащей ампициллин (100 мкг/мл) и канамицин (25 мкг/мл).
В результате анализа рекомбинантных клонов после трансформации был отобран клон Е. coli M15, содержащий плазмиду pQE31-scaAB с фрагментом recscaAB, обозначенный как Е. coli M15-recScaAB. Данный клон Е. coli M15-recScaAB, в отличие от клонов, содержащих плазмиды pQE30-scaAB и pQE32-scaAB с фрагментом recscaAB, показал наличие экспрессируемого рекомбинантного белка recScaAB в лизатах культур. Лизаты анализировали методом белкового 12% SDS-электрофореза в полиакриламидном геле. В качестве контроля использовали лизат культуры Е. coli штамма M15, который использовали для трансформации экспрессионных векторов pQE. Клон клеток Е. coli M15-recScaAB был использован для дальнейшей работы как штамм-продуцент.
Для получения чистого препарата recScaAB клетки Е. coli M15-recScaAB культивировали на L-бульоне (Difco, США) с добавлением антибиотиков (ампициллин (100 мкг/мл) и канамицин (25 мкг/мл)). Продукцию и очистку (с использованием Ni-сефарозы, Amersham, США) recScaAB проводили как описано в примере 3. Молекулярную массу recScaAB определяли с помощью 12% SDS-PAGE, сравнивая пробег полипептида recScaAB с пробегом белков известной молекулярной массы (Precision Plus Protein standards (№161-0373), Bio-Rad, США). Молекулярная масса рекомбинантного полипептида recScaAB оказалась равной (37,0±0,5) кДа.
Рекомбинантный полипептид recScaAB содержит аминокислотную последовательность поверхностного белка ScaAB СГВ штамма 78/471 II серотипа с 2 по 289 аминокислотный остаток, ковалентно связанную с 25 аминокислотными остатками, кодируемыми pGEM-T Easy и pQE-31.
Аминокислотная последовательность рекомбинантного полипептида recScaAB приведена в Перечне последовательностей под номером SEQ ID NO: 2.
Пример 3. Выделение и очистка рекомбинантного полипептида РВ1.
Выделение и очистку рекомбинантного полипептида РВ1 проводили согласно патенту №2378374 от 10.01.2010 г. Аминокислотная последовательность приведена в Перечне последовательностей под номером SEQIDNO: 3.
Пример 4. Выделение и очистка рекомбинантного полипептида StV.
Выделение и очистку рекомбинантного полипептида StV проводили согласно патенту №2542483 от 17.05.2012. Аминокислотная последовательность, состоящая из 1227 аминокислотных остатков, приведена в Перечне последовательностей под номером SEQ ID NO: 4.
Пример 5. Получение и очистка рекомбинантного полипептида Csp1a.
На основе геномной ДНК, выделенной из СГВ 090R Ia серотипа, методом ПЦР был получен ДНК-фрагмент csp11a (266 п.н.), с использованием специфических праймеров: прямого Csp1 (5′-aaggatccctaacaaaattgacgctgat), несущего на 5′-конце сайт рестрикции для BamHI и обратного Csp2 (5′-agcttctgcaggtaaagaagtatctgttt), несущего на 5′-конце сайт рестрикции для PstI.
Клонирование ДНК-фрагмента csp11a осуществляли с использованием экспрессионной плазмиды pQE-30 («The QIAexpress System», Qiagen, США). При подготовке к клонированию была проведена двойная рестрикция выделенного из агарозы csp11a (266 п.н.) и плазмиды pQE-30 (3462 п.н.) ферментами BamHI и PstI с образованием липких концов. В ходе клонирования была получена рекомбинантная плазмидная ДНК (обозначенная как pQE-csp1a), несущая рекомбинантную ДНК (обозначенную как csp1a и состоящую из 257 п.н. фрагмента гена cspA и 36 п.н. фрагмента плазмиды pQE-30). Рекомбинантную плазмидную ДНК pQE-csp1a трансформировали в гетерологичную систему Е. coli M15. Генетическим маркером плазмидной ДНК pQE-30 был ген amp, кодирующий бета-лактамазу, что обеспечивало устойчивость к ампициллину клеток, несущих данную плазмиду. Трансформацию осуществляли как описано в примере 3. Отбор клонов-трансформантов проводили через 18 часов роста клеток при 37°C на плотной среде с 1% L-агаром (Difco, США), содержащей ампициллин (100 мкг/мл) и канамицин (25 мкг/мл). В результате проведенного клонирования были получены рекомбинантные клоны, несущие плазмиду pQE-csp1a с рекомбинантной ДНК csp1a. Один из рекомбинантных клонов получил название Е. coli M15-Csp1a и был использован для дальнейшей работы.
Клон E.coli M15-Csp1a проверяли на способность продуцировать полипептид Csp1a. Для получения чистого препарата Csp1a клетки Е. coli М15-Csp1a культивировали на L-бульоне (Difco, США) с добавлением антибиотиков (ампициллин (100 мкг/мл) и канамицин (25 мкг/мл)). Продукцию и очистку (с использованием Ni-сефарозы, Amersham, США) Csp1a проводили как описано в примере 3. Молекулярную массу Csp1a определяли с помощью 14% SDS-PAGE, сравнивая пробег полипептида Csp1a с пробегом белков известной молекулярной массы (Precision Plus Protein standards (№161-0373), Bio-Rad, США). Молекулярная масса рекомбинантного полипептида Csp1a оказалась равной (12,0±0,5) кДа.
Таким образом, рекомбинантный полипептид Csp1a содержит аминокислотную последовательность поверхностного белка CspA СГВ штамма 090R Ia серотипа с 1249 по 1330 аминокислотный остаток, ковалентно связанную с четырнадцатью аминокислотными остатками, кодируемыми pQE-30 (The QIAexpress System, Qiagen, США).
Аминокислотная последовательность рекомбинантного полипептида Csp1a, состоящая из 96 аминокислотных остатков, приведена в Перечне последовательностей под номером SEQ ID NO: 5.
Пример 6. Сравнительное изучение динамики изменения титра анти-Csp1a антител в ходе подкожной иммунизации мышей полипептидом Csp1a.
Иммунный ответ приобретенного иммунитета к рекомбинантному полипептиду Csp1a изучали на беспородных белых мышах (самцах, массой 16÷18 г), полученных из питомника «Рапполово», РАМН. Иммунизацию проводили двукратно и подкожно с адъювантом гидроокиси алюминия (Imject® Alum, Thermo Scientific, США).
Первой группе мышей из 30 особей вводили 0,2 мл Csp1a пополам с адъювантом. Конечная концентрация Csp1a составляла 100 мкг/мл при первой инъекции и 50 мкг/мл при второй инъекции, которые делали на 1-й и 22-й дни, соответственно. Специфические антитела к Csp1a определяли с 20 по 216 день от начала иммунизации, используя пул сывороток от 3-х животных. Специфические антитела определяли с помощью двухслойного метода иммуноферментного анализа (ИФА).
В лунки полистиролового планшета с высокой сорбционной емкостью (Costar, США) вносили по 100 мкл Csp1a в концентрации 2 мкг/мл. Сорбцию проводили в 100 мМ бикарбонатном буфере (рН=9,45) в течение 16÷20 часов при 4°C. После этого содержимое из планшета удаляли и добавляли в лунки по 150 мкл 0,15 М NaCl, рН=7,4 (PBS), содержащего 0,05% Твин-20 (PBST). Инкубацию проводили при 37°C в течение 30 мин. Содержимое планшета удаляли и трижды промывали PBST. Затем в лунки планшета вносили иммунную или нормальную (в качестве отрицательного контроля) сыворотку (с начальным разведением 1:100) с последующим шагом разведения равным двум. Все разведения осуществляли в PBST, и каждую пробу дублировали. Инкубацию проводили в течение 1 часа при 37°C.
Далее содержимое планшета удаляли и дважды промывали планшет PBST. После этого в лунки добавляли по 100 мкл А-ПХ конъюгата (белок А стафилококка, ковалентно связанный с пероксидазой хрена (Sigma, США) в концентрации 10-7 моль/л. После часовой инкубации при 37°C содержимое планшета удаляли и трижды отмывали планшет PBST и один раз PBS, чтобы избежать ингибирующего действия Твин-20 на ферментативную активность пероксидазы. Далее для визуализации реакции в лунки планшета вносили по 100 мкл субстратной смеси (0,5 мкг/мл о-фенилендиамин (Sigma, США) в 100 мМ фосфатно-цитратном буфере (рН=5,0), 10 мкл 30% перекиси водорода), которую готовили непосредственно перед применением.
Планшет инкубировали в течение 30 мин в темноте при комнатной температуре, и реакцию останавливали внесением в лунки по 30 мкл 50% концентрированной серной кислоты. Реакцию регистрировали при длине волны 492 нм с помощью прибора Titertek Multiskan (США).
Через три недели от начала иммунизации в крови мышей регистрировали появление специфических антител к Csp1a.
На фиг. 1. показана динамика изменения титра анти-Csp1a антител в ходе иммунизации мышей Csp1a.
Максимум иммунного ответа наблюдали на 40 день от начала иммунизации с титром антител равным 1:12,8×103. Также отмечали наличие специфических антител через 88 дней с титром 1:3,2×103 и на 216 день с титром 1:1,6×103. Результаты, представленные на фиг. 1, демонстрируют, что введение Csp1a приводило к выраженной индукции анти-Csp1a с пролонгированной циркуляцией в организме мышей.
Пример 7. Сравнительное изучение динамики изменения титра анти-Csp1a антител в ходе подкожной иммунизации кроликов полипептидом Csp1a. Иммунный ответ приобретенного иммунитета к рекомбинантному полипептиду Csp1a изучали на беспородных кроликах (самках, массой 2,5 кг), полученных из питомника «Рапполово», РАМН. Иммунизацию проводили трехкратно и подкожно с адъювантом гидроокиси алюминия (Imject® Alum, Thermo Scientific, США). Csp1a вводили в объеме 0,5 мл пополам с адъювантом. Конечная концентрация полипептида была равной 140 мкг/мл при первой инъекции и 70 мкг/мл при второй и третьей инъекциях, которые делали на 1-й, 22-й и 47-й дни, соответственно. Специфические антитела кролика к Csp1a определяли с 1-го по 63-й день от начала иммунизации, используя пул сывороток от 3-х опытных животных. Специфические антитела определяли с помощью ИФА, как описано в примере 6.
На фиг. 2. представлена динамика изменения титра анти-Csp1a антител в ходе иммунизации кроликов Csp1a.
Через три недели от начала иммунизации в крови кроликов регистрировали специфические антитела к Csp1a. Анти-Csp1a антитела достигали максимальных значений (1:8,0×104) на 63 день от начала эксперимента. Таким образом, результаты опыта показали интенсивную выработку специфических антител организмом кролика на введение Csp1a.
Пример 8. Изучение протективных свойств анти-Csp1a антител при внутрибрюшинном заражении мышей СГВ 5/70 (Ia).
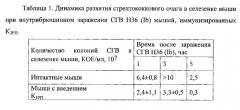
Протективные свойства анти-Csp1a антител изучали на мышах в экспериментах in vivo на модели генерализованной инфекции. Беспородных белых мышей (самцов, 18÷20 г) из питомника «Рапполово» в количестве 24 особей сначала иммунизировали по схеме, приведенной в примере 6. Контрольной группе не вводили никаких препаратов. Затем обеим группам мышей внутрибрюшинно вводили суспензию СГВ 5/70 серотипа Ia в летальной дозе LD50=7,1×107 КОЕ/мл на сроках с максимальной выработкой антител к введенным полипептидам (35-й день от начала иммунизации). Контроль развития инфекции осуществляли с помощью высева стрептококков из
гомогенатов селезенок мышей на 1% L-агар (Difco, США) с добавлением 5% крови лошади) на разных сроках после заражения СГВ (фиг. 8).
На фиг. 3. показано содержание СГВ в селезенках мышей после внутрибрюшинного заражения мышей СГВ 5/70 (Ia)):
1 - мыши, иммунизированные Csp1a;
2 - мыши без введения препаратов.
В течение первых трех часов наблюдали элиминацию стрептококков из селезенок как иммунных, так и контрольных мышей. Через пять часов после заражения мышей в селезенках контрольной группы происходило интенсивное накопление СГВ, достигая значения 108 КОЕ/мл. В противоположность этому продолжалась элиминация стрептококков из селезенок мышей, иммунизированных Csp1a. Полученные данные убедительно показывают протективность специфических антител, индуцированных введением Csp1a.
Пример 9. Сравнительное изучение динамики изменения титра анти-Р6, анти-RecScaAB и анти-PB1 антител в ходе подкожной иммунизации мышей отдельными полипептидами и комплексом К3РП (P6-recScaAB-PB1).
Иммунный ответ приобретенного иммунитета к рекомбинантным полипептидам Р6, recScaAB и РВ1 изучали на беспородных белых мышах (самцах, массой 16÷18 г), полученных из питомника «Рапполово», РАМН. Иммунизацию проводили двукратно и подкожно с адъювантом гидроокиси алюминия (Imject® Alum, Thermo Scientific, США). В эксперименте использовали 5 групп из 24 мышей, которым вводили 0,2 мл К3РП (либо отдельные полипептиды) с адъювантом в соотношении объемов 1:1. Конечная концентрация каждого полипептида, входящего в К3РП, составляла 100 мкг/мл при первой инъекции и 50 мкг/мл при второй инъекции, которые делали на 1-й и 22-й дни, соответственно. Конечная концентрация каждого полипептида при индивидуальном введении, составляла 100 мкг/мл при первой инъекции и 50 мкг/мл при второй инъекции, которые делали на 1-й и 22-й дни, соответственно. Специфические антитела к Р6, recScaAB и РВ1 определяли с 21-го по 52-ой дни от начала иммунизации, используя пул сывороток от 3-х животных. Специфические антитела определяли с помощью двухслойного метода иммуноферментного анализа (ИФА). В лунки полистиролового планшета с высокой сорбционной емкостью (Costar, США) вносили по 100 мкл антигена (в данном случае какой-либо из рекомбинантных полипептидов Р6, recScaAB и РВ1) в концентрации 2 мкг/мл. Сорбцию проводили в 100 мМ бикарбонатном буфере (рН=9,45) в течение 16÷20 часов при 4°C. После этого содержимое из планшета удаляли и добавляли в лунки по 150 мкл 150 мМ NaCl, рН=7,4 (PBS), содержащего 0,05% Твин-20 (PBST). Инкубацию проводили при 37°С в течение 30 мин. Содержимое планшета удаляли и трижды промывали PBST. Затем в лунки планшета вносили иммунную или нормальную (в качестве отрицательного контроля) сыворотку (с начальным разведением 1:100) с последующим шаго