Способ получения пирипиропена
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Предложены способы получения пирипиропена А, характеризуемые культивированием трансформированного микроорганизма, в который введен по меньшей мере один конкретный полинуклеотид или содержащий его/их рекомбинантный вектор, с пирипиропеном Е и выделением пирипиропена А через пирипиропен О или с деацетилпирипиропеном Е и выделением пирипиропена А через пирипиропен Е и пирипиропен О. Группа изобретений позволяет получать указанные пирипиропены способом генетической рекомбинации, внося значительный вклад в технологию крупномасштабного производства пирипиропенов А, Е, О. 7 н. и 2 з.п. ф-лы, 12 ил., 7 табл., 19 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] По данной патентной заявке испрашивается приоритет патентной заявки Японии № 14727/2010, поданной 26 января 2010 года и полное описание которой включено в настоящий документ в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[0002] Область изобретения
Настоящее изобретение относится к способу получения пирипиропена, более конкретно, к способу получения пирипиропенов A, E, O или т.п.
[0003] Предшествующий уровень техники
Как описано в выложенной публикации патента Японии № 360895/1992 (патентный документ 1) и Journal of Antibiotics (1993), 46(7), 1168-9 (непатентный документ 1), пирипиропен A обладает ингибирующей активностью в отношении ACAT (ацил-КоА-холестеринацилтрансферазы), и от него ожидают применений в лечении заболеваний, вызываемых накоплением холестерина или т.п.
[0004] В качестве продуцирующего пирипиропен A гриба в выложенной публикации патента Японии № 360895/1992 (патентный документ 1) описан штамм Aspergillus fumigatus FO-1289; в Applied and Environmental Microbiology (1995), 61(12), 4429-35 (непатентный документ 2) описан штамм Eupenicillium reticulosporum NRRL-3446; в WO2004/060065 (патентный документ 2) описан штамм Penicillium griseofulvum F1959 и в Journal of Technical Disclosure 500997/2008 (патентный документ 3) описан штамм Penicillium coprobium PF1169.
[0005] Кроме того, в качестве пути биосинтеза пирипиропена A в Journal of Organic Chemistry (1996), 61, 882-886 (непатентный документ 3) и в Chemical Review (2005), 105, 4559-4580 (непатентный документ 4) описан предполагаемый путь биосинтеза в штамме Aspergillus fumigatus FO-1289. В этих документах описано, что в штамме Aspergillus fumigatus FO-1289 с синтезом пирипиропена A циклазой связаны подструктуры, отдельно синтезируемые поликетидсинтазой или пренилтрансферазой.
ССЫЛКИ НА ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0006] [Патентный документ 1] выложенная публикация патента Японии № 360895/1992
[Патентный документ 2] WO2004/060065
[Патентный документ 3] Journal of Technical Disclosure 500997/2008
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0007] [Непатентный документ 1] Journal of Antibiotics (1993), 46(7), 1168-9.
[Непатентный документ 2] Applied and Environmental Microbiology (1995), 61(12), 4429-35.
[Непатентный документ 3] Journal of Organic Chemistry (1996), 61, 882-886.
[Непатентный документ 4] Chemical Review (2005), 105, 4559-4580.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Авторы настоящего изобретения обнаружили, что пирипиропен A или т.п. можно получать, культивируя микроорганизм, в который наряду с промежуточным соединением, необходимым для биосинтеза пирипиропена A, введен конкретный полинуклеотид или содержащий его/их рекомбинантный вектор. Настоящее изобретение сделано на основе такого открытия.
[0009] Таким образом, целью настоящего изобретения является предоставление способа получения пирипиропена A.
[0010] Кроме того, по одному из вариантов осуществления настоящего изобретения предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (I)-(III) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением пирипиропена A через пирипиропен O:
(I) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (a)-(d) ниже:
(a) нуклеотидная последовательность SEQ ID NO: 266,
(b) нуклеотидная последовательность, способная в жестких условиях гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO: 266, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266,
(c) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 266, в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266, и
(d) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью SEQ ID NO: 266 и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266;
(II) выделенный полинуклеотид, имеющий нуклеотидную последовательность, кодирующую, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 267-275, или по существу эквивалентную ей аминокислотную последовательность; и
(III) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность из (a)-(i) ниже:
(a) нуклеотидная последовательность от положения 3342 до положения 5158 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(b) нуклеотидная последовательность от положения 5382 до положения 12777 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(c) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(d) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(e) нуклеотидная последовательность от положения 18506 до положения 19296 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(f) нуклеотидная последовательность от положения 19779 до положения 21389 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(g) нуклеотидная последовательность от положения 21793 до положения 22877 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(h) нуклеотидная последовательность от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(i) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная в жестких условиях гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0011] Также согласно другому варианту осуществления настоящего изобретения предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0012] Кроме того, согласно другому варианту осуществления настоящего изобретения предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с 4-оксо-6-(3-пиридил)-α-пироном и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она.
[0013] Согласно другому варианту осуществления настоящего изобретения предоставлен, по меньшей мере, один выделенный полинуклеотид из указанных выше (I)-(III).
[0014] Кроме того, согласно другому варианту осуществления настоящего изобретения предоставлен рекомбинантный вектор, выбранный из группы, состоящей из pPP6 (№ доступа Aspergillus oryzae, трансформированного плазмидой pPP6: FERM BP-11218), pPP7 (№ доступа Aspergillus oryzae, трансформированного плазмидой pPP7: FERM BP-11219) и pPP9 (№ доступа Aspergillus oryzae, трансформированного плазмидой pPP9: FERM BP-11220).
[0015] Кроме того, согласно другому варианту осуществления настоящего изобретения предоставлен трансформант, содержащий один или более векторов, выбранных из группы, состоящей из плазмид pPP6, pPP7 и pPP9.
[0016] Согласно другому варианту осуществления настоящего изобретения предоставлено применение указанного выше рекомбинантного вектора для получения пирипиропена A.
[0017] Согласно другому варианту осуществления настоящего изобретения предоставлено применение указанного выше трансформанта для получения пирипиропена A.
[0018] В соответствии со способом получения по настоящему изобретению пирипиропены A, E, O или т.п. можно получать способами генетической рекомбинации. Таким образом, способ получения по настоящему изобретению вносит значительный вклад в технологию крупномасштабного производства пирипиропенов A, E, O или т.п.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0019] [Фигура 1] На фиг.1 представлено изображение электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали продукты ПЦР, амплифицированные с использованием следующих праймеров: M: маркер молекулярной массы (лестничный маркер 100 п.н.), полоса 1: праймеры SEQ ID NO: 1 и 2, полоса 2: праймеры SEQ ID NO: 239 и 240, полоса 3: праймеры SEQ ID NO: 237 и 238, полоса 4: праймеры SEQ ID NO: 241 и 242, полоса 5: праймеры SEQ ID NO: 247 и 248, полоса 6: праймеры SEQ ID NO: 251 и 252, полоса 7: праймеры SEQ ID NO: 245 и 246, полоса 8: праймеры SEQ ID NO: 243 и 244, полоса 9: праймеры SEQ ID NO: 249 и 250, полоса 10: праймеры SEQ ID NO: 235 и 236, полоса 11: праймеры SEQ ID NO: 233 и 234, полоса 12: праймеры SEQ ID NO: 227 и 228, полоса 13: праймеры SEQ ID NO: 229 и 230, полоса 14: праймеры SEQ ID NO: 231 и 232.
[Фигура 2] Подобно фиг.1 на фиг.2 представлено изображение электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали продукты ПЦР, амплифицированные с использованием следующих праймеров: M: маркер молекулярной массы (лестничный маркер 100 п.н.), полоса 1: праймеры SEQ ID NO: 253 и 254, полоса 2: праймеры SEQ ID NO: 257 и 258, полоса 3: праймеры SEQ ID NO: 259 и 260, полоса 4: праймеры SEQ ID NO: 255 и 256, полоса 5: праймеры SEQ ID NO: 261 и 262.
[Фигура 3] Подобно фиг.1 на фиг.3 представлено изображение электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали продукты ПЦР, амплифицированные с использованием следующих праймеров: полоса 1: маркер молекулярной массы (лестничный маркер 100 п.н.), полоса 2: праймеры SEQ ID NO: 264 и 265 (амплифицированный фрагмент 400 п.н.).
[Фигура 4] На фиг.4 представлена карта плазмиды pUSA.
[Фигура 5] На фиг.5 представлена карта плазмиды pPP2.
[Фигура 6] На фиг.6 представлена схема амплификации кДНК P450-2.
[Фигура 7] На фиг.7 представлена карта плазмиды pPP3.
[Фигура 8] На фиг.8 представлен спектр 1H-ЯМР пирипиропена E в дейтерированном ацетонитриле.
[Фигура 9] На фиг.9 представлен спектр 1H-ЯМР продукта культивирования Aspergillus oryzae, трансформированного плазмидой pPP2, в дейтерированном ацетонитриле.
[Фигура 10] На фиг.10 представлен спектр 1H-ЯМР пирипиропена O в дейтерированном ацетонитриле.
[Фигура 11] На фиг.11 представлен спектр 1H-ЯМР продукта культивирования Aspergillus oryzae, трансформированного плазмидой pPP3, в дейтерированном ацетонитриле.
[Фигура 12] На фиг.12 представлена карта плазмид pPP6, pPP7 и pPP9.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0020] Депонирование микроорганизмов
Escherichia coli (Escherichia coli EPI300TM-T1R), трансформированную плазмидой pCC1-PP1, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566) под № доступа FERM BP-11133 (преобразовано из внутреннего депонента под № доступа FERM P-21704) (ссылка для идентификации от депозиторов: Escherichia coli EPI300™-T1R/pCC1-PP1) 9 октября 2008 года (исходная дата депонирования).
[0021] Aspergillus oryzae, трансформированный плазмидой pPP2, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11137 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP2-1) 23 июня 2009 года.
[0022] Aspergillus oryzae, трансформированный плазмидой pPP3, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11141 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP3-2) 3 июля 2009 года.
[0023] Aspergillus oryzae, трансформированный плазмидой pPP6, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11218 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP6) 21 декабря 2009 года.
[0024] Aspergillus oryzae, трансформированный плазмидой pPP7, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11219 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP7) 21 декабря 2009 года.
[0025] Aspergillus oryzae, трансформированный плазмидой pPP9, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11220 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP9) 21 декабря 2009 года.
[0026] Способ получения пирипиропена
Настоящее изобретение относится к способу получения пирипиропена, где получают вторичный продукт метаболизма, культивируя микроорганизм, в который введены ген, вовлеченный в биосинтез пирипиропена A, с промежуточным соединением, необходимым для биосинтеза пирипиропена A.
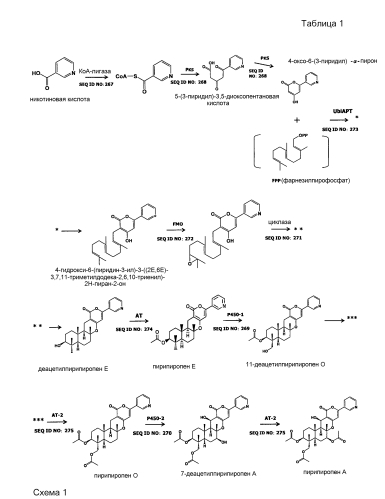
[0027] Пример пути биосинтеза пирипиропена A включает приведенную ниже схему 1.
| Таблица 1 | |
| Схема 1 |
[0028] Ниже будет подробно описан каждый путь биосинтеза указанной выше схемы 1.
1. Проводят реакцию никотиновой кислоты с КоА-лигазой и далее проводят реакцию полученного продукта с LovB-подобной поликетидсинтазой (PKS), таким образом, получая 5-(3-пиридил)-3,5-диоксопентановую кислоту.
2. Проводят реакцию 5-(3-пиридил)-3,5-диоксопентановой кислоты с LovB-подобной поликетидсинтазой (PKS), таким образом, получая 4-оксо-6-(3-пиридил)-α-пирон.
3. Проводят реакцию 4-оксо-6-(3-пиридил)-α-пирона и фарнезилпирофосфата (FPP) с UbiA-подобной пренилтрансферазой (UbiAPT), таким образом, получая 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-он.
4. Проводят реакцию 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она с FAD-зависимой монооксигеназой (FMO), а затем проводят реакцию полученного продукта с циклазой (IMP: интегральный мембранный белок), таким образом, получая деацетилпирипиропен E.
5. Проводят реакцию деацетилпирипиропена E с ацетилтрансферазой (AT), таким образом, получая пирипиропен E.
6. Проводят реакцию пирипиропена E с цитохром P450-зависимой монооксигеназой (1) (P450-1), таким образом, получая 11-деацетилпирипиропен O.
7. Проводят реакцию 11-деацетилпирипиропена O с ацетилтрансферазой-2 (AT-2), таким образом, получая пирипиропен O.
8. Проводят реакцию пирипиропена O с цитохром P450-зависимой монооксигеназой (2) (P450-2), таким образом, получая 7-деацетилпирипиропен A.
9. Проводят реакцию 7-деацетилпирипиропена A с ацетилтрансферазой-2 (AT-2), таким образом, получая пирипиропен A.
[0029] Деацетилпирипиропен E можно синтезировать, например, способом из ссылочного примера 3 ниже.
[0030] Пирипиропен E можно получать, например, способом, описанным в выложенной публикации патента Японии № 239385/1996.
[0031] 11-Деацетилпирипиропен O можно синтезировать, например, способом, описанным в ссылочном примере 4 ниже.
[0032] Пирипиропен O можно получать, например, способом, описанным в J. Antibiot. 1996, 49, 292.
[0033] 7-Деацетилпирипиропен A можно синтезировать, например, способом, описанным в выложенной публикации патента Японии № 259569/1996.
[0034] 4-Оксо-6-(3-пиридил)-α-пирон можно синтезировать, например, способом, описанным в J. Org. Chem. 1983. 48. 3945.
[0035] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с пирипиропеном E и выделением пирипиропена A через пирипиропен O.
[0036] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (IV) и (V) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением пирипиропена A через пирипиропен O:
(IV) Выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 269, 270 и 275, или по существу эквивалентную ей аминокислотную последовательность; и
(V) Полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность из (a)-(c) ниже:
(a) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(b) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(c) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0037] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pPP2, pPP3 и pPP9, с пирипиропеном E и выделением пирипиропена A через пирипиропен O.
[0038] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего плазмиды pPP2, pPP3 и pPP9, с пирипиропеном E и выделением пирипиропена A через пирипиропен O.
[0039] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0040] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0041] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (VI) и (VII) ниже или содержащий его/их рекомбинантный вектор, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропена O:
(VI) Выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из полинуклеотидных последовательностей, кодирующих, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 269, 270, 274 и 275, или по существу эквивалентную ей аминокислотную последовательность; и
(VII) Выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность из (a)-(d) ниже:
(a) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(b) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(c) нуклеотидная последовательность от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(d) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0042] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pPP2, pPP3, pPP7 и pPP9, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0043] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего плазмиды pPP2, pPP3, pPP7 и pPP9, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0044] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 4-оксо-6-(3-пиридил)-α-пироном, предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с 4-оксо-6-(3-пиридил)-α-пироном и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она. В этом случае предпочтительно, чтобы в качестве указанного выше микроорганизма использовался микроорганизм, способный к биосинтезу фарнезилпирофосфата (FPP) в клетке организма. Пример таких микроорганизмов включает микроорганизмы, принадлежащие роду Aspergillus.
[0045] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 4-оксо-6-(3-пиридил)-α-пироном, предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с 4-оксо-6-(3-пиридил)-α-пироном и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она.
[0046] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 4-оксо-6-(3-пиридил)-α-пироном, предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (VIII) и (IX) ниже или содержащий его/их рекомбинантный вектор, с 4-оксо-6-(3-пиридил)-α-пироном и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она:
(VIII) Выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 273 или по существу эквивалентную ей аминокислотную последовательность;
(IX) Полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже: и
(1) нуклеотидная последовательность от положения 21793 до положения 22877 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью.
[0047] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 4-оксо-6-(3-пиридил)-α-пироном, предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, содержащего плазмиду pPP6, с 4-оксо-6-(3-пиридил)-α-пироном, и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она.
[0048] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена E, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, c деацетилпирипиропеном E и выделением пирипиропена E.
[0049] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена E, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, c деацетилпирипиропеном E и выделением пирипиропена E.
[0050] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена E, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (X) и (XI) ниже или содержащий его/их рекомбинантный вектор, c деацетилпирипиропеном E и выделением пирипиропена E:
(X) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 274 или по существу эквивалентную ей аминокислотную последовательность; и
(XI) полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью.
[0051] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена E, характеризуемый культивированием микроорганизма, содержащего плазмиду pPP7, c деацетилпирипиропеном E и выделением пирипиропена E.
[0052] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением пирипиропена O.
[0053] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с пирипиропеном E и выделением пирипиропена O.
[0054] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (XII) и (XIII) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением пирипиропена O:
(XII) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 269 и 275, или по существу эквивалентную ей аминокислотную последовательность; и
(XIII) полинуклеотид, по меньшей мере, с одной нуклеотидной последовательностью, выбранной из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность из (a)-(b) ниже:
(a) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(b) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0055] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pPP2 и pPP9, с пирипиропеном E и выделением пирипиропена O.
[0056] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, содержащего плазмиды pPP2 и pPP9, с пирипиропеном E и выделением пирипиропена O.
[0057] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения 11-деацетилпирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением 11-деацетилпирипиропена O.
[0058] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения 11-деацетилпирипиропена O, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с пирипиропеном E и выделением 11-деацетилпирипиропена O.
[0059] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения 11-деацетилпирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (XIV) и (XV) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением 11-деацетилпирипиропена O:
(XIV) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 269 или по существу эквивалентную ей аминокислотную последовательность; и
(XV) полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белк