Способ прогнозирования риска развития инфекционного эндокардита
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к терапии и хирургии, и может быть использовано для прогнозирования генетической предрасположенности или повышенного риска развития инфекционного эндокардита (ИЭ) у пациентов из группы риска. Способ включает забор венозной крови, выделение генетического материала, проведение полимеразной цепной реакции, определение полиморфизма гена. Проводят генотипирование по полиморфному локусу I105V гена GSTP1 пациентов из группы риска и при выявлении гетерозиготного варианта I105V у его носителей прогнозируют высокий риск развития инфекционного эндокардита. В группу риска входят лица с врожденными или приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, с иммунодефицитными состояниями, наркоманы с угрозой развития тяжелой инфекции. Предложенный способ позволяет выявить индивидов, генетически предрасположенных к ИЭ, поможет определить тактику ведения пациентов и индивидуализировать комплекс профилактических и лечебных мероприятий. 1 з.п. ф-лы, 2 табл., 4 пр., 1ил.
Реферат
Изобретение относится к медицине, а именно к терапии и хирургии, и может быть использовано для прогнозирования генетической предрасположенности или повышенного риска развития инфекционного эндокардита (ИЭ) у пациентов из группы риска: с врожденными или приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, у лиц с иммунодефицитными состояниями, наркоманов с угрозой развития тяжелой инфекции.
ИЭ - воспалительное поражение эндокарда клапанных структур, пристеночного эндокарда, эндотелия в зоне врожденного порока магистральных сосудов, обусловленное прямым внедрением возбудителя и протекающее чаще всего по типу сепсиса остро или подостро с циркуляцией возбудителя в крови, эмболиями, иммунопатологическими и тромбогеморрагическими нарушениями (Тюрин В.П., Шевченко Ю.Л. «Инфекционные эндокардиты» Практическое руководство, 2-е издание Москва, 2012 г.). Заболевание может возникнуть в любом возрасте как у детей, так и у пожилых людей. Ежегодная заболеваемость ИЭ составляет 3,8 случая на 100 тысяч населения. Увеличение частоты заболеваемости ИЭ в последние годы связано с распространением оперативных вмешательств и диагностических манипуляций на сердце. Существенное влияние на заболеваемость оказывает рост наркомании. У лиц, употребляющих наркотики внутривенно, риск возникновения ИЭ в 1000 раз выше, чем у населения в целом (Тюрин В.П., Шевченко Ю.Л. «Инфекционные эндокардиты» Практическое руководство, 2-е издание, Москва, 2012 г.). По данным ФКСН РФ на 2014 г., число людей, эпизодически и регулярно употребляющих наркотики, составляет 8 млн человек, что является на сегодняшний день самостоятельной медицинской и социальной проблемой. Прогноз ИЭ остается в более чем 80% случаев неблагоприятным. Причиной смерти пациентов становятся септические состояния с проявлением полиорганной недостаточности, тромбоэмболические осложнения с поражением центральной нервной системы: гнойные менингиты, менингоэнцефалиты, отек мозга с вклинением его ствола, кровоизлиянием в мозг, тромбоэмболии легочной артерии.
За лицами с повышенным риском развития ИЭ устанавливается необходимое наблюдение и контроль. Однако участились случаи возникновения ИЭ при отсутствии известных факторов риска, у ослабленных возрастных пациентов, у пациентов, имеющих хронические очаги инфекции. По данным Тюрина В.П. и Шевченко Ю.Л. (2012), в 48% случаев диагноз ИЭ выставляется к концу 3-4 недели от начала заболевания, что приводит к тяжелым последствиям для здоровья больных и высоким экономическим затратам на лечение. Поэтому данная проблема составляет повышенный интерес и оправдан поиск новых маркеров повышенного риска и диагностики заболевания.
Развитие медицинской генетики привело к появлению способов, помогающих выявлять генетическую предрасположенность к различным заболеваниям при наличии в геноме индивида аллельных вариантов генов, связанных с патологией. Известно, что определенные варианты однонуклеотидных замен в генах (однонуклеотидные полиморфизмы) могут влиять на инфекционный процесс, что показано для сепсиса и других инфекций кровяного русла (Kumpf О., Schumann R.R. Genetic influence on bloodstream infections and sepsis. Int J Antimicrob Agents. 2008; V. 32 (1): 44-50). Поиск генетических маркеров инфекционного эндокардита пока практически безуспешен. Так, показано, что полиморфизмы в гене рецептора тромбоцитов не влияют на течение ИЭ (Daga S., Shepherd J.G., Callaghan J.G., Hung R.K., Dawson D.K., Padfield G.J., Hey S.Y., Cartwright R.A., Newby D.E., Fitzgerald J.R. Platelet receptor polymorphisms do not influence Staphylococcus aureus-platelet interactions or infective endocarditis. Microbes Infect. 2011; 13(3): 216-25). He обнаружено несомненных ассоциаций с ИЭ вариантов генов некоторых толл-подобных рецепторов и интерлейкинов - TLR4, IL10, IL1B, IL6 (М. Weinstock, I. Grimm, J. Dreier, C.s Knabbe, T. Vollmer Genetic Variants in Genes of the Inflammatory Response in Association with Infective Endocarditis PLoS One. 2014; 9(10): el 10151. Published online Oct 9, 2014. doi: 10.1371/journal.pone.0l10151 PMCID: PMC4192365).
Наиболее близким к заявляемому способу является способ определения высокого риска развития ИЭ у носителей варианта Q полиморфизма R753Q (rs 5743708) в гене толл-подобного рецептора 2 (TLR2) (Bustamante J., Tamayo Е., Florez S., Telleria J.J., Bustamante E., Lopez J., San Roman J.A., Alvarez FJ. Toll-Like Receptor 2 R753Q Polymorphisms Are Associated With an Increased Risk of Infective Endocarditis. Rev. Esp. Cardiol. 2011; 64 (11): 1056-1059). Способ заключается в выделении геномной ДНК из образцов крови, взятой в пробирки с антикоагулянтом - этилендиаминтетрауксусной кислотой (ЭДТА), определении полиморфизма R753Q в гене TLR2 с помощью полимеразной цепной реакции и рестрикционного анализа полученных ПЦР-продуктов. Было обследовано 65 больных ИЭ в сравнении с 66 практически здоровыми индивидами. При статистическом анализе результатов генотипирования авторами была найдена значительная ассоциация с ИЭ полиморфизма R753Q гена TLR2, установлен повышенный риск (в 3-13 раз) развития ИЭ у носителей аллеля Q.
Однако указанный патологический вариант (аллель Q) был обнаружен авторами только у 33% больных ИЭ и у 12,9% практически здоровых людей. Выявленная низкая частота аллеля Q у пациентов с ИЭ побуждает к поиску других более информативных генетических маркеров риска. Кроме этого, другие исследователи заявленную ассоциацию аллеля Q полиморфизма R753Q в гене TLR2 с ИЭ не подтвердили (Golovkin A.S., Ponasenko A.V., Yuzhalin A.E., Salakhov R.R., Khutornaya M.V., Kutikhin A.G., Rutkovskaya N.V., Savostyanova Y.Y., Barbarash L.S. An association between single nucleotide polymorphisms within TLR and TREM-1 genes and infective endocarditis. Cytokine. 2014, 8; 71(1): 16-21).
Задачей изобретения явилась разработка способа определения генетической предрасположенности к ИЭ и оценка риска его развития на основе выявления нового патологического для ИЭ варианта гена.
Поставленная задача достигается способом прогнозирования риска развития инфекционного эндокардита, включающим забор венозной крови, выделение генетического материала, проведение полимеразной цепной реакции, определение полиморфизма гена. Проводят генотипирование по полиморфному локусу I105V гена GSTP1 пациентов из группы риска и при выявлении гетерозиготного варианта I105V у его носителей прогнозируют высокий риск развития инфекционного эндокардита.
В группу риска входят лица с врожденными или приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, с иммунодефицитными состояниями, наркоманы с угрозой развития тяжелой инфекции.
Новизна изобретения
1. Генотипирование по полиморфному локусу I105V гена GSTP1 пациентов группы риска позволяет прогнозировать высокий риск развития ИЭ у носителей гетерозиготного варианта I105V.
2. Выделена группа риска.
В патентной и научной литературе отсутствуют сведения об аналогичном способе определения генетического риска ИЭ.
Совокупность существенных признаков изобретения позволяет получить новый технический результат, заключающийся в установлении генетической предрасположенности к ИЭ у пациентов из группы риска, что поможет определить тактику ведения пациентов и индивидуализировать комплекс профилактических и лечебных мероприятий.
Предложенный способ позволяет выявить индивидов, генетически предрасположенных к ИЭ, среди лиц с врожденными или приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, с иммунодефицитными состояниями, наркоманы с угрозой развития тяжелой инфекции.
Способ осуществлялся следующим образом.
Геномную ДНК выделяли из клеток периферической крови с помощью коммерческого реагента «ДНК-экспресс-кровь-плюс» (НПФ «Литех», Москва). Определение полиморфизма I105V гена GSTP1 (нуклеотидная замена A/G, аминокислотная замена I/V, rs 1695, аллель риска или мутантный аллель - G, алелль дикого типа или протективный аллель - А) проводили с помощью метода аллель-специфической полимеразной реакции с использованием коммерческого комплекта реагентов для анализа однонуклеотидного полиморфизма I105V в гене GSTP1 (мутация 1 Пи-глутатион-S-трансферазы) [НПФ Литех, Москва]. Согласно инструкции, с образцом выделенной ДНК осуществляли одновременно две реакции амплификации - с двумя парами аллель-специфичных праймеров, на параллельное выявление аллелей 105I и 105V. Реакционная смесь для ПНР состояла из 5 мкл исследуемого образца ДНК и 20 мкл рабочей амплификационной смеси, содержащей 0,2 мкл рабочего раствора Taq полимеразы. Амплификацию проводили в автоматическом термоциклере Терцик («ДНК-Технология», Москва). Программ: 1 цикл при 93°С в течение 1 мин, 35 циклов с этапами денатурации ДНК в течение 10 сек при 93°С, отжига праймеров в течение 10 сек при 64°С и синтеза цепей в течение 20 сек при 72°С, и 1 цикла при 72°С в течение 1 мин. Анализ ПЦР-продуктов проводили после их электрофоретического разделения в 50 мл 3%-агарозного геля на 50× ТАЕ-буфере, в который до застывания вносили 5 мкл 1% раствора бромистого этидия. В каждом геле вырезали два ряда лунок - для детекции аллеля дикого типа и мутации. Фрагменты анализируемой ДНК проявлялись в виде светящихся полос. Гели анализировали в УФ-трансиллюминаторе ЕСХ-15М (Vilber Lourmat, Франция) с помощью гельдокументирующей видеосистемы GL-2 (Россия).
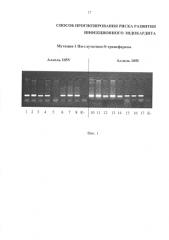
Изобретение иллюстрируется фотографией на Фиг. 1, на которой представлены результаты проведения генотипирования пациентов с инфекционным эндокардитом по полиморфизму I105V гена GSTP1 в виде электрофореграммы, на которой показаны продукты амплификации исследуемого локуса в виде светящихся полос. К- - отрицательный контроль; дорожки 1-4, 6-8, 10-17 - положительные образцы ПЦР, дорожка 5 - отрицательный образец. У 7 пациентов выявлен гетерозиготный генотип I105V и у 1 пациента - гомозиготный генотип I105I гена GSTP1.
Всего было обследовано 32 пациента (14 женщин и 18 мужчин) в возрасте от 23 до 75 лет, находившихся на стационарном лечении в терапевтических клиниках г. Новокузнецка с диагнозом «инфекционный эндокардит». Большинство пациентов страдали наркоманией (13 человек), у 4 человек обнаружен ревматический порок митрального клапана (одному из них проведено протезирование), 1 пациент с врожденным пороком сердца, 1-е пролапсом митрального клапана 2-3 степени, атеросклеротические изменения митрального и аортального клапанов сердца (МК, АК) - у 3 человек. Контрольную группу составили 55 практически здоровых лиц. Забор крови и молекулярно-генетические исследования осуществляли на основании информированного согласия обследованных лиц. Математическую обработку результатов исследований проводили с помощью пакетов статистических программ InStatII, Microsoft Excel. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05. Соответствие распределения частот генотипов равновесию Харди-Вайнберга определяли по стандартным формулам при помощи программы Chi-sq Hardy-Weinberg equilibrium test calculator for biallelic markers. Отклонений от равновесия Харди-Вайнберга в группе контроля не наблюдалось (р>0,05), а в группе больных ИЭ оно было выявлено (р=0,0001). Достоверность различий в распределении частот аллелей и генотипов между группами больных и здоровых индивидов оценивали двусторонним точным критерием Фишера. Частота аллеля/генотипа определялась по соотношению количества его носителей к общему количеству носителей тестируемых аллелей/генотипов в исследуемой выборке. Относительный риск заболевания по конкретному признаку вычисляли как соотношение шансов (OR-odds ratio): OR=(а×d)/(b×с), где a u b - количество больных, имеющих и не имеющих мутантный аллель (генотип) соответственно; с и d - количество человек в группе контроля, имеющих и не имеющих мутантный аллель (генотип) соответственно.
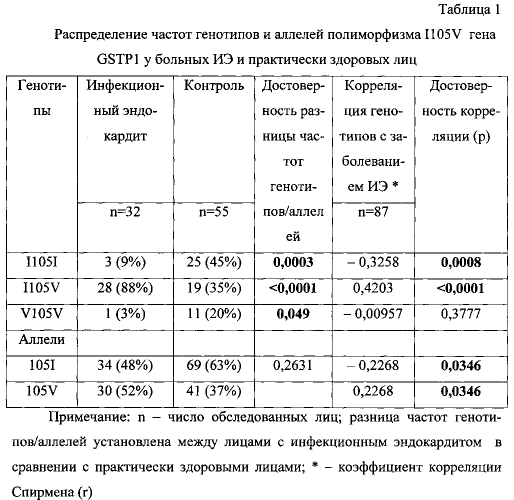
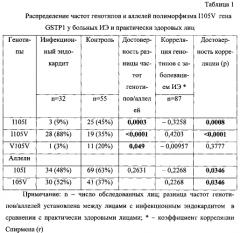
Результаты генотипирования по полиморфизму I105V гена GSTP1 пациентов с ИЭ и практически здоровых лиц представлены в таблице 1. Они свидетельствуют, что 88% больных ИЭ являлись носителями гетерозиготного варианта I105V гена GSTP1, 3% больных ИЭ - носителями гомозиготного варианта V105V, и только 9% больных имели нормальный гомозиготный генотип I105I. Частота гомозигот I105I среди практически здоровых лиц превышала в 5 раз таковую у больных ИЭ. Частота мутантного аллеля 105V у больных ИЭ почти в 1,5 раза превысила таковую среди здоровых людей. Полученные нами данные о частоте мутантного аллеля 105V полиморфизма I105V близки данным Информационной системы по медицински-значимым полиморфизмам генома человека ФГУ НИИ Физико-химической медицины России (http://www.genepassport.ru/base). В соответствии с ними носительство аллеля дикого типа (I) в популяции преобладает над носительством аллеля мутантного типа (V) и соотношение частот составляет 56%:44%.
Анализ корреляционной связи исследуемых генотипов с ИЭ показал, что носительство генотипа I105V или аллеля 105V положительно коррелирует с ИЭ, а носительство генотипа I051I или аллеля 105I отрицательно связано с заболеванием (табл.1).
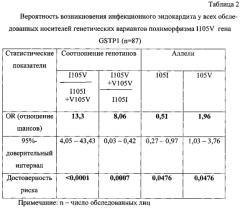
Результаты логистического регрессионного анализа полученных данных показаны в таблице 2. Они указывают, что максимальный (13,3-кратный) риск заболеть ИЭ существует у носителей гетерозиготного варианта полиморфизма I105V гена GSTP1. Носительство мутантного аллеля 105V усиливает риск заболевания в 2 раза, носительство аллеля 1051 является защитным фактором. Следовательно, аллель 105V - это аллель риска по ИЭ, аллель 105I - соответственно протективный аллель.
Таким образом, предложенный способ генотипирования по полиморфному локусу I105V гена GSTP1 позволяет обнаружить высокий (13-кратный) риск развития инфекционного эндокардита у носителей гетерозиготного генотипа I105V среди лиц с врожденными или приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, у лиц с иммунодефицитными состояниями, наркоманов с угрозой развития тяжелой инфекции.
Клинический пример 1. Пациент Р., 31 год, поступил в отделение пульмонологии МБЛПУ ГКБ №1 г. Новокузнецка с жалобами на выраженную слабость, одышку при обычной нагрузке, боль в левой половине грудной клетки, усиливающейся при глубоком вдохе, кашле, повышением температуры тела до 39-40°С, ознобом. Заболел остро 10 дней назад: насморк, головная боль, слабость, повышение t до 40°С. В течение первых трех дней лечился самостоятельно приемом жаропонижающих препаратов - без эффекта. Бригадой скорой помощи доставлен в терапевтическое отделение Центральной больницы г. Киселевска. В течение последующих 6-7 дней проводилась дезинтоксикационная, антибактериальная терапия - без эффекта. Общее состояние ухудшалось: сохранялась лихорадка, прогрессировала одышка, появились отеки на ногах. Переведен в МБЛПУ ГКБ №1 г. Новокузнецка. В анамнезе: гепатит, туберкулез, ВИЧ - отрицает, вредных привычек нет. Простудные заболевания 3-4 раза в год. Частые рецидивы герпетических высыпаний на половых органах 4-5 раз в год. Работа механиком на разрезе связана с переохлаждением. При осмотре состояние тяжелое за счет интоксикационного синдрома. Кожа сухая, бледная, легкая отечность стоп. В легких дыхание ослаблено в подлопаточных областях, хрипов нет. ЧД 22 в мин, Sp CO2-97%. Тоны сердца глухие ритмичные, ЧСС 113 в мин, диастолический шум на аорте. АД 60/40 мм рт.ст. Живот мягкий, безболезненный. Печень +2 из-под края реберной дуги. При обследовании: AT к ВИЧ, вирусным гепатитам - не выявлено. Общий анализ крови (OAK): Нв 99 г/л, эр 3.4, лейк 14.6, СОЭ 53 мм/ч. Общий анализ мочи (ОАМ): уд. вес 1025, белок 0.1 г/л, кетоны 0.5, лейкоциты 0-1 в п/зр., ан. мокроты на ВК №3 - отрицательный; биохимический анализ крови (Б/х. ан. крови): креатинин 87, мочевина 7.2, АЛТ 3.38, ACT - 1.47 (повышены), альбумины 29.3, СРБ 201.9 мг/л, прокальцитонин 0.28. Ультразвуковое исследование (УЗИ): гепатоспленомегалия, небольшое количество жидкости в брюшной полости. В синусах плевральных полостей - жидкость больше слева, Эхокардиография (ЭХО-КГ): дилятация левого предсердия, створки аортального клапана неравномерно утолщены, выраженная (3 ст.) аортальная недостаточность, регургитация митрального, трикуспидального клапана - допустимая. Открытое овальное окно, умеренное количество жидкости в перикарде, листки перикарда утолщены, умеренная легочная гипертензия, фракция выброса 58%. Электрокардиография (ЭКГ) - синусовая тахикардия 100 ударов в мин. Посевы крови на стерильность - выделены Serratia marcescens, Candida albicans, Proteus mirabilis, Streptococcus viridans, Klebsiella spp. Назначена терапия антибиотиками с учетом чувствительности: кубицин, гентамицин. сульпирацеф. Несмотря на проводимое лечение, состояние ухудшилось: прогрессировала одышка и слабость, сохранялись повышение t до 38°С и ознобы, появились отеки на голенях, постоянная головная боль. Спиральная компьютерная томография (СКТ), а затем и магнитнорезонансная томография (МРТ) с контрастированием - выявили внутримозговое образование в субкортикальных отделах, правой лобной доли (абсцесс). На рентгенограмме органов грудной клетки (Rn-ОГК): инфильтрации в легочной ткани нет. Консультирован нейрохирургом, кардиохирургом: с учетом быстрого разрушения аортального клапана, нарастанием сердечной недостаточности рекомендовано оперативное вмешательство с подготовкой в условиях ОНК ККД г. Кемерово. Результаты генотипирования по полиморфному локусу I105V гена GSTP1: выявлен гетерозиготный вариант генотипа I105V. Дз: Первичный инфекционный эндокардит, активный, с поражением аортального клапана. Недостаточность аортального клапана 3 ст. ХСН 2Б. Абсцесс правой лобной доли.
Клинический пример 2. Больная М., 26 лет. Госпитализирована в отделение пульмонологии МБЛПУ ГКБ №1 г. Новокузнецка с жалобами на сухой кашель, одышку при незначительной физической нагрузке, озноб, повышение температуры тела до 39°С, потливость по ночам, кашель с небольшим количеством гнойной мокроты. Больна в течение 2-3 недель, накануне перенесла ОРВИ, за медицинской помощью не обращалась, лечение симптоматическое с кратковременным улучшением состояния. В течение последних 2 недель появились ознобы, вновь отмечает повышение температуры до 39°С, без эффекта от жаропонижающих препаратов, нарастала слабость, появился кашель, потливость по ночам. Доставлена бригадой скорой помощи. В анамнезе частые простудные заболевания до 4-6 раз в год и лечение антибиотиками. В 2009 г. выявлен порок сердца, документов с результатами обследования нет, врачами не наблюдалась. Прием наркотиков отрицает. Работа на хладокомбинате фасовщицей связана с переохлаждением. При осмотре: состояние средней степени тяжести за счет интоксикационного синдрома, температура тела - 38,5°С. Кожа бледная, влажная, чистая, отеков нет. В легких дыхание жесткое, ослаблено в подлопаточной области справа, хрипов нет, частота дыхания 18 в минуту, тоны сердца глухие, ритмичные ЧСС ПО в минуту, грубый систолический и протодиастолический шумы в зоне аускультации левого желудочка. При обследовании: OAK Нв 91 г/л, эр 3.4, Л 15.0, п/я 14, лимф 10.5, юные - 1, тромбоциты 415, СОЭ 52 мм/ч. ОАМ - Уд. Вес 1005, белок 2.5 гр/, эр 40-50 в п/зр., Л - 2-6 в п/зр. Б/х ан. крови: АЛТ 2.26, ACT - 3.0, мочевина 10.2, креатинин 106, белок 59.6, сахар 5.0, прокальцитонин 6.1, СРБ 460.3 мг/л, Д димер 2350, AT к вирусным гепатитам, ВИЧ не выявлено. ЭКГ - синусовая тахикардия, 118 ударов в минуту, нарушение процессов реполяризации в задней стенке левого желудочка. Рентгенологическое исследование органов грудной клетки: полисегментарная пневмония справа с распадом. ЭХО-КГ: признаки ревматического поражения митрального клапана, стеноз створок митрального клапана. Sмо 1.62 см2, регургитация 1-2 ст. Аортальный клапан - стеноз не выявлен, кальциноз и фиброз створок, регургитация 2 степени. Уплотнены створки трикуспидального клапана и клапана легочной артерии, регургитация трикуспидального клапана 2 ст. В правом предсердии по в/стенке дополнительное округлое образование, подвижное средней эхогенности 2,7*1,75 см. Дилятация полостей обоих предсердий, больше левого, фракция выброса 47,8%, пародоксальное движение межжелудочковой перегородки. УЗИ: гепатоспленомегалия, диффузное изменение паренхимы почек. В динамике - появилась свободная жидкость в брюшной полости. По результатам посева крови на стерильность выделены: Staphylococcus aureus, Streptococcus viridans. В последующих посевах - Pseudomonas stutseri. Учитывая тяжесть состояния, проводимую инфузионную, антибактериальную терапию, больной был поставлен подключичный катетер. Состояние ухудшилось: возник тромбоз подколенной артерии справа, рецидивировали тромбоэмболии легочной артерии (ТЭЛА), прогрессировали сердечная и дыхательная недостаточность. Проведена ампутация правой нижней конечности до средней трети бедра. Несмотря на проводимое лечение, больная погибла от массивной ТЭЛА. Результаты генотипирования по полиморфному локусу I105V гена GSTP1: выявлен гетерозиготный вариант генотипа I105V.
Дз: Вторичный инфекционный эндокардит. Хр. ревматическая болезнь сердца: комбинированный митральный порок с преобладанием стеноза. Недостаточность аортального, трикуспидального клапанов, ХСН 2Б. ФК III. Состояние после ампутации правой нижней конечности до средней трети бедра по поводу острого артериального тромбоза. Полисегментарная пневмония справа с распадом. Рецидивирующие ТЭЛА.
Клинический пример 3. Больной С., 26 лет. Поступил с жалобами на слабость, повышение температуры тела до 39°С, ознобы, боли в мышцах, сухой кашель. Болен в течение трех недель, принимал жаропонижающие препараты. Доставлен бригадой скорой помощи, госпитализирован в терапевтическое отделение МБЛПУ ГКБ №2. В анамнезе: в течение длительного времени употребляет наркотики внутривенно (ханка, героин, соли). ВИЧ, гепатиты - отрицает. Длительное время не работает. При осмотре состояние средней степени тяжести, температура тела 38,4°С. Кожа бледная, сухая, отеков нет. В легких дыхание везикулярное, хрипов нет, частота дыхания 17 в мин. Тоны сердца приглушены, ритмичные, ЧСС 199 в мин, АД 115/75 мм рт. ст. Живот мягкий, безболезненный, печень увеличена: +2-3 см из-под края реберной дуги. При обследовании: Rn ОГК: в легких справа по всем легочным полям, слева в нижнем легочном поле определяются очаги и фокусы до 2 см с полостями распада, сердце умеренно расширено в поперечнике. УЗИ - гепатоспленомегалия, умеренные диффузные изменения в паренхиме печени, селезенки, почек. ЭКГ - синусовая тахикардия 110 в мин, ишемия в задней стенке левого желудочка. ЭХО-КГ: умеренно расширена полость правого желудочка, сократительная способность левого желудочка удовлетворительная, в области верхушки правого желудочка - гипоэхогенный очаг вегетации 24*20 мм. На трикуспидальном клапане - флотирующий гетерогенный очаг на септальной створке 16*13 мм, трикуспидальная регургитация III ст., признаков легочной гипертензии нет, перикард без особенностей. Посев крови на стерильность №3 - дважды обнаружен Staphylococcus aureus. OAK - Нв 122 г/л, эр 4.6, лейк - 17.3, СОЭ 35 мм/ч, п/я 15, с/я 56, лимфоциты 19. ОАМ - уд. вес 1017, белок 0.3 г, л - 2-3, эр - сплошь. Б/х ан. крови: сахар 5,8, белок 64,9, альбумины 45,9, мочевина 4,3, креатинин 0,05, билирубин 20,5, ACT 47, АЛТ 35, щелочная фосфатаза 240, железо 10,9. Найдены антитела к вирусу гепатита «С», ВИЧ. Лечение: дезинтоксикационная, антибактериальная терапия с учетом чувствительности. Выписан с улучшением. Результаты генотипирования по полиморфному локусу I105V гена GSTP1: выявлен гетерозиготный вариант генотипа I105V.
Дз: Инфекционный эндокардит, первичный, стафилококковый, с поражением трикуспидального клапана. Недостаточность трикуспидального клапана 3 ст. ХСН 1-2а ст. Септическая двусторонняя пневмония. Наркомания. Хр. вирусный гепатит «С». ВИЧ инфекция.
Клинический пример 4. Больная 3., 23 года. Поступила в отделение кардиологии МБЛПУ ГКБ №29 с жалобами на приступы сухого кашля, боли в мышцах, суставах, повышение температуры тела до 40°С, ознобы. Больна в течение месяца, принимала жаропонижающие препараты. Доставлена бригадой скорой помощи. В анамнезе: употребляет наркотики внутривенно в течение 1,5 лет. Гепатит, ВИЧ, туберкулез отрицает. При осмотре состояние средней степени тяжести. Кожа бледная, сухая, отеки на голенях умеренные, пониженного питания. В легких дыхание ослаблено в подлопаточных областях влажные хрипы, частота дыхания 24 в мин. Тоны сердца приглушены, ритмичные, в области мечевидного отростка выслушивается систолический шум, ЧСС 100 в мин, АД 100/70. Живот мягкий, безболезненный, печень +5-6 см из-под края реберной дуги. При обследовании: ЭКГ: синусовая тахикардия 105 ударов в мин, перегрузка правого желудочка. ЭХО-КГ: митральный клапан - передняя створка прогибается в систолу, трикуспидальный клапан регургитация II-III ст., на створках облаковидные вегетации, фракция выброса 58%, размеры полостей сердца, толщина миокарда в норме. Rn ОГК: двусторонняя септическая пневмония, абсцесс верхней доли справа, гидроторакс справа. OAK: Нв 104 г/л, эритроциты 3,6, лейкоциты 5,4, п/я 7, тромбоциты 317, СОЭ 3 мм/ч. При посеве крови на стерильность трижды выделена культура Staphylococcus aureus. Б/х. ан. крови: АЛТ 28,4, АСТ 27, билирубин 4,3, сахар 4,74, креатинин 15,3. АЧТВ 48,9, MHO 1,1 фибриноген 3,75. УЗИ: значительная гепатоспленомегалия. Проводилась антибактериальная, дезинтоксикационная терапия. Выписан с улучшением. Результаты генотипирования по полиморфному локусу I105V гена GSTP1: выявлен гетерозиготный вариант генотипа I105V.
Дз: Первичный инфекционный эндокардит, стафилококковый: с поражением трикуспидального клапана. Недостаточность трикуспидального клапана 2-3 ст., ХСН 2 Б. ФК 3. Септическая двусторонняя пневмония. Абсцесс в/доли справа. Гидроторакс - справа. Наркомания. Хр. гепатит «С».
1. Способ прогнозирования риска развития инфекционного эндокардита, включающий забор венозной крови, выделение генетического материала, проведение полимеразной цепной реакции, определение полиморфизма гена, отличающийся тем, что проводят генотипирование по полиморфному локусу I105V гена GSTP1 пациентов группы риска и при выявлении гетерозиготного варианта I105V у его носителей прогнозируют высокий риск развития инфекционного эндокардита.
2. Способ по п. 1, отличающийся тем, что в группу риска входят лица с врожденными или приобретенными пороками сердца, протезированными клапанами и другими операциями на сердце, коронарных артериях, с иммунодефицитными состояниями, наркоманы с угрозой развития тяжелой инфекции.