Способ определения функциональной активности гликопротеина-р
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фармакологии и клинической фармакологии, и предназначено для оценки функциональной активности гликопротеина-Р (Pgp) в эксперименте и клинике для осуществления эффективной и безопасной фармакотерапии субстратами данного белка-транспортера. Сущность способа: в качестве маркера вводится фексофенадин кроликам однократно перорально в дозе 67,5 мг/кг массы в форме суспензии, приготовленной на воде очищенной, а забор крови у животных с последующим анализом плазменной концентрации фексофенадина выполняется только 3 раза. Для оценки функционирования Pgp рассчитывают его максимальную концентрацию - Cmax, значение которой обратно пропорционально функциональной активности белка-транспортера по формуле:
Изобретение позволяет экономически выгодно, информативно и в относительно короткие сроки проанализировать интенсивность функционирования данного белка-транспортера и скорректировать дозы лекарственных веществ, принадлежащих к числу его субстратов с целью оказания эффективной и безопасной фармакотерапии. 1 табл.
Реферат
Изобретение относится к медицине, а именно к фармакологии и клинической фармакологии, и предназначено для внедрения в практику фармаколога и клинического фармаколога в качестве информативного и удобного метода оценки функциональной активности гликопротеина-Р (Pgp) в эксперименте и клинике, что может быть использовано для осуществления эффективной и безопасной фармакотерапии субстратами данного белка-транспортера.
Pgp - это широко представленный в тканях организма энергозависимый белок-транспортер с широкой субстратной специфичностью, функционирующий в качестве насоса, удаляющего в мочу, желчь и просвет органов большое число липофильных эндогенных и экзогенных, в том числе лекарственных веществ. Интенсивное функционирование Pgp может привести к неэффективности фармакотерапии его субстратами в связи со снижением их плазменной концентрации, а угнетение эффлюксной активности транспортера - к проявлению их токсичности, связанной с увеличением плазменной концентрации. Исходя из вышеизложенного, с целью персонализированного подхода к терапии рационально оценивать функциональную активность Pgp для последующей корректировки доз назначаемых лекарственных средств-субстратов транспортера (1).
Известен способ определения функциональной активности Pgp в тканях с помощью оценки количества иРНК гена MDR1, кодирующего данный белок-транспортер, используя методы полимеразной цепной реакции (2, 3), Nothern blotting (4) и др.
Известен полуколичественный способ анализа функционирования Pgp посредством изучения экспрессии белка-транспортера на цитоплазматических мембранах различных органов, применяя метод иммуногистохимического окрашивания со специфическими моноклональными антителами (5), Western blotting (2) и др.
Известен способ оценки функциональной активности Pgp по анализу фармакокинетики маркерных субстратов белка-транспортера, например, фексофенадина (6), дигоксина (7), домперидона (8) и др.
Известен способ изучения функционирования Pgp путем оценки резистентности культуры клеток к химиотерапии препаратами, принадлежащими к числу субстратов данного белка-транспортера (качественная оценка изменения активности транспортера) (9, 10).
Однако зачастую нет корреляции между уровнем экспрессии гена MDR1, кодирующего Pgp, с внутриклеточным накоплением его иРНК и эффлюксной активностью белка-транспортера, что может быть результатом различий в транкрипционных и трансляционных процессах (11). Это придает методу анализа уровня иРНК гена MDR1 при исследовании функционирования Pgp невысокую информативность для клиники. Кроме того, подобные исследования требуют наличия дорогостоящего оборудования, что недоступно большинству лабораторий.
Оценка экспрессии гена MDR1 в тканях и уровня Pgp на мембране клеток методами гистохимического анализа не дает полного представления о функционировании белка-транспортера на уровне целостного организма, т.к. требует масштабного исследования с применением всех тканей, участвующих в фармакокинетике субстратов Pgp: различных отделов кишечника, печени, почек. Проведение подобных исследований в эксперименте является методически сложным, инвазивным и дорогостоящим, а в клинике практически невозмжным.
Оценка функциональной активности Pgp по анализу фармакокинетики его маркерных субстратов является высокоинформативным методом и может использоваться как у людей, так и ряда лабораторных животных. Однако обнаруженные методики предполагают заборы крови в 7-9 и более временных точках (8, 12), что создает значительные технические и этические проблемы (неудобства при работе с пациентами, трудности при получении информированного согласия пациентов на установку кубитального катетера для забора крови и выполнение подобного исследования).
В научной литературе не было обнаружено информации об оценке функциональной активности Pgp путем анализа плазменной концентрации его маркерного субстрата -фексофенадина в трех временных точках с последующим расчетом основного фармакокинетического параметра фексофенадина - максимальной концентрации по соответствующей формуле.
Фексофенадин - гистаминолитик III поколения, который является активным метаболитом терфенадина. Он не подвергается метаболизму, а в его фармакокинетике ведущая роль принадлежит Pgp, который препятствует его всасыванию в кишечнике и выводит в желчь (90%) и мочу (10%). Препарат в терапевтических дозах не угнетает когнитивные и психомоторные функции, не потенцирует действие алкоголя на центральную нервную систему (13), не отличается от плацебо по снотворному действию (14). Препарат не блокирует К+-каналы кардиомиоцитов и не удлиняют интервал QT (15).
Таким образом, особенности фармакокинетики фексофенадина, а также его высокая безопасность позволяют использовать его в качестве маркера функциональной активности Pgp как у людей, так и у животных.
Целью изобретения являлась разработка способа оценки функциональной активности Pgp, который не создавал бы этических и технических проблем с забором крови, не сопровождался проявлением побочных эффектов вводимого вещества при исследовании на добровольцах, а при изучении на животных был бы методически обоснован, информативен и не требовал дорогостоящего лабораторного спецоборудования, материалов и комплектующих для проведения исследований на культурах клеток.
Поставленная задача достигается тем, что в качестве маркера функциональной активности Pgp выбран безопасный и экономически доступный препарат - фексофенадин, а забор крови с последующим анализом плазменной концентрации фексофенадина производится только 3 раза - через 3, 4 и 6 часов после его однократного введения. При этом с применением регрессионного анализа по предлагаемой формуле рассчитывается наиболее информативный фармакокинетический параметр фексофенадина - его максимальная концентрация, значение которой обратно пропорционально функциональной активности Pgp.
Описание способа
Для решения поставленной задачи нами выполнен эксперимент на 81 половозрелом кролике (42 самца, 39 самок) породы Шиншилла, средней массой 3500-4300 г. Для определения активности Pgp животным однократно внутрижелудочно через металлический зонд вводили фексофенадин (Препарат Телфаст 180 мг; производитель: Aventis Pharma, Италия) в дозе 67,5 мг/кг массы тела животного в форме суспензии на воде очищенной (12). Через 1, 2, 3, 4, 5, 6, 8, 12 и 24 часа после введения препарата для анализа динамики его плазменной концентрации из краевой вены уха кролика отбирали пробы крови в объеме 5 мл в гепаринизированные пробирки, центрифугировали 10 минут при 3000 об/мин, плазму хранили при -29°С до анализа (16). Введение фексофенадина и последующий забор крови у каждого кролика проводился трижды с интервалом, достаточным для полного удаления препарата из организма и восстановления объема циркулирующей крови. Таким образом, регрессионному анализу было подвергнуто 243 кривые динамики его плазменной концентрации.
Содержание фексофенадина в плазме крови определяли методом ВЭЖХ на хроматографе «Stayer» (Россия) с ультрафиолетовым детектором и обращенно-фазовой колонке «Beckman Coulter» 4,6*250 мм, зернением 5 мкм. Экстракцию и хроматографирование маркерного субстрата осуществляли по методу Раменской Г.В. с соавт. в собственной модификации. Анализ выполняли при длине волны 220 нм и скорости подвижной фазы 1 мл/мин.
Элюирование выполняли подвижной фазой следующего состава (на 200 мл): 133,7 мл бидистиллированной воды, содержащей 2,33 мл ледяной уксусной кислоты и 0,936 мл триэтиламина, доведенной триэтиламином до рН 4,3 и 64 мл ацетонитрила. Время удерживания пика фексофенадина составило 12,31 мин.
В качестве экстрагентов для жидкостной экстракции фексофенадина использовали дихлорметан, этилацетат и диэтиловый эфир. Коэффициент экстракции фексофенадина из плазмы крови составил 64%.
Плазменную концентрацию фексофенадина определяли методом абсолютной калибровки по высоте хроматографических пиков.
В результате хроматографического анализа определяли максимальную концентрацию фексофенадина из 9 полученных значений у каждого из 81 кроликов. Затем с применением регрессионного анализа вычисляли, от значений концентраций фексофенадина в каких временных точках в наибольшей степени зависит найденная экспериментально максимальная концентрация вещества. Регрессионный анализ показал, что забор крови через 3, 4 и 6 часов после однократного введения фексофенадина является наиболее рациональным, т.к. использование данных концентраций маркерного субстрата (С3 часа, С4 часа, С6 часов) в предлагаемой для расчета формуле дают значения максимальной концентрации, статистически не отличающиеся (р>0,05) от экспериментальной, рассчитанной по 9 временным точкам.
Предлагаемая для упрощенного расчета формула имеет вид:
,
где Cmax - максимальная плазменная концентрация фексофенадина;
С3 часа, С4 часа, С6 часов - концентрация фексофенадина через 3, 4 и 6 часов после его введения соответственно;
43,77; 0,56684; 0,43428; 0,34084 - весовые коэффициенты, рассчитанные с применением регрессионного анализа.
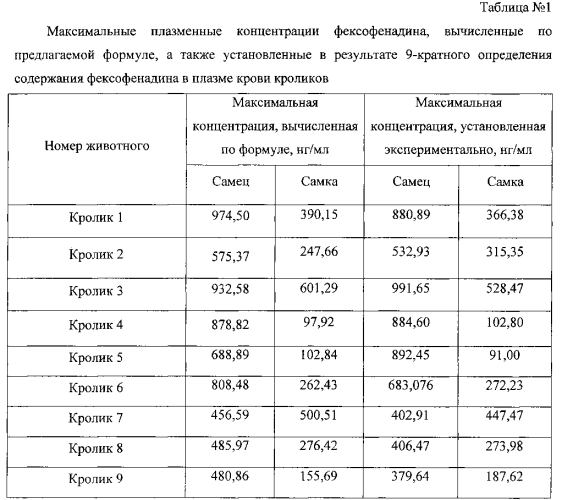
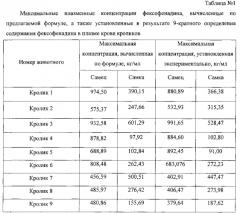
В таблице 1 в качестве примера отражены максимальные плазменные концентрации фексофенадина, вычисленные по предлагаемой формуле, а также установленные в результате 9-кратного определения содержания фексофенадина у 18 кроликов (9 самцов, 9 самок).
Применение программы «Biostat» и критерия Стьюдента для несвязанных выборок (в случае нормального распределения данных) или критерия Манна-Уитни (в случае распределения данных, отличном от нормального) показало, что приведенные значения максимальных концентраций фексофенадина, вычисленных по формуле и установленных в классическом эксперименте, статистически не отличаются (р>0,05).
Использование предлагаемого способа определения функциональной активности Pgp позволяет в эксперименте и клинике экономически выгодно, информативно и в относительно короткие сроки проанализировать интенсивность функционирования данного белка-транспортера и скорректировать дозы лекарственных веществ, принадлежащих к числу его субстратов, с целью оказания эффективной и безопасной фармакотерапии.
Источники информации
1. Konig J. Transporters and drug-drag interactions: important determinants of drug disposition and effects / J. Konig, F. Muller, M.F. Fromm // Pharmacol. Rev. - 2013. - Vol. 65, №3. - P. 944-966.
2. Influence of intermittent hypoxia on myocardial and hepatic P-glycoprotein expression in a rodent model / J.M. Dopp [et al.] // Pharmacotherapy. - 2009. - Vol. 29, №4. - P. 365-372.
3. Ultrasound Reverses Multidrug Resistance in Human Cancer Cells by Altering Gene Expression of ABC Transporter Proteins and Bax Protein / F. Wu [et al.] // Ultrasound Med. Biol. - 2010. - Vol. 15. - P. 557-561.
4. SXR, a novel steroid and xenobiotic-sensing nuclear receptor / B. Blumberg [et al.] // Genes Dev. - 1998. - Vol. 12, №20. - P. 3195-3205.
5. Gunel C. Osteitis is associated with P-glycoprotein overexpression in patients with chronic sinusitis without nasal polyps / C. Gunel, R.E. Feldman, B.S. Bleier // Am. J. Rhinol. Allergy. - 2014. - Vol. 28, №2. - P. 99-102.
6. Раменская Г.В. Разработка методики количественного определения маркера активности Р-гликопротеина фексофенадина в плазме крови / Г.В. Раменская, Е.А. Скуридина, Л.М. Красных // Химико-фармацевтический журнал. - 2006. - Т. 40, №12. - С. 47-50.
7. Effect of therapeutic moderate hypothermia on multi-drug resistance protein 1-mediated transepithelial transport of drugs / J.S. Jin [et al.] // Neurol. Med. Chir. (Tokyo). - 2006. - Vol. 46, №7. - P. 321-327.
8. Домперидон как маркер для оценки активности Р-гликопротеина / Г.В. Раменская [и др.] // Фармация. - 2007, №3. - С. 37-39.
9. Multidrug resistant cells with high proliferative capacity determine response to therapy in acute myeloid leukemia / P.A. Boekhorst [et al.] // Leukemia. - 1995. - Vol. 9, №6. - P. 1025-1031.
10. Indomethacin and SC236 enhance the cytotoxicity of doxorubicin in human hepatocellular carcinoma cells via inhibiting P-glycoprotein and MRP1 expression / C.G. Ye [et al.] // Cancer Lett. - 2011. - Vol. 304, №2. - P. 90-96.
11. ABCB1 single nucleotide polymorphisms (1236C>T, 2677G>T, and 3435C>T) do not affect transport activity of human P-glycoprotein / D. Dickens [et al.] // Pharmacogenet. Genomics. - 2013. - Vol. 23, №6. - P. 314-323.
12. Скуридина Е.А. Особенности фармакокинетики фексофенадина при совместном применения с верапамилом и негрустином: автореф. дис. на соискание ученой степени кандидата фармацевтических наук: 15.00.02 / Е.А. Скуридина; ГОУ ВПО ММА им. И.М. Сеченова. - Москва, 2007. - 24 с.
13. A single-center, randomized, double-blind, placebo-controlled, crossover investigation of the effects of fexofenadine hydrochloride 180 mg alone and with alcohol, with hydroxyzine hydrochloride 50 mg as a positive internal control, on aspects of cognitive and psychomotor function related to driving a car / F. Ridout [et al.] // Clin. Ther. - 2003. - Vol. 25, №5. - P. 1518-1538.
14. Devillier P. Clinical pharmacokinetics and pharmacodynamics of desloratadine, fexofenadine and levocetirizine: a comparative review / P. Devillier, N. Roche, C. Faisy // Clin. Pharmacokinet. - 2008. - Vol. 47, №4. - P. 217-230.
15. Simons F.E. Clinical pharmacology of new histamine HI receptor antagonists / F.E. Simons, K.J. Simons // Clin. Pharmacokinet. - 1999. - Vol. 36, №5. - P. 329-352.
16. Колхир СВ. Клиническое значение изучения активности транспортера лекарственных средств гликопротеина-Р для оптимизации фармакотерапии: диссертация на соискание ученой степени кандидата медицинских наук: 14.00.25 / СВ. Колхир; ГОУ ВПО ММА им. И.М. Сеченова. - Москва, 2007. - 21 с.
Способ определения функциональной активности гликопротеина-Р на уровне целостного организма по максимальной концентрации - Cmax в плазме крови его маркерного субстрата - фексофенадина, отличающийся тем, что образцы крови у людей и экспериментальных животных забираются только в трех временных точках: через 3, 4 и 6 часов после введения препарата с последующим расчетом максимальной концентрации по формуле: при этом величина Cmax фексофенадина обратно пропорциональна функциональной активности гликопротеина-Р.