Способ получения синтетических металл-полимерных комплексов радиоизотопа галлия-68
Иллюстрации
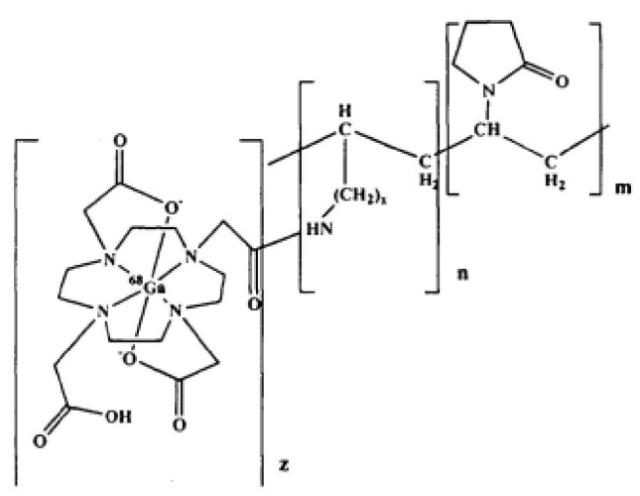
Показать всеИзобретение относится к области химии высокомолекулярных соединений и ядерной медицины, а именно к способу получения синтетических металл-полимерных комплексов радиоизотопов галлия-68. Комплекс включает водорастворимый сополимер N-винилпирролидона с аллил- или N-виниламином с молекулярной массой 5000-50000 Да, с содержанием N-винилпирролидона m=95-60 мол. % и аллил- или N-виниламина n=5-40 мол. %. Способ включает введение в сополимер хелатного узла, такого как 1,4,7,10-тетраазациклододекан-1,4,7,10-тетраацетат (ДОТА) (z=1-20 мол. %) с получением полимера-носителя, взаимодействие полимера-носителя с введенным хелатным узлом с радионуклидом, в качестве которого используют позитронный эмиттер галлий-68, в водном растворе в кислородной атмосфере или в инертном газе при температуре 60-95°С, при рН среды 1-5.5 и концентрации полимера-носителя 5-20 масс. % в течение 15-30 мин с получением металл-полимерного конъюгата следующего строения:
Способ позволяет создавать новые синтетические макромолекулярные радиофармацевтические препараты (РФП) для более точной и достоверной ранней диагностики новообразований методом позитронной эмиссионной томографии (ПЭТ). 2 ил., 4 пр.
Реферат
Изобретение относится к области химии высокомолекулярных соединений и ядерной медицины и ставит задачу создания синтетических биологически активных полимерных носителей, меченных радионуклидом галлия-68, для получения радиофармацевтических препаратов (РФП) для экспрессной диагностики новообразований организма методом позитронной эмиссионной томографии (ПЭТ). ПЭТ является современной неинвазивной медицинской диагностической технологией, основанной на введении позитрон-излучающих радионуклидов в биологически активные молекулы. Этот подход позволяет получать высокоспецифичные изображения тканей, органов и протекающих in vivo молекулярных процессов. За последнее десятилетие в мире резко возрос интерес к клиническому применению препаратов, меченных 68uGa. Этот интерес вызван разработкой коммерческих генераторов 68Ge/68Ga, позволяющих получать радионуклид без использования циклотрона. 68Ga (Т1/2=67,71 мин) распадается путем электронного захвата (ЭЗ) (10%) и испускания позитронов (90%, Еβ+=1900 кэВ). Распад сопровождается испусканием аннигиляционных γ-квантов (Еγ=511 кэВ, выход 180%) и γ-квантов с энергией Еγ=1077,4 кэВ (выход 2,93%). Такие энергетические характеристики 68Ga позволяют получать РФП необходимой активности, не создавая при этом значительной дозовой нагрузки на организм. Кроме того, катион 68Ga3+ может образовывать устойчивые комплексные соединения с различными лигандами, что делает его пригодным для синтеза большого количества биологически активных комплексов, меченых малых молекул и макромолекул различного функционального назначения.
На сегодняшний день изучено большое количество различных соединений, меченых 68Ga, от 68Ga-цитрата и 68Ga-апотрансферрина для визуализации инфекционных очагов и воспалений до сложных высокомолекулярных биоконьюгатов, меченных 68Ga и стабилизированных нерадиоактивными элементами [Melpomeni Fania, Joao P. Andre and Helmut R. Maecke Contrast Media Mol. Imaging, 2008, V. 3, P. 67-77 41. Abstracts of 1st World Congress on Ga-68 and Peptide Receptor Radionuclide Theapy (PRRNT). // World Journal of Nuclear Medicine, 2011, V. 10 (1), P. 25-107].
В качестве носителей для 68Ga используют пептиды, белки, антитела и др. [WO 1999056792 А1, 1999, US Pat Appl 20130310537, 2013, US 7011816 B2, 2006 Tiina Ujula, Satu , Pauliina Virsu, Petteri Lankinen, Tatu J. , Anu Autio, Gennady G. Yegutkin, Juhani Knuuti, Sirpa Jalkanen, Anne Roivainen. Nuclear Medicine and Biology, 2009, V. 36, P. 631-641].
В настоящее время в мировой клинической практике приняты циклические пептиды - аналоги соматостатина, меченые 68Ga (ДОТА-ТАТЕ, ДОТА-ТОС), и аналога циклического пептида - октреотида - ДОТА-NOC [WO 2013029616 A1, 2013, US 7122622 В2, 2006, WO 2012138251 А1, 2012], которые демонстрируют высокое накопление в опухолевых тканях различной морфологии.
Однако приведенные аналоги являются скорее исключением, поскольку введение металлов в состав биомолекул с малой молекулярной массой, как правило, приводит к нарушению их транспортных свойств. При этом происходит неселективное накопление радиоактивности в органах и тканях организма, мышечной ткани и кровотоке, что снижает контрастность визуализации опухолей. Недостатком также является сложная процедура получения исходных пептидов и прививка того или иного полифункционального хелатного узла.
Разумной альтернативой пептидам являются макромолекулы с высокой молекулярной массой (белки, антитела). В этом случае введение тяжелого металла существенным образом не отражаться на свойствах получаемого конъюгата.
Известны макромолекулы, меченые 68Ga, такие как антитела, содержащие хелатный лиганд (например, ДОТА - 1,4,7,10-тетраазациклододекан-1,4,7,10-тетраацетат) [WO 2003048207 А2, 2002], белки [68Ga-ДОТА-VAP-P1 (VAP-P1 - селективный аналог белка) Tiina Ujula, Satu , Pauliina Virsu, Petteri Lankinen, Tatu J. , Anu Autio, Gennady G. Yegutkin, Juhani Knuuti, Sirpa Jalkanen, Anne Roivainen. Nuclear Medicine and Biology, 2009, V. 36, P. 631-641], сложные конъюгированные системы, содержащие лейкоциты, связанные с водорастворимыми полимерами и полидентатным хелатным узлом [US 20120107232 А1, 2012].
Общими недостатками природных макромолекул являются: сложная процедура выделения, очистки и идентификации предшественников; неконтролируемое введение хелатных узлов для связывания радиоизотопов по причине наличия большого количества свободных активных функциональных амино- и карбоксильных групп; крайне высокая стоимость конечных РФП.
Наиболее близким прототипом по технической сущности и достигаемому результату является конъюгированный сополимер фракции липосом с гидрофильными полимерами (полиглицин, полиэтиленгликоль, полипропиленгликоль, полиметакриламид и др.) с молекулярной массой 1-3 кДа и привитым полидентатным хелатным узлом [US 20120107232 А1, 2012]. Способ получения сополимера заключается в следующем: а) выделение фракции липосом, б) прививка хелатного узла (ДОТА) к гидрофильному полимеру-спейсеру, в) введение полученного сополимера в липосомы, г) проведение радиохимического синтеза, д) очистка целевого конъюгата методом эксклюзионной хроматографии.
Недостатками известного способа является сложная процедура получения липосом и их конъюгации с полимером, трудоемкость радиохимического синтеза и необходимость препаративной очистки и, как следствие, низкий радиохимический выход целевого продукта препарата. Кроме того, синтез таких РФП требует привлечения высококвалифицированного персонала и организации хорошо оборудованных лабораторий, что отражается на стоимости.
Технической задачей и положительным результатом заявляемого способа является получение металл-полимерных комплексов галлия-68 для диагностики новообразований организма с использованием синтетических металл-полимерных комплексов радиоизотопа галлия-68, включающих водорастворимый сополимер N-винилпиролидона с аллил- или N-виниламином с молекулярной массой 5-50 кДа, содержанием N-винилпирролидона m=95-60 мол. % и аллил- или N-виниламина n=5-40 мол. %. Это достигается тем, что в сополимер вводят хелатный узел, такой как ДОТА - 1,4,7,10-тетраазациклододекан-1,4,7,10-тетраацетат z=1-20 мол. % с бутоксикарбонильной защитой, с использованием метода активированных эфиров с последующим снятием защиты и получением целевого полимера-носителя, при этом в качестве вводимого радионуклида используют позитронный эмиттер галлий-68. Взаимодействие полимера-носителя с введенным хелатным узлом с радиоактивным изотопом проводят в водном растворе в кислородной атмосфере или в инертном газе при температуре 60-95°С, при рН среды 1-5.5 и концентрации полимера-носителя 5-20 масс. % в течение 15-30 мин с получением металл-полимерного конъюгата следующего строения:
Металл-полимерные комплексы, отличающиеся тем, что в качестве водорастворимых высокомолекулярных носителей используются сополимеры с молекулярной массой (5-70 кДа) и содержанием хелатных узлов ДОТА 1-20 мол. %.
Способ получения водорастворимых сополимеров с хелатными узлами ДОТА отличается тем, что конъюгацию ДОТА(ВОС)3 с сополимером винилпирролидона с винил/аллиламином проводили методом активированных эфиров с последующим снятием ВОС защиты.
Способ отличается тем, что взаимодействие полимера-носителя с радиоактивным генераторным элюатом 68Ga с концентрацией полимера 8-15 масс. % проводили при различных значениях рН в атмосфере инертного газа при температуре 90°С в течение 15-30 мин с последующей экспресс-очисткой препарата на гель-фильтрационном картридже.
В результате получают полимерные водорастворимые системы, меченные диагностическим ПЭТ радионуклидом 68Ga, для диагностики новообразований организма, обладающие полифункциональной биологической активностью.
На фиг. 1. представлен профиль гель-фильтрационного выделения ВП-АА-ДОТА-68Ga на сорбенте Sephadex G-25 superfine (детектирование по радиоактивности). Объем пробы 0.5 мл, элюент - 0,9% NaCl, время - мин*0.1. Выход целевого продукта 65%. Пик 1 - ВП-АА-ДОТА-68Ga
На фиг. 2. представлена хроматограмма [ВП-АА-ДОТА-68Ga] (ММ 39 кДа) фракция, выделенная на гель-фильтрационном картридже с сорбентом Sephadex G-25 superfine. Колонка Ultrahydrogel Linear 0,78×30 см 0,6×4 см, элюент 0.2 М NaCl, 0,8 мл/мин. Верхняя хроматограмма - УФ-детектирование (210 нм) 11.9 мин, нижняя - детектирование по радиоактивности - 12,18 мин. Задержка между детекторами - 0,25 мин.
Сущность данного способа получения РФП раскрывается ниже на примерах его экспериментального осуществления.
Синтез сополимера ВП-АА. Сополимер ВП-АА синтезировали методом радикальной сополимеризации мономеров в 50% растворе этанола в присутствии 1 масс. % инициатора - 2,2′-азо-бис-изобутиронитрила при 60°С в течение 48 часов. Мольное соотношение ВП:АА в исходной смеси составляло 70:30 мол. %. Полученный сополимер очищали от низкомолекулярных примесей диализом против воды. Использовали диализные мембраны Spectra/Por 7 фирмы "SpectrumLab. Inc." (США), позволяющие удалять соединения с М≤1000. Полимер выделяли с помощью лиофильной сушки. Получен сополимер, содержащий 7,0 мол. % звеньев АА, [ η ] 0.1 M C H 3 C O O H = 0.16 д л / г .
Синтез сополимеров ВП-ВА. Мономеры N-ВП (N-винилпирролидон) и N-ВФА (N-винилформамид) очищали вакуумной перегонкой Ткип=69°С (3 мм рт. ст.), η D 20 = 1.5120 , d=1.014; Ткип=65°С (4 мм рт. ст.), η D 20 = 1.4920 , d=1.015 соответственно.
Полимеризацию проводили в этиловом и пропиловом спирте при 60°С, заполненных ампулах в атмосфере аргона. В качестве инициатора использовали динитрилазобисизомасляной кислоты (ДАК) 1-2 масс. % от массы загруженных мономеров. Полученные сополимеры выделяли осаждением в диэтиловый эфир. Осадок сушили в вакууме при комнатной температуре до постоянного веса.
Гидролиз сополимеров ВП-ВФА проводили 1 N HCl при температуре 90°С в течение 7 часов. Гидролизованный сополимер очищали диализом относительно воды, затем выделяли путем лиофильной сушки. Полноту гидролиза определяли аргентометрическим методом по содержанию в сополимере иона Cl-.
Получен сополимер, содержащий 10,0 мол. % звеньев ВА, [ η ] 0.1 M C H 3 C O O H = 0,23 д л / г .
Содержание аминогрупп в полученных сополимерах определяли методом спектроскопии, спектрофотометрически по полосе поглощения 420 нм, характерной для комплексов первичных аминов с 2,4,6-тринитробензолсульфокислотой, и методом потенциометрического титрования 0.1 N раствором HCl.
Сополимеры ВП-АА-ДОТА, ВП-ВА-ДОТА были синтезированы по методу активированных эфиров с использованием N-гидроксисукцинимида (ГОСИ). Сополимер растворяли в ДМФА, добавляли 0.01 экв. (относительно общего количества фрагментов ВП и единиц АА/ВА в полимерной цепи) ДОТА(ВОС)3, ГОСИ и диизоциклогексилкарбодиимид (ДЦК) в ДМФА. Реакционную смесь выдерживали 2 часа при комнатной температуре для получения полимера с 1 мол. % групп, конъюгированных с ДОТА. Полимер осаждали в холодный эфир и высушивали при пониженном давлении. Для снятия БОК-защиты и получения свободных карбоксильных групп лиганда ДОТА препарат был обработан смесью трифторуксусная кислота: вода (95:5 об. %, 2 часа). Раствор упаривали при пониженном давлении, обрабатывали 5% раствором триэтиламина в ДМФА и осаждали в охлажденный эфир, сушили при пониженном давлении, перерастворяли в воде, два раза проводили диализ против дистиллированной воды и подвергали лиофильной сушке.
Процедура радиохимического синтеза заключалась в следующем.
Пример 1. К аликвоте 20 мкл водного раствора, содержащей 80 мкг сополимера ВП-АА-ДОТА, помещенной в пробирку для микропроб («Эппендорф»), заполненную азотом, добавляли 250 мкл элюата генератора 68Ga с активностью 17-25 МБк. Полученный раствор разбавляли 750 мкл 0,2 М раствора ацетата натрия (рН=5.5). Микропробирку с реакционной смесью герметично закрывали и нагревали в течение 15 мин при 95°С. Объем картриджа подбирали таким образом, чтобы целевой металл-полимерный конъюгат практически не удерживался (элюировался с Vo удерживаемым объемом). После этого реакционную смесь переносили на картридж с сорбентом Sephadex-25 superfine (10×80 мм) и элюировали 0.9% раствором NaCl при помощи перистальтического насоса со скоростью 0,3 мл/мин. В ходе элюирования собирали фракции - Vo (содержавшую металл-полимерный комплекс) - от 1,5 мл элюата до 2,8 мл элюата и Ve (содержавшую часть свободного 68Ga3+) (большая часть необратимо сорбировалась на колонке) - от 2,8 до 7,8 мл элюата. При этом проводили препаративное отделение пика целевого металл-полимерного конъюгата и оценку радиохимического выхода реакции (РХВ). РХВ составлял 60-75%, а радиохимическая чистота (РХЧ) целевого продукта, которую контролировали методом ВЭЖХ на эксклюзионной колонке UltrahydrogelLinear 0,78×30 см (элюент - 0.2 М NaCl), достигала 97-99%.
Пример 2. К аликвоте 20 мкл водного раствора, содержащей 30 мкг сополимера ВП-АА-ДОТА, помещенной в пробирку для микропроб («Эппендорф»), заполненную азотом, добавляли 250 мкл элюата генератора 68Ga с активностью 17-25 МБк. Полученный раствор разбавляли 750 мкл 0,2 М HCl (рН 2). Микропробирку с реакционной смесью герметично закрывали и нагревали в течение 15 мин при 90°С. После очистки методом гель-фильтрации РХВ препарата составлял 30%, а РХЧ - 97%.
Пример 3. К аликвоте 20 мкл водного раствора, содержащей 60 мкг сополимера ВП-ВА-ДОТА, помещенной в пробирку для микропроб («Эппендорф»), заполненную азотом, добавляли 250 мкл элюата генератора 68Ga с активностью 17-25 МБк. Полученный раствор разбавляли 750 мкл фосфатного буфера (рН 7.5). Микропробирку с реакционной смесью герметично закрывали и нагревали в течение 15 мин при 60°С. После очистки методом гель-фильтрации РХВ препарата составлял 10%, а РХЧ - 8%.
Пример 4. К аликвоте 20 мкл водного раствора, содержащей 100 мкг сополимера ВП-ВА-ДОТА, помещенной в пробирку для микропроб («Эппендорф»), заполненную азотом, добавляли 250 мкл элюата генератора 68Ga с активностью 17-25 МБк. Полученный раствор разбавляли 750 мкл 0,2 М раствора ацетата натрия (рН 5.5). Микропробирку с реакционной смесью герметично закрывали и нагревали в течение 30 мин при 95°С. После очистки методом гель-фильтрации РХВ препарата составлял 80%, а РХЧ - 97%.
Таким образом, разработанный способ получения водорастворимых сополимерных комплексов 68Ga на основе сополимеров N-виниламидов (N-винилпирролидона (ВП)), N-виниламина (ВА) и N-аллиламина (АА) с привитым хелатным узлом ДОТА позволяет направленно создавать новые синтетические макромолекулярные РФП для более точного и достоверного диагностирования новообразований организма методом ПЭТ, что свидетельствует о соответствии данного технического решения всем требуемым критериям изобретения, защищаемым патентом.
Способ получения синтетических металл-полимерных комплексов радиоизотопов галлия-68, включающих водорастворимый сополимер N-винилпирролидона с аллил- или N-виниламином с молекулярной массой 5000-50000 Да, содержанием N-винилпирролидона m=95-60 мол. % и аллил- или N-виниламина n=5-40 мол. %, отличающийся тем, что в сополимер вводят хелатный узел, такой как 1,4,7,10-тетраазациклододекан-1,4,7,10-тетраацетат (ДОТА) z=1-20 мол. %, с получением полимера-носителя, при этом в качестве радионуклида используют позитронный эмиттер галлий-68, причем взаимодействие полимера-носителя с введенным хелатным узлом с радионуклидом проводят в водном растворе в кислородной атмосфере или в инертном газе при температуре 60-95°С, при рН среды 1-5.5 и концентрации полимера-носителя 5-20 масс. % в течение 15-30 мин с получением металл-полимерного конъюгата следующего строения: