Способ определения чувствительности helicobacter pylori к антибиотикам
Иллюстрации
Показать всеИзобретение относится к медицинской микробиологии и может быть использовано в гастроэнтерологии. Предложен способ определения чувствительности Helicobacter pylori к антибактериальным препаратам. Проводят серию двукратных разведений антибактериальных препаратов в бульоне Шедлера с рН 7,6±0,2 в горизонтальных лунках 96-луночного планшета. Приготовленную взвесь бактерий вносят в лунки, культуру инкубируют в микроаэрофильных условиях в течение 24 часов при температуре 37°С. Добавляют реагент, используемый при постановке уреазного теста идентификации Helicobacter pylori. Измеряют оптическую плотность содержимого лунок планшета с помощью спектрофотометра, используя длину волны 630 нм. Минимальная подавляющая концентрация антибиотика определяется при построении графика соотношения концентрации антибиотика и оптической плотности и находится в точке выхода кривой на нулевой уровень значения оптической плотности. Способ обеспечивает повышение точности определения чувствительности культур Helicobacter pylori к антибактериальным препаратам. 2 ил., 6 табл., 2 пр.
Реферат
Изобретение относится к медицине, в частности медицинской микробиологии, и может быть использовано для определения чувствительности Helicobacter pylori, а также других уреазопозитивных культур к антибиотикам с целью выбора препарата для включения в схему эрадикационной терапии.
Резистентность Helicobacter pylori к антибиотикам является распространенным явлением как в России, так и во всем мире. С каждым годом наблюдается рост устойчивости штаммов данного микроорганизма к антибактериальным препаратам, входящим в состав схем эрадикационной терапии, что снижает эффективность лечения и обосновывает все возрастающую актуальность проводимых в данном направлении исследований.
Одним из путей повышения эффективности лечения инфекции, вызванной Helicobacter pylori, является индивидуальный подбор антибактериальных препаратов по результатам определения антибиотикочувствительности возбудителя [Оптимизация лечения заболеваний, ассоциированных с Helicobacter pylori [Текст] / Е. Ткаченко, Ю. Успенский, Н. Барышникова // Врач. - 2012. - №1. - С. 36-38].
Уровень техники
Из уровня техники известен способ определения чувствительности микроорганизмов к антибиотикам методом двукратных серийных разведений препарата в жидких питательных средах [Поздеев О.К. Медицинская микробиология: учебное пособие / под ред. В.И. Покровского. - 4-е изд. испр. [Текст]. - М.: ГЭОТАР-Медиа, 2007. - С. 177, 178].
Постановку данного способа осуществляют следующим образом. Среду разливают по 2 мл в 6÷10 пробирок. В первую пробирку добавляют 2 мл раствора антибиотика определенной концентрации, перемешивают, после чего переносят 2 мл в следующую пробирку, продолжая разведение до предпоследней пробирки, из которой удаляют 2 мл содержимого. Последняя пробирка - контрольная.
В каждую пробирку с соответствующим разведением антибиотика, а также в контрольную пробирку добавляют по 0,2 мл взвеси культуры, приготовленной в зависимости от вида микроорганизма в концентрации 0,1÷1·109 м.кл.·см-3. Минимальную подавляющую концентрацию (МПК) антибиотика в отношении исследуемого штамма микроорганизма определяют по последней пробирке с задержкой роста (прозрачная среда). МПК соответствует степени чувствительности микроорганизма к данному антибиотику.
Недостатками данного метода являются трудоемкость, большой расход материалов, особенно при одновременном определении чувствительности нескольких штаммов микроорганизма к различным антибактериальным препаратам, длительность анализа, а также субъективность оценки результатов опыта - результат оценивают визуально.
Наиболее близким к заявляемому является способ определения чувствительности патогенных бактерий к комплексным антибактериальным препаратам [Патент РФ №2013110948/10, 12.03.2013 Способ определения чувствительности патогенных бактерий к комплексным антибактериальным препаратам [Текст] /С.В. Шабунин, О.А. Манжурина, А.В. Степанов // Патент России №2529711 С1, 2013]. Определение чувствительности бактерий, вызывающих кишечные инфекции, проводят путем посева в лунки планшета, содержащие разведения антибактериальных препаратов в концентрации 10 мкг·см-3 в питательной среде с pH 7,2-7,6 ЕД. Индикатором служит 0,5%-ный раствор бромкрезолового пурпурного. Вывод о чувствительности бактерий к антибактериальным препаратам проводят по наличию или отсутствию роста бактерий и изменению окраски среды с красной на желтую.
Однако данный метод адаптирован только в отношении группы кишечных бактерий (Escherichia coli, Enterococcus faecalis, Enterococcus faecium, Proteus vulgaris, Pseudomonas aeruginosa, Salmonella choleraesuis и др.), которые растут на специфических селективных питательных средах, непригодных для роста Helicobacter pylori. Недостатком данного метода является также визуальная оценка результатов исследования.
Задачей изобретения является уменьшение трудоемкости, сокращение расхода материала и времени анализа с 3-5 суток до 24 часов, повышение точности определения чувствительности культур Helicobacter pylori к антибактериальным препаратам путем оценки результатов с помощью спектрофотометра.
Поставленная задача решена путем внесения в лунки 96-луночного планшета бульона Шедлера, добавления в лунки первого вертикального ряда планшета антибиотиков в определенной концентрации, осуществления серий двукратных последовательных разведений каждого препарата в горизонтальных рядах планшета с последующим внесением в каждую лунку одинаковой концентрации исследуемого штамма Helicobacter pylori, инкубации содержимого в течение 24 часов при 37°C в микроаэрофильных условиях, внесения по окончанию инкубации реагента, используемого для биохимической идентификации Helicobacter pylori при постановке уреазного теста, учета результата оптической плотности содержимого лунок на спектрофотометре.
Определение чувствительности к антибиотикам было проведено в отношении штаммов, находящихся в музейной коллекции кафедры микробиологии Вятского Государственного университета (г. Киров).
Для исследования, на основании анализа литературных источников [Ткач С.М. Оптимизация терапевтических стратегий лечения Helicobacter pylori на современном этапе [Текст] // Крымский терапевтический журнал. - 2009. - №2. - С. 43-48; Ивашкин В.Т. Рекомендации Российской Гастроэнтерологической Ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых. - 2012. - Т.22. - №1. - С. 87-89] были выбраны антибактериальные препараты, наиболее часто используемые в схемах эрадикационной терапии хеликобактериозов: кларитромицин, амоксициллин, доксициклин, метронидазол, ципрофлоксацин, фуразолидон.
Осуществление изобретения
Культуру Helicobacter pylori выращивают из биологического материала (биопсия слизистой желудка, биологический материал из зубодесневых карманов, кал) на селективной питательной среде - колумбийский кровяной агар с антибиотиками амфотерицином (300 мкг·л-1) и ванкомицином (300 мкг·л-1) в эксикаторе при температуре 37°С в течение 3-5 суток. После микробиологической и биохимической идентификации Helicobacter pylori [Кудрявцева Л.В. Биологические свойства Helicobacter pylori [Текст] / Альманах клинической медицины. - 2006. - Т. XIV. - С. 39-46] из выращенной культуры по стандартному образцу мутности ФГБУ «НЦЭСМП» МЗ РФ (ОСО 42-28-85П) готовят микробную взвесь с концентрацией, соответствующей 10 единицам ОСО 42-28-85П, эквивалентную 1·109 м.к.·см-3. Для разведения культуры используют 0,9% раствор натрия хлорида с pH 7,0±0,2 ЕД.
Из культуры Helicobacter pylori с концентрацией 1·109 м.к.·см-3, используя бульон Шедлера [Патент РФ №2012125394/10, 20.06.2012 Двухфазная питательная среда для тонкослойного культивирования Helicobacter pylori и способ его осуществления [Текст] / В.А. Алешкин, Г.Ш. Исаева, Е.П. Селькова, С.С. Афанасьева // Патент России №2012125394 С1, 2013 г.], готовят десятикратные разведения путем последовательного переноса по 0,10 см3 суспензии клеток в 0,9·см3 бульона, получая концентрации 1·108, 1·107 м.к.·см-3. Для проверки чувствительности к антибиотикам используют суспензию клеток с концентрацией 1·107 м.к.·см-3.
В качестве питательной среды для определения чувствительности Helicobacter pylori к антибиотикам используют бульон Шелдера с pH 7,6±0,2 ЕД.
В качестве индикатора применяют реактив для постановки уреазного теста [Конорев М.Р. Методы диагностики Helicobacter pylori [Текст]/ Методические рекомендации. - Витебск, 2000. - С. 25], который готовят следующим образом:
- приготовить на дистиллированной воде 0,4 М фосфатно-солевой буфер с pH 6,7-6,8 ЕД путем смешивания заранее приготовленных солей: 0,4 М КH2PO4 и 0,4 М К2HPO4;
- растворить 5 г мочевины и 0,02 г азида натрия в 90 см3 приготовленного по п. 1 0,4 М фосфатно-солевого буфера, получив реагент №1;
- 0,02 г фенолового красного развести в 10 см3 бидистиллированной H2O, получив 0,2% феноловый красный - реагент №2;
- 903 см реагента №1 смешать с 10 см реагента №2. Готовый раствор хранить при температуре 4°C.
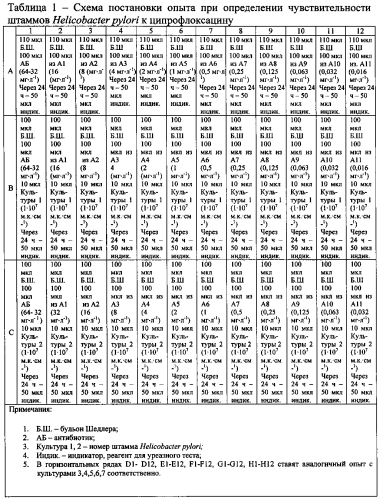
Постановку способа проводят следующим образом. Один планшет рассчитан на исследование чувствительности семи культур с одним антибиотиком. В лунки стерильного 96-луночного планшета вносят по 100 мкл бульона Шедлера. Концентрацию антибиотика для внесения в первую лунку каждого горизонтального ряда определяли по результатам предварительных опытов с более широким диапазоном значений. Исходя из этого, антибиотик добавляют в первую лунку каждого горизонтального ряда планшета в концентрации 256 мг·л-1 (128 мг·л-1 или 64 мг·л-1) и титруют слева направо, перенося 100 мкл из каждой предыдущей лунки в последующую до 12 лунки, из которой 100 мкл удаляют. В каждую лунку первого горизонтального ряда вносят по 10 мкл бульона, в лунки остальных горизонтальных рядов вносят 10 мкл готовой взвеси культуры Helicobacter pylori, выделенной из биологического материала соответствующего пациента, в концентрации 1·107 м.к.·см-1, получая конечную концентрацию культуры в каждой лунке 1·106 м.к.·см-1. Схема опыта представлена в таблице 1.
Содержимое планшета закрывают крышкой и инкубируют в микроаэрофильных условиях (5% O2, 5-10% CO2, 85-90% N2) в течение 24 ч при температуре 37°C [Патент РФ №2012125394/10, 20.06.2012 Двухфазная питательная среда для тонкослойного культивирования Helicobacter pylori и способ его осуществления [Текст] / В.А. Алешкин, Г.Ш. Исаева, Е.П. Селькова, С.С. Афанасьева // Патент России №2012125394 С1, 2013 г.]. Для создания микроаэрофильных условий используют эксикатор со свечой или анаэростат с газогенераторными пакетами «GAS РАК 150» («Becton Dickinson», США). По окончании времени инкубации в каждую лунку вносят 50 мкл индикатора, используемого для биохимической идентификации Helicobacter pylori при постановке уреазного теста.
Выбор времени инкубации был определен экспериментальным путем. При инкубации содержимого планшета более 24 ч (в течение 48 ч) после добавления индикатора значение оптической плотности, определяемое на спектрофотометре, превышало 1,0, что затрудняло интерпретацию результатов.
Результаты оценивают на планшетном спектрофотометре типа Multiscan ascent (Финляндия), измеряя оптическую плотность содержимого лунок планшета при длине волны 630 нм.
Принцип оценки чувствительности Helicobacter pylori к антибиотикам, входящим в схемы эрадикационной терапии с использованием мочевины и фенолового красного, заключается в следующем. Если соответствующая концентрация антибиотика не подавляет рост Helicobacter pylori, микроорганизм размножается и продуцирует уреазу. При добавлении реагента, содержащего мочевину, уреаза взаимодействует с мочевиной, при этом мочевина разлагается на углекислый газ и аммиак. Аммиак сдвигает pH среды в щелочную сторону, что сопровождается изменением цвета индикатора на розово-красный. Таким образом, чем более выражена уреазная активность микроорганизма, тем интенсивней цвет окраски содержимого лунки, что определяется по значению оптической плотности.
За минимальную подавляющую концентрацию принимают ту концентрацию антибиотика, которой соответствует первое минимальное значение оптической плотности в лунке, отличающееся от предыдущего не менее чем в 2 раза.
Микроскопия мазков, сделанных из соответствующих лунок при отработке способа, показала отсутствие в мазках микробных клеток. При высеве содержимого из таких лунок на колумбийский агар рост микроорганизма отсутствовал.
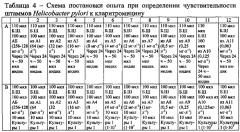
Для подтверждения правильности полученных результатов параллельно проводили определение МПК антибиотиков в отношении Helicobacter pylori с применением метода двукратных серийных разведений в пробирках. Учет результатов проводили на 3-5 сутки инкубации культур при 37°C в микроаэрофильных условиях в течение 3-5 дней. МПК в отношении исследуемого штамма определяли по концентрации антибиотика, содержащейся в последней пробирке с задержкой роста микроорганизма (прозрачный бульон). Помимо визуальной оценки проводили постановку уреазного теста с содержимым пробирок в планшетах. Для этого после тщательного перемешивания 110 мкл содержимого пробирок, последовательно по мере убывания концентрации содержащегося в них антибиотика, переносили в лунки планшета, добавляли 50 мкл реагента и проводили измерение на спектрофотометре.
Результаты определения МПК исследуемых антибиотиков в отношении Helicobacter pylori при постановке метода в планшетах с использованием уреазного теста были сопоставимы с результатами, полученными при определении МПК в пробирках.
Для отрицательного контроля была использована уреазонегативная культура Escherichia coli. Определение чувствительности Escherichia coli к антибиотикам с помощью уреазного теста в планшетах не выявило закономерностей, определяемых при постановке данного теста с уреазепозитивной Helicobacter pylori.
Изобретение поясняется следующими примерами, но не ограничивается ими.
Пример 1. Определение чувствительности штаммов Helicobacter pylori к ципрофлоксацину с помощью уреазного теста
Результаты оценки чувствительности штаммов Helicobacter pylori к ципрофлоксацину с помощью уреазного теста в планшетах представлены в таблице 2.
На примере оценки МПК ципрофлоксацина в отношении культуры №2 Helicobacter pylori построен график зависимости оптической плотности содержимого лунок планшета от концентрации антибиотика в лунках (рисунок 1). Значение МПК находится в точке выхода графика на «плато» - в точке выхода кривой на нулевой уровень значения оптической плотности.
Из данных, представленных на рисунке 1, видно, что МПК ципрофлоксацина в отношении тестируемой культуры Helicobacter pylori составляет 1 мг·л-1.
Результаты определения МПК ципрофлоксацина в отношении культур Helicobacter pylori при постановке уреазного теста в планшетах были сопоставимы с таковыми при определении МПК методом двукратных разведений ципрофлоксацина в пробирках. Учет результатов при этом проводили визуально и на планшетном спектрофотометре после инкубации содержимого пробирок в течение 5-ти суток в микроаэрофильных условиях при температуре 37°C. Для объективной оценки результата после тщательного перемешивания 110 мкл содержимого пробирок переносили в лунки планшета с последующей постановкой уреазного теста и учетом данных на спектрофотометре, используя длину волны 630 нм.
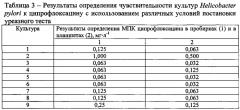
В таблице 3 представлены результаты определения чувствительности культур Helicobacter pylori к ципрофлоксацину с использованием различных условий постановки уреазного теста (непосредственно в планшетах через 24 ч и в планшетах при использовании содержимого пробирок после 5-ти суток инкубации).
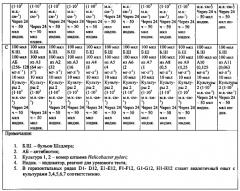
Пример 2 - Определение чувствительности штаммов Helicobacter pylori к кларитромицину с помощью уреазного теста.
Результаты оценки чувствительности штаммов Helicobacter pylori к кларитромицину с помощью уреазного теста в планшетах представлены в таблице 5.
На примере оценки МПК кларитромицина в отношении культуры №2 Helicobacter pylori построен график зависимости оптической плотности содержимого лунок планшета от концентрации антибиотика в лунках (рисунок 2). Значение МПК находится в точке выхода графика на нулевое значение оптической плотности.
Из данных, представленных на рисунке 2, видно, что МПК кларитромицина в отношении тестируемой культуры Helicobacter pylori составляет 8 мг·л-1.
Результаты определения МПК в отношении культур Helicobacter pylori при постановке уреазного теста в планшетах были сопоставимы с таковыми при определении МПК методом двукратных разведений кларитромицина в пробирках. Учет результатов при этом проводили визуально и на планшетном спектрофотометре после инкубации содержимого пробирок в течение 5-ти суток в микроаэрофильных условиях при температуре 37°C. Для объективной оценки результата после тщательного перемешивания 110 мкл содержимого пробирок переносили в лунки планшета с последующей постановкой уреазного теста и учетом данных на спектрофотометре, используя длину волны 630 нм.
В таблице 6 представлены результаты определения чувствительности культур Helicobacter pylori к кларитромицину с использованием различных условий постановки уреазного теста (непосредственно в планшетах через 24 ч и в планшетах при использовании содержимого пробирок после 5-ти суток инкубации).
Способ определения чувствительности Helicobacter pylori, заключающийся во внесении антибактериальных препаратов в лунки планшета, отличающийся тем, что в горизонтальных лунках 96-луночного планшета проводят серию двукратных разведений антибактериальных препаратов в бульоне Шедлера рН 7,6±0,2, при этом приготовленную взвесь бактерий вносят в лунки, культуру инкубируют в микроаэрофильных условиях в течение 24 часов при температуре 37°С, затем добавляют реагент, используемый для биохимической идентификации Helicobacter pylori при постановке уреазного теста, после чего результат учитывают с помощью спектрофотометра, измеряют оптическую плотность содержимого лунок планшета, используя длину волны 630 нм, причем за минимальную подавляющую концентрацию принимают минимальное значение концентрации антибиотика в ряду его разведений, при котором наблюдается снижение оптической плотности до фонового уровня, и при построении графика соотношения концентрации антибиотика и оптической плотности данное значение минимальной подавляющей концентрации находится в точке выхода кривой на нулевой уровень значения оптической плотности.