Штамм гриба phoma ligulicola var.inoxydabilis boerema, обладающий микогербицидной активностью против полыни обыкновенной
Иллюстрации
Показать всеИзобретение относится к сельскохозяйственной микробиологии, в частности к области биологической борьбы с нежелательной (сорной) растительностью при помощи фитопатогенных грибов. Штамм гриба Phoma ligulicola var. inoxydabilis Boerema, обладающий высокой микогербицидной активностью в отношении полыни обыкновенной, депонирован в Государственной коллекции ФГБНУ ВНИИ защиты растений под регистрационным номером ВИЗР 1.43 и может быть использован для борьбы с полынью обыкновенной и близкородственными видами этого растения. Изобретение позволяет сократить численность полыни обыкновенной. 7 табл., 3 пр.
Реферат
Изобретение относится к сельскохозяйственной микробиологии, в частности к области биологической борьбы с нежелательной (сорной) растительностью при помощи фитопатогенных грибов. Представляет собой штамм гриба Phoma ligulicola var. inoxydabilis Boerema, выделенный из листьев растения Artemisia sp. Штамм депонирован в Государственной коллекции микроорганизмов, патогенных для растений и их вредителей ФГБНУ ВИЗР, ему присвоен коллекционный номер ВИЗР 1.43. Штамм предназначен для борьбы с полынью обыкновенной и близкородственными видами этого растения.
Полынь обыкновенная Artemisia vulgaris L. является вредоносным многолетним сорным растением в городских и сельскохозяйственных фитоценозах в Евразии и Северной Америке. Оно засоряет обочины дорог, газоны, цветники, посадки деревьев и кустарников в парках, скверах, детских площадках. Кроме рудеральных местообитаний полынь обыкновенная произрастает в посевах озимых и яровых зерновых, пропашных культур, многолетних трав, являясь трудноискоренимым сорняком (Надточий, 2008). Полынь обыкновенная считается проблемным сорняком 25 культур в 56 странах (Holm et al., 1997). Высокий уровень засоренности полынью отмечается в цветниках, питомниках, площадках для гольфа. Например, в США индустрия декоративных растений включает полынь обыкновенную в первую десятку наиболее вредоносных сорняков (Henderson, Weller, 1985; Holm et al., 1997). Мощная корневая система, высокая семенная продуктивность и способность образовывать аллелопатические вещества позволяет растению быстро заселять различные местообитания и вытеснять местную растительность, приводя к обеднению видового состава. Помимо экологических проблем полынь обыкновенная представляет определенную угрозу для здоровья человека, поскольку ее пыльца является дыхательным аллергеном (Barney, DiTommaso, 2002).
В настоящее время для борьбы с полынью используются в основном механические и химические методы, которые не всегда достаточно эффективны и безопасны, в частности применение химических гербицидов в городских условиях запрещено или строго регламентировано, что не позволяет всегда достигать нужного эффекта. Использование фитопатогенных грибов, сдерживающих развитие растений в естественных условиях, потенциально позволяет контролировать численность сорных растений на определенном уровне ниже порога вредоносности или на незначительно более высоком уровне (Hasan, Ayers, 1990).
Исследования, посвященные обитающим на видах Artemisia микромицетам, очень немногочисленны. Имеется сообщение об обнаружении в США возбудителя снежной плесени на Artemisia tridentata (Hess et al., 1985). Обнаружена антимикробная активность культурального фильтрата Colletotrichum gloeosporioides, являющегося эндофитом А. mongolica (Zou et al., 2000). Выявлены новые источники антибиотиков среди эндофитных грибов A. annua (Zhang et al., 2012). Отдельные сведения о встречаемости микромицетов на видах полыни можно обнаружить в работах, посвященных микофлористическим исследованиям различных территорий или таксономическим исследованиям (Conners, 1967, Гасич и др., 1999; Farr, Rossman, 2012).
Несмотря на то, что изучению микобиоты сорных растений России уделяется определенное внимание, данные о видовом составе и распространении грибов на Artemisia vulgaris и близкородственных видах Artemisia остаются весьма фрагментарными.
В результате изучения микобиоты видов Artemisia на территории России обнаружено 23 вида микромицетов из 19 родов 4-х отделов. На основании результатов экспериментальной работы выявлен определенный потенциал у штамма ВИЗР 1.43 Phoma ligulicola var. inoxydabilis как агента биологического контроля полыни обыкновенной.
Ранее фитопатогенные микромицеты не изучались как возможные агенты биологической борьбы с полынью обыкновенной. Известны штаммы Phoma macrostoma Mont., поражающие сорные виды семейства Asteraceae (Bailey, Derby, 2001). Эффективность штаммов Phoma macrostoma для подавления бодяка полевого и одуванчика лекарственного достигала 70 и 90%, соответственно (Bailey et al., 2011). Особенностью Phoma macrostoma является его широкая специализация - гриб поражает виды многих семейств двудольных растений. Установлено, что штамм этого вида, выделенный из бодяка полевого, патогенен для 38 видов растений 12 семейств, в том числе Asteraceae, Brassicaceae, Fabaceae и Rosaceae (Bailey et al., 2011). Широкая специализация этого штамма не позволяет использовать его в посевах ряда сельскохозяйственных культур.
Согласно Боерема с соавторами (Boerema et al., 2004) вид Phoma ligulicola var. inoxydabilis приурочен к семейству Asteraceae, то есть характеризуется сравнительно узкой специализацией. Возможность применения штаммов Phoma ligulicola var. inoxydabilis для биологической борьбы с сорными растениями ранее не изучалась.
Задачей изобретения является получение штамма гриба Phoma ligulicola var. inoxydabilis, обладающего высокой микогербицидной активностью для подавления полыни обыкновенной, а также характеризующегося узкой специализацией.
Задача решена путем выделения и отбора штамма ВИЗР 1.43 с указанными выше свойствами. Штамм был выделен Е.Л. Гасич из пораженных пятнистостью листьев Artemisia sp., собранных Ф.Б. Ганнибалом во Владивостоке, 07.09.2006. Идентификация штамма проводилась по: Boerema G.H., de Gruyter J., Noordeloos M.E., Hamers M.E.C. Phoma identification manual, CABI Publishing, 2004, 470 p.и Vaghefi N., Pethybridge S.J., Ford R., Nicolas M.E., Crous P.W., Taylor P.W.J. Stagonosporopsis spp.associated with ray blight disease of Asteraceae // Australasian Plant Pathol. 2012. 41. P. 675-686.
Штамм депонирован в Государственной коллекции микроорганизмов, патогенных для растений и их вредителей ФГБНУ ВИЗР, ему присвоен коллекционный номер ВИЗР 1.43. Штамм предназначен для борьбы с полынью обыкновенной и близкородственными видами этого растения.
Культурально-морфологические особенности штамма.
На картофельно-сахарозном агаре (КСА) колонии войлочно-бархатистые, бурые. Пикниды шаровидные или почти шаровидные, 90-280 (400) мкм в диаметре, с 1(-3) устьицами, устьица со слабо выраженными сосочками или без них. Конидии эллипсоидальные до продолговатых, (4-)6(-8)×(1.5-)2.5(-3.6) км, одноклеточные, иногда встречаются конидии с 1 перегородкой. Наряду с пикнидами в свежих культурах также развиваются псевдотеции. Псевдотеции округлые, с сосочковидным устьицем, сумки 50-85×8-10 мкм, аскоспоры 2-клетные, 12-17×4-7 мкм, перетянутые у перегородки.
Физиолого-биохимические признаки.
Штамм хорошо растет как на агаризованных средах (картофельно-сахарозный агар, агар Чапека), так и на жидких средах (в стационарной культуре и на качалке).
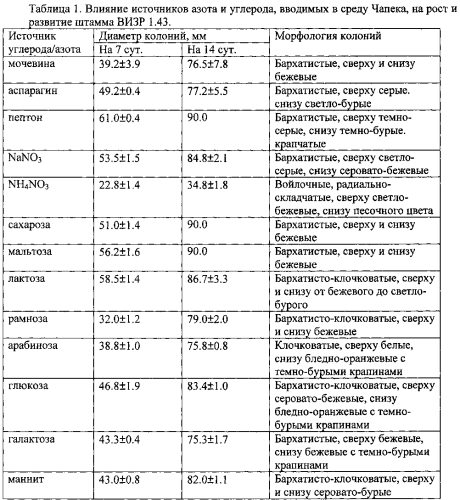
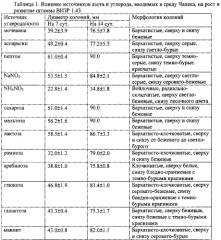
На среде Чапека максимальный рост отмечен на среде с сахарозой, лактозой и мальтозой, на втором месте по усвояемости находится глюкоза и маннит. Из источников азота лучше всего усваивается нитрат натрия и пептон (табл. 1).
Наибольшая скорость роста штамма на КСА отмечена при 16-24°С, при 28°С на 14 сутки диаметр колоний был меньше в 1.4 раза, при 7°С рост штамма значительно замедлялся, при 32°С роста не отмечено (табл. 2).
Штамм характеризуется высокой интенсивностью спороношения на зерновых субстратах, споровая продуктивность на зерновых субстратах (пшено, перловая, овсяная крупа) составляет порядка 105-108 спор/г субстрата.
Штамм проявляет высокую патогенность для Artemisia vulgaris. На 2 сутки после обработки в контролируемых условиях растений полыни обыкновенной суспензией конидий штамма интенсивность развития заболевания составила 95%; на 6 сутки гибель надземных побегов превысила 90% при 100% поражении листовой поверхности.
Хранение штамма осуществляется в пробирках на скошенном картофельно-сахарозном агаре в бытовом холодильнике при температуре +5-8°С в течение 1-1.5 лет без пересева.
Методы использования штамма описаны в примерах, а результаты представлены в таблицах.
Пример 1. Пример культивирования штамма.
Штамм культивировали по стандартной методике (Наумов, 1937) на агаризованной картофельно-сахарозной среде (КСА) в чашках Петри при 7, 16, 20, 24, 28, 32°С или на среде Чапека с различными источниками азота и углерода при 24°С в темноте в течение 2-х недель.
Зерновые субстраты (пшено, овсяная или перловая крупа) насыпали по 2 г в стеклянные пробирки с ватно-марлевыми пробками, добавляли 2 мл воды и стерилизовали при 1 атмосфере 30 минут, после автоклавирования субстрат инокулировали мицелиально-агаровым блоком, взятым из 14-суточной культуры гриба на КСА. Культуры инкубировали в течение 2-х недель при переменном (12/12 часов) эритемном или люминесцентном освещении, а также в темноте. Споровую суспензию получали методом смыва конидий водой с поверхности культуры, количество спор в суспензии подсчитывали при помощи камеры Горяева.
Штамм характеризуется высокой интенсивностью спороношения на зерновых субстратах, споровая продуктивность на зерновых субстратах (пшено, перловая, овсяная крупа) составляет порядка 105-108 спор/г субстрата. Наибольшая интенсивность спороношения штамма выявлена на пшене и овсяной крупе при эритемном освещении (9.2×108 спор/г и 2.5×108 спор/г, соответственно). Без освещения на пшене споровая продуктивность была значительно ниже (4.2×105 спор/г), чем на перловой (13.4×106 спор/г) и овсяной крупе (34.3×106 спор/г) (табл. 3).
Для получения мицелия штамм культивировали на модифицированной среде Чапека в 250 мл колбах с 50 мл среды на качалке при 200 об/мин в течение 7 суток. Среду инокулировали тремя агаровыми блоками (диаметр 0.5 см), вырезанными при помощи бура из 14-суточной культуры гриба на картофельно-сахарозной агаризованной среде. Мицелий отфильтровывали через мельничный газ и высушивали до постоянного веса для определения продуктивности, либо для получения мицелиальной суспензии измельчали в ступке при помощи пестика в определенном объеме воды.
Состав модифицированной среды Чапека
KH2PO4 - 1 г
KCl - 0.5 г
MgSO4 - 0.5 г
Глюкоза - 20 г
Пептон - 1 г
Дрожжевой экстракт - 5 г
Вода - 1 л
В жидкой культуре при культивировании на качалке формируются многочисленные пеллеты (0.6-2 см в диаметре) телесного цвета, ободок хорошо развит, бледно-серого цвета, сверху с темно-бурым рыхлым кольцом, на ободке формируются зачаточные пикниды, культуральная жидкость коричневого цвета, сухая биомасса мицелия составляет 13.6 мг/мл среды.
Пример 2. Пример использования штамма.
Патогенность штамма определялась методом искусственного заражения растений полыни обыкновенной (Наумов, 1937). Растения получали в лабораторных условиях из семян, которые высевали в вегетационные сосуды (объемом 200 мл) с почвой. Растения выращивали в лабораторных условиях на светоустановке при искусственном освещении люминесцентными лампами в течение 3 месяцев.
Споровую суспензию с концентрацией 1×106 спор/мл наносили на растения при помощи пульверизатора (5 мл суспензии на сосуд). После инокуляции растения помещали во влажные камеры на 0, 6, 24, 48 часов, а затем переносили на светоустановку.
Для получения споровой суспензии в пробирки с 2-недельной культурой гриба на пшене добавляли 10 мл воды, содержимое тщательно перемешивали, фильтровали через мельничный газ, делали необходимые разведения и определяли количество спор в 1 мл суспензии при помощи камеры Горяева.
Учет проводили на 2-7, 14 и 21 сутки после инокуляции. Определяли площадь пораженной поверхности каждого листа растения по 0-6 балльной шкале (0 = нет симптомов, 1 = до 5%; 2=6-25%; 3=26-75%; 4=76-95%; 5>95%; 6 = гибель листа). Площадь пораженной поверхности растения определяли по формуле: (2.5xn1+15xn2+50xn3+85xn4+97.5xn5+100xn6)/N, nx - число листьев с данным баллом, N - общее число листьев (Pfirter, Defago, 1998).
Оценку фитотоксичности фильтрата культуральной жидкости (ФКЖ), патогенности мицелия, полученного в жидкой культуре, влияния температуры на патогенность штамма и специализации проводили методом листовых дисков (Berestetskiy et al., 2007). Листовые диски, вырезанные при помощи бура из листьев среднего яруса, помещали рядами верхней стороной вниз в пластиковые кюветы на увлажненную водой фильтровальную бумагу. Штамм культивировали на жидкой модифицированной среде Чапека. Мицелий отфильтровывали через мельничный газ, по 1 мл ФКЖ помещали в пробирки типа Эппендорф, центрифугировали 4 мин при 14000 об/мин, затем наносили по 1 капле (10 мкл) в центр наколотого листового диска. Мицелий промывали водопроводной водой, обсушивали между листами фильтровальной бумаги и растирали в ступке (80 мг мицелия на 1 мл воды); по одной капле (10 мкл) мицелиальной суспензии наносили в центр неповрежденного листового диска. Аналогично для изучения влияния температуры на патогенность штамма наносили капли споровой суспензии с концентрацией 1×106 спор/мл. После инокуляции дисков кюветы накрывали крышками и выставляли на светоустановку. В случае изучения влияния температуры на патогенность штамма, кюветы с листовыми дисками инкубировали при 16, 20, 24 и 28°С.
Штамм проявляет высокую патогенность для Artemisia vulgaris. Наибольшая патогенность штамма для листовых дисков зарегистрирована при 24°С (100% поражение диска на 3 сутки); при 16 и 20°С на 3 сутки площадь поражения листовых дисков была около 50%. При 28°С площадь поражения диска достигала 20% на 6 сутки, тогда как при 16-24°С к этому сроку диски были поражены на 100% (табл. 4).
На 2 сутки после обработки в контролируемых условиях растений полыни обыкновенной споровой суспензией штамма при 24 ч продолжительности росяного периода и концентрации инокулюма 1×106 спор/мл интенсивность развития заболевания составила 95%; на 6 сутки гибель надземных побегов превысила 90% при 100% поражении листовой поверхности (табл. 5).
Мицелий штамма проявляет высокую патогенность для листовых дисков полыни обыкновенной. Не выявлено фитотоксической активности фильтрата культуральной жидкости штамма для полыни обыкновенной (табл. 6).
Пример 3. Пример оценки специализации штамма.
Специализация штамма была оценена на листовых дисках и отрезках листьев 56 видов растений из 54 родов 26 семейств. Диски извлекали при помощи бура (диаметром 1 см) из листьев среднего яруса растений, выросших в природных местообитаниях. Диски (по 12 штук) раскладывали в кюветы на увлажненную фильтровальную бумагу, половину дисков помещали верхней стороной вверх, половину верхней стороной вниз. При помощи автоматической пипетки в середину дисков наносили каплю (10 мкл) споровой суспензии гриба (концентрация 4×107 спор/мл). Кюветы на 24 часа помещали в термостат (24°С), а затем на светоустановку (режим: свет/темнота - 12/12 ч). Диаметр некрозов измеряли на 3, 4 и 7 сутки после инокуляции (Berestetskiy et al., 2007).
Штамм характеризуется сравнительно узкой специализацией и приурочен главным образом к семейству Asteraceae. В наиболее сильной степени поражались Artemisia vulgaris, A. abrotanum, Tanacetum vulgare, Cirsium arvense, Cirsium heterophyllum, Leucanthemum vulgare, Helianthus tuberosus, Tripleurospermum perforatum, Chrysanthemum morifolium. Ограниченные некрозы выявлены на Taraxacum officinale, Tagetes patula, Solidago virgaurea и Sonchus arvensis. Из представителей других семейств на 3 сутки отмечено слабое поражение Convolvulus arvensis (семейство Convolvulaceae) и Viola canina (семейство Violaceae). Штамм характеризуется более длительным инкубационным периодом при заражении Brassica rapa и Beta vulgaris, на этих видах слабые симптомы проявились на 7 сутки (табл. 7).
Штамм Phoma ligulicola var. inoxydabilis ВИЗР 1.43 обладает высокой микогербицидной активностью в отношении полыни обыкновенной. На 6 сутки после обработки растений суспензией конидий гибель надземных побегов превысила 90% при 100% поражении листовой поверхности. Также штамм характеризуется узкой специализацией, что определяет возможность его применения в посевах большинства сельскохозяйственных культур, охраняемых природных зонах, рудеральных местообитаниях, а также в населенных пунктах, где использование химических средств защиты ограничено или запрещено. Штамм приурочен главным образом к некоторым видам семейства Asteraceae, поэтому его не рекомендуется применять в посевах экономически значимых растений этого семейства, в частности, таких как топинамбур, салат, хризантема, календула (табл.7).
Использованная литература
Гасич Е.Л., Титова Ю.А., Берестецкий А.О., Жаров В.Р. Микромицеты сорных растений Европейской части России. Итоги исследований 1993-1998 гг. СПб. 1999. 88 с.
Надточий И.Н. (Всероссийский институт защиты растений, Санкт-Петербург, Россия). Artemisia vulgaris. В: Афонин А.Н.; Грин СЛ.; Дзюбенко Н.И.; Фролов А.Н. (ред.) Агроэкологический атлас России и сопредельных стран: экономически значимые растения, их вредители, болезни и сорные растения [Интернет-версия 2.0]. 2008. http://www.agroatlas.ru/en/content/related/Artemisia vulgaris/.
Наумов Н.А. Методы микологических и фитопатологических исследований. М.-Л.: Госиздат колхозной и совхозной литературы, 1937. 272 с.
Bailey K.L., Derby J. Fungal isolates and biological control compositions for the control of weeds. US Patent Application Serial No. 60/294.475. Filed 20 May 2001.
Bailey K.L., Pitt W.M., Falk S., Derby J. The effects of Phoma macrostoma on nontarget plant and target weed species // Biological control. 2011.58. 379-386.
Barney J.N., DiTommaso A. The biology of Canadian weeds. 118. Artemisia vulgaris L. // Canadian Journal of Plant Science. 2003. 83(1). P. 205-215.
Berestetskiy A.O., Fyodorova A.F., Kustova S. A laboratory technique for the evalution of pathogenicity of Septoria cirsii for Cirsium arvense // XV Congress of European mycologists. 2007. P. 242.
Boerema G.H., de Gruyter J., Noordeloos M.E., Hamers M.E.C. Phoma identification manual. CABI Publishing. 2004. 470 p.
Conners I. L. An annotated index of plant diseases in Canada and fungi recorded on plants in Alaska. Canada, and Greenland. Department of Agriculture. Ottawa. 1967. Publ. 1251. 381 p.
Farr D.F., Rossman A.Y. Fungal Databases. Systematic Mycology and Microbiology Laboratory. ARS. USDA. Retrieved July 14. 2012. from http://nt.ars-grin.gov/fungaldatabases/.
Hasan S., Ayers P.G. The control of weeds through fungi: principles and prospects // New Phytol. 1990. 115. P. 201-222.
Henderson J. C, Weller S. C. Biology and control of Artemisia vulgaris // Proc. 40th North Central Weed Control Conf. 1985. 40. P.100-101.
Hess W.M. Morphology and ultrastructure of a snowmold fungus on sagebrush (Artemisia tridentata) // Mycologia. 1985. 77 (4). P. 637-645.
Holm L., Doll J., Holm E., Pancho J., Herberger J. World weeds: Natural histories and distribution. John Wiley and Sons. New York. 1997. 1129 p.
Pfirter H., Defago G. The potential of Stagonospora sp.as a mycoherbicide for field bindweed // Biocontrol Science and Technology. 1998. 8. P. 93-101.
Vaghefi N., Pethybridge S.J., Ford R., Nicolas M.E., Crous P.W., Taylor P.W.J. Stagonosporopsis spp. associated with ray blight disease of Asteraceae // Australasian Plant Pathol. 2012. 41. P. 675-686.
Zang H., Bai X., Wu B. Evaluation of antimicrobial activities of extracts of endophytic fungi from Artemisia annua // Bangladesh J Pharmacol. 2012. 7. P. 120-123.
Zou W.X., Meng J.C., Lu H., Chen G.X., Shi G.X., Zang T.Y., Tan R.X. Metabolites of Colletotrichum gloeosporioides. an endophytic fungus in Artemisia mongolica // J Nat Prod. 2000. 63 (11). P. 1529-1530.
Штамм гриба Phoma ligulicola var.inoxydabilis Boerema ВИЗР 1.43, обладающий микогербицидной активностью против полыни обыкновенной.