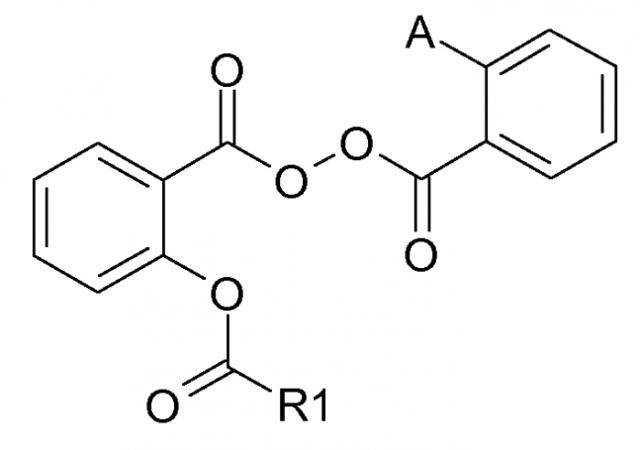
Новые производные пероксида, способ их получения и их применение в медицине и косметике для лечения или профилактики угрей у человека
Иллюстрации
Показать всеДанное изобретение относится к соединениям приведенной ниже общей формулы (I). В указанной формуле R1 представляет собой (С2-С4)алкил, (С3-С10)циклоалкил, (С3-С10)циклоалкил (С2-С4)алкил, (С2-С4)алкокси или (С3-С10)циклоалкилокси; А является водородом или представляет собой группу -ОС(О)R2, где R2 представляет собой (С2-С4)алкокси или (С3-С10)циклолкилокси. Термин "алкил" означает насыщенную линейную или разветвленную углеводородную цепь. Соединения формулы (I) ингибируют пролиферацию патогенных микроорганизмов, вовлечееных в появление угревых расстройств кожи, в частности P.acnes, и могут применяться для лечения патологий и расстройств, связанных с P.acnes. 3 з.п. ф-лы, 12 пр.
Реферат
Угри поражают 90% всех подростков, а также двадцатилетних и тридцатилетних мужчин и женщин, или они даже могут сохраняться в течение всего взрослого состояния. Процесс развития угрей описан W.J. Cunliffe в "New Approaches to Acne Treatment", опубликованной Martin Dunitz, London, 1989.
Обыкновенные угри представляют собой хроническое расстройство пилосебацейных фолликулов (аппарата), которое характеризуется черными угрями (черными точками), папулами, гнойничками, кистами, узелками и часто шрамами, которые возникают на наиболее видимых областях кожи, а именно на лице, груди, спине и, иногда, шее и плечах.
Пилосебацейный аппарат в большей степени находится под контролем эндогенных гормонов (в основном, андрогенов), которые присутствуют в необычно больших концентрациях в крови во время подросткового периода и пубертата и вызывают образование избыточного количества кожного сала. Эта ситуация может ухудшиться в результате сопутствующего увеличения степени ороговения рогового слоя кожи (stratum corneum). Так как клетки рогового слоя пролиферируют, они могут образовывать закупоривающую массу или угри, которые в сочетании с повышенным образованием кожного сала являются идеальной средой для пролиферации штаммов бактерий, которые находятся в и на коже, таких как грамм-положительные анаэробные бактерии Propionibacterium acnes.
Пораженные фолликулы могут темнеть из-за отложения пигмента, получаемого из поврежденных клеток глубокого слоя кожи.
Угри представляют собой состояние, проходящее несколько стадий, и их наиболее серьезная форма приводит к госпитализации пациента и оказывается очень проблематичной с точки зрения появления долговременных шрамов на коже.
Существует необходимость в улучшенном лечении угрей, которое позволит эффективно предотвращать развитие состояния до его наиболее тяжелой формы и которое может применяться, не вызывая побочных эффектов у большинства пораженных пациентов.
В настоящее время доступно множество способов лечения угрей, но, к сожалению, каждый способ лечения имеет ограничения, которые желательно преодолеть.
В большинстве случаев лечение угрей включает местные композиции в виде кремов, гелей, эмульсий или лосьонов, содержащих выбранные средства.
Эти средства включают, например, гормоны или агонисты и антагонисты гормонов (EPAI 0563813 и US 5439923), противомикробные агенты (US 4446145, GB 2088717, GB 2090135, GB 1054124, US 5409917) или салициловую кислоту (US 4514385, US 4355028, EPAI 0052705, FR-A 2581542 и FR-A 2607498).
Проблемы, связанные с местным лечение угрей кремами, гелями, эмульсиями или лосьонами, включают отсутствие пунктуальности нанесения и отсутствие четкого контроля дозы в предполагаемом месте обработки. Нанесение крема, геля, эмульсии или лосьона включает обработку площади, значительно большей, чем поражена, поэтому нормальная здоровая кожа также подвергается воздействию противоугревой композиции. Салициловая кислота, например, раздражает нормальную кожу в случае продолжительного воздействия, особенно в высоких концентрациях.
Пероральное введение противоугревого средства обычно применяется при тяжелых случаях угревого поражения. Оно рассматривается Sykes N.I. and Webster G. в "Acne, A Review of Optimum Treatment", Drugs 48, 59-70 (1994). Множество побочных эффектов описано при введении противоугревых активных соединений пероральным путем.
Например, изотретионин, который является производным витамина А, вызывает риски тератогенности и может являться опасным для женщин детородного возраста.
Пероральное введение антибиотиков, подходящих для лечения угрей, может сопровождаться развитием побочных эффектов, таких как колики в животе, глоссофития, кашель, диарея, утомляемость, раздражение во рту и другие нежелательные симптомы.
Поэтому существует ясная медицинская и косметическая потребность в лечении расстройств и связанных с ними патологий.
В этом контексте, в данном изобретении предлагаются новые производные пероксидов, обладающие улучшенной противоугревой эффективностью, являющейся результатом, например, лучшей бактериальной активности по сравнению с соединениями известного уровня техники, такими как пероксид бензоила, в то же время контролирующие потенциальное сенсибилизирующее действие, раздражающее действие, без добавления противовоспалительного активного компонента.
Таким образом, данное изобретение относится к соединениям следующей общей формулы (I):
в которой
R1 является низшим алкилом, высшим алкилом, циклоалкилом, циклоалкилалкилом, низшим алкокси, высшим алкокси, циклоалкилокси, циклоалкилалкокси, арилом, арилокси или моно- или диалкиламино;
A является водородом или следующей последовательностью:
R2 является низшим алкокси, высшим алкокси, циклоалкилокси, циклоалкилалкокси, арилокси или моно- или диалкиламино.
В соответствии с данным изобретением предпочтительные соединения, соответствующие общей формуле (I), включают соединения, имеющие следующие характеристики:
-R1 является низшим алкилом, циклоалкилом, циклоалкилалкилом, низшим алкокси, циклоалкилокси или моно- или диалкиламино;
A является водородом или определенной группой такого типа:
-R2 является низшим алкокси, циклоалкилокси или моно- или диалкиламино.
Далее, в соответствии с данным изобретением особенно предпочтительными соединениями, соответствующими общей формуле (I), являются такие, в которых
-R1 является низшим алкилом, циклоалкилом, циклоалкилалкилом, низшим алкокси или циклоалкилокси;
A является водородом или определенной группой типа:
-R2 является низшим алкокси или циклоалкилокси.
В соответствии с данным изобретением термин "низший алкил" означает насыщенную линейную или разветвленную углеводородную цепь, содержащую от 2 до 4 атомов углерода.
В соответствии с данным изобретением термин "высший алкил" означает насыщенную линейную или разветвленную углеводородную цепь, содержащую от 5 до 10 атомов углерода.
В соответствии с данным изобретением термин "циклоалкил" означает насыщенную и циклическую, бициклическую или трициклическую углеводородную цепь, содержащую от 3 до 10 атомов углерода.
В соответствии с данным изобретением термин "циклоалкилалкил" означает алкил, замещенный циклоалкилом.
В соответствии с данным изобретением термин "низший алкокси" означает атом кислорода, замещенный низшим алкилом.
В соответствии с данным изобретением термин "высший алкокси" означает атом кислорода, замещенный высшим алкилом.
В соответствии с данным изобретением термин "арил" означает незамещенный фенил или нафтил.
В соответствии с данным изобретением термин "арилокси" означает атом кислорода, замещенный арилом.
В соответствии с данным изобретением термин "циклоалкилалкокси" означает атом кислорода, замещенный циклоалкилом(низшим алкилом).
В соответствии с данным изобретением термин "циклоалкокси" означает атом кислорода, замещенный циклоалкилом.
В соответствии с данным изобретением термин "моно- или диалкиламино" означает амино, замещенный одним или двумя идентичными или разными низшими алкилами.
Среди соединений общей формулы (I), входящих в объем данного изобретения, особенно необходимо отметить следующие:
Пример 1: пероксид (2-(этоксикарбонилокси)бензоил)бензоила
Пример 2: пероксид (2-(трет-Бутоксикарбонилокси)бензоил)бензоила
Пример 3: пероксид бис(2-(этоксикарбонилокси)бензоила)
Пример 4: пероксид бис(2-(трет-бутоксикарбонилокси)бензоила)
Пример 5: пероксид (2-(изопропоксикарбонилокси)бензоил)бензоила
Пример 6: пероксид бис(2-(изопропоксикарбонилокси)бензоила)
Пример 7: пероксид (2-(циклогексилоксикарбонилокси)бензоил)бензоил
Пример 8: пероксид бис(2-(циклогексилоксикарбонилокси)бензоила)
Пример 9: пероксид (2-(трет-бутирилокси)бензоил)бензоила
Пример 10: пероксид (2-(изобутирилокси)бензоил)бензоила
Пример 11: пероксид (2-(циклогексанкарбонилокси)бензоил)бензоила
Пример 12: пероксид [2-(2-(адамантан-1-ил)ацетокси)бензоил]бензоила
Пример 13: пероксид [2-(адаментен-1-карбонилокси)бензоил]бензоила
Пример 14: пероксид (2-(феноксикарбонилокси)бензоил)бензоила
Пример 15: пероксид (2-(метоксикарбонилокси)бензоил)бензоила
Пример 16: пероксид (2-(пропоксикарбонилокси)бензоил)бензоила
Пример 17: пероксид (2-(бутоксикарбонилокси)бензоил)бензоила
Пример 18: пероксид (2-(втор-бутоксикарбонилокси)бензоил)бензоила
Пример 19: пероксид (2-(изобутоксикарбонилокси)бензоил)бензоила
Пример 20: пероксид (2-(пропионилокси)бензоил)бензоила
Пример 21: пероксид (2-(бутирилокси)бензоил)бензоила
Пример 22: пероксид (2-(пентаноилокси)бензоил)бензоила
Пример 23: пероксид [2-(3-метилбутирилокси)бензоил]бензоила
Пример 24: пероксид [2-(2-метилбутирилокси)бензоил]бензоила
Пример 25: пероксид (2-(циклопропанкарбонилокси)бензоил)бензоила
Пример 26: пероксид (2-(циклобутанкарбонилокси)бензоил)бензоила
Пример 27: пероксид (2-(циклопентанкарбонилокси)бензоил)бензоила
Пример 28: пероксид (2-(бензоилокси)бензоил)бензоила
Пример 29: пероксид (2-(диметилкарбамоилокси)бензоил)бензоила
Пример 30: пероксид (2-(диэтилкарбамоилокси)бензоил)бензоила
Пример 31: пероксид (2-(метилкарбамоилокси)бензоил)бензоила
Пример 32: пероксид (2-этилкарбамоилокси)бензоил)бензоила
Пример 33: пероксид (2-изопропилкарбамоилокси)бензоил)бензоила
Пример 34: пероксид (2-пропилкарбамоилокси)бензоил)бензоила
Пример 35: пероксид [2-(изопропил)(метил)карбамоилокси)бензоил]бензоила
Пример 36: пероксид [2-(этил)(изопропил)карбамоилокси)бензоил]бензоила
Пример 37: пероксид (2-гексаноилокси)бензоил)бензоила
Пример 38: пероксид (2-гептаноилокси)бензоил)бензоила
Пример 39: пероксид (2-октаноилокси)бензоил)бензоила
Пример 40: пероксид (2-нонаноилокси)бензоил)бензоила
Пример 41: пероксид [2-(2-этилбутирилокси)бензоил]бензоила
Пример 42: пероксид [2-(3,3-диметилбутирилокси)бензоил]бензоила
Пример 43: пероксид (2-пентилоксикарбонилокси)бензоил)бензоила
Пример 44: пероксид (2-гексилоксикарбонилокси)бензоил)бензоила
Пример 45: пероксид (2-гептилоксикарбонилокси)бензоил)бензоила
Пример 46: пероксид (2-октилоксикарбонилокси)бензоил)бензоила
Пример 47: пероксид [2-(1-этилпропоксикарбонилокси)бензоил]бензоила
Пример 48: пероксид [2-(2,2-диметилпропоксикарбонилокси)бензоил]бензоила
Пример 49: пероксид бис(2-(феноксикарбонилокси)бензоила)
Пример 50: пероксид бис(2-(метоксикарбонилокси)бензоила)
Пример 51: пероксид бис(2-(пропоксикарбонилокси)бензоила)
Пример 52: пероксид бис(2-(бутоксикарбонилокси)бензоила)
Пример 53: пероксид бис[2-(3-метилбутирилокси)бензоила]
Пример 54: пероксид бис[2-(2-метилбутирилокси)бензоила]
Пример 55: пероксид бис(2-(диметилкарбамоилокси)бензоила)
Пример 56: пероксид бис(2-(диэтилкарбамоилокси)бензоила)
Пример 57: пероксид бис(2-(метилкарбамоилокси)бензоила)
Пример 58: пероксид бис(2-(этилкарбамоилокси)бензоила)
Пример 59: пероксид бис(2-(изопропилкарбамоилокси)бензоила)
Пример 60: пероксид бис(2-пропилкарбамоилокси)бензоила)
Пример 61: пероксид бис(2-((изопропил)(метил)карбамоилокси)бензоила)
Пример 62: пероксид бис(2-((этил)(изопропил)карбамоилокси)бензоила)
Пример 63: пероксид бис(2-(пентилоксикарбонилокси)бензоила)
Пример 64: пероксид бис(2-(гексилоксикарбонилокси)бензоила)
Пример 65: пероксид бис(2-(гептилоксикарбонилокси)бензоила)
Пример 66: пероксид бис(2-(октилоксикарбонилокси)бензоила)
Пример 67: пероксид бис[2-(1-этилпропоксикарбонилокси)бензоила]
Пример 68: пероксид бис[2-(2,2-диметилпропоксикарбонилокси)бензоила]
Пример 69: пероксид (2-(метоксикарбонилокси)бензоил) 2-(изобутирилокси)бензоила
Пример 70: пероксид (2-(метоксикарбонилокси)бензоил) 2-(трет-бутирилокси)бензоила
Пример 71: пероксид (2-(метоксикарбонилокси)бензоил) 2-(циклогексанкарбонилокси)бензоила
Пример 72: пероксид (2-(метоксикарбонилокси)бензоил) 2-(метилкарбамоилокси)бензоила
Пример 73: пероксид (2-(метоксикарбонилокси)бензоил) 2-(диметилкарбамоилокси)бензоила
Пример 74: пероксид (2-(этоксикарбонилокси)бензоил) 2-(изобутирилокси)бензоил
Пример 75: пероксид (2-(этоксикарбонилокси)бензоил) 2-(трет-бутирилокси)бензоила
Пример 76: пероксид (2-(этоксикарбонилокси)бензоил) 2-(циклогексанкарбонилокси)бензоила
Пример 77: пероксид (2-(этоксикарбонилокси)бензоил) 2-(метилкарбамоилокси)бензоила
Пример 78: пероксид (2-(этоксикарбонилокси)бензоил) 2-(диметилкарбамоилокси)бензоила
Пример 79: пероксид (2-(изопропоксикарбонилокси)бензоил) 2-(изобутирилокси)бензоила
Пример 80: пероксид (2-(изопропоксикарбонилокси)бензоил) 2-(трет-бутирилокси)бензоила
Пример 81: пероксид (2-(изопропоксикарбонилокси)бензоил) 2-(циклогексанкарбонилокси)бензоила
Пример 82: пероксид (2-(изопропоксикарбонилокси)бензоил) 2-(метилкарбамоилокси)бензоила
Пример 83: пероксид (2-(изопропоксикарбонилокси)бензоил) 2-(диметилкарбамоилокси)бензоила
Пример 84: пероксид (2-(трет-бутоксикарбонилокси)бензоил) 2-(изобутирилокси)бензоила
Пример 85: пероксид (2-(трет-бутоксикарбонилокси)бензоил) 2-(трет-бутирилокси)бензоила
Пример 86: пероксид (2-(трет-бутоксикарбонилокси)бензоил) 2-(циклогексанкарбонилокси)бензоила
Пример 87: пероксид (2-(трет-бутоксикарбонилокси)бензоил) 2-(метилкарбамоилокси)бензоила
Пример 88: пероксид (2-(трет-бутоксикарбонилокси)бензоил) 2-(диметилкарбамоилокси)бензоила
Пример 89: пероксид (2-(циклогексилоксикарбонилокси)бензоил) 2-(изобутирилокси)бензоила
Пример 90: пероксид (2-(циклогексилоксикарбонилокси)бензоил) 2-(трет-бутирилокси)бензоила
Пример 91: пероксид (2-(циклогексилоксикарбонилокси)бензоил) 2-(циклогексанкарбонилокси)бензоила
Пример 92: пероксид (2-(циклогексилоксикарбонилокси)бензоил) 2-(метилкарбамоилокси)бензоила
Пример 93: пероксид (2-(циклогексилоксикарбонилокси)бензоил) 2-(диметилкарбамоилокси)бензоила
Пример 94: пероксид (2-(этоксикарбонилокси)бензоил) 2-(изопропоксикарбонилокси)бензоила
Пример 95: пероксид (2-(этоксикарбонилокси)бензоил) 2-(трет-бутоксикарбонилокси)бензоила
Пример 96: пероксид (2-(этоксикарбонилокси)бензоил) 2-(циклогексилоксикарбонилокси)бензоила
Пример 97: пероксид (2-(трет-бутирилокси)бензоил) 2-(циклогексилоксикарбонилокси)бензоила.
Общее описание способов получения соединений формулы (I) представлено ниже. На этих схемах и в представленном ниже описании способа, если не указано иначе, все заместители такие, как определены для соединений формулы (I).
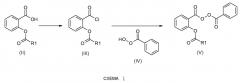
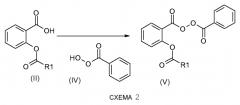
Если группа A, определенная в формуле (I), является водородом, соединения общей формулы (I) получают по схеме реакции 1 или схеме реакции 2, представленной ниже.
Согласно схеме 1 хлорангидриды общей формулы (III) получают из карбоновой кислоты (II) способами, выбранными из известных специалисту в данной области техники (EP 1219682). Они включают применение тионилхлорида и пиридина в растворителе, таком как толуол или дихлорметан, например.
Карбоновые кислоты общей формулы (II) коммерчески доступны или могут быть получены согласно способам, описанным на схемах 7 и 8.
На конечной стадии соединения общей формулы (V) могут быть получены сочетанием хлористых ацилов формулы (III) и перкислотой формулы (IV) с применением, в качестве основания, пиридина в смеси растворителей, таких как дихлорметан и хлороформ (Evanochko, W.T. and Shevlin, P.B.; J. Org. Chem., 1979, 44(24), 4426-4430).
Перкислоту общей формулы (IV) получают из пероксида бензоила согласно способу, описанному на схеме 11.
Согласно схеме 2 пероксиды общей формулы (V) получают сочетанием карбоновых кислот формулы (II) и перкислоты формулы (IV) с применением, например, в качестве сочетающего агента, N,N'-дициклогексилкарбодиимида в смеси растворителей, таких как диэтиловый эфир и дихлорметан (Spantulescu, M.D.; Jain, R.P.; Derksen, D.J. and Vederas, J.C.; Org. Lett., 2003, 5(16), 2963-2965).
Карбоновые кислоты общей формулы (II) коммерчески доступны или получены способами, описанными на схемах 7 и 8.
Перкислоту общей формулы (IV) получают из пероксида бензоила согласно способу, описанному на схеме 11.
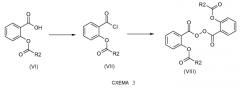
Если группа A, определенная в формуле (I), не является водородом и если группа R2 идентична группе R1, соединения общей формулы (I) получают согласно схеме реакции 3 или схеме реакции 4, представленным ниже.
Согласно схеме 3 хлорангидриды общей формулы (VII) получают из карбоновой кислоты (VI) способами, выбранными из известных специалисту в данной области техники (EP 1219682). Они включают применение тионилхлорида и пиридина в растворителе, таком как толуол или дихлорметан, например.
Карбоновые кислоты общей формулы (VI) получают способами, описанными на схемах 9 и 10.
На конечной стадии соединения общей формулы (VIII) могут быть получены сочетанием двух хлористых ацилов формулы (VII) способами, выбранными из известных специалисту в данной области техники (EP 0108821). Они включают применение пероксида водорода и бикарбоната натрия в растворителе, таком как тетрагидрофуран, например.
Согласно схеме 4 пероксиды общей формулы (VIII) получают взаимодействием между двумя карбоновыми кислотами формулы (VI) с применением, например, N,N'-дициклогексилкарбодиимида и пероксида водорода, например, в смеси растворителей, таких как диэтиловый эфир и дихлорметан (Spantulescu, M.D.; Jain, R.P.; Derksen, D.J.; Vederas, J.C.; Org. Lett., 2003, 5(16), 2963-2965).
Карбоновые кислоты общей формулы (VI) коммерчески доступны или могут быть получены способами, описанными на схемах 9 и 10.
Если группа A, определенная в формуле (I), не является водородом и если группа R2 отличается от группы R1, соединения общей формулы (I) получают согласно схеме реакции 5 и схеме реакции 6, представленным ниже.
Согласно схеме 5 хлорангидриды общей формулы (III) получают из карбоновой кислоты (II) способами, выбранными из известных специалисту в данной области техники (EP 1219682). Они включают применение тионилхлорида и пиридина в растворителе, таком как толуол или дихлорметан, например.
Карбоновые кислоты общей формулы (II) коммерчески доступны, или их получают способами, описанными на схемах 7 и 8.
На конечной стадии соединения общей формулы (X) могут быть получены сочетанием хлористых ацилов формулы (III) и перкислоты формулы (IX) с применением, в качестве основания, пиридина, например, в смеси растворителей, таких как дихлорметан и хлороформ.
Перкислоту общей формулы (IX) получают способом, описанным на схеме 12, начиная с пероксида формулы (VIII).
Согласно схеме 6 пероксиды общей формулы (X) получают сочетанием карбоновых кислот формулы (II) и перкислоты формулы (IX) с применением, например, в качестве сочетающего агента N,Ν'-дициклогексилкарбодиимида в смеси растворителей, таких как диэтиловый эфир и дихлорметан, например.
Карбоновые кислоты общей формулы (II) коммерчески доступны или могут быть получены способами, описанными на схемах 7 и 8.
Перкислоту общей формулы (IX) получают способом, описанным на схеме 12, начиная с определенного пероксида формулы (VIII).
Карбоновые кислоты формулы (II) могут быть получены согласно схеме реакции 7 или 8.
Согласно схеме 7 карбоновые кислоты формулы (II) получают из салициловой кислоты (XI) способами, выбранными из известных специалисту в данной области техники (Lima, S.; Kumar, S.; Gawandi, V.; Momany, C. and Phillips, R.S.; J. Med. Chem., 2009, 52 (2), 389-396, и Sessions, E.H. and Jacobi, P.A.; Org. Lett., 2006, 8(18), 4125-4128). Они включают применение хлорангидрида формулы (XII) и оснований, таких как N,N-диметиланилин, триэтиламин или пиридин, в растворителе, таком как толуол или дихлорметан, например.
Хлорангидриды формулы (XII) коммерчески доступны.
Согласно схеме 8 альдегиды формулы (XV) получают из салицилальдегида (XIII) способами, выбранными из известных специалисту в данной области техники (Lima, S.; Kumar, S.; Gawandi, V.; Momany, C.; Phillips, R.S.; J. Med. Chem., 2009, 52 (2), 389-396, и Sessions, E.H. and Jacobi, P.A.; Org. Lett., 2006, 8(18), 4125-4128). Они включают применение хлорангидрида формулы (XII) или ангидридов формулы (XIV) и оснований, таких как триэтиламин или пиридин, в растворителе, таком как ацетон или дихлорметан, например.
На конечной стадии карбоновые кислоты общей формулы (II) могут быть получены окислением альдегидов формулы (XV) с перхлоритом натрия в смеси растворителей, таких как вода и трет-бутанол (Marsini, M.A.; Gowin, K.M.; Pettus, T.R.R.; Org. Lett., 2006, 8(16), 3481-3483).
Карбоновые кислоты формулы (VI) могут быть получены согласно схеме реакции 9 или 10.
Согласно схеме 9 карбоновые кислоты формулы (VI) получают из салициловой кислоты (XI) способами, выбранными из известных специалисту в данной области техники (Lima, S.; Kumar, S.; Gawandi, V.; Momany, C.; Phillips, R.S.; J. Med. Chem., 2009, 52 (2), 389-396, и Sessions, E.H. and Jacobi, P.A.; Org. Lett., 2006, 8(18), 4125-4128). Они включают применение хлорангидрида формулы (XVI) и оснований, таких как N,N-диметиланилин, триэтиламин или пиридин, в растворителе, таком как толуол или дихлорметан, например.
Хлорангидриды формулы (XVI) коммерчески доступны.
Согласно схеме 10 альдегиды формулы (XVIII) получают из салицилового альдегида (XIII) способами, выбранными из известных специалисту в данной области техники (Lima, S.; Kumar, S.; Gawandi, V.; Momany, C.; Phillips, R.S.; J. Med. Chem. 2009, 52 (2), 389-396, и Sessions, E.H. and Jacobi, P.A.; Org. Lett., 2006, 8(18), 4125-4128). Они включают применение хлорангидрида формулы (XVI) или ангидридов формулы (XVII) и оснований, таких как триэтиламин или пиридин, в растворителе, таком как ацетон или дихлорметан, например.
На конечной стадии карбоновые кислоты общей формулы (VI) могут быть получены окислением альдегидов формулы (XVIII) с перхлоридом натрия в смеси растворителей, таких как вода и трет-бутанол.
Перкислота формулы (IV) может быть получена согласно схеме реакции 11.
Согласно схеме 11 перкислоту формулы (IV) получают из пероксида дибензоила (XIX) способами, выбранными из известных специалисту в данной области техники (US 3075921). Они включают применение пероксида дибензоила (XIX) и натрия в смеси растворителей, таких как метанол и хлороформ.
Перкислоты формулы (IX) могут быть получены согласно схеме реакции 12.
Согласно схеме 12, перкислоты формулы (IX) получают из пероксида формулы (VIII) способами, выбранными из известных специалисту в данной области техники (US 3075921). Они включают применение пероксида (VIII) и натрия в смеси растворителей, таких как метанол и хлороформ.
Исследование чувствительности пероксидов к Propionibacterium acnes
Принцип тестирования: целью является оценка антибактериального действия пероксидов через измерение минимальной ингибирующей концентрации (МИК). МИК определяют как наименьшую концентрацию продукта, способную ингибировать любой видимый рост.
Микробный штамм и происхождение:
Исследование чувствительности продуктов проводят на штамме Propionibacterium acnes (P. acnes) из Collection de l'Institut Pasteur (CIP): P. acnes CIP53.117, эквивалент ATCC6919, происхождение: лезии лицевых угрей (1920), источник CRBIP, Institut Pasteur, Paris.
Тестирование на продуктах:
Продукты растворяют при 1280 мг/л в смеси абсолютного этанола/стерильного Tween 80/стерильного Wilkins-Chalgren бульона (5/10/85 об./об./об.). Применяемые степени разведения адаптированы к способу, описанному в CLSI для способов разведения в жидкой среде. Они включают 10 концентраций от 2,5 мг/л до 1280 мг/л при интервалах соотношения 2.
Суспензию P. acnes получают в бульоне Wilkins-Chalgren и калибруют при оптической плотности около 0,4 при длине волны 525 нм. Ее разводят до 1/10 в бульоне Wilkins-Chalgren и затем помещают в тестовые лунки с получением конечной суспензии около 105-106 КОЕ/мл в каждой тестовой лунке.
Растворы тестируемых продуктов помещают в 96-луночный микропланшет и инкубируют при 36±2°C в анаэробной атмосфере в течение по меньшей мере 72 ч. Первую лунку, в которой отсутствует видимый невооруженным глазом рост, считают МИК.
| Пример № | МИК в мг/л |
| 1 | 80 |
| 2 | 40 |
| 3 | 160 |
| 4 | 160 |
| 5 | 40 |
| 6 | 80 |
| 7 | НТ |
| 8 | 320 |
| 9 | 320 |
| 10 | 80 |
| 11 | 320 |
| 12 | 320 |
| НТ: не тестирован. |
Оценка противовоспалительного действия пероксидов после однократного местного введения на вызванный TPA отек уха
Принцип тестирования: целью является оценка противовоспалительного действия пероксидов через измерение толщины уха мыши после местного нанесения TPA. Противовоспалительное действие определяют как процент ингибирования вызванного TAP отека уха.
Объектом исследования является демонстрация противовоспалительного действия нового пероксида по сравнению с BPO (пероксидом бензоила).
Тестирование на продуктах:
Отек вызывают однократным местным нанесением 20 мкл TPA, растворенной в ацетоне при 0,01%.
Затем проводят однократное местное нанесение тестируемых соединений, растворенных в растворе TPA.
Способ оценки:
Толщину уха измеряют при T6h.
Результаты выражены в процентах на основании ингибирования отека, вызванного нанесением TPA.
Пероксид бензоила (BPO) тестируют 2 раза в качестве ссылочного пероксида.
Вывод:
Целью этого исследования является демонстрация противовоспалительного действия новых пероксидов после однократного местного нанесения в модели вызванного TPA отека уха мыши.
Пр.1 при 1%, 2,5% и 5% показал зависимое от дозы противовоспалительное действие. При 5% действие значительно превосходит действие BPO при 5%.
Пр.3 показал сильное зависимое от дозы противовоспалительное действие.
Пр.5 при 5% показал значительное противовоспалительное действие.
Пр.6 показал сильное зависимое от дозы противовоспалительное действие.
По сравнению с BPO при 5%, Пр.5 и Пр.6 демонстрируют более сильное противовоспалительное действие.
Пример 1: пероксид (2-(этоксикарбонилокси)бензоил)бензоила
1-1: 2-(этоксикарбонилокси)бензойная кислота
60 г (434 ммоль) салициловой кислоты и 111 мл N,N-диметиланилина растворяют в 360 мл толуола. Смесь охлаждают до 0°C и затем по каплям добавляют 41,5 мл (434 ммоль) этилхлорформиата. После перемешивания в течение 2 часов при температуре окружающей среды смесь промывают 1N водным раствором хлористоводородной кислоты и затем насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. Остаток помещают в дихлорметан и осаждают из гептана. Твердое вещество отфильтровывают и затем сушат. 38 г 2-(этоксикарбонилокси)бензойной кислоты получают в виде белого твердого вещества с выходом 42%.
1-2: хлорид 2-(этоксикарбонилокси)бензоила
5,9 г (28 ммоль) 2-(этоксикарбонилокси)бензойной кислоты растворяют в 30 мл толуола с несколькими каплями пиридина. 2,15 мл (29 ммоль) тионилхлорида добавляют по каплям, и смесь перемешивают при температуре окружающей среды в течение 18 ч и затем концентрируют досуха. Остаток осаждают из пентана. Твердое вещество отфильтровывают и затем сушат. 5,2 г хлорида 2-(этоксикарбонилокси)бензоила получают в виде белого твердого вещества с выходом 80%.
1-3: бензолкарбопероксикислота
19 г (78 ммоль) пероксида дибензоила растворяют в 125 мл хлороформа при -5°C. По каплям добавляют 2,2 г (94 ммоль) натрия, растворенного в 50 мл метанола в токе азота. После перемешивания при -5°C в течение 30 минут, добавляют ледяную воду и смесь подкисляют 2N водным раствором хлористоводородной кислоты. Экстрагируют дихлорметаном и затем органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. 9 г бензолкарбопероксикислоты получают в виде белого твердого вещества с выходом 83%.
1-4: пероксид 2-(этоксикарбонилокси)бензоил)бензоила
8,6 г (67 ммоль) хлорида 2-(этоксикарбонилокси)бензоила (полученного в Примере 1.2) и 10,2 г (44 ммоль) бензолкарбопероксикислоты растворяют в 43 мл хлороформа. Смесь охлаждают до -18°C и затем по каплям добавляют 2,2 мл (38 ммоль) пиридина в 5 мл дихлорметана. После перемешивания при -18°C в течение 2 часов, добавляют воду и смесь экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, фильтруют и затем концентрируют. Остаток очищают хроматографией на силикагеле, элюируя смесью пентана/дихлорметана 5/5. 11 г пероксида (2-(этоксикарбонилокси)бензоил)бензоила в виде бежевого твердого вещества с выходом 75%.
1Н ЯМР/CDCl3: δ=1,32 (т, J=7,1 Гц, 3H); 4,29 (кв, J=7,2 Гц, 2H); 7,22 (дд, J=1 Гц, J=7 Гц, 1H); 7,34 (тд, J=1 Гц, J=8 Гц, 1H); 7,45 (т, J=8 Гц, 2H); 7,60 (м, 2H); 8,00 (м, 3H).
Пример 2: пероксид (2-(трет-бутоксикарбонилокси)бензоил)бензоила
2-1: 2-(трет-бутоксикарбонилокси)бензальдегид
350 мг (2,8 ммоль) N,N-диметиламинопиридина и 8,1 мл (46,9 ммоль) N,N-диизопропилэтиламина добавляют к раствору, содержащему 20,9 г (95,7 ммоль) ди(трет-бутил)дикарбоната в 150 мл тетрагидрофурана в токе азота. По каплям добавляют 10 мл (93,8 ммоль) салицилальдегида. После перемешивания при температуре окружающей среды с течение 2 часов, смесь обрабатывают 1N водным раствором хлористоводородной кислоты, и затем экстрагируют смесью гептана/этилацетата 1/1. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. 21,5 г 2-(трет-бутоксикарбонилокси)бензальдегида получают в виде желтого масла с количественным выходом.
2-2: 2-(трет-бутоксикарбонилокси)бензойная кислота
21,5 г (93,8 ммоль) 2-(трет-бутоксикарбонилокси)бензальдегида и 80 мл (750 ммоль) 2-метил-2-бутена разбавляют в 250 мл трет-бутанола. Раствор, содержащий 28,1 г (234 ммоль) гидрофосфата натрия и 29,7 г (328 ммоль) хлорита натрия в 75 мл воды по каплям добавляют к реакционной смеси, которую перемешивают при температуре окружающей среды в течение 2 часов. Смесь выпаривают при пониженном давлении и остаток растворяют в дихлорметане. Органическую фазу промывают водой, сушат над сульфатом магния, фильтруют и концентрируют. Полученное белое твердое вещество осаждают из гептана при 0°C. Осадок отфильтровывают и затем промывают гептаном и сушат. 15,8 г 2-(трет-бутоксикарбонилокси)бензойной кислоты получают в виде белого порошка с выходом 70%.
2-3: пероксид (2-(трет-бутоксикарбонилокси)бензоил)бензоила
3 г (13 ммоль) 2-(трет-бутоксикарбонилокси)бензойной кислоты и 1,8 г (13 ммоль) бензолкарбопероксикислоты (полученной, как описано в Примере 1-3) растворяют в смеси диэтилового эфира/дихлорметана 6/4. Раствор охлаждают до 0°C и затем по каплям добавляют 2,6 г (13 ммоль) N,N'-дициклогексилкарбодиимида, растворенного в 50 мл диэтилового эфира. После перемешивания при 0°C в течение 3 часов, реакционную среду фильтруют и затем концентрируют досуха. Остаток очищают хроматографией на силикагеле, элюируя смесью пентана/дихлорметана 4/6. 2,2 г пероксида (2-(трет-бутоксикарбонилокси)бензоил)бензоила получают в виде белого твердого вещества с выходом 49%.
1Н ЯМР/CDCl3: δ=1,57 (с, 9H); 7,29 (дд, J=0,9 Гц, J=8 Гц, 1H); 7,40 (тд, J=1 Гц, J=7,7 Гц, 1H); 7,52 (т, J=7,5 Гц, 2H); 7,68 (т, J=7,6 Гц, 2H); 8,07 (дд, J=1,3 Гц, J=7,4 Гц, 3H).
Пример 3: пероксид бис(2-(этоксикарбонилокси)бензоила)
3-1: пероксид бис(2-(этоксикарбонилокси)бензоила)
5,2 г (23 ммоль) хлорида 2-(этоксикарбонилокси)бензоила (получен по методике Примера 1-2) растворяют в 26 мл тетрагидрофурана в токе азота с 2,4 г (23 ммоль) бикарбоната натрия. Смесь охлаждают до -15°C и затем по каплям добавляют 0,7 мл (12,4 ммоль) 50% водного пероксида водорода. После перемешивания при 0°C в течение 4 ч, к смеси добавляют ледяную воду и затем экстрагируют диэтиловым эфиром. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха. Остаток очищают хроматографией на силикагеле, элюируя смесью циклогексана/дихлорметана 3/7. 2,1 г пероксида бис(2-(этоксикарбонилокси)бензоила) получают в виде белого твердого вещества с выходом 45%.
1Н ЯМР/CDCl3: δ=1,32 (т, J=7,1 Гц, 6H); 4,28 (кв, J=7,2 Гц, 4H); 7,24 (дд, J=1 Гц, J=8 Гц, 2H); 7,33 (тд, J=1 Гц, J=7,7 Гц, 2H); 7,61 (тд, J=1,7 Гц, J=7,6 Гц, 2H); 7,98 (дд, J=1,7 Гц, J=7,8 Гц, 2H).
Пример 4: пероксид бис(2-(трет-бутоксикарбонилокси)бензоила)
4-1: пероксид бис(2-(трет-бутоксикарбонилокси)бензоил)
3,5 г (17 ммоль) N,N'-дициклогексилкарбодиимида растворяют в 40 мл диэтилового эфира при -18°C. Добавляют 2,4 мл (42 ммоль) водного раствора пероксида водорода и 4 г (17 ммоль) 2-(трет-бутоксикарбонилокси)бензойной кислоты (получена, как описано в Примере 2-2), растворенной в 30 мл дихлорметана. После перемешивания при -18°C в течение 5 часов, добавляют 50 мл диэтилового эфира, реакционную смесь фильтруют и затем концентрируют, и полученное твердое вещество осаждают из смеси диэтилового эфира/пентана 2/8, отфильтровывают и затем сушат. 2,2 г пероксида бис(2-(трет-бутоксикарбонилокси)бензоила) в виде белого твердого вещества с выходом 28%.
1Н ЯМР/CDCl3: δ=1,57 (с, 18H); 7,31 (д, J=1 Гц, J=8,2 Гц, 2H); 7,39 (тд, J=1,1 Гц, J=8 Гц, 2H); 7,68 (тд, J=1,7 Гц, J=7,6 Гц, 2H); 8,04 (дд, J=1,6 Гц, J=7,8 Гц, 2H).
Пример 5: пероксид (2-(изопропоксикарбонилокси)бензоил)бензоила
5-1: 2-(изопропоксикарбонилокси)бензальдегид
26 мл (190 ммоль) триэтиламина и затем 185 мл (190 ммоль) 1M раствора изопропилхлорформиата в толуоле по каплям добавляют к раствору, содержащему 15 г (120 ммоль) салицилальдегида в 150 мл тетрагидрофурана при 0°C. Смесь перемешивают при 0°C в течение 2 часов и затем при температуре окружающей среды в течение 18 часов. Добавляют воду и реакционную смесь экстрагируют этилацетатом. Органическую фазу промывают водой, сушат над сульфатом магния, фильтруют и концентрируют. 27 г 2-(изопропоксикарбонилокси)бензальдегида получают в виде желтого масла с количественным выходом.
5-2: 2-(изопропоксикарбонилокси)бензойная кислота
По методике Примера 2-2 получают 9 г 2-(изопропоксикарбонилокси)бензойной кислоты из 15 г (72 ммоль) 2-(изопропоксикарбонилокси)бензальдегида в виде белого твердого вещества с выходом 56%.
5-3: хлорид 2-(изопропоксикарбонилокси)бензоила
5 г (22 ммоль) 2-(изопропоксикарбонилокси)бензойной кислоты растворяют в 50 мл дихлорметана с несколькими каплями пиридина. По каплям добавляют 1,95 мл (27 ммоль) тионилхлорида и смесь перемешивают при температуре окружающей среды в течение 18 ч и затем концентрируют досуха. 5,7 г хлорида 2-(изопропоксикарбонилокси)бензоила получают с количественным выходом.
5-4: пероксид (2-(изопропоксикарбонилокси)бензоил)бензоила
По методике Примера 1-4 получают 3,7 г пероксида (2-(изопропоксикарбонилокси)бензоил)бензоила из 5,4 г (22 ммоль) карбоната 2-(хлоркарбонил)фенилизопропила и 4,6 г (33 ммоль) бензолкарбопероксикислоты (полученной по методике Примера 1-3) в виде белого твердого вещества с выходом 49%.
1Н ЯМР/CDCl3: δ=1,40 (д, J=6,2 Гц, 6H); 5,03 (кв, J=6,2 Гц, 1H); 7,32 (д, J=8,2 Гц, 1H); 7,41 (т, J=7,7 Гц, 1H); 7,53 (м, 2H); 7,70 (м, 2H); 8,08 (м, 3H).
Пример 6: пероксид бис(2-(изопропоксикарбонилокси)бензоила)
6-1: пероксид бис(2-(изопропоксикарбонилокси)бензоила)
По методике Примера 4-1 получают 1,48 г пероксида бис(2-(изопропоксикарбонилокси)бензоила) из 3,6 г (16 ммоль) 2-(изопропоксикарбонилокси)бензойной кислоты в виде белого твердого вещества с выходом 41%.
1Н ЯМР/CDCl3: δ=1,40 (д, J=6,2 Гц, 12H); 5,03 (кв, J=6,2 Гц, 2H); 7,23 (дд, J=8,2 Гц, J=1 Гц, 2H); 7,32 (тд, J=7,6 Гц, J=1 Гц, 2H); 7,59 (тд, J=7,6 Гц, J=1,7 Гц, 2H); 7,96 (дд, J=7,8 Гц, J=1,7 Гц, 2H).
Пример 7: пероксид (2-(циклогексилоксикарбонилокси)бензоил)бензоила
7-1: 2-(циклогексилоксикарбонилокси)бензальдегид
6,3 мл (45 ммоль) триэтиламина и затем 7,4 г (45 ммоль) циклогексилхлорформиата по каплям добавляют к раствору, содержащему 5 г (41 ммоль) салицилальдегида в 50 мл тетрагидрофурана при 0°C. После перемешивания при температуре окружающей среды в течение 2 часов смесь обрабатывают водой и затем экстрагируют смесью гептана/этилацетата 1/1. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. 10,3 г 2-(циклогексилоксикарбонилокси)бензальдегида получают в виде желтого масла с количественным выходом.
7-2: 2-(циклогексилоксикарбонилокси)бензойная кислота
По методике Примера 2-2 получают 8,5 г 2-(циклогексилоксикарбонилокси)бензойной кислоты из 10,3 г (41 ммоль) карбоната циклогексил 2-формилфенила в виде белого твердого вещества с выходом 78%.
7-3: пероксид (2-(циклогексилоксикарбонилокси)бензоил)бензоила
По методике Примера 2-3 получают 4 г пероксида (2-(циклогексилоксикарбонило