Способ получения хиральных гидразидов
Иллюстрации
Показать всеИзобретение относится к способам получения хиральных соединений, в частности к способу получения хирального соединения формулы (II). Способ включает реакцию хирального соединения формулы (I) с H2N-NH-CHO в растворителе с получением соединения формулы (II). В формулах (I) и (II) Y обозначает замещенный или незамещенный арильный фрагмент, где замещенный арильный фрагмент содержит 1, 2 или 3 заместителя, которые выбраны из группы, включающей галоген, алкил и C1-C6алкоксигруппу. Изобретение относится также к способам получения хиральных соединений формул (III)-(V) с использованием способа получения хирального соединения формулы (II), хиральным соединениям формул (II)-(V) и их применению для получения фунгицидного средства, предпочтительно позаконазола. В формулах (III)-(V) Y имеет значение, указанное для соединений формул (I) и (II); Raa, Rbb и Rcc могут быть одинаковыми или разными и представляют собой алкильные или арильные остатки; R1 означает алкильный остаток. 9 н. и 22 з.п. ф-лы, 2 ил., 3 пр.
Реферат
Настоящее изобретение относится к способу получения хирального соединения, в частности к способу получения хирального соединения, которое можно использовать в качестве промежуточного продукта для получения фунгицидных средств, предпочтительно позаконазола.
Уровень техники
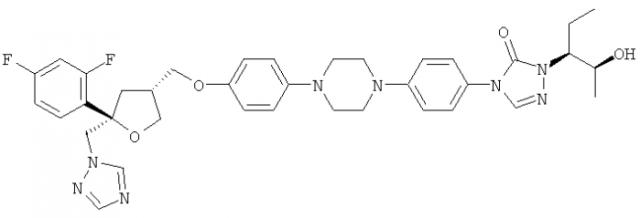
Позаконазол (регистрационный № CAS 171228-49-2; название CAS: 2,5-ангидро-1,3,4-тридезокси-2-C-(2,4-дифторфенил)-4-[[4-[4-[4-[1-[(1S,2S)-1-этил-2-гидроксипропил]-1,5-дигидро-5-оксо-4Н-1,2,4-триазол-4-ил]фенил]-1-пиперазинил]фенокси]метил]-1-(1Н-1,2,4-триазол-1-ил)-D-трео-пентит) является триазольным фунгицидным лекарственным средством, обладающим структурой:
Позаконазол используется, например, для предупреждения и/или лечения инвазивных грибковых инфекций, вызванных штаммами Candida, штаммами Mucor, штаммами Aspergillus, штаммами Fusarium или штаммами Coccidioides, у пациентов с ослабленным иммунитетом и/или у пациентов, у которых заболевание устойчиво к воздействию других фунгицидных средств, таких как амфотерицин B, флуконазол или итраконазол, и/или у пациентов, которые не переносят эти фунгицидные средства. Одним из важных промежуточных продуктов для получения позаконазола является соединение формулы (V)
предпочтительно соединение формулы (V), в которой R1 = этил
.
В настоящее время отсутствует способ, который дает соединение формулы (V), предпочтительно соединение формулы (V), в которой R1 = этил, в особенности с высокой энантиомерной, диастереоизомерной чистотой и выходом. До настоящего времени в литературе описано только соответствующее содержащее бензильную защитную группу соединение, представленное ниже. К сожалению, соединение формулы (V), в которой R1 = этил, затруднительно получить путем удаления бензильной защитной группы при стандартных условиях гидрогенолиза.
Обычным промежуточным продуктом для способа получения позаконазола является соединение формулы
.
Способ получения этого промежуточного продукта раскрыт в WO 95/17407. Суммарный выход этого способа составляет примерно 25% и диастереоизомерная чистота изомера формулы
находится в диапазоне 94-99% и энантиомерная чистота зависит от качества исходного вещества, метилового эфира молочной кислоты. WO 95/17407 не описана очистка указанного промежуточного продукта.
В WO 97/22579 и публикации Saksena et al., Tetrahedron Lett. 2004, 45 (44), 8249-8251, раскрыты улучшенные способы проведения реакции Гриньяра в последовательности реакций, описанной в WO 95/17407. Описана стадия силилирования и добавление трет-BuMgCl при реакции Гриньяра с получением промежуточного продукта чистотой 95% без проведения дополнительной очистки с помощью хроматографии. Однако авторы настоящего изобретения, хотя и являющиеся высококвалифицированными специалистами в этой конкретной области химии, не смогли воспроизвести эти результаты. Несмотря на разумную модификацию методики, описанной в WO 97/22579 и публикации Saksena et al., промежуточный продукт всегда получали в виде сложной смеси, которую для обеспечения заявленной чистоты было необходимо дважды обработать с помощью хроматографии.
Другой способ, раскрытый в WO 96/33163, включает стереохимическое разделение промежуточного продукта путем образования соли с использованием хиральных кислот (например, дибензоил-L-винной кислоты, L-ДБВК) и кристаллизации полученных диастереоизомерных солей для получения указанного выше промежуточного продукта с высокой оптической чистотой. В другом способе, раскрытом в WO 97/33178, необходима защита одного гидразинового атома азота для введения хирального центра восстановлением дорогостоящими реагентами с селективностью по искомому изомеру, составляющей 0-94%. Ни в WO 96/33163, ни в WO 97/33178 не описана очистка продуктов за исключением стереохимического разделения.
Все эти способы предшествующего уровня техники обладают значительными недостатками.
Во-первых, в описанных методиках необходимо использовать защитной группы для группы ОН при синтезе промежуточного гидразида, и при последующем получении фунгицидных средств. Кроме того, жесткие условия проведения реакции синтеза могут рассматриваться, как запретительные для широко использующихся защитных групп, включая силиловые простые и сложные эфирные группы. Представляется, что достаточно стабильны только простые эфиры, и это может быть причиной того, что во всех конкретных примерах раскрыт только бензиловый эфир.
Во-вторых, ни один из этих способов предшествующего уровня техники не позволяет прямо получить незащищенные соединения формулы (V) и, например, необходима защита группы OH соединения формулы (V) желательной защитной группой, подобранной для последующих реакций.
В-третьих, как отмечено выше, трудоемкая очистка маслообразных продуктов с помощью хроматографии или стереохимического разделения необходима для компенсации недостаточной химической селективности и стереоселективности реакций предшествующего уровня техники.
В-четвертых, регулировка множества стадий окисления реакций предшествующего уровня техники, включая большой избыток дорогостоящих реагентов, увеличивает количество отдельных стадий и уменьшает суммарный выход. Эти недостатки значительно уменьшают выход искомого гидразида формулы (V) и предпочтительно формулы (V), в которой R1 = этил
и соответственно их защищенных производных. Одновременно образуется большое количество нежелательных побочных продуктов, что делает способ предшествующего уровня техники еще более неудовлетворительным.
Поэтому объектом настоящего изобретения является разработка эффективного способа получения хиральных гидразидов, предпочтительно получения соединения формулы (V), в которой R1 = этил
которое можно эффективно использовать в качестве промежуточного продукта для получения азольных фунгицидных средств, предпочтительно позаконазола.
Другим объектом настоящего изобретения является разработка эффективного способа получения кристаллического соединения формулы (V) и предпочтительно формулы (V), в которой R1 = этил
и, кроме того, соединений на основе этого кристаллического соединения, в которых группа ОН соответствующим образом защищена.
Другим объектом настоящего изобретения является получение самого кристаллического соединения, а также указанного соответствующим образом защищенного соединения.
Согласно изобретению неожиданно было установлено, что указанные выше задачи решаются способом, в котором на первой стадии получают соединение формулы
в которой Y обозначает необязательно замещенный арильный фрагмент, и его вводят в реакцию с H2N-NH-CHO в подходящем растворителе, в результате чего получают хиральное соединение формулы
.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу получения хирального соединения, включающему
(1) использование хирального соединения формулы (I)
,
в которой Y обозначает необязательно замещенный арильный фрагмент, предпочтительно необязательно замещенный фенильный фрагмент, более предпочтительно незамещенный фенил;
(2) реакцию соединения формулы (I) с H2N-NH-CHO в растворителе с получением соединения формулы (II)
.
Кроме того, настоящее изобретение относится к способу получения хирального соединения, включающему
(1) использование хирального соединения формулы (I)
,
в которой Y обозначает необязательно замещенный арильный фрагмент, предпочтительно необязательно замещенный фенильный фрагмент, более предпочтительно незамещенный фенил;
(2) реакцию соединения формулы (I) с H2N-NH-CHO в растворителе с получением соединения формулы (II)
;
(3) выделение соединения формулы (II) из реакционной смеси, полученной на стадии (2), с помощью жидкостной экстракции, где до стадии (3) предпочтительно проводят замену растворителя;
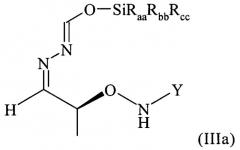
(4) реакцию соединения формулы (II) в растворителе с силилирующим реагентом, содержащим остаток -SiRaaRbbRcc, с получением соединения формулы (III)
в которой остатки Raa, Rbb и Rcc могут быть одинаковыми или разными и предпочтительно представляют собой алкильные или арильные остатки, более предпочтительно алкильные остатки, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, более предпочтительно 1 или 2 атома углерода;
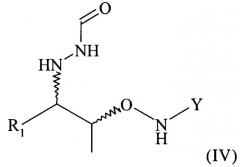
(5) реакцию соединения формулы (II) или реакцию соединения формулы (III) с нуклеофильным соединением, содержащим нуклеофильный остаток R1, в растворителе с получением соединения формулы (IV)
;
(6) восстановление соединения формулы (IV), предпочтительно путем гидрирования, с получением соединения формулы (V)
;
(7) необязательно реакцию соединения формулы (V) в растворителе с силилирующим реагентом, содержащим остаток -SiRaRbRc, с получением соединения формулы (VI)
,
в которой остатки Ra, Rb и Rc могут быть одинаковыми или разными и предпочтительно представляют собой алкильные или арильные остатки.
Настоящее изобретение также относится к хиральному соединению, которое можно получить или получают способом, предлагаемый в настоящем изобретении.
В частности, настоящее изобретение относится к предпочтительно кристаллическому хиральному соединению формулы (V), в которой R1 предпочтительно означает алкильный остаток, предпочтительно содержащий от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода, еще более предпочтительно 1 или 2 атома углерода, наиболее предпочтительно 2 атома углерода, R1 предпочтительно обозначает этил, где предпочтительно не менее 95%, более предпочтительно не менее 97%, еще более предпочтительно не менее 99% молекул указанного кристаллического соединения находятся в виде изомера формулы (Va)
,
предпочтительно в виде изомера формулы (Vb)
.
Кроме того, настоящее изобретение также относится к применению хирального соединения, предлагаемого в настоящем изобретении, предпочтительно соединения формулы (Vb), для получения фунгицидного средства, предпочтительно для получения позаконазола.
Краткое описание чертежей
На фиг.1 приведен инфракрасный спектр (ИК) соединения формулы (V), полученного в примере 3 настоящего изобретения. На фиг.1 по оси y отложено пропускание в %, а по оси x отложено волновое число в см-1. В частности, могут обнаруживаться следующие пики в ИК-спектре: 3341, 3298, 2970, 2881, 1674, 1497, 1447, 1319, 1125, 1071, 945, 910, 876, 775 и 650 +/-2 см-1.
На фиг.2 приведена рентгенограмма соединения формулы (V), полученного в примере 3 настоящего изобретения. На фиг.2 по оси y отложена интенсивность, измеренная в импульсах за 300 с (линейная шкала), а по оси x отложено положение, указанное в значениях 2-тета в градусах. В частности, могут обнаруживаться следующие пики ПРГ: 9,0, 13,9, 17,4, 18,1, 20,0, 20,7, 23,4, 24,6, 27,5 и 29,2 +/-0,2°2-тета.
Подробное описание изобретения
Как отмечено выше, настоящее изобретение относится к способу получения хирального соединения, включающему
(1) использование хирального соединения формулы (I)
,
в которой Y обозначает необязательно замещенный арильный фрагмент, предпочтительно необязательно замещенный фенильный фрагмент, более предпочтительно незамещенный фенил;
(2) реакцию соединения формулы (I) с H2N-NH-CHO в растворителе с получением соединения формулы (II)
.
Стадия (1)
На стадии (1) настоящего изобретения используют соединение формулы (I), которое взаимодействует на стадии (2) с H2N-NH-CHO в подходящем растворителе.
Обычно на получение соединения формулы (I) не налагают специальных ограничений. В частности, можно использовать любую подходящую методику получения соединения формулы (I). В предпочтительном варианте осуществления настоящего изобретения являются предпочтительными такие методики, которые позволяют получить соединение формулы (I) с высокой энантиоселективностью. В еще более предпочтительном варианте осуществления настоящего изобретения являются предпочтительными такие методики, которые позволяют получить соединения (I) где не менее 95%, более предпочтительно не менее 97%, более предпочтительно не менее 99% молекул хирального соединения формулы (I), полученного на стадии (1), содержатся в виде изомера формулы (Ia)
.
При Y = фенил получение соединения формулы (I) по реакции с использованием органического катализатора с превосходной энантиоселективностью является известным. Дается ссылка на публикации Brown et al., J. Chem. Soc. 2003, 125 (36), 10808-10809 и Cordova et al., Chem. Eur. J. 2004, 10 (15), 3673-3684; а также Hayashi et al. J. Org. Chem. 2005, 69 (18), 5966-5973.
В предпочтительном варианте осуществления соединение формулы (I), предлагаемое в настоящем изобретении, получают по реакции пропионового альдегида в подходящем растворителе с соединением формулы (i)
.
Остаток Y в соединении формулы (i) обозначает необязательно замещенный арильный фрагмент, предпочтительно необязательно замещенный фенильный фрагмент, более предпочтительно незамещенный фенил. Термин "арильный фрагмент" при использовании в контексте настоящего изобретения означает карбоциклическую ароматическую группу, такую как фенил или нафтил и т.п. Термин "замещенный арильный фрагмент" и "замещенный фенил" соответственно при использовании в контексте настоящего изобретения означает такой арильный фрагмент и фенил соответственно, которые предпочтительно содержат 1, 2 или 3 заместителя, которые предпочтительно выбраны из группы, включающей галоген, алкил и C1-алкоксигруппу или C2-алкоксигруппу, или C3-алкоксигруппу, или C4-алкоксигруппу, или C5-алкоксигруппу, или C6-алкоксигруппу. Термин "алкил" при использовании в контексте настоящего изобретения означает линейные или разветвленные алкильные фрагменты, которые предпочтительно содержат 1, 2, 3, 4, 5 или 6 атомов углерода. Термин "галоген" при использовании в контексте настоящего изобретения предпочтительно означает атом хлора, брома или йода.
Поэтому, предпочтительно, если остаток Y в соединении формулы (i) не означает бензильный фрагмент, предпочтительно не означает алкиларильный фрагмент. Термин "алкиларильный фрагмент" при использовании в контексте настоящего изобретения означает алкильный фрагмент, который замещен по меньшей мере одним арильным фрагментом. Для иллюстрации, бензильный фрагмент представляет собой алкиларильный фрагмент, где алкилом является метил, который замещен одним фенильным фрагментом.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения соединением формулы (i) является нитрозобензол.
На реакцию пропионового альдегида с соединением формулы (i) не налагают специальных ограничений при условии, что получают соединение формулы (I), предпочтительно соединение (I), где не менее 95%, более предпочтительно не менее 97%, более предпочтительно не менее 99% молекул хирального соединения формулы (I), полученного на стадии (1) содержатся в виде изомера формулы (Ia)
.
Предпочтительно, если в реакции получения соединения формулы (I) используют по меньшей мере один, предпочтительно точно один органический катализатор. Более предпочтительно, если в качестве органического катализатора используют пролин (Pro), еще более предпочтительно D-пролин (D-Pro)
.
В необязательном варианте осуществления настоящего изобретения по меньшей мере один подходящий промотор можно использовать для промотирования реакции, предпочтительно реакции с использованием органического катализатора на стадии (1). Хотя можно использовать любой подходящий промотор, в контексте настоящего изобретения предпочтение отдается производному мочевины и 1-(2-диметиламиноэтил)-3-фенилмочевина является особенно предпочтительной.
Согласно изобретению было установлено, что проведение этой реакции в присутствии кислоты является еще более предпочтительным. Хотя обычно может не быть специальных ограничений, предпочтение отдается кислотам Бренстеда, в особенности органическим кислотам Бренстеда. В других предпочтительных вариантах осуществления используют уксусную кислоту или пропионовую кислоту или смесь этих кислот. а количество используемых кислот не налагают специальных ограничений. Каталитические количества являются предпочтительными. По сравнению с количествами использующегося органического катализатора является еще более предпочтительным использование кислоты в меньшем количестве. В возможных вариантах осуществления и в пересчете на 1 экв. соединения формулы (i) количество органического катализатора может находиться в диапазоне от 0,15 до 0,5, более предпочтительно в диапазоне от 0,2 до 0,4, еще более предпочтительно в диапазоне от 0,25 до 0,35 экв. и количество кислоты может находиться в диапазоне от 0,01 до 0,1, более предпочтительно в диапазоне от 0,02 до 0,09, еще более предпочтительно в диапазоне от 0,03 до 0,08 экв.
Химическая природа подходящего растворителя, в котором проводят реакцию на стадии (1), зависит главным образом от конкретных исходных веществ, использующегося катализатора или катализаторов, кислоты или кислот, если они используются, и/или содержащегося промотора или промоторов, если они используются. Можно использовать один растворитель или смесь двух или большего количества растворителей. В предпочтительном варианте осуществления настоящего изобретения, в котором пропионовый альдегид вводят в реакцию с нитрозобензолом в присутствии D-Pro и в присутствии уксусной кислоты и/или пропионовой кислоты, реакцию предпочтительно проводят в дихлорметане (ДХМ) в качестве растворителя.
Температура, при которой проводят реакцию на стадии (1), зависит главным образом от конкретных исходных веществ, использующегося катализатора или катализаторов, кислоты или кислот, если они используются, и/или содержащегося промотора или промоторов, если они используются. В предпочтительном варианте осуществления настоящего изобретения, в котором предпочтительно пропионовый альдегид вводят в реакцию с нитрозобензолом в присутствии D-Pro и в присутствии уксусной кислоты и/или пропионовой кислоты в ДХМ в качестве растворителя, реакцию предпочтительно проводят при температуре в диапазоне от -15 до +5°C, более предпочтительно от -12 до +3°C, еще более предпочтительно от -10 до 0°C.
Атмосфера, в которой проводят реакцию получения соединения формулы (I), обычно зависит от конкретных исходных веществ, использующегося растворителя или растворителей, использующегося катализатора или катализаторов, кислоты или кислот, если они используются, и/или содержащегося промотора или промоторов, если они используются. В предпочтительном варианте осуществления настоящего изобретения, в котором пропионовый альдегид вводят в реакцию с нитрозобензолом в присутствии D-Pro, реакцию проводят в инертной или в основном инертной атмосфере, такой как атмосфера N2.
Таким образом, по реакции, которую проводят на стадии (1), соединение формулы (I) предпочтительно получают по меньшей мере в одном растворителе, предпочтительно ДХМ, где не менее 95%, более предпочтительно не менее 97%, более предпочтительно не менее 99% молекул хирального соединения формулы (I), полученного на стадии (1), содержатся в виде изомера формулы (Ia)
.
Стадия (2)
Обычно можно выделить соединение формулы (I) из реакционной смеси, полученной на стадии (1). Однако в особенно предпочтительном варианте осуществления настоящего изобретения такое выделение не требуется. Поэтому настоящее изобретение также относится к описанному выше способу, в котором после стадии (1) соединение формулы (I) не выделяют из реакционной смеси, полученной на стадии (1), до реакции с H2N-NH-CHO на стадии (2).
Таким образом, в возможном варианте осуществления реакционную смесь, полученную на стадии (1), можно использовать на стадии (2) без обработки. Альтернативно, реакционную смесь можно дополнительно разбавить по меньшей мере одним подходящим растворителем, или, при желании, подходящее количество растворителя можно удалить из реакционной смеси с помощью подходящего концентрирования.
На стадии (2) настоящего изобретения соединение формулы (I) вводят в реакцию с H2N-NH-CHO в растворителе. Этот растворитель может представлять собой смесь растворителей, если, например, реакционную смесь, полученную на стадии (1), смешивают с H2N-NH-CHO (формилгидразин), содержащимся в растворителе, который отличается от растворителя, содержащегося в реакционной смеси, полученной на стадии (1). В особенно предпочтительном варианте осуществления настоящего изобретения растворителем, который содержится в реакционной смеси, полученной на стадии (1), является тот же растворитель, который используют для проведения реакции на стадии (2). Предпочтительно, если этим растворителем является ДХМ.
Как и для реакции на стадии (1), температура, при которой проводят реакцию на стадии (2), зависит главным образом от конкретных соединений, которые вводят в реакцию друг с другом, использующегося катализатора или катализаторов, кислоты или кислот, если они используются, и/или содержащегося промотора или промоторов, если они используются. В предпочтительном варианте осуществления настоящего изобретения предпочтительно, в котором пропионовый альдегид вводят в реакцию с нитрозобензолом в присутствии D-Pro и в присутствии уксусной кислоты и/или пропионовой кислоты в ДХМ в качестве растворителя на стадии (1), и, если также реакцию на стадии (2) проводят в ДХМ в качестве растворителя, реакцию на стадии (2) предпочтительно проводят при температуре в диапазоне от -10 до +20°C, предпочтительно от -5 до +5°C.
Предпочтительно, если реакцию на стадии (2) проводят в присутствии по меньшей мере одного молекулярного сита. Характеристики пор по меньшей мере одного молекулярного сита можно адаптировать в соответствии с конкретными требованиями. Однако являются предпочтительными такие сита, которые обладают диаметрами пор, определенными в соответствии со стандартом DIN 66131, находящимися в диапазоне от 0,3 до 0,5 нм (нанометров; от 3 до 5 Å), предпочтительно от 0,35 до 0,45 нм (от 3,5 до 4,5 Å), и диаметр пор, равный примерно 0,4 нм (4 Å), является особенно предпочтительным.
Атмосфера, в которой проводят реакцию на стадии (2) для получения соединения формулы (II), также, обычно зависит от конкретных соединений, которые вводят в реакцию друг с другом, использующегося растворителя или растворителей, использующегося катализатора или катализаторов, кислоты или кислот, если они используются, и/или содержащегося промотора или промоторов, если они используются. В предпочтительном варианте осуществления настоящего изобретения, в котором пропионовый альдегид вводят в реакцию с нитрозобензолом в присутствии D-Pro и в присутствии уксусной кислоты и/или пропионовой кислоты в ДХМ в качестве растворителя на стадии (1), и, если также реакцию на стадии (2) проводят в ДХМ в качестве растворителя, реакцию на стадии (2) проводят в инертной или в основном инертной атмосфере, такой как атмосфера N2.
Стадия (3)
Из реакционной смеси, полученной на стадии (2), можно выделить соединение формулы (II). Поскольку на то, как проводят такое выделение, не налагают специальных ограничений, жидкостная экстракция является предпочтительной методикой, предлагаемым в настоящем изобретении. До стадии такой экстракции предпочтительно проводят подходящую замену растворителя. При замене растворителя особенно предпочтительно заменять растворитель, в котором получают соединение формулы (II) на стадии (2), на растворитель или смесь двух или большего количества растворителей, которые являются подходящими для предпочтительной следующей стадии настоящего изобретения, такой как стадия реакции (4), подробно описанная ниже в настоящем изобретении. Конкретный тип растворителя зависит от конкретного соединения формулы (II) и конкретного типа последующей реакции. В случае, если последующей реакцией является реакция, описанная ниже в настоящем изобретении на стадии (4), и в случае, если соединение формулы (II) используют на стадии (3) предпочтительно содержащимся в ДХМ, предпочтительно заменять этот растворитель на МТБЭ (метил-трет-бутиловый эфир), этилацетат или смесь МТБЭ и этилацетата. Особенно предпочтительным является МТБЭ.
В контексте настоящего изобретения предпочтительные экстрагирующие реагенты выбраны из группы, включающей воду, предпочтительно содержащую по меньшей мере одну подходящую соль, органические простые эфиры, органические сложные эфиры и смесь двух или большего количества из них, где указанная соль предпочтительно выбрана из группы, включающей хлорид натрия, гидрокарбонат натрия и хлорид аммония. Более предпочтительным экстрагирующим реагентом является вода, содержащая по меньшей мере одну подходящую соль, предпочтительно содержащая одну подходящую соль, более предпочтительно содержащая хлорид натрия. Применительно к количеству соли, содержащейся в воде, типичными вариантами осуществления являются водные растворы, содержащие от 10 до 30 мас.% соли.
Кроме того, можно соответствующим образом кристаллизовать соединения формулы (II), полученные на стадии (3). На кристаллизацию не налагают специальных ограничений при условии, что кристаллизуется по меньшей мере часть соединения формулы (II).
Поэтому настоящее изобретение также относится к самому необязательно кристаллическому соединению формулы (II)
,
в которой Y обозначает необязательно замещенный арильный фрагмент, предпочтительно необязательно замещенный фенильный фрагмент, более предпочтительно незамещенный фенил, где предпочтительно не менее 95%, более предпочтительно не менее 97%, еще более предпочтительно не менее 99% молекул указанного необязательно кристаллического соединения находятся в виде изомера формулы (IIa)
.
В частности, настоящее изобретение относится к необязательно кристаллическому соединению формулы (II), в которой Y = фенил, где не менее 99% молекул указанного необязательно кристаллического соединения находятся в виде изомера формулы (IIb)
.
Преимуществом способа, предлагаемого в настоящем изобретении, явно является тот факт, что стадии (1), (2), и (3) можно провести в одном реакционном сосуде. Не требуется сложный перенос реакционных смесей, что, в частности, позволяет упростить крупномасштабное производство.
Стадия (4)
Как отмечено выше, в качестве экстрагирующего реагента можно использовать водный раствор соли. Поэтому до последующей стадии реакции может потребоваться удаление оставшейся воды из смеси, полученной жидкостной экстракции. Для такого удаления воды в контексте настоящего изобретения можно использовать по меньшей мере одно молекулярное сито. Характеристики пор по меньшей мере одного молекулярного сита можно адаптировать в соответствии с конкретными требованиями. Однако являются предпочтительными такие сита, которые обладают диаметрами пор, определенными в соответствии со стандартом DIN 66131, находящимися в диапазоне от 0,3 до 0,5 нм (от 3 до 5 Å), предпочтительно от 0,35 до 0,45 нм (от 3,5 до 4,5 Å), и диаметр пор, равный примерно 0,4 нм (4 Å) является особенно предпочтительным. Содержание воды в полученных смесях наиболее предпочтительно составляет не менее 0,1 мас.%, более предпочтительно не менее 0,05 мас.%.
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (II), предпочтительно содержащееся в растворителе, указанном выше, еще более предпочтительно после указанной выше замены растворителя, предпочтительно содержащееся в МТБЭ и необязательно после удаления оставшихся следов воды вводят в реакцию на стадии (4) с силилирующим реагентом. Таким образом, растворителем, использующимся для этой реакции, наиболее предпочтительно является МТБЭ. По этой реакции на стадии (4) получают соединение формулы (III)
в которой остатки Raa, Rbb и Rcc могут быть одинаковыми или разными и предпочтительно представляют собой алкильные или арильные остатки, более предпочтительно алкильные остатки, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, более предпочтительно 1 или 2 атома углерода.
Термин "арильный остаток" при использовании в контексте настоящего изобретения означает карбоциклическую ароматическую группу, такую как фенил или нафтил и т.п. Термин "алкильный остаток" при использовании в контексте настоящего изобретения означает линейные или разветвленные алкильные фрагменты, которые предпочтительно содержат 1, 2, 3, 4, 5 или 6 атомов углерода. Предпочтительно, если остатки Raa, Rbb и Rcc могут быть одинаковыми или разными и представляют собой алкильные остатки. Более предпочтительно, если алкильные остатки содержат 1, 2, 3 или 4 атомов углерода, такие как метил, этил, пропил или бутил. Более предпочтительно, если алкильные остатки содержат 1 или 2 атома углерода. Еще более предпочтительно, если остатки Raa, Rbb и Rcc являются одинаковыми, предпочтительно представляют собой метил.
На сами силилирующие реагенты не налагают специальных ограничений при условии, что по меньшей мере часть соединения формулы (II) силилируют с получением соединения формулы (III). В наиболее предпочтительных вариантах осуществления настоящего изобретения, в которых Raa, Rbb и Rcc обозначают метил, наиболее предпочтительным силилирующим реагентом является гексаметилдисилазан, триметилхлорсилан, бис-триметилсилилацетамид или смесь двух или трех из этих соединений, предпочтительно бис-триметилсилилацетамид.
Температура, при которой проводят реакцию на стадии (4), зависит главным образом от конкретной природы соединений формулы (III), от конкретной природы силилирующего реагента и/или растворителя. Предпочтительные температуры в контексте настоящего изобретения находятся в диапазоне от 15 до 70°C.
Из полученной реакционной смеси, можно соответствующим образом кристаллизовать соединение формулы (III), полученное на стадии (4). На кристаллизацию не налагают специальных ограничений при условии, что кристаллизуется по меньшей мере часть соединения формулы (III).
Поэтому настоящее изобретение также относится к самому соединению формулы (III)
,
которое в возможном варианте осуществления может быть по меньшей мере частично кристаллическим, в которой Y обозначает необязательно замещенный арильный фрагмент, предпочтительно необязательно замещенный фенильный фрагмент, более предпочтительно незамещенный фенил, в которой остатки Raa, Rbb и Rcc могут быть одинаковыми или разными и предпочтительно представляют собой алкильные или арильные остатки, более предпочтительно алкильные остатки, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, более предпочтительно 1 или 2 атома углерода, предпочтительно метил, где предпочтительно не менее 95%, более предпочтительно не менее 97%, более предпочтительно не менее 99% молекул указанного хирального соединения находятся в виде изомера формулы (IIIa)
.
В частности, настоящее изобретение относится к соединению формулы (III), в которой Y = фенил, которое в возможном варианте осуществления может быть по меньшей мере частично кристаллическим, где не менее 99% молекул указанного необязательно кристаллического соединения находятся в виде изомера формулы (IIIb)
.
Как отмечено выше, на стадии (4) настоящего изобретения соединение формулы (III) получают содержащимся в растворителе, которым наиболее предпочтительно является МТБЭ. В этом варианте осуществления соединение формулы (III) не кристаллизуют. В особенно предпочтительном варианте осуществления настоящего изобретения эту реакционную смесь без дополнительной очистки направляют на дополнительную стадию (5), которая подробно описана ниже в настоящем изобретении.
Поэтому настоящее изобретение также относится к описанному выше способу, в котором после стадии (4) соединение формулы (III) не выделяют из реакционной смеси, полученной на стадии (4), до реакции с нуклеофильным соединением на стадии (5).
Стадия (5)
На этой предпочтительной стадии (5) настоящего изобретения соединение формулы (III) вводят в реакцию с нуклеофильным соединением, содержащим нуклеофильный остаток R1, в растворителе с получением соединения формулы (IV)
.
В альтернативном возможном способе, предлагаемом в настоящем изобретении, и соединение формулы (II), как это подробно описано выше в настоящем изобретении, можно ввести в реакцию с нуклеофильным соединением, содержащим нуклеофильный остаток R1, в растворителе с получением соединения формулы (IV)
.
В альтернативном возможном способе, необязательно можно проводить стадию (4) настоящего изобретения.
На нуклеофильное соединение, содержащее нуклеофильный остаток R1, не налагают специальных ограничений при условии, что реакция этого нуклеофильного соединения с соединением формулы (III) или с соединением формулы (II) позволяет получить соединение формулы (IV), этим нуклеофильным соединением предпочтительно является соединение Гриньяра R1MgX, в котором X предпочтительно выбран из группы, включающей Cl, Br и I. Предпочтительно, если R1 представляет собой линейный или разветвленный алкильный остаток, который предпочтительно содержит от 1 до 6 атомов углерода, а именно, 1, 2, 3, 4, 5 или 6 атомов углерода, еще более предпочтительно от 1 до 4 атомов углерода, а именно, 1, 2, 3, или 4 атома углерода, еще более предпочтительно 1 или 2 атома углерода, еще более предпочтительно 2 атома углерода.
Поэтому в особенно предпочтительном варианте осуществления настоящего изобретения нуклеофильное соединение, содержащее нуклеофильный остаток R1, представляет собой соединение Гриньяра CH3CH2MgX, в котором X выбран из группы, включающей Cl, Br и I. Предпочтительно, если нуклеофильным соединением, содержащим нуклеофильный остаток R1, является CH3CH2MgCl.
Растворитель или растворители, которые используют для проведения реакции на стадии (5) настоящего изобретения, можно выбрать соответствующим требованиям конкретной природы соединения формулы (III) или соединения формулы (II) и конкретной природы нуклеофильного соединения. Предпочтительно, если растворителем, использующимся в реакции на стадии (5) настоящего изобретения, является толуол или по меньшей мере один простой эфир, где простой эфир предпочтительно выбран из группы, включающей тетрагидрофуран (ТГФ), МТБЭ и смесь ТГФ и МТБЭ.
Температура, при которой проводят реакцию на стадии (5), зависит главным образом от конкретной