Триплетный антиген treponema pallidum
Иллюстрации
Показать всеИзобретение относится к биохимии. Описана конструкция триплетного антигена Treponema pallidum, которая включает три антигена к Treponema pallidum (TP15, TP17 и TP47), а также лидерную последовательность из десяти аминокислот (метка 261) и медь-цинк содержащую супероксиддисмутазу (hSOD) человека. Данная конструкция оптимизирована для диагностики сифилитической инфекции in vitro. Также описаны плазмиды, содержащие ДНК, кодирующую триплетный антиген, клетки-хозяева, способы получения, способы обнаружения и наборы. Изобретение расширяет арсенал средств и методов для определения сифилиса. 10 н. и 35 з.п. ф-лы, 19 ил., 8 табл., 4 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ЗАЯВКИ
Настоящая заявка испрашивает преимущество по предварительной заявке на патент США № 61/432570, поданной 13 января 2011 г.
ИСПОЛЬЗОВАНИЕ В ДАННОМ ИССЛЕДОВАНИИ ФЕДЕРАЛЬНОГО ФИНАНСИРОВАНИЯ
Не применимо.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области рекомбинантных антигенов, и в частности к конструкции триплетного антигена Treponema pallidum, и его применению в иммунологических анализах для определения сифилиса.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
За последние полвека благодаря эффективным схемам лечения антибиотиками сифилис стал сравнительно редким заболеванием в США, при этом в 2003 г. было диагностировано менее 7100 первичных и вторичных случаев. Однако последние данные показывают, что число регистрируемых случаев в некоторых группах населения снова растет, и в течение десятилетий наблюдались периодические вспышки эпидемий сифилиса. Число новых случаев заболевания сифилисом в мире в 1995 г. по оценкам достигло 12 млн. в год. Без лечения сифилис может развиваться от первичных поражений (шанкры) до диссеминированных, хронических инфекций, включая вторичные, латентные и третичные формы.
Поскольку сифилитическая инфекция у людей проявляется в широком диапазоне различных симптомов, для точной постановки диагноза инфекции часто требуются лабораторные тесты. Из-за невозможности культивировать патогенный микроорганизм, Treponema pallidum (T. pallidum) (TP), in vitro существует потребность в разработке и оптимизации способов для определения T. pallidum in vitro в различных клинических образцах [Morse, Salud Publica Mex 5 (Suppl 45): 698-708, 2003 г.]. Хотя на рынке доступны твердофазные иммуноферментные анализы (ИФА) для Treponema, они демонстрируют разную эффективность на разных стадиях заболевания [Schmidt et al., J Clin Microbiol 38: 1279-1282 (2000 г.)]. Было разработано несколько вариантов ИФА на основе цельноклеточного лизата, которые обеспечивали чувствительность от 93,3% до 100% и специфичность от 95,5% до 99,8% [Castro et al., J Clin Microbiol 41: 250-253 (2003 г.)].
В последнее время у пациентов, страдающих сифилисом, а также у младенцев с врожденным сифилисом были идентифицированы несколько иммунодоминантных и предположительно патоген-специфичных мембранных липопротеинов T. pallidum. У данных пациентов и младенцев вырабатывались антиген-специфичные антитела, которые можно было обнаружить иммуноблоттингом и иммуноферментным анализом. Следовательно, в современных способах обнаружения в тестах ИФА с Treponema применяют рекомбинантные антигены, главным образом интегрированные мембранные белки 47 кДа, 17 кДа и 15 кДа (TP47, TP17 и TP15 соответственно). Хотя TP47 был идентифицирован самым первым, а также присутствует в наибольших количествах и является высоко иммуногенным [Norgard et al., Infect Immun 54: 500-506 (1986 г.)], идентифицированные позже TP15 и TP17, которые присутствуют в меньших количествах, также являются сильно иммуногенными [Purcell et al., Infect Immun 57: 3708-3714 (1989 г.); Akins et al., Infect Immun 61: 1202-1210 (1993 г.)].
В условиях роста регистрируемых случаев сифилиса и периодических эпидемий, а также с учетом степени тяжести заболевания сохраняется потребность в чувствительных и специфичных методах иммуноанализа для обнаружения Treponema pallidum.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В данных целях настоящее изобретение представляет рекомбинантную плазмиду, кодирующую триплетный антиген Treponema pallidum. Плазмида представляет собой нуклеиновую кислоту, кодирующую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12.
Настоящее изобретение дополнительно представляет рекомбинантную плазмиду, кодирующую триплетный антиген Treponema pallidum и выбранную из группы, состоящей из: плазмиды, обозначенной p261nS-TP17-15-47 и депонированной в Американской коллекции типовых культур (ATCC) с № доступа ATCC PTA-11590 12 января 2011 г.; плазмиды, обозначенной p261nS-TP47-17-15 и депонированной в Американской коллекции типовых культур с № доступа ATCC PTA-11589 12 января 2011 г.; плазмиды, обозначенной p261nS-TP17-47-15; плазмиды, обозначенной p261nS-TP47-15-17; плазмиды, обозначенной p261nS-TP15-17-47; и плазмиды, обозначенной p261nS-TP15-47-17.
Также представлены данные о векторах, клетках-хозяевах и способы получения триплетного антигена с использованием клеток-хозяев.
Кроме того, настоящее изобретение представляет триплетный антиген Treponema pallidum с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12. Также дополнительно представлен способ обнаружения присутствия антител Treponema pallidum в образце, в котором используется триплетный антиген Treponema pallidum, а также наборы для такого обнаружения.
Дополнительные особенности и преимущества настоящего изобретения будут очевидны из следующего описания при рассмотрении в совокупности с приложенными фигурами.
КРАТКОЕ ОПИСАНИЕ ФИГУР
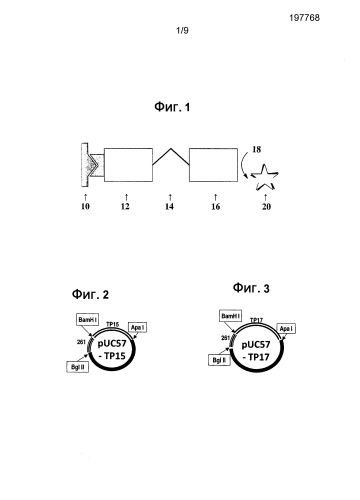
На фиг. 1 представлена схема реакции при проведении теста VITROS® Syphilis TPA.
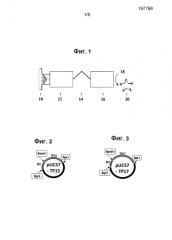
На фиг. 2 представлена карта плазмиды pUC57-TP15.
На фиг. 3 представлена карта плазмиды pUC57-TP17.
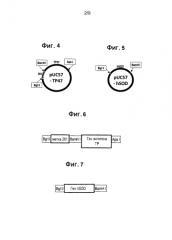
На фиг. 4 представлена карта плазмиды pUC57-TP47.
На фиг. 5 представлена карта плазмиды pUC57-hSOD.
На фиг. 6 представлена конструкция TP для клонирования в pB10G.
На фиг. 7 представлена конструкция hSOD для клонирования в плазмиду триплета pB10G.
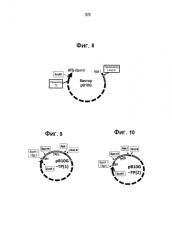
На фиг. 8 представлена карта плазмиды pB10G.
На фиг. 9 представлена карта плазмиды pB10G-TP(1).
На фиг. 10 представлена карта плазмиды pB10G-TP(2).
На фиг. 11 представлена карта плазмиды pB10G-TP(3).
На фиг. 12 представлена конструкция TP(1) для клонирования в pB10G-TP(2).
На фиг. 13 представлена карта плазмиды pB10G-TP(1-2).
На фиг. 14 представлена конструкция TP(3) для клонирования в pB10G-TP(1-2).
На фиг. 15 представлена карта плазмиды pB10G-TP(1-2-3).
На фиг. 16 представлена карта плазмиды pB10G-TP(1-2-3) с уникальным сайтом рестрикционного фермента.
На фиг. 17 представлена карта плазмиды p261nS-TP(1-2-3).
На фиг. 18 представлен прямой формат анализа в соответствии с настоящим изобретением.
На фиг. 19 представлен непрямой формат анализа в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В процедуре анализа (способ обнаружения) настоящего изобретения используются рекомбинантные антигены внешних мембранных белков Treponema pallidum (TP) (возбудитель сифилиса) для обнаружения антител анти-IgG, анти-IgM и анти-IgA в образце пациента. Рассматриваемые рекомбинантные белковые антигены представляют собой антиген с молекулярной массой 15 килодальтон (TP15), антиген с молекулярной массой 17 килодальтон (TP17) и антиген с молекулярной массой 47 килодальтон (TP47). Была разработана слитая конструкция рекомбинантного антигена, которая содержит три рассматриваемых антигена, а также человеческую медь-цинк супероксиддисмутазу (hSOD). Кроме последовательностей антигена Treponema pallidum и hSOD на N-конце слитой конструкции антигена присутствует метка из 10 аминокислот («последовательность 261»), чтобы была возможность проводить определение с помощью вестерн-блоттинга и ИФА, а также при необходимости обеспечить возможность аффинной очистки. При анализе в соответствии с настоящим изобретением используется данная слитая конструкция рекомбинантного антигена.
В одном варианте осуществления для анализа используется тест VITROS® Syphilis TPA, и анализ проводится с использованием иммунодиагностической системы VITROS® ECi/ECiQ, иммунодиагностической системы VITROS® 3600 или интегрированной системы VITROS® 5600 с применением технологии Intellicheck®. Каждый из данных анализаторов доступен в продаже от компании Ortho-Clinical Diagnostics, Inc., 100 Indigo Creek Drive, Rochester, NY, 14626. Используется методика количественного иммуноанализа, которая включает взаимодействие антител IgG, IgM или IgA, присутствующих в образце, с биотинилированным рекомбинантным антигеном TP и конъюгатом рекомбинантного антигена ТР, меченным пероксидазой хрена (HRP). Комплекс антитело-антиген фиксируется стрептавидином на лунках (лунки SAC). Несвязанные материалы удаляются промыванием. Связанный HRP-конъюгат измеряют по люминесцентной реакции. В лунки добавляют реагент, содержащий люминогенный субстрат (производное люминола и соль надкислоты), и переносчик электронов. HRP в связанном конъюгате катализирует окисление производного люминола, вызывая свечение. Переносчик электронов (замещенный ацетанилид) увеличивает интенсивность испускаемого света и делает свечение более продолжительным. Световые сигналы считывают системой анализатора. Концентрация связанного HRP-конъюгата прямо пропорциональна концентрации присутствующих антител анти-ТР. Схема данной реакции представлена на фиг. 1, где 10 - лунка, покрытая стрептавидином, 12 - биотинилированный антиген ТР, 14 - антитела к антигенам ТР, присутствующим в образце, 16 - антиген ТР, меченный HRP, 18 - сигнальный реагент с усилителем, и 20 - люминесценция. В составе аналитического биотинового реагента присутствует супероксиддисмутаза для блокирования связывания антител анти-SOD, которые могут присутствовать в образце, взятом у пациента. Это позволяет исключить образование ложных реакционных сигналов.
Настоящее изобретение представляет рекомбинантную плазмиду, кодирующую триплетный антиген Treponema pallidum. Плазмида представляет собой нуклеиновую кислоту, кодирующую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12.
В одном варианте осуществления плазмида обозначается p261nS-TP17-15-47 и депонирована в Американской коллекции типовых культур (ATCC) с № доступа ATCC PTA-11590. Плазмида p261nS-TP17-15-47 включает нуклеиновую кислоту с нуклеотидной последовательностью, представленной в SEQ ID NO:3, кодирующей конструкцию триплетного антигена с аминокислотной последовательностью, представленной в SEQ ID NO:9. В данном конкретном варианте осуществления аминокислоты 5-14 кодируют метку 261, аминокислоты 17-150 кодируют TP17, аминокислоты 155-277 кодируют TP15, аминокислоты 282-695 кодируют TP47 и аминокислоты 697-849 кодируют hSOD.
В другом варианте осуществления плазмида обозначается p261nS-ТР47-17-15 и депонирована в Американской коллекции типовых культур с № доступа ATCC PTA-11589. Плазмида p261nS-ТР47-17-15 включает нуклеиновую кислоту с нуклеотидной последовательностью, представленной в SEQ ID NO:6, кодирующей конструкцию триплетного антигена с аминокислотной последовательностью, представленной в SEQ ID NO:12. В данном конкретном варианте осуществления аминокислоты 5-14 кодируют метку 261, аминокислоты 17-430 кодируют TP47, аминокислоты 435-568 кодируют TP17, аминокислоты 573-695 кодируют TP15 и аминокислоты 697-849 кодируют hSOD.
В дополнительном варианте осуществления плазмида обозначается p261nS-TP17-47-15. Плазмида p261nS-TP17-47-15 включает нуклеиновую кислоту с нуклеотидной последовательностью, представленной в SEQ ID NO:4, кодирующей конструкцию триплетного антигена с аминокислотной последовательностью, представленной в SEQ ID NO:10. В данном конкретном варианте осуществления аминокислоты 5-14 кодируют метку 261, аминокислоты 17-150 кодируют TP17, аминокислоты 155-568 кодируют TP47, аминокислоты 571-693 кодируют TP15 и аминокислоты 695-847 кодируют hSOD.
В еще одном варианте осуществления плазмида обозначается p261nS-TP47-15-17. Плазмида p261nS-ТР47-15-17 включает нуклеиновую кислоту с нуклеотидной последовательностью, представленной в SEQ ID NO:5, кодирующей конструкцию триплетного антигена с аминокислотной последовательностью, представленной в SEQ ID NO:11. В данном конкретном варианте осуществления аминокислоты 5-14 кодируют метку 261, аминокислоты 17-430 кодируют TP47, аминокислоты 435-557 кодируют TP15, аминокислоты 560-693 кодируют TP17 и аминокислоты 695-847 кодируют hSOD.
В дополнительном варианте осуществления плазмида обозначается p261nS-TP15-17-47. Плазмида p261nS-ТР15-17-47 включает нуклеиновую кислоту с нуклеотидной последовательностью, представленной в SEQ ID NO:1, кодирующей конструкцию триплетного антигена с аминокислотной последовательностью, представленной в SEQ ID NO:7. В данном конкретном варианте осуществления аминокислоты 5-14 кодируют метку 261, аминокислоты 17-139 кодируют TP15, аминокислоты 143-276 кодируют TP17, аминокислоты 281-694 кодируют TP47 и аминокислоты 696-848 кодируют hSOD.
В другом дополнительном варианте осуществления плазмида обозначается p261nS-TP15-47-17. Плазмида p261nS-ТР15-47-17 включает нуклеиновую кислоту с нуклеотидной последовательностью, представленной в SEQ ID NO:2, кодирующей конструкцию триплетного антигена с аминокислотной последовательностью, представленной в SEQ ID NO:8. В данном конкретном варианте осуществления аминокислоты 5-14 кодируют метку 261, аминокислоты 17-139 кодируют TP15, аминокислоты 143-556 кодируют TP47, аминокислоты 559-692 кодируют TP17 и аминокислоты 694-846 кодируют hSOD.
ATCC размещена по адресу 10801 University Boulevard, Manassas, Virginia 20110-2209 USA, и каждая из представленных выше депонированных плазмид была приготовлена 12 января 2011 г. в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры («Будапештский договор»).
Каждая конструкция триплетного антигена Treponema pallidum включает три антигена Treponema pallidum (TP15, TP17 и TP47). Хотя каждая из них образуется своей аминокислотной последовательностью, а также нуклеотидной последовательностью, специалистам в данной области должно быть очевидно, что добавления, делеции и/или замещения нуклеотидов, такие, которые не влияют на трансляцию молекулы ДНК, входят в объем конкретной нуклеотидной последовательности (т.е. кодируемая аминокислотная последовательность при этом остается неизменной). Такие добавления, делеции и/или замещения могут быть, например, результатом точечных мутаций, проводимых в соответствии со способами, известными специалистам в данной области. Можно также проводить замены нуклеотида, который меняет кодируемую при этом аминокислотную последовательность, где замещенная аминокислота представляет собой консервативную замену или не меняет гомологии аминокислот. Можно также производить незначительные добавления, делеции и/или замещения нуклеотидов, которые не меняют функцию полученного триплета (т.е. его способность обнаруживать антитела анти-TP15, анти-TP17 и/или анти-TP47).
Добавления, делеции и/или замещения аминокислот, которые не сводят к нулю способность полученного триплета обнаруживать антитела анти-TP15, анти-TP17 и/или анти-TP47, таким образом, входят в объем конкретной аминокислотной последовательности. Такие добавления, делеции и/или замещения могут быть, например, следствием точечных мутаций в ДНК, кодирующей аминокислотную последовательность, например, таких точечных мутаций, которые проводятся в соответствии со способами, известными специалистам в данной области. Замены аминокислот могут быть консервативными. Два аминокислотных остатка рассматриваются в качестве консервативных замен друг друга, например, если два остатка относятся к одному типу. С данной точки зрения пролин, аланин, глицин, серин и треонин, все из которых являются нейтральными, слабо гидрофобными остатками, относятся к одному типу. Глутамин, глутаминовая кислота, аспарагин и аспарагиновая кислота, все из которых являются кислыми, гидрофильными остатками, относятся к одному типу. Другой тип остатка представляет собой основной, гидрофильный аминокислотный остаток, который включает гистидин, лизин и аргинин. Лейцин, изолейцин, валин и метионин, все из которых являются гидрофобными, алифатическими аминокислотными остатками, образуют еще один тип остатков. Еще один тип остатков состоит из фенилаланина, тирозина и триптофана, все из которых являются гидрофобными, ароматическими остатками. Дополнительное описание концепции консервативных замещений представлено в работах French и Robson [J Molecular Evolution 19: 171-175 (1983 г.)], Taylor [J Theor Biol 119: 205-218 (1986 г.)], а также Bordo и Argos [J Mol Biol 217: 721-729 (1991 г.)].
Хотя в данном случае предпочтительная векторная система для нуклеиновой кислоты, кодирующей конструкцию триплетного антигена, представляет собой плазмидный вектор, могут также использоваться другие векторные системы. Более того, хотя в данном случае предпочтительная клетка-хозяин для экспрессии конструкции триплетного антигена представляет собой бактериальную клетку-хозяина Escherichia coli, для экспрессии конструкции триплетного антигена может использоваться любая подходящая клетка-хозяин и/или векторная система. Можно применять другие подходящие бактериальные клетки-хозяева, дрожжевые клетки-хозяева (например, Saccharomyces cerevisiae), а также клетки-хозяева млекопитающих (например, клетки Hela, клетки Cv-1, клетки COS) и насекомых (например, клеточные линии Drosophila).
Методики введения молекул нуклеиновой кислоты в клетки-хозяева могут опираться на применение векторов экспрессии, которые содержат молекулы нуклеиновой кислоты. Данные векторы экспрессии (например, плазмиды и вирусы; причем вирусы включают бактериофаги) могут затем применяться для введения молекул нуклеиновой кислоты в подходящие клетки-хозяева. Например, ДНК, кодирующая триплетный антиген, может вводиться в ядро клетки-хозяина или трансформироваться в клетку-хозяина с помощью подходящего вектора, или же мРНК, кодирующая триплетный антиген, может вводиться непосредственно в клетку-хозяина, чтобы обеспечить экспрессию триплетного антигена в клетке-хозяине.
Специалистам в данной области известны различные способы введения молекул нуклеиновых кислот в клетки-хозяева. Один способ представляет собой микроинъекцию, при которой ДНК вводят непосредственно в ядро клеток через тонкие стеклянные иголки (или РНК вводят непосредственно в цитоплазму клеток). В альтернативном варианте осуществления ДНК можно инкубировать с инертным углеводным полимером (декстран), с которым связана положительно заряженная химическая группа (DEAE, диэтиламиноэтил). ДНК связывается с DEAE-декстраном за счет своих отрицательно заряженных фосфатных групп. Данные крупные частицы, содержащие ДНК, фиксируются на поверхности клеток, которые предположительно захватывают их в ходе процесса, называемого эндоцитозом. Части ДНК удается избежать распада в цитоплазме клетки и попасть в ядро, где она может транскрибироваться в РНК подобно любому другому гену в клетке. В другом способе клетки эффективно захватывают ДНК в форме осадка с фосфатом кальция. В ходе электропорации клетки помещают в раствор, содержащий ДНК, и подвергают воздействию короткого электрического импульса, что приводит к кратковременному открытию отверстий в их мембранах. ДНК проходит через отверстия непосредственно в цитоплазму, минуя эндоцитозные везикулы, посредством которых она попадает в клетку при использовании DEAE-декстрана и фосфата кальция (прохождение данных везикул может иногда приводить к уничтожению или разрушению ДНК). ДНК также может включаться в искусственные липидные везикулы, липосомы, которые закрепляются на клеточной мембране и доставляют свое содержимое непосредственно в цитоплазму. В рамках еще более прямого подхода с использованием, главным образом, клеток и тканей растений ДНК абсорбируется на поверхности микроснарядов из вольфрама и доставляется в клетки с помощью устройства, напоминающего ружье.
Дополнительные способы введения молекул нуклеиновой кислоты в клетки предусматривают применение вирусных векторов. Поскольку развитие вирусов зависит от возможности доставки вирусного генома в клетки, для этой цели у вирусов была выработана продуманная и эффективная система способов. Один такой вирус, широко применяемый при продукции белка, представляет собой вирус насекомых, бакуловирус. Бакуловирус привлек внимание исследователей, поскольку в процессе инфицирования он вырабатывает впечатляющие уровни одного из своих структурных белков (белка оболочки). Если такой вирусный ген будет замещен чуждым геном, он тоже будет отличаться высокими уровнями продукции. Бакуловирус, как и осповакцина, также является очень большим, и, следовательно, чуждые гены необходимо вносить в вирусный геном с помощью рекомбинантных технологий. Для экспрессии чуждого гена в бакуловирусе рассматриваемый ген клонируют на месте гена белка оболочки вируса в плазмиде, несущей небольшую часть вирусного генома. Рекомбинантная плазмида котрансфектируется в клетки насекомых вместе с ДНК бакуловируса дикого типа. При низкой частоте плазмида и вирусные ДНК рекомбинируются посредством гомологичных последовательностей, что приводит к вставке чуждого гена в вирусный геном. Образуются вирусные бляшки, причем бляшки с рекомбинантным вирусом отличаются внешне, поскольку не содержат белок оболочки. Бляшки с рекомбинантным вирусом отбирают и культивируют. Данный вирусный материал затем применяют для инфицирования свежей культуры клеток насекомых, что приводит к высокому уровню экспрессии чуждого белка. Обзор по векторам бакуловируса представлен в работе Miller [Bioessays 11: 91-95 (1989 г.)]. Для трансформации клеток млекопитающих также применяют различные вирусные векторы, такие как бактериофаг, вирус осповакцины, аденовирус и ретровирус.
Как указано выше, некоторые из данных способов трансформации клетки требуют применения промежуточного плазмидного вектора. В патенте США № 4237224, выданном Cohen и Boyer, описано получение экспрессирующих систем в форме рекомбинантных плазмид с использованием расщепления рестрикционным ферментом и сшивания ДНК-лигазой. Затем данные рекомбинантные плазмиды вводят посредством трансформации и реплицируют в моноклеточных культурах, включая прокариотные организмы и эукариотные клетки, выращиваемые в тканевой культуре. Последовательности ДНК клонируют в плазмидный вектор с использованием стандартных процедур клонирования, известных специалистам в данной области, как описано в работе Sambrook et al. [Molecular Cloning: A Laboratory Manual, 2-е изд., Cold Spring Harbor Laboratory Press, Колд-Спринг-Харбор, штат Нью-Йорк (1989 г.)].
Клетки-хозяева, в которые введена нуклеиновая кислота, кодирующая триплетный антиген, можно использовать для продукции (т.е. функциональной экспрессии) триплетного антигена.
Настоящее изобретение дополнительно представляет триплетный антиген Treponema pallidum с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12. В настоящее время предпочтительные варианты осуществления триплетного антигена представляют собой такие варианты, которые представлены последовательностями SEQ ID NO:9 и SEQ ID NO:12. В данных вариантах осуществления часть TP17 триплета предшествует части TP15 триплета, и с помощью данных конструкций достигается более высокая чувствительность к обнаружению антител. Все конструкции включают лидерную последовательность (в настоящее время предпочтительно использовать лидерную последовательность из десяти аминокислот (метка 261), хотя они могут быть замещены другими подходящими лидерными последовательностями). Все конструкции на карбоксильном конце дополнительно включают медь-цинк содержащую супероксиддисмутазу (hSOD) человека, белок с низкой иммуногенностью. Одиннадцать лизиновых остатков в hSOD обеспечивают сайты для связывания биотина и конъюгации HRP, и два цистеиновых остатка мутируют в серин (Cys 4 и Cys 112) для предотвращения межцепной полимеризации белка [Hallewel et al., J Biol Chem 264: 5260-5268 (1989 г.)]. Таким образом, данная конструкция оптимизируется для диагностики сифилитической инфекции in vitro. Могут использоваться и другие подходящие белки с низкой иммуногенностью, которые обеспечивают аналогичные сайты для связывания биотина и конъюгации HRP. В предпочтительной в настоящее время конструкции плазмиды триплетный антиген контролируется промотором T5.
Хотя конкретные детали анализа для обнаружения присутствия антител Treponema pallidum в образце раскрыты ниже, по существу способ включает: приведение образца в контакт с триплетным антигеном Treponema pallidum, составляющим предмет настоящего изобретения, причем антитела Treponema pallidum, присутствующие в образце, связываются с триплетным антигеном Treponema pallidum с образованием комплекса антитело/антиген; и обнаружение комплекса антитело/антиген, чем осуществляется обнаружение присутствия антител Treponema pallidum. Для применения в формате анализа для обнаружения антител к Treponema pallidum триплетный антиген может быть помечен обнаруживаемым маркером. Подходящие маркеры включают, например, ферментативные метки, такие как пероксидаза хрена или щелочная фосфатаза, а также флуоресцентные метки (такие как флуоресцеин, родамин и зеленый флуоресцентный белок).
В формате анализа также могут использоваться биотин/авидин/стрептавидин, чтобы получить триплетный антиген, связанный с твердой фазой. Подходящие твердые фазы включают, например, любые неводные матрицы, с которыми может связываться триплетный антиген. Такие твердые фазы хорошо известны специалистам в области иммуноанализа и включают, например, полистирольные пластинки, полиакриламиды, стекло, полисахариды, поливиниловый спирт и силиконы. В иммуноанализах в качестве твердых фаз применяют предметные стекла, микролунки и микронаконечники.
Формат анализа может включать прямое обнаружение комплекса антитело/антиген (см. фиг. 18), которое может включать: приведение комплекса антитело/антиген в контакт со вторым триплетным антигеном Treponema pallidum, составляющим предмет настоящего изобретения, причем второй триплетный антиген Treponema pallidum помечен обнаруживаемым маркером (представленным как HRP). Второй триплетный антиген Treponema pallidum связывается с антителом, присутствующим в комплексе антитело/антиген, с образованием комплекса антиген/антитело/меченый антиген, который затем обнаруживается, чем осуществляется обнаружение присутствия антител Treponema pallidum в образце.
Формат анализа может включать непрямое обнаружение комплекса антитело/антиген (см. фиг. 19), которое может включать: приведение комплекса антитело/антиген в контакт с меченым антителом к иммуноглобулину человека (показанным как моноклональное мышиное антитело к иммуноглобулину человека). Меченое антитело к иммуноглобулину человека связывается с антителом, присутствующим в комплексе антитело/антиген, с образованием комплекса антиген/антитело/меченое анти-антитело, который затем обнаруживается, чем осуществляется обнаружение присутствия антител Treponema pallidum в образце.
Для всех анализов, составляющих предмет настоящего изобретения, образец может представлять собой любой подходящий образец (например, сыворотку, плазму и ЭДТА или гепариновую плазму), но предпочтительно представляет собой образец сыворотки.
Конструкция триплетного антигена Treponema pallidum, составляющего предмет настоящего изобретения, таким образом, может использоваться в качестве компонента набора для определения антител Treponema pallidum. Предлагается набор, который содержит конструкцию триплетного антигена Treponema pallidum, а также дополнительно конструкцию второго триплетного антигена Treponema pallidum, меченную обнаруживаемым маркером («ферментативный конъюгат», такой как меченный HRP триплетный антиген Treponema pallidum) (см. выше описание маркеров). Набор также может содержать подходящие положительный и/или отрицательный контроли, калибровочные образцы, ферментативные конъюгаты, субстраты для ферментативных конъюгатов (такие как О-фенилендиамин), буферный раствор и промывочный раствор.
Ниже представлена подробная информация о конструкции триплетного антигена и его применении в анализе для обнаружения антител Treponema pallidum в образце пациента.
Синтетические гены. Каждый из генов белка внешней мембраны T. pallidum TP15, TP17 и TP47 синтезировали на основе аминокислотной последовательности P16055 (аминокислоты 19-141), P29722 (аминокислоты 23-156) и P29723 (аминокислоты 21-434) соответственно, опубликованных в центральной базе данных UniProt (http://www.uniprot.org). Ген человеческой медь-цинк содержащей супероксиддисмутазы (hSOD) синтезировали на основе аминокислотной последовательности P00441 (аминокислоты 2-154) кроме мутации двух цистеиновых остатков (аминокислоты 7 и 112) в серин для предотвращения полимеризации. Все четыре синтезированных генетических кодона были оптимизированы для бактериальной экспрессии, и каждый вставляли в сайт EcoR V плазмиды-хозяина pUC57. Полученные плазмиды pUC57-15, pUC57-17, pUC57-45 и pUC57-hSOD представлены на фиг. 2-5 соответственно.
Четыре синтетических гена не содержат стоп-кодонов, и ниже представлено описание всех внутренних сайтов Apa I, BamH I, Bgl II, EcoR I и Hind III, которые использовали в последовательном субклонировании. В четыре синтетических гена включали сайты рестрикционного фермента, содержащие или не содержащие ген-метку (последовательность 261).
Вектор экспрессии и конструкция дублета TP. Каждый из генов TP из pUC57 расщепляли на Bgl II и Apa I (см. фиг. 6, где представлена полученная конструкция ТР) и по отдельности клонировали в сайты BamH I и Apa I ранее сконструированного вектора экспрессии, pB10G (см. фиг. 8), который содержал промотор T5, стартовый сайт ATG и уникальные сайты рестрикции EcoR I, BamH I, Apa I и Hind III. В результате получили три экспрессивных вектора: pB10G-TP15, pB10G-TP17 и pB10G-TP47 (в общем показаны как pB10G-TP(1), pB10G-TP(2) и pB10G-TP(3) на фиг. 9-11 соответственно). Лигирование совместимых концов Bgl II фрагментов генов и концов BamH I на плазмидах позволило удалить сайты рестрикционного фермента Bgl II/BamH I во всех трех конструкциях. Дублет TP получали субклонированием. Для конструирования субклона дублета TP (см. фиг. 13) с помощью реакции ПЦР получали вставку гена ДНК с помощью вектора экспрессии второго антигена в качестве матрицы и пары прямых и обратных праймеров. Прямой праймер распространяется на сайт EcoR I, размещенный в участке промотора T5 вверх от гена TP. Обратный праймер совмещен с концом гена ТР и трансформирует сайт Apa I в сайт Bgl II. Полученный продукт ПЦР затем расщепляли EcoR I/Bgl II (см. фиг. 12, где представлена полученная конструкция TP-1) и клонировали в другой вектор экспрессии антигена, который раскрывался с помощью EcoR I и BamH I. Аналогичным образом лигирование совместимого Bgl II на вставке и BamH I на хозяине позволяло удалять оба сайта рестрикционного фермента.
Конструкция триплета TP. Для получения шести конечных генов слитых триплетов в качестве хозяина использовали четыре дублетных вектора ТР: pB10G-TP17-TP47, pB10G-TP15-TP47, pB10G-TP47-TP15 и pB10G-TP17-TP15, а третий ген ТР добавляли либо к 5'-концу дублета ТР, либо добавляли к 3'-концу дублета TP. Двойной вектор TP(1-2) в общем показан на фиг. 13, и конструкция ТР(3) для вставки в дублетный вектор показана на фиг. 14. Для добавления вставки на 3'-конце с помощью реакции ПЦР получали вставку гена ДНК с помощью вектора экспрессии третьего антигена в качестве матрицы и пары прямых и обратных праймеров. Прямой праймер совмещался с 5'-концом гена ТР и содержал сайт Apa I. Обратный праймер совмещался с 3'-концом гена ТР и содержал сайт Hind III. Полученный продукт ПЦР затем расщепляли Apa I/Hind III и клонировали в дублетный вектор экспрессии, который раскрывали соответствующими рестрикционными ферментами. Триплеты pB10G-TP15-TP17-TP47, pB10G-TP17-TP15-TP47 и pB10G-TP47-TP17-TP15 получали добавлением третьего гена ТР к дублетному 5'-концу, тогда как триплеты pB10G-TP15-TP47-TP17, pB10G-TP47-TP15-TP17 и pB10G-TP17-TP47-TP15 получали добавлением третьего гена ТР к дублетному 3'-концу. Праймеры ПЦР, которые применяли для приготовления дублетов и триплетов, представлены в таблице 4 «Праймеры ПЦР», группа А. Данная триплетная конструкция в целом показана на фиг. 15.
Конструкция триплета TP со слитой SOD. Триплет ТР с С-концевой меткой слитой SOD (в целом показан на фиг. 17) получали посредством «двойной» ПЦР и клонирования. «Двойную ПЦР» проводили для связывания С-концевого ТР3 с SOD (см. фиг. 7, где представлена конструкция SOD) и введения сайтов рестрикционного фермента для клонирования. Первый цикл ПЦР состоял из двух отдельных ПЦР, причем обратный праймер (таблица 4 «Праймеры ПЦР», группа В) в одной ПЦР дополнялся прямым праймером (таблица 4 «Праймеры ПЦР», группа С) в другой ПЦР. Во втором цикле ПЦР два продукта первого цикла ПЦР объединяли и амплифицировали с третьим набором вложенных праймеров (таблица 4 «Праймеры ПЦР», группа D). Прямой праймер соответствовал последовательности ТР3 и содержал уникальный сайт рестрикционного фермента. Обратный праймер соответствовал 3'-концу SOD. Два стоп-кодона и сайт Hind III образовали новую вставку ДНК (см. фиг. 16). Для слияния гена SOD с существующим триплетом T. pallidum новый продукт ПЦР расщепляли и напрямую клонировали в плазмиду триплета pB10G-TP, которая расщеплялась по сконструированному уникальному сайту рестрикции и сайту Hind III с образованием pB10G-TP(1-2-3)-SOD (см. фиг. 17). Используемые в настоящем документе обозначения TP1, TP2 и TP3 соответствуют трем антигенам T. pallidum TP15, TP17 и TP47 в любом порядке. Таким образом, TP1 может представлять собой TP15, TP2 может представлять собой TP17, и TP3 может представлять собой TP47. Другие комбинации включают: TP1 может представлять собой TP15, TP2 может представлять собой TP47, и TP3 может представлять собой TP17; TP1 может представлять собой TP17, TP2 может представлять собой TP15, и TP3 может представлять собой TP47; TP1 может представлять собой TP17, TP2 может представлять собой TP47, и TP3 может представлять собой TP15; TP1 может представлять собой TP47, TP2 может представлять собой TP15, и TP3 может представлять собой TP17; и TP1 может представлять собой TP47, TP2 может представлять собой TP17, и TP3 может представлять собой TP15.
Все амплификации ПЦР проводили с помощью Taq-полимеразы с использованием стандартной последовательности 35 циклов ПЦР: 95°C (15 с), 55°C (20 с), 72°C (30 с). Нуклеотидные последовательности ПЦР-праймеров перечислены в таблице 4. Указано использование каждого праймера для получения конкретных триплетов. Все продукты ПЦР очищали в соответствии с протоколом набора Qiagen для ПЦР. Все рестрикционные ферменты приобретали у New England Biolabs. Плазмиды готовили с использованием наборов Qiagen DNA Miniprep. Все шесть участков, кодирующих триплеты, проходили ДНК-секвенирование (SEQ ID NO:1-6) с последующей трансляцией аминокислотных последовательностей (SEQ ID NO:7-12).
Анализ, составляющий предмет настоящего изобретения, предусматривает измерение антител к трем антигенам T. pallidum - TP15, TP17 и TP47. Анализ проводят на микропланшетах, предварительно покрытых антигеном. Образцы добавляют в лунки титрационного микропланшета и инкубируют. При присутствии специфичных антител T. pallidum IgG/IgM они будут связываться и иммобилизироваться на лунках, предварительно покрытых антигеном. Связанные антитела обнаруживают либо прямым сэндвич-форматом для конъюгированного антигена (см. фиг. 18), либо непрямым форматом по конъюгированному антителу к человеческому IgG и IgM (см. фиг. 19).
В частности, рекомбинантные триплеты ТР в качестве антигенной ловушки пассивно наносили на поверхность лунок планшета ИФА с высоким уровнем связывания. Затем планшет блокировали 1% BSA/ФСБ, чтобы покрыть все несвязанные поверхности лунок. В лунки добавляли сыворотку или плазму инфицированного сифилисом пациента и инкубировали в течение первого инкубационного периода, что позволяло антителам T. pallidum (IgG, IgM и IgA) в образце взаимодействовать с предварительно нанесенными триплетными антигенами. После первой инкубации несвязанные материалы смывали. В случае прямого анализа детектором был конъюгированный с HRP рекомбинантный триплет ТР, и его добавляли в лунки и инкубировали в течение второго инкубационного периода. После второй инкубации несвязанные триплетные конъюгаты смывали. Образованный комплекс антиген-человеческое антитело T. pallidum (IgG/IgM)-антиген измеряли при добавлении раствора субстрата пероксидазы, затем через 30 минут реакцию останавливали и для анализа регистрировали оптическую плотность. При непрямом анализе в качестве детектора выступала смесь конъюгированного с HRP мышиного моноклонального антитела к человеческому IgG и конъюгированного с HRP мышиного моноклонального антитела к человеческому IgM, и ее добавляли в лунки и инкубировали в течение второго инкубационного периода. После второй инкубации несвязанные конъюгаты смывали. Образованный комплекс антитело к человеческому IgG/IgM-человеческое антитело T. pallidum (IgG/IgM)-антиген измеряли при добавлении раствора субстрата пероксидазы, затем через 30 минут реакцию останавливали и для анализа регистрировали оптическую плотность.
Генетически сконструированный рекомбинантный триплет T. pallidum имеет лидерную последовательность из 10 аминокислот (метка 261) на N-конце и от двух до четырех аминокислотных линкеров между каждым антигеном TP. Последовательность метки 261 была получена из фактора роста плаценты человека (PlGF). Человеческую медь-цинк содержащую супероксиддисмутазу (hSOD) включают у С-конца триплетного антигена T. pallidum для образования слитого белка.
hSOD ранее использовали в различных рекомбинантных слитых антигенах для диагностических анализов инфекционных патогенов, таких как ВГС, ВИЧ