Стабильные водные композиции белка mia/cd-rap
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, в частности к стабильной водной композиции, содержащей примерно от 5 до 30 мг/мл белка CD-RAP и заряженную аминокислоту, имеющую суммарный заряд при рН приблизительно от 6 до 8, и набору для восстановления хряща, содержащему указанную композицию и инструкции для применения. Настоящее изобретение позволяет получать стабильные водные композиции белка CD-RAP, содержащие указанный белок в высокой концентрации, в которых при этом снижена агрегация полипептидов CD-RAP на протяжении длительного периода времени и при повторных циклах замораживания-оттаивания. Композиция по настоящему изобретению предназначена для применения в лечении воспалительных расстройств, предпочтительно остеоартрита. 2 н. и 8 з.п. ф-лы, 11 ил., 5 табл., 8 пр.
Реферат
Настоящее изобретение относится к стабильным водным композициям, содержащим по меньшей мере 5 мг/мл белка CD-RAP и заряженную аминокислоту, предпочтительно имеющую суммарный заряд при рН приблизительно от 6 до 8. Предпочтительно, ингредиенты композиции обеспечивают стабильность при повторных циклах замораживания-оттаивания. В предпочтительном аспекте композиция предназначена для применения в лечении, предпочтительно для применения в лечении воспалительных расстройств, предпочтительно остеоартрита. Кроме того, предложен набор, содержащий композицию по изобретению.
Белки используют для многих прикладных задач в области фармацевтики, продуктов для ветеринарии, косметики и других потребительских продуктов, продуктов питания, кормов, диагностики, промышленной химии и деконтаминации. Иногда такое применение ограничено факторами, обусловленными самими белками или связанными с условиями или средой, в которых их используют. Такие факторы могут приводить к недостаточной стабильности белков, изменению их свойств или высокой стоимости. Благодаря прогрессу в области биотехнологии возможно получение широкого спектра белков для терапевтического применения. После изготовления белковых фармацевтических продуктов обычно их хранят до их использования. В виду того факта, что белки обычно крупнее и сложнее «традиционных» фармацевтических продуктов, изготовление и обработка пригодных для хранения белковых фармацевтических продуктов могут быть особенно затруднительными. Обзор по разработке и изготовлении белковых фармацевтических композиций приведен в Carpenter et al. (1997), Pharm. Res. 14:969-975; Wang (2000), Int. J. Pharmaceutics 203:1-60; and Tang and Pikal (2004), Pharm. Res. 21:191-200.
При разработке композиций и способов получения белков для фармацевтического применения следует принимать во внимание несколько факторов. Первостепенное значение имеет стабильность белка на всех стадиях его получения, транспортировки и на стадиях применения, которые могут включать изготовление композиции, замораживание, сушку, хранение, транспортировку, восстановление, циклы замораживания-оттаивания и хранение после восстановления конечным пользователем. Другие возможные факторы включают простоту и экономичность изготовления, применения и распределения; состав конечного продукта для введения пациенту; и простоту применения конечным пользователем, включая растворимость лиофилизированной композиции после восстановления.
Жидкие композиции могут обеспечивать выполнение определенных задач. Потенциальные преимущества жидких композиций включают простоту и экономичность изготовления и удобство для конечного пользователя. Часто полипептиды в растворе нестабильны при их хранении на протяжении длительных периодов времени (Manning et al (1989), Pham. Res. 6: 903-918). Соответственно, были разработаны дополнительные стадии обработки, позволяющие увеличить срок хранения, включающие сушку, например лиофилизацию. Лиофилизированные композиции могут также обеспечивать определенные преимущества. Потенциальные преимущества лиофилизации включают большую стабильность белка, а также простоту и экономичность транспортировки и хранения. Тем не менее, лиофилизированные фармацевтические композиции могут быть менее удобными для конечного пользователя.
Помимо выбора основной формы композиции (например, лиофилизированной, жидкой, замороженной и так далее) оптимизация белковой композиции обычно включает вариабельность компонентов композиции и их соответствующих концентраций для обеспечения максимальной стабильности белка. На стабильность белка могут влиять множество факторов, включая ионную силу, рН, температуру, циклы замораживания-оттаивания, силы сдвига, замораживание, сушку, перемешивание и восстановление. Нестабильность белка может быть обусловлена физической деградацией (например, денатурацией, агрегацией или преципитацией) или химической деградацией (например, дезаминированием, окислением или гидролизом). Оптимизация компонентов композиции и их концентраций основана исключительно на эмпирических исследованиях и/или разумных способах устранения причин нестабильности.
Иногда при длительном хранении фармацевтических композиций, содержащих полипептиды, включая водные и лиофилизированные композиции, возможна утрата активных полипептидов из-за агрегации и/или деградации.
Соответственно, типичные способы повышения стабильности полипептидов могут включать изменение концентрации элементов композиции или добавление эксципиентов для модификации композиции (патенты США 5580856 и 6171586 и заявки на патенты США 2003/0202972, US 2003/0180287). US 5580856 является прототипной заявкой, где для стабилизации высушенного белка могут быть добавлены во время или после регидратации такие агенты, как природные полимеры, поверхностно-активные вещества, сульфатированные полисахариды, белки и буферы. Тем не менее, среди множества возможных вариантов в патенте США 5580856 не указано, какие именно регидратационные стабилизаторы следует добавлять к конкретным белкам. Соответственно, несмотря на то что специалисту в данной области техники, читающему указанный патент США, будет сообщено о таком множестве возможных вариантов, ему придется выявлять наилучшие для его белка условия из множества этих возможных вариантов, описанных в US 5580856. В заявке на патент США 2003/0202972 описана стабильная лиофилизированная композиция антитела против Her-2, где стабилизатор представляет собой сахар, трегалозу или буфер. Тем не менее, полезность этих стабилизаторов для антител нельзя экстраполировать на другие белки. Заявка на патент США 2003/0180287 сходна с US 2003/0202972, поскольку в ней также описан стабильный раствор иммуноглобулиноподобного белка, то есть белка, содержащего Fc-домен. Стабилизатор может представлять собой фосфат натрия, фосфат калия, цитрат натрия или калия, яблочную кислоту, ацетат аммония, трис-буфер (буфер с трис(гидроксиметил)аминометаном), ацетат, диэтаноламин, гистидин, лизин или цистеин. Из этих химически различных стабилизаторов, которые могут быть выбраны специалистом в данной области техники, наиболее подходящим оказался лизин. Однако, подобно US 2003/0202972, данный конкретный стабилизатор подходит лишь для конкретного белка, в данном случае белка, содержащего Fc-домен, что само по себе нельзя экстраполировать на другой белок. Таким образом, применение добавок нельзя экстраполировать с одного конкретного белка на другой неродственный белок. Действительно, несмотря на то что применение добавок способствует хранению, оно может также приводить к инактивации полипептидов. Кроме того, в случае лиофилизации, условия, обусловленные стадией регидратации, могут приводить к инактивации полипептида, например, посредством агрегации или денатурации (Hora et al. (1992), Pharm. Res., 9: 33-36; Liu et al. (1991), Biotechnol. Bioeng., 37: 177-184). Действительно, агрегация полипептидов нежелательна, поскольку она может приводить к иммуногенности (Cleland et al. (1993), Crit. Rev. Therapeutic Drug Carrier Systems, 10: 307-377; and Robbins et al. (1987), Diabetes, 36: 838-845).
Сохранение биологической активности при разработке и изготовлении фармацевтических продуктов зависит от естественной стабильности макромолекулы, а также от применяемых методик стабилизации. Существует множество методик стабилизации белка, включая добавление химических «стабилизаторов» к водному раствору или суспензии белка. Например, в патенте США 4297344 раскрыта стабилизация II и VIII факторов свертывания, антитромбина III и плазминогена к нагреванию путем добавления выбранных аминокислот. В патенте США 4783441 раскрыт способ стабилизации белков путем добавления поверхностно-активных веществ. В патенте США 4812557 раскрыт способ стабилизации интерлейкина-2 с использованием человеческого сывороточного альбумина. Другими возможными способами стабилизации белка являются способы замораживания-оттаивания, в которых препарат смешивают с криопротектором и хранят при очень низких температурах. Тем не менее, не все белки переносят цикл замораживания-оттаивания. Еще один возможный вариант представляет собой хранение при низкой температуре с добавлением криопротектора, обычно глицерина. Также возможно хранение в стеклообразной форме, как описано в патенте США 5098893. В таком случае белки растворяют в водорастворимых или набухаемых в воде веществах, представленных в аморфном или стеклообразном состоянии. Наиболее широко применяемым способом стабилизации белков является сублимация или лиофилизация. В случаях, когда не удается достигнуть достаточной стабильности белка в водном растворе, лиофилизация является наиболее реальной альтернативой. Недостатки лиофилизации заключаются в необходимости сложной обработки, больших затратах времени и высокой стоимости. Кроме того, при ненадлежащем проведении лиофилизации происходит по меньшей мере частичная денатурация большинства препаратов, обусловленная стадиями замораживания и обезвоживания, входящими в данную методику. Это часто приводит к необратимой агрегации части белковых молекул, что делает композицию неприемлемой для парентерального введения.
В целом, деградация белков хорошо описана в литературе, но хранение и растворимость, в частности, белка CD-RAP/MIA (называемого далее CD-RAP) описаны не были. CD-RAP представляет собой небольшой растворимый белок, секретируемый клетками злокачественной меланомы и хондроцитами. Согласно полученным недавно данным было установлено, что CD-RAP является прототипом небольшого семейства внеклеточных белков, содержащих структуру, подобную домену SH3. Предполагают, что взаимодействие CD-RAP с определенными эпитопами белков внеклеточного матрикса регулирует адгезию опухолевых клеток и хондроцитов (Moser et al (2002), Mol Cell Biol. 5:1438-45). В то же время белки, родственные CD-RAP, известны из US 2002/0103360 и WO 2004/015078. Тем не менее, в этих заявках не описаны стабильные композиции белков, родственных CD-RAP.
В настоящее время известна липосомная композиция CD-RAP, описанная в WO 2008/040556. Конкретно, раскрыта сухая фармацевтическая композиция, содержащая многослойные везикулы, содержащие CD-RAP, после восстановления, где белок CD-RAP инкапсулирован и/или захвачен в липосомы для длительной доставки CD-RAP, так что он может оставаться в желаемом месте действия на протяжении более длительного периода времени.
Одна функция CD-RAP состоит в том, что он действует как хемотаксический фактор на мезенхимальные стволовые клетки. В то время как CD-RAP не способен индуцировать дифференцировку мышиных или человеческих мезенхимальных стволовых клеток (HMSC), он влияет на действие морфогенетического белка кости 2 (BMP-2) и трансформирующего фактора роста бета-3 (TGF-бета-З) при дифференцировке мезенхимальных стволовых клеток, поддерживая хондрогенный фенотип и ингибируя остеогенную дифференцировку. Кроме того, CD-RAP приводит к понижающей регуляции экспрессии генов остеопонтина и остеокальцина в обработанных ВМР-2 культурах HMSC, снижая остеогенный потенциал ВМР-2. В случае человеческих первичных хондроцитов CD-RAP стимулирует образование внеклеточного матрикса, повышая содержание гликозаминогликанов. По этой причине полагают, что CD-RAP является важным регулятором при хондрогенной дифференцировке и поддержании хряща. Соответственно, полагают, что CD-RAP является перспективным агентом для восстановления хряща. Таким образом, желательно обеспечить доступные фармацевтические композиции, содержащие достаточно высокое количество CD-RAP, стабильные на протяжении длительного времени при хранении. Действительно, стабильные композиции с высокими концентрациями CD-RAP позволят уменьшить объем инъекций, проводимых пациентам, что уменьшит побочные эффекты, такие как боль, связанная с большим объемом инъекции, и, конечно, позволит увеличить каждую дозу.
Кроме того, в то время как в данной области техники было известно о доступности множества вариантов агентов, стабилизирующих белки, а также агентов, позволяющих сохранять стабильность белков при их высокой концентрации, до настоящего изобретения в данной области техники не было представления о том, что композиция, содержащая белок CD-RAP в высоких концентрациях, может быть нестабильной и, следовательно, требует улучшения.
Таким образом, техническая проблема, рассмотренная в настоящем изобретении, состоит в удовлетворении описанных выше потребностей.
В настоящем изобретении рассмотрены эти потребности и, соответственно, в качестве решения указанной технической проблемы согласно настоящему изобретению предложены воплощения, касающиеся композиций, а также способов и применений этих композиций в лечении страдающих от заболеваний субъектов, которым будет полезно введение CD-RAP. Эти воплощения охарактеризованы и описаны здесь, проиллюстрированы в Примерах и отражены в формуле изобретения.
Необходимо отметить, что при использовании здесь формы единственного числа включают множественное число, если в контексте явно не указано иное. Таким образом, например, ссылка на «антитело» включает одно или несколько таких различных антител, и ссылка на «способ» включает ссылку на эквивалентные стадии и способы, известные специалистам в данной области техники, которые могут быть модифицированы или заменены способами, описанными здесь.
Все публикации и патенты, упомянутые в данном описании, полностью включены посредством ссылки. В той степени, в которой материал, включенный посредством ссылки, противоречит или не соответствует данному описанию, описание будет заменять любой такой материал.
Если не указано иное, подразумевают, что термин «по меньшей мере», расположенный перед группой элементов, относится к каждому элементу данной группы. Специалистам в данной области техники будут ясны многие эквиваленты конкретных воплощений изобретения, описанных здесь, или специалисты в данной области техники смогут установить такие эквиваленты с использованием не более чем рутинных экспериментов. Предполагают, что такие эквиваленты входят в объем настоящего изобретения.
Подразумевают, что в данном описании и последующей формуле изобретения, если контекст не требует иного, слово «содержать» и такие варианты, как «содержит» и «содержащий», означают включение указанного целого, или стадии, или группы целых или стадий, но не исключение любого другого целого, или стадии, или группы целых или стадий. При использовании здесь термин «содержащий» может быть заменен термином «включающий» или иногда, при использовании здесь, термином «имеющий».
При использовании здесь термин «состоящий из» исключает любые элемент, стадию или ингредиент, не указанные в заявленном элементе. При использовании здесь термин «состоящий по существу из» не исключает вещества или стадии, по существу не влияющие на основные и новые признаки заявленного элемента/пункта формулы изобретения. В каждом случае в настоящей заявке любой из терминов «содержащий», «состоящий по существу из» и «состоящий из» может быть заменен любым из двух других терминов.
Подразумевают, что при использовании здесь союзный термин «и/или» между несколькими перечисленными элементами включает как отдельные, так и комбинированные варианты. Например, когда два элемента соединены посредством «и/или», первый вариант относится к возможности использования первого элемента без второго. Второй вариант относится к возможности использования второго элемента без первого. Третий вариант относится к возможности использования первого и второго элемента совместно. Подразумевают, что любой из этих вариантов входит в объем значения данного термина и, следовательно, соответствует требованию термина «и/или», как он использован здесь. Подразумевают, что возможность одновременного использования нескольких вариантов также входит в объем значения данного термина и, следовательно, соответствует требованию термина «и/или», как он использован здесь.
В тексте данного описания упомянуты несколько документов. Каждый из упомянутых здесь документов (включая все патенты, заявки на патенты, научные публикации, описания изготовителей, инструкции и так далее), приведенные выше или ниже, полностью включены сюда посредством ссылки. Ни один элемент настоящей заявки не следует толковать как признание того, что настоящее изобретение не предвосхищает такое описание, приведенное в предшествующем изобретении.
С целью обеспечения композиции, содержащей большое количество CD-RAP, что позволит уменьшить объем инъекций, проводимых субъектам, нуждающимся в этом, и уменьшить побочные эффекты, такие как боль, связанная с большим объемом инъекции, авторы настоящего изобретения обнаружили, что белок CD-RAP может быть нестабильным в высоких концентрациях и может также быть нестабильным на протяжении длительного периода хранения.
Таким образом, во время своих исследований, направленных на получение высококонцентрированной стабильной композиции, авторы изобретения наблюдали определенную нестабильность белков CD-RAP и, следовательно, поставили задачу исправить это нежелательное свойство. Соответственно, они поставили задачу концентрирования CD-RAP, сохраняя его в растворе, то есть в растворенном состоянии. Для этого им было доступно множество вариантов и альтернатив, однако без каких-либо данных о том, что какой-либо вариант или альтернатива будут подходящими для решения данной объективной задачи.
«Растворенное состояние» означает, что белок CD-RAP, предпочтительно в концентрации по меньшей мере 5 мг/мл CD-RAP, находится в растворе, то есть растворен и/или диспергирован непосредственно в водном растворе (то есть в водной фазе) композиции. Предпочтительно, белок CD-RAP растворен и/или диспергирован равномерно. «Равномерно» означает, что количество белка CD-RAP, растворенного и/или диспергированного в стабильной водной композиции, почти равномерно, предпочтительно равномерно распределено в водной композиции, так что концентрация («с») количества белка CD-RAP («n» в случае молярной массы или «m» в случае массы) почти одинакова, предпочтительно одинакова в (или во всем) объеме («v») водного раствора, то есть c=n/v или c=m/v, соответственно, почти постоянны, предпочтительно постоянны. Предпочтительно, в композиции нет градиента концентрации.
Соответственно, стабильную водную композицию по настоящему изобретению, содержащую белок CD-RAP, можно предпочтительно рассматривать как водный раствор, в котором непосредственно растворен и/или диспергирован CD-RAP.
Более предпочтительно, стабильную водную композицию по настоящему изобретению можно рассматривать как водный раствор, содержащий по меньшей мере 5 мг/мл белка CD-RAP и заряженную аминокислоту. Это означает, что основой композиции является водный раствор, где по меньшей мере 5 мг/мл белка CD-RAP растворены и/или диспергированы совместно с по меньшей мере заряженной аминокислотой.
Альтернативно, стабильную водную композицию по настоящему изобретению можно более предпочтительно рассматривать как стабильную композицию на основе водного раствора, содержащую белок CD-RAP в концентрации по меньшей мере 5 мг/мл (масса/объем) и заряженную аминокислоту.
«Раствор» представляет собой гомогенную смесь одного, или двух, или более веществ/компонентов. В такой смеси растворенное вещество (в настоящем изобретении белок CD-RAP, предпочтительно по меньшей мере 5 мг/мл белка CD-RAP) растворено (как описано выше) в другом веществе (в настоящем изобретении предпочтительно в водной композиции), также известном как растворитель.
С учетом сказанного выше, белок CD-RAP предпочтительно не гетерогенно растворен и/или диспергирован в водном растворе. Термин «растворенное состояние» также включает то, что белок CD-RAP в водном растворе предпочтительно по существу не эмульгирован или, более предпочтительно, не эмульгирован вовсе.
Кроме того, термин «растворенное состояние» включает то, что белок CD-RAP предпочтительно по существу не инкапсулирован и/или не захвачен, например, в липосомы, многослойные липосомы или тому подобное (предпочтительно, менее 2%, 1% или 0,5% белка CD-RAP может быть инкапсулировано и/или захвачено), или, более предпочтительно, не инкапсулирован и/или не захвачен вовсе.
Соответственно, в предпочтительном аспекте настоящее изобретение включает стабильную водную композицию, по существу свободную от липосом (предпочтительно, менее 2%, 1% или 0,5% липосом), предпочтительно, свободную от липосом, содержащую по меньшей мере 5 мг/мл белка CD-RAP и заряженную аминокислоту.
В альтернативном более предпочтительном аспекте настоящее изобретение включает стабильную водную композицию, содержащую по меньшей мере 5 мг/мл белка CD-RAP и заряженную аминокислоту, где белок CD-RAP по существу не включен (предпочтительно, менее 2, 1 или 0,5%), предпочтительно не включен (не инкапсулирован и/или не захвачен) в липосомы.
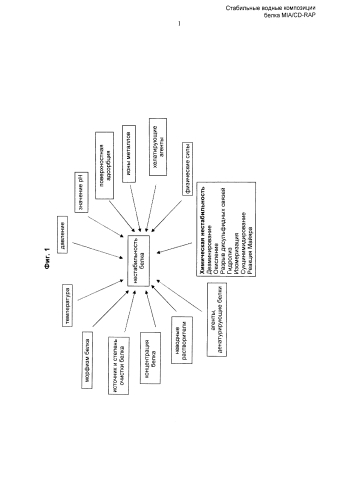
Действительно, существует множество возможных механизмов нестабильности белка. Например, нестабильность белка может быть обусловлена агрегацией белка, а также химической нестабильностью, связанной с дезаминированием, окислением, разрывом и образованием дисульфидных связей, гидролизом, сукцинимидированием, образованием поперечных сшивок без дисульфидных связей, дегликозилированием, или «ферментативным потемнением» (реакцией Майяра), или любой комбинацией этих явлений; см., например, Wang et al. (1999), Int. J. Pharm. 185: 129-188) и Фиг.1. Кроме того, на стабильность белка могут влиять физико-химические условия, такие как температура, значение рН, поверхностная адсорбция, соли, ионы металлов, хелатирующие агенты, физические силы, такие как силы сдвига, агенты, денатурирующие белки, неводные растворители, концентрация белка, источник и степень очистки белка, морфизм белка или давление.
Однако, при множестве факторов, способных влиять на стабильность белка, существует множество способов, которые могут быть использованы для стабилизации белка. Например, возможна внутренняя (посредством замены аминокислот) или внешняя стабилизация белка. Внешняя стабилизация может быть осуществлена хелатирующими агентами, ионами металлов, восстанавливающими агентами, полимерами, полиэтиленгликолями/полиолами, сывороточным альбумином, поверхностно-активными веществами, сахарами и полиолами, жирными кислотами и фосфолипидами, аминокислотами, буферами и так далее; см., например, Wang, Y and Hanson M (1988), J. Parental Sci. & Technology, 42, Supplement: 4-26; Wang et al. (1999), Int. J. Pharm. 185: 129-188, и Фиг.2. В целом, для стабилизации белка CD-RAP в композиции специалисту в данной области техники доступно множество вариантов.
В данном случае авторы изобретения наблюдали, что белок CD-RAP проявляет агрегацию. К агрегации белка в белковой композиции может приводить множество различных факторов. Обычные способы очистки и хранения могут приводить к воздействию на белковые композиции условий и компонентов, приводящих к агрегации белка. Например, агрегация белков в белковой композиции может быть результатом одного или более из следующего: хранения, воздействия повышенных температур, рН композиции, ионной силы композиции и присутствия некоторых поверхностно-активных веществ (например, полисорбата-20 и полисорбата-80) и эмульгаторов. Сходным образом, агрегация белков возможна при воздействии сил сдвига, как, например, при восстановлении лиофилизированного сухого белка в растворе, очистке образца белка фильтрацией, замораживании-оттаивании, встряхивании или переносе раствора белка шприцом. Агрегация может также происходить в результате взаимодействий полипептидных молекул в растворе и на границах раздела «жидкость-воздух» в флаконах для хранения. При уменьшении или увеличении поверхности границ раздела «жидкость-воздух» и «твердое тело-жидкость», связанном со взбалтыванием при транспортировке, возможны изменения конформации полипептидов, адсорбированных на этих границах раздела. Такое взбалтывание может приводить к образованию в композиции белковых агрегатов и, в итоге, их преципитации с другими адсорбированными белками.
Кроме того, к агрегации белка может приводить воздействие света на белковую композицию. Таким образом, согласно настоящему изобретению предложены композиции, позволяющие повысить концентрации CD-RAP и уменьшающие агрегацию белков. Безотносительно теории, уменьшения агрегации белков достигают контролем одного или нескольких указанных выше механизмов агрегации. Это может приводить, например, к большей стабильности продукта и большей гибкости производственных процессов и условий хранения.
Конкретно, авторы настоящего изобретения обнаружили, что из множества исследованных агентов аминокислоты с суммарным зарядом при рН приблизительно от 6 до 8 полезны для стабилизации белка CD-RAP в высокой концентрации, благодаря, среди прочего, опосредованию растворимости белка и/или ингибированию агрегации белка. Подразумевают, что при упоминании здесь аминокислота предпочтительно представляет собой L-аминокислоту. D-аминокислота менее предпочтительна. Предпочтительно, аминокислота представляет собой L-гистидин, L-аргинин, L-глутаминовую кислоту или их соль; предпочтительно, соль представляет собой хлорид, фосфат, ацетат или сульфат.
Соответственно, изобретение основано, по меньшей мере частично, на обнаружении того, что композиции, содержащие по меньшей мере 5 мг/мл CD-RAP и заряженную аминокислоту или ее соль, предпочтительно хлорид, фосфат, ацетат или сульфат, более предпочтительно, вместе с буфером, дисахаридом, наполнителем и, возможно, поверхностно-активным веществом, обладают достаточной стабильностью при длительном хранении и/или при одном или нескольких циклах замораживания-оттаивания. Композиция по изобретению имеет множество преимуществ по сравнению со стандартными забуференными композициями. В одном аспекте композиция содержит белок CD-RAP в высоких концентрациях, например 30 мг/мл или более. Неожиданным образом, несмотря на высокую концентрацию белка, агрегация в композиции минимальна, и такую композицию можно хранить с использованием множества различных способов и форм, например замораживания, без проявления неблагоприятных эффектов, которые можно ожидать при использовании композиций с высокой концентрацией белка.
В некоторых менее предпочтительных воплощениях в композициях по изобретению нет необходимости использовать эксципиенты, такие как, например, поверхностно-активные вещества и буферные системы, используемые в обычных композициях для стабилизации белков в растворе. Кроме того, композиции, описанные здесь, более предпочтительны по сравнению со стандартными композициями, поскольку они обладают сниженной иммуногенностью, в виду отсутствия дополнительных агентов, необходимых для стабилизации белка.
Таким образом, настоящее изобретение направлено на жидкую композицию, предпочтительно стабильную жидкую композицию, которая неожиданно обеспечивает возможность длительного сохранения полипептида CD-RAP или его биологически активного аналога, аминокислотная последовательность которого по меньшей мере на 63% гомологична четырехцистеиновому каркасу CD-RAP, аминокислотам 12-107 SEQ ID NO: 1, как описано ниже, в концентрации по меньшей мере 5 мг/мл, предпочтительно по меньшей мере 7,5 мг/мл, более предпочтительно по меньшей мере 10 мг/мл, еще более предпочтительно по меньшей мере 15 мг/мл, особенно предпочтительно по меньшей мере 20 мг/мл, более предпочтительно по меньшей мере 25 мг/мл, еще более предпочтительно по меньшей мере 30 мг/мл, и заряженную аминокислоту или ее соль, предпочтительно хлорид, фосфат, ацетат или сульфат. Эта композиция полезна, в частности, в виду ее большего удобства в использовании для пациента, поскольку полипептид CD-RAP в данной композиции является высококонцентрированным, что позволяет уменьшить побочные эффекты, такие как боль, связанная с большим объемом инъекции. Кроме того, применение композиции посредством внутрисуставной инъекции пациенту при низком уровне динамического давления жидкости усиливает хондрогенез.
Композиция по изобретению (иногда также называемая здесь «композиция веществ» или «композиция») может предпочтительно быть представлена в разных физических состояниях, таких как жидкие, замороженные, лиофилизированные, сублимированные, высушенные распылением и восстановленные композиции, при этом предпочтительны жидкие и лиофилизированные композиции. Предпочтительно, рН композиции составляет 6,0 и более, более предпочтительно от 5,5 до 9,0, более предпочтительно рН композиции составляет от 6,0 до 8,0, еще более предпочтительно от 6,5 до 7,6, наиболее предпочтительно от 7,0 до 7,5.
При использовании здесь «жидкая композиция» относится к композиции веществ, представленной в жидкой форме, для которой характерно свободное перемещение составляющих ее молекул друг относительно друга, но без тенденции к разделению при комнатной температуре. Жидкие композиции включают водные и неводные жидкости, при этом водные композиции являются предпочтительными. Водная композиция представляет собой композицию, в которой растворителем является вода. Полипептид CD-RAP может быть растворен в композиции равномерно или неравномерно, при этом равномерное растворение является предпочтительным, как описано выше.
Может быть использована любая подходящая неводная жидкость, при условии, что она обеспечивает стабильность композиции по изобретению, Предпочтительно, неводная жидкость является гидрофильной жидкостью. Типичные примеры подходящих неводных жидкостей включают: глицерин; диметилсульфоксид (DMSO); полидиметилсилоксан (PMS); этиленгликоли, такие как этиленгликоль, диэтиленгликоль, триэтиленгликоль, полиэтиленгликоль («PEG») 200, PEG 300 и PEG 400; и пропиленгликоли, такие как дипропиленгликоль, трипропиленгликоль, полипропиленгликоль («PPG») 425 и PPG 725.
При использовании здесь «смешанная водная/неводная жидкая композиция» относится к жидкой композиции, содержащей смесь воды и дополнительной жидкой композиции.
При использовании здесь «композиция» представляет собой смесь полипептида CD-RAP (то есть активного лекарственного средства/вещества) и других химических веществ и/или добавок, необходимых для лекарственного продукта, представленного предпочтительно в жидком состоянии. Композиция по изобретению включает фармацевтическую композицию. Термин «фармацевтическая композиция» относится к композициям, представленным в такой форме, которая позволяет активным ингредиентам эффективно проявлять свою биологическую активность, и которые, таким образом, могут быть введены субъекту для терапевтического применения, как описано здесь.
Изготовление композиции включает способ, при котором различные химические вещества, включая активное лекарственное средство, объединяют с получением конечного лекарственного продукта, такого как фармацевтическая композиция. Активным лекарственным средством композиции по изобретению является полипептид CD-RAP. Термин «полипептид» может быть использован здесь взаимозаменяемо с термином «белок» и при использовании здесь включает пептид, полипептид, белок и слитый белок. Белки могут быть получены рекомбинантными или синтетическими способами.
В определенных воплощениях белок CD-RAP для включения в композицию является по существу чистым и/или по существу гомогенным (то есть по существу свободен от контаминирующих белков и так далее). Термин «по существу чистый» белок обозначает композицию, в которой белковая фракция составляет по меньшей мере приблизительно 80%, предпочтительно 90% по массе, предпочтительно по меньшей мере приблизительно 95% по массе, более предпочтительно 97% по массе и наиболее предпочтительно 98% по массе. Термин «по существу гомогенный» белок обозначает композицию, в которой белковая фракция составляет по меньшей мере приблизительно 99% по массе, исключая массу различных стабилизаторов и воды в растворе.
Полипептид CD-RAP композиции по изобретению известен в данной области техники (см. ЕР-В1 710248 или ЕР-В1 1146897) и/или описан здесь. Полипептид CD-RAP (хрящевой белок, чувствительный к ретиноевой кислоте), используемый в композициях по изобретению, представляет собой полипептид CD-RAP, также называемый MIA (активность, ингибирующая меланому), OTOR (фиброцитарный белок, FDP, MIA-подобный белок, MIAL) и TANGO 130, являющийся представителем класса секретируемых белков, как описано в Bosserhoff et al. (2004), Gene Expr. Patterns. 4: 473-479; Bosserhoff and Buettner (2003), Biomaterials 24: 3229-3234; Bosserhoff et al. (1997), Dev. Dyn. 208: 516-525; WO 00/12762; WO 2004/015078; EP-B1 710248; US 2002/0103360; или ЕР-В1 1146897. Белок CD-RAP, используемый в композиции по изобретению, предпочтительно представляет собой рекомбинантный человеческий белок CD-RAP (rhCD-RAP).
Также предпочтительно, чтобы полипептид CD-RAP композиции по изобретению представлял собой: (а) полипептид, содержащий или имеющий зрелую последовательность CD-RAP (SEQ ID NO: 1) и ее функциональные фрагменты или варианты; (б) полипептид, аминокислотная последовательность которого по меньшей мере на 63%, более предпочтительно на 70%, еще более предпочтительно на 80%, более предпочтительно на 90%, наиболее предпочтительно на 95% гомологична четырехцистеиновому каркасу CD-RAP, аминокислотам 12-107 SEQ ID NO: 1; или (в) полипептид, имеющий любую из общих последовательностей 1-3, определенных здесь (SEQ ID NO: 2, 3 и 4). Вариантом CD-RAP является белок, имеющий последовательность SEQ ID NO: 4 или ее зрелый вариант, как описано в WO 2004/015078, или белок, имеющий последовательность SEQ ID NO: 14 или ее зрелый вариант, как описано в US 2002/0103360.
«Процент (%) гомологии аминокислотных последовательностей» применительно к последовательностям CD-RAP, указанным здесь, определяют как процент аминокислотных остатков в рассматриваемой последовательности, идентичным аминокислотным остаткам в последовательности CD-RAP после выравнивания последовательностей и, при необходимости, введения разрывов для достижения максимального процента идентичности последовательностей, при этом любые консервативные замены не рассматривают как часть процента идентичности. Выравнивание в целях определения процента идентичности аминокислотных последовательностей может быть проведено различными способами, известными специалистам в данной области техники, например с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры оценки выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
Длина функциональных фрагментов, имеющих одинаковую с CD-RAP биологическую функцию, предпочтительно составляет по меньшей мере 20, в частности по меньшей мере 40, и более предпочтительно по меньшей мере 50, наиболее предпочтительно 80 смежных аминокислот последовательности, показанной в SEQ ID NO: 1. Предпочтительно, функциональные фрагменты содержат аминокислоты, локализованные в положениях 1-50, 1-70, 1-80, 20-80, 20-107 SEQ ID NO: 1.
Зрелая последовательность CD-RAP (SEQ ID NO: 1)
GPMPKLADRKLCADQECSHPISMAVALQDYMAPDCRFLTIHRGQVVYVFSKLKGRGRLFWGGSVQGDYYGDLAARLGYFPSSIVREDQTLKPGKVDVKTDKWDFYCQ
Общая последовательность 1 (SEQ ID NO; 2)
С Х4 С X17 С X12 V X11-13 W X7-18 F X4 V X21 С X
Общая последовательность 2 (SEQ ID NO: 3)
K X C X D X E C X11 D X3 P D C X12 V X2 K L X7-9 W X G S X5-13 G Y F P Х3 V X18 D F X C X
Общая последовательность 3 (SEQ ID NO: 4)
K X C X D X2 C X8 A X2 D X3 P D C R F X5 G X V X5 K L X7 W X G S V X12 G Y F P X22 D F X С Q
В каждом случае «X» независимо представляет собой аминокислоту, и номер, указанный подстрочным индексом, означает число любых аминокислот. Предпочтительно, «X» независимо представляет собой встречающуюся в природе аминокислоту и, в частности, A, R, N, D, С, Q, Е, G, H, I, L, К, М, F, P, S, Т, W, Y или V. «X» может также представлять собой нестандартные аминокислоты, такие как лантионин, 2-аминоизомасляная кислота, дегидроаланин, орнитин, цитруллин, бета-аланин или норлейцин. Разумеется, также предусмотрены посттрансляционные модификации, хорошо известные в данной области техники. Таким образом, возможна посттрансляционная модификация полипептида CD-RAP по изобретению.
Белок CD-RAP, используемый в композиции по изобретению, может быть экспрессирован с интактной или процессированной геномной ДНК либо комплементарной ДНК (кДНК), или с синтетической ДНК в прокариотических или эукариотических клетках-хозяевах. Белки могут быть выделены из культуральной среды или телец включений и/или подвергнуты рефолдингу