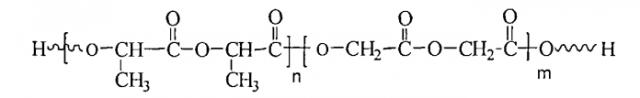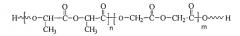Композиции ротиготина, его производных, или фармацевтически приемлемых солей ротиготина или их производных
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается фармацевтической микросферной композиции, включающей ротиготин или его фармацевтически приемлемую соль; по крайней мере один полилактид-гликолид (ПЛГлА) с молекулярной массой 5000-100000 Да и полимеризационным соотношением лактид:гликолид от 95:5 до 5:95; и, по меньшей мере, одну жирную кислоту, имеющую 8-24 атомов углерода, где ротиготин или его фармацевтически приемлемая соль составляет 20-40%, ПЛГлА составляет 45-79%, и, по меньшей мере, одна жирная кислота составляет 1-15% по весу относительно общего веса композиции. Группа изобретений также касается способа лечения болезни Паркинсона с применением описанных композиций. Группа изобретений обеспечивает состав ротиготина, который существенно уменьшает взрывное высвобождение препарата. 3 н. и 20 з.п.ф-лы, 28 пр., 12 табл., 38 ил.
Реферат
Настоящее изобретение относится к композиции на основе ротиготина, его производных, или фармацевтически приемлемых солей ротиготина или их производных.
Ввиду метаболизма в печени, оральная биодоступность ротиготина низка (приблизительно 1-5%), таким образом, ротиготин не подходит для перорального приема. В настоящее время на рынке в Германии, Великобритании, Австралии и др. находится первый трансдермальный пластырь для лечения болезни Паркинсона, трансдермальный пластырь под торговой маркой Neupro® разработан фирмой Schwarz Pharma AG. Однако при использовании этого продукта может образовываться кристаллизованный ротиготин. Чтобы решить эту проблему, используют хранение типа «холодовая цепь» и распределение при температуре 2-8°C, и каждый рецепт не должен выписываться более чем на один месяц, чтобы избежать кристаллизации, которая, очевидно, усугубит трудности пациентов при использовании этого медикамента.
Заявка CN 1762495 A раскрывает композицию на основе микросфер, включающую ротиготин и деградируемые полимерные вспомогательные материалы. Ротиготиновая микросферная композиция, раскрытая в заявке CN 1762495 А, может обеспечить эффект долгодействующего высвобождения, но может возникнуть проблема взрывного (немедленного) высвобождения препарата. Как показано на фиг.17 (тест in vivo с относительным содержанием препарата 8%), фиг.12 (тест in vivo с относительным содержанием препарата 20%) и фиг.20 (тест in vivo с относительным содержанием препарата 40%) из заявки CN 1762495 А, когда относительное содержание препарата составляет 20 или 40%, эффект взрывного высвобождения очевиден. Из фиг.20 (тест in vivo с относительным содержанием препарата 40%) и фиг.19 (тест in vitro с относительным содержанием препарата 40%) в заявке CN 1762495 A также видно, что высвобожденное количество ротиготина в течение одних суток в тесте in vitro коррелирует с взрывным высвобождением препарата в тесте in vivo. При том же самом относительном содержании препарата, чем больше высвобожденное количество в тесте in vitro, тем больше препарата немедленно высвобождается in vivo.
Как возрастное дегенеративное заболевание, болезнь Паркинсона прогрессирует с возрастом пациентов. Таким образом, вводимая дозировка также должна постепенно увеличиваться во время лечения. При лечении пациентов с болезнью Паркинсона в прогрессивный период ежесуточная доза препарата должна значительно увеличиваться. Таким образом, при лечении пациентов с болезнью Паркинсона в прогрессивный период микросферами ротиготина, относительное содержание активного компонента не должно быть слишком низким. Иначе, чтобы достигнуть того же самого терапевтического эффекта, как и микросферы, имеющие более высокое относительное содержание препарата, микросферы с более низким относительным содержанием препарата нужно было бы вводить в относительно большем количестве, что может причинять пациентам боль. Однако, если относительное содержание препарата в микросферах при введении пациентам слишком высоко, препарат может претерпеть внезапное высвобождение, что может вызвать его передозировку.
Настоящее изобретение обеспечивает состав (композицию) препарата, такого как ротиготин, его производных или фармацевтически приемлемых солей ротиготина или их производных, которые существенно уменьшают взрывное высвобождение препарата. Состав включает ротиготин, его производные или фармацевтически приемлемые соли ротиготина или их производные; по крайней мере, один полилактид-гликолид (ПЛГлА); и по крайней мере, одну жирную кислоту, причем по крайней мере одна жирная кислота составляет по крайней мере приблизительно 0.5%, например, приблизительно 1-15 вес.% относительно общей массы состава.
В некоторых воплощениях состав находится в форме микросфер. Например, диаметр частицы в форме микросферы может составить приблизительно 1-250 мкм, например, приблизительно 10-200 мкм.
В некоторых воплощениях состав - это ротиготин или его фармацевтически приемлемая соль.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляют приблизительно 20-40 вес.% относительно общей массы состава. В одном примере ротиготин или его фармацевтически приемлемая соль могут составить приблизительно 25-5%, приблизительно 25-30%, приблизительно 20-30%, приблизительно 20-25%, приблизительно 25-40%, приблизительно 30-35%, приблизительно 30-40% или приблизительно 35-40 вес.% относительно общей массы состава. В другом примере ротиготин или его фармацевтически приемлемая соль могут составить приблизительно 21, 22, 23, 24, 25, 26, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 вес.% относительно общей массы состава.
В некоторых воплощениях по крайней мере один ПЛГлА составляет приблизительно 45-79 вес.% относительно общей массы состава. По крайней мере один ПЛГлА может включить два, три, четыре или пять различных типов полимеров ПЛГлА, которые могут отличаться, например, молекулярной массой и/или полимеризационным соотношением. В одном примере по крайней мере один ПЛГлА составляет приблизительно 47.5-77.5%, приблизительно 50-77.5%, приблизительно 52.5-72.5%, приблизительно 55-72.5%, приблизительно 55-69%, приблизительно 57.5-72.5%, приблизительно 57.5-77.5%, приблизительно 60-72.5%, приблизительно 60-70%, приблизительно 62.5-67.5%, приблизительно 45-50%, приблизительно 47.5-60% или приблизительно 50-60 вес.% относительно общей массы состава. В другом примере по крайней мере один ПЛГлА составляет приблизительно 45%, приблизительно 47.5%, приблизительно 50%, приблизительно 52.5%, приблизительно 55%, приблизительно 57.5%, приблизительно 60%, приблизительно 62.5%, приблизительно 65%, приблизительно 67.5%, приблизительно 70%, приблизительно 72.5%, приблизительно 75%, приблизительно 77.5%, приблизительно 78% или приблизительно 79 вес.% относительно общей массы состава.
В некоторых воплощениях фармацевтически приемлемая соль образована ротиготином и неорганической кислотой или органической кислотой. Неорганическая кислота может быть выбрана из списка: соляная кислота, серная кислота, фосфорная кислота и азотная кислота. Органическая кислота выбирается из списка: лимонная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, бензойная кислота, молочная кислота, метансульфоновая кислота, нафталинсульфоновая кислота и толуол-n-сульфоновая кислота. Например, органическая кислота может быть кислой аминокислотой, такой как глютаминовая кислота или аспарагиновая кислота.
В некоторых воплощениях по крайней мере один ПЛГлА имеет молекулярную массу приблизительно 5,000-100,000 Да. Например, по крайней мере один ПЛГлА может иметь молекулярную массу приблизительно 5500-99000 Да, приблизительно 6000-98000 Да, приблизительно 6500-97000 Да, приблизительно 7000-96000 Да, приблизительно 7500-95000 Да, приблизительно 8000-94000 Да, приблизительно 8500-93000 Да, приблизительно 9000-92000 Да, приблизительно 9500-91000 Да, приблизительно 10000-90000 Да, приблизительно 10500-89000 Да, приблизительно 11000-88000 Да, приблизительно 10500-87000 Да, приблизительно 11000-86000 Да, приблизительно 11500-85000 Да, приблизительно 12000-84000 Да, приблизительно 12500-83000 Да, приблизительно 13000-82000 Да, приблизительно 13500-81000 Да, приблизительно 14000-80000 Да, приблизительно 14500-79000 Да, приблизительно 15000-78000 Да, приблизительно 15500-77000 Да, приблизительно 16000-76000 Да, приблизительно 16500-75000 Да, приблизительно 17000-74000 Да, приблизительно 17500-73000 Да, приблизительно 18000-72000 Да, приблизительно 18500-71000 Да, приблизительно 19000-70000 Да, приблизительно 19500-69000 Да, приблизительно 20000-68000 Да, приблизительно 21,000-67000 Да, приблизительно 22000-66000 Да, приблизительно 23000-65000 Да, приблизительно 24,000-64000 Да, приблизительно 25000-63000 Да, приблизительно 26000-62000 Да, приблизительно 27,000-61000 Да, приблизительно 28000-60000 Да, приблизительно 29,000-60000 Да, приблизительно 30,000-5,9000 Да, приблизительно 31,000-5,8000 Да, приблизительно 32,000-5,7000 Да, приблизительно 33,000-5,9000 Да, приблизительно 34,000-5,8000 Да, приблизительно 35,000-5,7000 Да, приблизительно 36,000-5,6000 Да, приблизительно 37,000-5,5000 Да, приблизительно 38,000-5,4000 Да, приблизительно 39,000-5,3000 Да, приблизительно 40,000-5,2000 Да, приблизительно 41,000-5,1000 Да, приблизительно 42,000-5,0000 Да, приблизительно 42000-49000 Да, приблизительно 43000-48000 Да, приблизительно 44000-47000 Да или приблизительно 45000-46000 Да.
В некоторых воплощениях по крайней мере один ПЛГлА имеет полимеризационное соотношение лактида к гликолиду в пределах от приблизительно 95:5 к 5:95. Например, полимеризационное соотношение лактид-гликолид может быть от 90:10 до 10:90, от 85:15 до 15:85, от 80:20 до 20:80, от 75:25 до 25:75, от 70:30 до 30:70, от 65:35 до 35:65, от 60:40 до 40:60 или от 55:45 до 45:55. Для другого примера полимеризационное соотношение лактид-гликолид может быть около 50:50.
В некоторых воплощениях полимеризационное соотношение лактид-гликолид находится в пределах приблизительно от 75:25 до 25:75.
В некоторых воплощениях по крайней мере одна жирная кислота выбрана из ряда жирных кислот, имеющих 8-24 углеродных атома. По крайней мере одна жирная кислота может быть выбрана из списка: стеариновая кислота, пальмитиновая кислота, олеиновая кислота, декановая кислота, октановая кислота и лигноцериновая кислота. Например, по крайней мере одна жирная кислота может быть стеариновой кислотой.
В некоторых воплощениях по крайней мере одна жирная кислота составляет по крайней мере 0.5 вес.% относительно общей массы состава. Например, по крайней мере одна жирная кислота может составлять приблизительно 1-15%, приблизительно 2-15%, приблизительно 3-15%, приблизительно 4-15%, приблизительно 5-15%, приблизительно 6-15%, приблизительно 7-15%, приблизительно 8-15%, приблизительно 9-15%, приблизительно 10-15%, приблизительно 11-15%, приблизительно 12-15%, приблизительно 13-15%, приблизительно 14-15%, приблизительно 1-12.5%, приблизительно 2-12.5%, приблизительно 3-12.5%, приблизительно 4-12.5%, приблизительно 5-12.5%, приблизительно 6-12.5%, приблизительно 7-12.5%, приблизительно 8-12.5%, приблизительно 9-12.5%, приблизительно 10-12.5%, приблизительно 11-12.5%, приблизительно 1-10%, приблизительно 2-10%, приблизительно 3-10%, приблизительно 4-10%, приблизительно 5-10%, приблизительно 6-10%, приблизительно 7-10%, приблизительно 8-10%, приблизительно 9-10%, приблизительно 1-7.5%, приблизительно 2-7.5%, приблизительно 3-7.5%, приблизительно 4-7.5%, приблизительно 5-7.5%, приблизительно 6-7.5%, приблизительно 1-5%, приблизительно 2-5%, приблизительно 3-5%, приблизительно 4-5%, приблизительно 1-3%, приблизительно 2-3%, приблизительно 2-4%, приблизительно 3-4 вес.% относительно общей массы состава. В другом примере по крайней мере одна жирная кислота может составлять приблизительно 1%, приблизительно 1.5%, приблизительно 2%, приблизительно 2.5%, приблизительно 3%, приблизительно 3.5%, приблизительно 4%, приблизительно 4.5%, приблизительно 5%, приблизительно 5.5%, приблизительно 6%, приблизительно 6.5%, приблизительно 7%, приблизительно 7.5%, приблизительно 8%, приблизительно 8.5%, приблизительно 9%, приблизительно 10%, приблизительно 10.5%, приблизительно 11%, приблизительно 11.5%, приблизительно 12%, приблизительно 12.5%, приблизительно 13%, приблизительно 13.5%, приблизительно 14%, приблизительно 14.5% или приблизительно 15%.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляют приблизительно 20-40 вес.% относительно общей массы состава, по крайней мере один ПЛГлА составляет приблизительно 57.5-72.5%, и по крайней мере одна жирная кислота составляет приблизительно 2.5-7.5%.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляют приблизительно 20-40 вес.% относительно общей массы состава, по крайней мере один ПЛГлА составляет приблизительно 57.5-77.5%, и по крайней мере одна жирная кислота составляет приблизительно 2.5%.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляют приблизительно 30 вес.% относительно общей массы состава, по крайней мере один ПЛГлА составляет приблизительно 55.5-69%, и по крайней мере одна жирная кислота составляет приблизительно 1-15%.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляют приблизительно 30 вес.% относительно общей массы состава, по крайней мере один ПЛГлА составляет приблизительно 62.5-67.5%, и по крайней мере одна жирная кислота составляет приблизительно 2.5-7.5%.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляют приблизительно 30%, по крайней мере один ПЛГлА составляет приблизительно 67.5%, и жирная кислота составляет приблизительно 2.5% относительно общей массы состава.
В некоторых воплощениях по крайней мере один ПЛГлА включает первый ПЛГлА и второй ПЛГлА, причем молекулярная масса первого ПЛГлА составляет приблизительно 42000-75000 Да, молекулярная масса второго ПЛГлА - приблизительно 15000-35000 Да, и весовое отношение первого ПЛГлА и второго ПЛГлА равно от 95:5 до 5:95.
В некоторых воплощениях молекулярная масса первого ПЛГлА составляет приблизительно 15000-30000 Да, приблизительно 15000-25000 Да, приблизительно 15000-20000 Да, приблизительно 20000-35000 Да, приблизительно 20000-30000 Да, приблизительно 20000-25000 Да, приблизительно 25000-35000 Да, приблизительно 25000-30000 Да или приблизительно 30000-35000 Да.
В некоторых воплощениях молекулярная масса второго ПЛГлА составляет приблизительно 45000-70000 Да, приблизительно 50000-65000 Да, приблизительно 55000-60000 Да, приблизительно 45000-65000 Да, приблизительно 45000-60000 Да, приблизительно 45000-55000 Да, приблизительно 45000-50000 Да, приблизительно 50000-70000 Да, приблизительно 50000-55000 Да, приблизительно 60000-65000 Да, приблизительно 60000-70000 Да, приблизительно 45000-75000 Да, приблизительно 50000-75000 Да, приблизительно 55000-75000 Да, приблизительно 60000-75000 Да, приблизительно 65000-75000 Да или приблизительно 70000-75000 Да.
В некоторых воплощениях весовое соотношение первого ПЛГлА и второго ПЛГлА может быть от 90:10 до 10:90, от 85:15 до 15:85, от 80:20 до 20:80, от 75:25 до 25:75, от 70:30 до 30:70, от 65:35 до 35:65, от 60:40 до 40:60 или от 55:45 до 45:55.
В некоторых воплощениях первый ПЛГлА выбирается из: ПЛГлА (7525 4 А) и ПЛГлА (7525 5 А), а второй ПЛГлА - это ПЛГлА (5050 2.5 А).
В некоторых воплощениях весовое соотношение первого ПЛГлА и второго ПЛГлА равно примерно 50:50.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляет приблизительно 20-40%, количество первого ПЛГлА и второго ПЛГлА составляет приблизительно 57.5-72.5%, и жирная кислота составляет приблизительно 2.5-7.5% относительно общей массы состава.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляет приблизительно 20-40%, количество первого ПЛГлА и второго ПЛГлА составляет приблизительно 57.5-77.5%, и жирная кислота составляет приблизительно 2.5% относительно общей массы состава.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляет приблизительно 30%, количество первого ПЛГлА и второго ПЛГлА составляет приблизительно 55-69%, и жирная кислота составляет приблизительно 1-15% относительно общей массы состава.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляет приблизительно 30%, количество первого ПЛГлА и второго ПЛГлА составляет приблизительно 62.5-67.5%, и жирная кислота составляет приблизительно 2.5-7.5% относительно общей массы состава.
В некоторых воплощениях ротиготин или его фармацевтически приемлемая соль составляет приблизительно 30%, количество первого ПЛГлА и второго ПЛГлА составляет приблизительно 67.5%, и жирная кислота составляет приблизительно 2.5% относительно общей массы состава.
Раскрываемый здесь состав может обеспечить длительное высвобождение вещества, такого как ротиготин или его фармацевтически приемлемая соль. Например, микросферный препарат, содержащий ротиготин или его фармацевтически приемлемую соль, ПЛГлА и жирную кислоту, может уменьшить эффект малого высвобождения препарата, который может иметь место после того, как микросферный препарат введен на 1-4 сут, и одновременно уменьшить эффект взрывного высвобождения. Микросферы, приготовленные, как раскрыто здесь, также имеют хорошую однородность от партии к партии. Изменение концентрации препарата в крови среди отдельных животных может также быть значительно уменьшено.
Состав, раскрытый в данной заявке, может уменьшить эффект взрывного высвобождения, особенно когда препарат, такой как ротиготин или его фармацевтически приемлемая соль, составляют более 20 вес.% относительно общей массы состава. Весовой процент вещества, такого как ротиготин или его фармацевтически приемлемая соль, относительно общей массы состава называется здесь ″относительным содержанием препарата″.
Раскрываемый здесь состав высвобождает препарат устойчиво долгое время без существенного взрывного высвобождения, таким образом, достигая цели длительного высвобождения.
Раскрываемый здесь ПЛГлА также известен как полилактид-гликолид, сополимер лактида/гликолида. Полимеризационное соотношение лактида к гликолиду в пределах полилактида-гликолида может быть любым подходящим соотношением. Например, полимеризационное соотношение лактида к гликолиду может быть от 95:5 до 5:95, или от 75:25 до 25:75.
ПЛГлА может быть представлен следующей структурой:
где n - ноль или положительное целое число, и m - ноль или положительное целое число, но n и m не могут быть нулями одновременно. ПЛГлА в том виде, какой раскрыт здесь, может быть далее химически модифицирован.
Раскрываемые здесь микросферы - матричного типа, содержащие препарат, растворенный и/или гомогенно диспергированный по всей матрице полимера.
Раскрываемые здесь микросферы могут иметь размеры в пределах приблизительно 1-250 мкм, например, приблизительно 10-240 мкм, приблизительно 20-230 мкм, приблизительно 40-210 мкм, приблизительно 50-200 мкм, приблизительно 60-190 мкм, приблизительно 70-180 мкм, приблизительно 80-170 мкм, приблизительно 90-160 мкм, приблизительно 100-150 мкм, приблизительно 110-140 мкм или приблизительно 120-130 мкм. Например, микросферы, раскрываемые здесь, могут быть размером приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240 или 250 мкм.
Раскрываемые здесь микросферы могут быть приготовлены любым обычным методом, включая, но не ограничиваясь, методом распыления (спрей), методом испарения растворителя или распылительно-экстракционным методом.
Когда микросферы изготавливают методом испарения растворителя, вещество, такое как ротиготин или его фармацевтически приемлемая соль, ПЛГлА и жирную кислоту сначала растворяют в органическом растворителе, чтобы приготовить органическую фазу. Непрерывную водную фазу готовят из водорастворимых фармацевтических полимерных вспомогательных материалов. Органическую фазу затем вводят в непрерывную водную фазу через маленькую трубку с образованием смеси, которую превращают в эмульсию при энергичном механическом перемешивании или ультразвуковом перемешивании для образования микросфер. Затем органический растворитель испаряют, и получившиеся микросферы отфильтровывают и высушивают. Если необходимо, микросферы можно также дополнительно обработать, промывая, просеивая, и т.д., согласно обычным методам, высушить в вакууме или лиофилизировать, и, наконец, упаковать.
В вышеупомянутых процессах органический растворитель должен иметь достаточную летучесть, малый остаток и низкую точку кипения. Например, органический растворитель может быть дихлорметаном, хлороформом, этилацетатом, диэтиловым эфиром или любой их комбинацией. Растворимые в воде фармацевтические полимерные вспомогательные материалы, используемые для получения непрерывной водной фазы, могут быть выбраны из списка (неограничивающего): поливиниловый спирт, натрий-карбоксиметилцеллюлоза, поливинилпирролидин, полиметакрилат натрия, полиакрилат натрия и любая их комбинация.
Количества соединений, таких как ротиготин или его фармацевтически приемлемая соль, полилактид-гликолид и жирная кислота в органическом растворителе особенно не ограничиваются, при условии, что они могут быть растворены (без остатка) в органическом растворителе. Например, полилактид-гликолид и жирная кислота могут составлять приблизительно 1-30% (вес./об.), например, приблизительно 5-25% (вес./об.) или приблизительно 10-20% (вес./об.) в органическом растворителе.
Когда непрерывная водная фаза приготовлена из поливинилового спирта, натрий-карбоксиметилцеллюлозы, поливинилпирролидина, полиметакрилата натрия, полиакрилата натрия или любой их комбинации, нет никаких специальных пределов для концентраций этих полимерных вспомогательных материалов. Например, концентрация этих полимерных вспомогательных материалов может составлять 0.01-12.0% (вес./об.), например, 0.01-10.0% (вес./об.) или 0.1-5% (вес./об.) в водной фазе, исходя из их растворимости в воде.
Когда органическая фаза введена в водную фазу и энергично размешана для образования микросфер, объемное соотношение водной и органической фаз должно быть достаточно большим, чтобы в достаточной степени диспергировать органическую фазу в водной фазе, чтобы образовались микросферы с достаточно малыми размерами и хорошей однородностью. Но если количество водной фазы превосходит необходимое, последующая обработка может быть осложнена, что увеличит стоимость. Например, объемное соотношение органической и водной фаз может быть от 1:4 до 1:100, например, около 1:5, около 1:10, около 1:20, около 1:30, около 1:40, около 1:50, около 1:60, около 1:70, около 1:80, около 1:90 или около 1:100.
Микросферы могут также быть изготовлены методом распылительной сушки. Например, соединение, такое как ротиготин или его фармацевтически приемлемая соль, ПЛГлА и другие наполнители растворяют в органическом растворителе до образования органического раствора. Органический раствор фильтруют и высушивают обычным методом распылительной сушки с образованием микросфер. Если необходимо, микросферы можно также дополнительно обработать, промывая, просеивая, и т.д., согласно обычному методу, и затем упаковать.
Когда микросферы изготовлены вышеупомянутым методом распылительной сушки, органический растворитель может быть выбран из списка (неограничивающего): дихлорметан, хлороформ, этилацетат, диоксан, диэтиловый эфир, ацетон, тетрагидрофуран, ледяная уксусная кислота и любая их комбинация.
При приготовлении органической фазы нет никаких специальных пределов на количестве ПЛГлА в органическом растворителе, при условии, что ПЛГлА растворяется в данном органическом растворителе (без остатка). Например, концентрация ПЛГлА может составлять приблизительно 1-30% (вес./об.), например, приблизительно 5-25% (вес./об.) или приблизительно 10-20% (вес./об.).
Микросферы могут также быть изготовлены распылительно-экстрационным методом. Когда микросферы готовят распылительно-экстрационным методом, соединение, такое как ротиготин или его фармацевтически приемлемая соль, ПЛГлА и другие наполнители растворяют в достаточном объеме органического растворителя (в котором соединение, такое как ротиготин или его фармацевтически приемлемая соль, ПЛГлА и жирная кислота растворяются) для приготовления органического раствора. Затем органический раствор распыляют в воду или органический растворитель B (в котором ротиготин или его фармацевтически приемлемая соль, ПЛГлА и жирная кислота имеют ограниченную растворимость) и экстрагируют с образованием микросфер. Если необходимо, микросферы можно также дополнительно обработать, промывая, просеивая, и т.д., согласно обычному методу, и затем упаковать.
Органический растворитель A может быть, по крайней мере, одним из списка: дихлорметан, хлороформ, этилацетат, диоксан, диэтиловый эфир, ацетон, тетрагидрофуран, бензол, толуол и ледяная уксусная кислота. Органический растворитель B может быть, по крайней мере, одним выбранным из списка: метанол, этанол, пропанол, изопропиловый спирт, петролейный эфир, алкан и вазелиновое масло.
Нет никаких специальных пределов для количества ПЛГлА в органическом растворителе A, при условии, что ПЛГлА растворяется в органическом растворителе A (без остатка). Например, концентрация ПЛГлА в органическом растворителе A может составлять приблизительно 1-30% (вес./об.), например, приблизительно 5-25% (вес./об.) или приблизительно 10-20% (вес./об.).
Чтобы улучшить однородность размеров образованных микросфер и для удобства обработки, метод распылительной сушки следует предпочесть методу испарения растворителя и распылительно-экстракционному методу. Чтобы снизить начальное высвобождение, однако, метод испарения растворителя может быть предпочтителен.
После приготовления микросферы могут быть подвергнуты сортировке по размерам, очистке, сушке и упакованы согласно предопределенной дозировке (порошковые инъекции). Если размер частиц достаточно однороден, этап сортировки по размерам частиц может быть опущен.
Настоящее изобретение также обеспечивает порошковые инъекции, приготовленные с использованием раскрывыемого здесь состава. Порошковые инъекции могут быть преобразованы в жидкие инъекции in situ перед использованием. Порошковые инъекции могут быть приготовлены непосредственно из состава, например, в форме микросфер, как раскрыто здесь, и однородно смешаны с натрий-карбоксиметилцеллюлозой, вводимой до использования. Порошковые инъекции могут также быть приготовлены смешением состава, например, в форме микросфер, как раскрыто здесь, с соответствующим количеством натрий-карбоксиметилцеллюлозы, маннита, глюкозы и т.д. Чтобы приготовить инъекцию, до использования может быть добавлено необходимое количество очищенной воды.
Настоящее изобретение также обеспечивает способ лечения заболевания, связанного с рецепторами допамина и/или болезнью Паркинсона, включающий введение эффективного количества раскрытого здесь состава нуждающемуся в нем пациенту. Например, метод может включить введение состава, содержащего ротиготин или его фармацевтически приемлемую соль в количестве приблизительно 20-35 вес.% относительно общей массы состава, по крайней мере одну жирную кислоту в количестве приблизительно 2.5-10 вес.% относительно общей массы состава и по крайней мере один ПЛГлА в количестве приблизительно 55-77.5 вес.% относительно общей суммы состава, причем состав находится в форме микросфер. В другом примере способ может включать введение состава, содержащего ротиготин или его фармацевтически приемлемую соль в количестве приблизительно 30 вес.% относительно общей массы состава, по крайней мере одну жирную кислоту в количестве приблизительно 2.5 вес.% относительно общей массы состава и по крайней мере один ПЛГлА, такого, как первый ПЛГлА и второй ПЛГлА, как раскрыто здесь, в количестве приблизительно 67.5 вес.% относительно общей суммы состава, причем состав находится в форме микросфер.
Раскрытый здесь состав можно вводить парентерально нуждающемуся в нем пациенту. Например, состав можно вводить внутримышечной инъекцией, подкожной инъекцией, внутрикожной инъекцией, внутрибрюшинной инъекцией и т.д. Для простоты введения, раскрытый здесь состав можно вводить внутримышечной инъекцией или подкожной инъекцией.
Раскрытый здесь состав можно вводить с промежутками по крайней мере приблизительно две недели, или приблизительно три недели, приблизительно четыре недели, приблизительно пять недель и т.д.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 - диаграмма высвобождения in vitro из микросфер (с теоретическим относительным содержанием препарата 20%), содержащих единственный ПЛГлА, изготовленных в примере 1, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.2 - диаграмма in vitro высвобождения из микросфер (с теоретическим относительным содержанием препарата 25%), содержащих единственный ПЛГлА, изготовленных в примере 2, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.3 - диаграмма in vitro высвобождения из микросфер (с теоретическим относительным содержанием препарата 30%), содержащих единственный ПЛГлА, приготовленных в примере 3, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.4 - диаграмма in vitro высвобождения из микросфер (с теоретическим относительным содержанием препарата 35%), содержащих единственный ПЛГлА, приготовленных в примере 4, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.5 - диаграмма in vitro высвобождения из микросфер (с теоретическим относительным содержанием препарата 40%), содержащих единственный ПЛГлА, приготовленных в примере 5, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.6 показывает концентрационные кривые in vivo микросфер, изготовленных в примерах 3 и 8, где ♦ - кривая in vivo высвобождение-время для микросфер (ПЛГлА 7525 4 А), изготовленных в примере 3, и ▲ - кривая in vivo высвобождение-время для микросфер (содержащих 2.5% стеариновой кислоты и ПЛГлА 7525 4 А), приготовленных в примере 8.
Фиг.7 - диаграмма in vitro высвобождения из микросфер (с теоретическим относительным содержанием препарата 20%), содержащих единственный ПЛГлА и стеариновую кислоту, приготовленных в примере 6, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.8 - диаграмма in vitro высвобождения препарата из микросфер (с теоретическим относительным содержанием препарата 25%), содержащих единственный ПЛГлА и стеариновую кислоту, изготовленных в примере 7, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.9 - диаграмма in vitro высвобождения препарата из микросфер (с теоретическим относительным содержанием препарата 30%), содержащих единственный ПЛГлА и стеариновую кислоту, изготовленных в примере 8, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.10 - диаграмма in vitro высвобождения препарата из микросфер (с теоретическим относительным содержанием препарата 35%), содержащих единственный ПЛГлА и стеариновую кислоту, изготовленных в примере 9, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.11 - диаграмма in vitro высвобождения препарата из микросфер (с теоретическим относительным содержанием препарата 40%), содержащих единственный ПЛГлА и стеариновую кислоту, приготовленных в примере 10, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.12 - диаграмма in vitro высвобождения препарата из микросфер, содержащих 2.5% октановой кислоты (С8), приготовленных в примере 11, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.13 - диаграмма in vitro высвобождения препарата из микросфер, содержащих 2.5% лигноцериновой кислоты (С24), приготовленных в примере 12, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.14 - диаграмма in vitro высвобождения препарата из микросфер, содержащих 0.5% стеариновой кислоты, приготовленных в примере 13, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.15 - диаграмма in vitro высвобождения препарата из микросфер, содержащих 1% стеариновой кислоты, приготовленных в примере 14, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.16 - диаграмма in vitro высвобождения препарата их микросфер, содержащих 5% стеариновой кислоты, приготовленных в примере 15, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.17 - диаграмма in vitro высвобождения препарата из микросфер, содержащих 10% стеариновой кислоты, приготовленных в примере 16, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.18 -диаграмма in vitro высвобождения препарата из микросфер, содержащих 15% стеариновой кислоты, приготовленных в примере 17, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.19 - кривая высвобождения in vivo препарата из микросфер, содержащих ПЛГлА 5050 2.5 А.
Фиг.20 - диаграмма in vitro высвобождения препарата из микросфер, содержащих два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=95:5), приготовленных в примере 18, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.21 - диаграмма in vitro высвобождения препарата из микросфер, содержащих два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=50:50), приготовленных в примере 19, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.22 - диаграмма in vitro высвобождения препарата из микросфер, содержащих два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=5:95), приготовленных в примере 20, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.23 - диаграмма in vitro высвобождения препарата из микросфер, содержащих стеариновую кислоту (1%) и два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=50:50), приготовленных в примере 21, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.24 - диаграмма in vitro высвобождения препарата из микросфер, содержащих стеариновую кислоту (2.5%) и два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=50:50), приготовленных в примере 22, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.25 - диаграмма in vitro высвобождения препарата из микросфер, содержащих стеариновую кислоту (7.5%) и два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=50:50), приготовленных в примере 23, где Δ - ежесуточно высвобождаемое количество, ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.26 - диаграмма in vitro высвобождения препарата из микросфер, содержащих стеариновую кислоту (10%) и два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=50:50), приготовленных в примере 24, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.27 - диаграмма in vitro высвобождения препарата из микросфер, содержащих октановую кислоту (2.5%) и два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=50:50), приготовленных в примере 25, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.28 - диаграмма in vitro высвобождения препарата из микросфер, содержащих лигноцериновую кислоту (2.5%) и два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=50:50), приготовленных в примере 26, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.29 - диаграмма in vitro высвобождения препарата из микросфер, содержащих стеариновую кислоту (2.5%) и два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=95:5), приготовленных в примере 27, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.30 - диаграмма in vitro высвобождения препарата из микросфер, содержащих стеариновую кислоту (2.5%) и два ПЛГлА с различными молекулярными массами (7525 4 А: 5050 2.5 А=5:95), приготовленных в примере 28, где Δ - ежесуточно высвобождаемое количество и ■ - совокупное (кумулятивное) высвобожденное количество.
Фиг.31 - кривая высвобождения препарата in vivo из микросфер, содержащих стеариновую кислоту (2.5%) и два ПЛГлА с различными молекулярными массами в различных весовых соотношениях, где ♦ - кривая высвобождения in vivo препарата из микросфер (7525 4 А: 5050 2.5 А=50:50) (2.5% стеариновая кислота), ▲ - кривая высвобождения in vivo препарата из микросфер (7525 4 А: 5050 2.5 А=70:30) (2.5% стеариновой кислоты), ─ - кривая высвобождения in vivo препарата из микросфер (7525 4 А: 5050 2.5 А=80:20) (стеариновая кислота на 2.5%), и ■ - кривая высвобождения in vivo препарата из микросфер (7525 4 А: 5050 2.5 А=90:10) (2.5% стеариновой кислоты).
Фиг.32 - диаграмма корреляции in vitro - in vivo для ротиготиновых микросфер, приготовленных в примере 22.
Фиг.33 - диаграмма in vitro высвобождения препарата из 5 партий микросфер, приготовленных в примере 3.
Фиг.34 - диаграмма in vitro высвобождения препарата из 5 партий микросфер, приготовленных в примере 8.
Фиг.35 - диаграмма in vitro высвобождения препарата из 5 партий микросфер, приготовленных в примере 14.
Фиг.36 - диаграмма in vitro высвобождения препарата из 5 партий микросфер, приготовленных в примере 16.
Фиг.37 - диаграмма in vitro высвобождения препарата и