Фармацевтическая композиция для перорального введения с улучшенными растворимостью и/или всасываемостью
Иллюстрации
Показать всеДанное изобретение относится к фармацевтической композиции для перорального введения, содержащей 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид, его соль или его сольват в качестве активного фармацевтического ингредиента и фумаровую кислоту в качестве кислотной добавки. Фумаровая кислота содержится в количестве от 0,25 до 5 массовых долей на массовую долю 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида. Также описан способ стабилизации, улучшения растворимости и улучшения всасываемости 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида благодаря добавлению к фармацевтической композиции фумаровой кислоты. 8 н. и 4 з.п. ф-лы, 5 ил., 8 табл., 9 пр.
Реферат
ОБЛАСТЬ ТЕХНИЧЕСКОГО ПРИМЕНЕНИЯ
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка заявляет приоритет японской заявки на патент №2012-205681, поданной 19 сентября 2012 года, раскрытие которой включено в настоящий документ путем ссылки во всей ее полноте.
Настоящее изобретение относится к фармацевтической композиции для перорального введения, содержащей 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид, его соль или его сольват.
УРОВЕНЬ ТЕХНИКИ
Биодоступность, которая представляет собой показатель, демонстрирующий степень, с которой вводимое лекарство достигает и действует в крови, в системе кровообращения, представляет собой клинически-значимый параметр, тесно связанный с лекарственной эффективностью и токсичностью. Прогнозирование или контроль лекарственной эффективности или токсичности лекарств с низкой биодоступностью является затруднительным, так как им иногда не удается достичь ожидаемой лекарственной эффективности или обладают большой внутри- и межиндивидуальной изменчивостью. Таким образом, в разработке фармацевтических продуктов важно получение подходящей биодоступности. Препараты для перорального введения подвергаются эффективному всасыванию в желудочно-кишечном тракте и метаболизму в печени и желудочно-кишечном тракте. В частности, для плохорастворимых лекарств, улучшение растворимости лекарства из фармацевтического препарата или улучшение растворимости лекарства в воде является важным для получения подходящей биодоступности.
4-((1-Метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид или его соль является лекарством для предупреждения и/или лечения аллергических заболеваний, воспалительных заболеваний, дегенеративных заболеваний мышц и того подобного, вызванного ингибирующим действием простагландин D-синтазы, особенно гематопоэтической простагландин D-синтазы (патентная литература 1). Однако существует проблема гарантированной подходящей биодоступности из-за низких всасываемости и растворимости лекарства в нейтральном диапазоне рН.
Для улучшения растворимости и всасываемости лекарства широко известен способ добавления органической кислоты. Описанные методики включают, например, методику комбинирования бензимидазольного соединения и рН-модификатора, такого как фумарат натрия (патентная литература 2), методику комбинирования производного морфинана и органической кислоты, такой как фумаровая кислота (патентная литература 3) и тому подобное.
Однако относительно 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-илкарбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида нет документа, описывающего, что растворимость и/или всасываемость улучшаются путем добавления конкретной органической кислоты в качестве кислотной добавки, как в настоящем изобретении.
СПИСОК ЦИТИРУЕМЫХ ИСТОЧНИКОВ
ПАТЕНТНАЯ ЛИТЕРАТУРА
ПТЛ 1: WO 2010/104024
ПТЛ 2: WO 2008/123536
ПТЛ 3: WO 2008/143240
Сущность изобретения
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Целью настоящего изобретения является предоставление фармацевтической композиции для перорального введения, содержащей 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид, обладающей улучшенными растворимостью и/или всасываемостью.
РЕШЕНИЕ ПРОБЛЕМЫ
Авторы настоящего изобретения добавляли разные типы органической кислоты к 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамиду, его соли или его сольвату для оценки его совместимости, растворимости и всасываемости. В результате, они обнаружили, что при добавлении конкретной органической кислоты, такой как адипиновая кислота, янтарная кислота или фумаровая кислота, в качестве кислотной добавки, может быть получена фармацевтическая композиция для перорального введения с превосходными растворимостью и всасываемостью, без влияния на стабильность 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида. Настоящее изобретение было выполнено таким образом.
Конкретно, настоящее изобретение предоставляет фармацевтическую композицию для перорального введения, содержащую 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид, его соль или его сольват и по меньшей мере одну органическую кислоту, выбранную из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет пациентам и специалистам в области здравоохранения фармацевтическую композицию для перорального введения, обладающую превосходными растворимостью и всасываемостью, поскольку на стабильность активного фармацевтического ингредиента не оказывается неблагоприятного влияния, а фармацевтическая композиция обеспечивает его активность.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
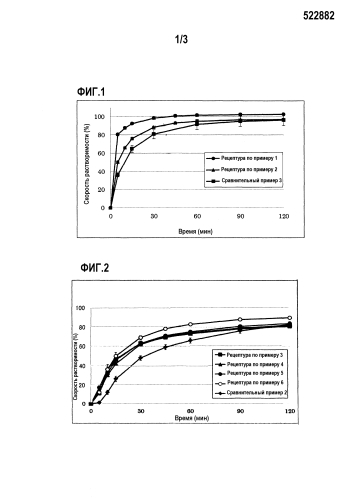
На фиг. 1 показаны результаты испытания на растворимость примера 2.
На фиг. 2 показаны результаты испытания на растворимость примера 3.
На фиг. 3 показаны результаты испытания на растворимость примера 4.
На фиг. 4 показаны результаты испытания на растворимость примера 5.
На фиг. 5 показаны результаты испытания на растворимость примера 5.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В контексте описания изобретения формы единственного числа включают в себя как единственное, так и множественное число за исключением случаев, указанных в настоящем документе или очевидно не противоречившие контексту.
Активный фармацевтический ингредиент фармацевтической композиции для перорального введения по настоящему изобретению представляет собой 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид. 4-((1-Метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид, который может быть солью. Примеры соли соединения по настоящему изобретению включают соли, обычно используемые в области органической химии, такие как соли присоединения кислоты.
Примеры солей присоединения кислоты включают в себя соли неорганических кислот, такие как гидрохлориды, сульфаты, нитраты, фосфаты и перхлораты; соли органических кислот, такие как ацетаты, формиаты, малеаты, фумараты, тартраты, цитраты, аскорбаты и трифторацетаты; сульфонаты, такие как метансульфонаты, изетионаты, бензолсульфонаты, п-толуолсульфонаты, и так далее.
4-((1-Метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид может быть сольватом, предпочтительно гидратом и наиболее предпочтительно моногидратом.
Фармацевтическая композиция для перорального введения по настоящему изобретению включает кислотную добавку. Кислотная добавка представляет собой адипиновую кислоту, янтарную кислоту, фумаровую кислоту, L-аспарагиновую кислоту или L-глутаминовую кислоту. Данные кислотные добавки можно использовать отдельно или в комбинации двух или более.
Количество кислотной добавки для смешивания составляет примерно от 0,25 до 5 массовых долей, предпочтительно примерно от 0,5 до 2 массовых долей, более предпочтительно примерно от 0,8 до 1,5 массовых долей и наиболее предпочтительно примерно 1 массовую долю на массовую долю активного фармацевтического ингредиента 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида. Когда добавляют две или более кислотные добавки общее количество кислотных добавок рассматривают как суммарное количество кислотной добавки.
Фармацевтическая композиция для перорального введения по настоящему изобретению может включать различные наполнители, которые обычно используют для фармацевтических препаратов до тех пор, пока действие по настоящему изобретению не уменьшится. Наполнители для фармацевтических препаратов особенно не ограничивают до тех пор, пока они являются обычно используемыми наполнителями. Примеры таких наполнителей включают дезинтегранты, смазывающие вещества, ароматизаторы, покрывающие вещества, красители, корригирующие вещества и тому подобное.
Когда в качестве наполнителя содержится разбавитель, количество кислотной добавки для смешивания составляет примерно от 0,15 до 6 массовых долей, предпочтительно примерно от 0,2 до 2 массовых долей и более предпочтительно примерно от 0,5 до 2 массовых долей на массовую долю разбавителя. Когда используют две или более кислотные добавки общее количество кислотных добавок рассматривают как суммарное количество кислотной добавки.
Примеры разбавителей включают лактозу, сахарозу, сукрозу, маннит, кристаллическую целлюлозу, кукурузный крахмал, декстран и тому подобное. Примеры связующих веществ включают гидроксипропилцеллюлозу, гипромеллозу, поливиниловый спирт и тому подобное. Примеры дезинтегрантов включают кроскармеллозу натрия, кросповидон, гидроксипропилцеллюлозу с низкой степенью замещения и тому подобное. Примеры смазывающих веществ включают гидрированные масла, стеарат магния, стеарат кальция, тальк, сложные эфиры сукрозы и жирных кислот и стеариновую кислоту. Примеры покрывающих веществ включают этилцеллюлозу, гипромеллозу, сложный эфир гипромеллозы и фталевой кислоты, макрогол, Опадрай и тому подобное. Примеры красителей включают в себя пищевой желтый №5, пищевой голубой №2, пищевой лаковый краситель, оксид железа, желтый оксид железа, оксид титана и тому подобное. Примеры ароматизаторов включают различные ароматы апельсина, лимона и тому подобного. Примеры корригирующих веществ включают 1-ментол, камфару, перечную мяту и тому подобное. Они могут быть использованы отдельно или в комбинации двух или более.
Фармацевтической композиции для перорального введения по настоящему изобретению можно придать форму гранулированных продуктов, сформированных под давлением продуктов (например, непокрытых таблеток и таблеток с пленочным покрытием), порошки и тому подобное. Фармацевтическому препарату для перорального введения по настоящему изобретению можно придать форму таблеток, гранул, порошков, мелких зерен и тому подобному. Примеры таблеток включают в себя жевательные таблетки, пастилки, капли, таблетки, которые быстро растворяются или распадаются в ротовой полости и можно принимать без воды и шипучие таблетки, которые растворяются при применении. Примеры гранул, порошков и мелких зерен включают в себя сухие сиропы, которые растворяются при использовании и порошкообразные или гранулированные продукты, которые быстро растворяются в ротовой полости и которые можно принимать без воды.
Фармацевтическая композиция или фармацевтический препарат для перорального введения по настоящему изобретению может быть приготовлена при использовании известного способа получения фармацевтических препаратов для перорального приема. Примеры способа включают непосредственно способ таблетирования, в котором компоненты смешиваются с последующим таблетированием и способ, в котором получают гранулированный продукт, содержащий компоненты с последующим таблетированием. Примеры способа гранулирования включают гранулирование в псевдоожиженном слое, гранулирование перемешиванием, гранулирование вращением в псевдоожиженном слое, гранулирование экструзией, гранулирование распылением, гранулирование дроблением и тому подобное. Получаемые таблетки могут быть покрытыми пленкой, например напылением покрывающей жидкостью на таблетки.
Композиция по настоящему изобретению вводится млекопитающим, таким как люди, обезьяны, собаки, кошки, кролики, мыши, крысы и морские свинки, и предпочтительно людям.
Суточная доза фармацевтической композиции для перорального введения по настоящему изобретению может быть соответственно выбрана согласно состоянию пациента, возрасту, весу тела и полу, способу введения или тому подобному. Суточная доза 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида, который содержится в качестве активного фармацевтического ингредиента для взрослого (вес тела 50 кг) типично составляет примерно от 1 до 1000 мг и предпочтительно от 10 до 800 мг. Композицию можно вводить в однократной дозе или двумя-тремя разделенными дозами в день.
В одном варианте осуществления активный фармацевтический ингредиент соединения 1, его соль или его сольват в композиции по настоящему изобретению стабилизирован. Выражение «стабилизированный» означает, что разложение количества моногидрата соединения 1, полученного при смешивании порошка активного фармацевтического ингредиента соединения 1 и кислотной добавки, сохраняющего устойчивость в течение конкретного периода (например, двух недель), меньше чем количество, полученное без добавления кислотной добавки.
В другом варианте осуществления композиция по настоящему изобретению обладает улучшенной растворимостью. Выражение «улучшенная растворимость» здесь означает, что фармацевтическая композиция или препарат, содержащий кислотную добавку по настоящему изобретению, обладает эквивалентной или большей растворимостью, чем растворимость фармацевтической композиции или препарата, не содержащей кислотной добавки. Одним примером является случай, когда разница в растворимости между активным фармацевтическим ингредиентом в фармацевтическом препарате, содержащем кислотную добавку, и активным фармацевтическим ингредиентом в фармацевтическом препарате, не содержащем кислотную добавку, составляет примерно 10%, тогда как оба препарата получены через 15 минут после испытания на растворимость, который осуществлен согласно испытанию на растворимость (конкретно, лопастной способ), описанному в японской фармакопее, шестнадцатом издании.
В еще одном варианте осуществления композиция по настоящему изобретению может достигать улучшенной всасываемости. Выражение «улучшенная всасываемость» означает, что всасываемость телом фармацевтической композиции или препарата, содержащей кислотную добавку по настоящему изобретению является эквивалентной или большей, чем всасываемость фармацевтической композиции или препарата, которая не содержит кислотную добавку. Например, область под кривой концентрация крови - время (AUC), полученная после введения фармацевтической композиции или препарата по настоящему изобретению в 1,5 или более раз больше, чем область под кривой концентрация крови - время фармацевтического препарата, который не содержит кислотную добавку. Кроме того, максимальная концентрация лекарства (Cmax) активного фармацевтического ингредиента полученного после введения фармацевтической композиции или препарата по настоящему изобретению в 1,5 или более раз больше, чем максимальная концентрация фармацевтического препарата, не содержащего кислотную добавку.
Ниже представлены варианты осуществления, включающие предпочтительные варианты осуществления настоящего изобретения.
1. Фармацевтическая композиция для перорального введения содержит 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид, его соль или его сольват в качестве активного фармацевтического ингредиента и по меньшей мере одну кислотную добавку, выбранную из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты.
2. Фармацевтическая композиция для перорального введения по п.1, в которой кислотная добавка содержится в количестве от 0,25 до 5 массовых долей на массовую долю 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида.
3. Фармацевтическая композиция для перорального введения по п.1, в которой кислотная добавка содержится в количестве от 0,5 до 2 массовых долей на массовую долю 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида.
4. Фармацевтическая композиция для перорального введения по п.1, в которой композиция дополнительно содержит разбавитель, и кислотная добавка содержится в количестве от 0,15 до 6 массовых долей на массовую долю разбавителя.
5. Фармацевтическая композиция для перорального введения по любому из пп.1-4, в которой кислотной добавкой является фумаровая кислота.
6. Фармацевтическая композиция по любому из пп.1-5, в котором разница в скорости растворения между активным фармацевтическим ингредиентом фармацевтического препарата, содержащего кислотную добавку, и активным фармацевтическим ингредиентом фармацевтического препарата, не содержащего кислотную добавку, составляет примерно 10%, фармацевтические препараты получены через 15 минут после испытания на растворимость, согласно способу испытания на растворимость, описанному в японской фармакопее, шестнадцатом издании.
7. Фармацевтическая композиция для перорального введения по любому из пп.1-5, в которой AUC и Cmax активного фармацевтического ингредиента, полученного после перорального введения фармацевтической композиции, в 1,5 или более раз больше, чем AUC и Cmax фармацевтического препарата, не содержащего кислотную добавку.
8. Способ стабилизации 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида, его соли или его сольвата, содержащегося в фармацевтической композиции, способ включает добавление к фармацевтической композиции по меньшей мере одной кислотной добавки, выбранной из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты.
9. Способ улучшения растворимости 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида, его соли или его сольвата, содержащегося в фармацевтической композиции, способ включает добавление к фармацевтической композиции по меньшей мере одной кислотной добавки, выбранной из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты.
10. Способ улучшения всасываемости 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида, его соли или его сольвата, содержащегося в фармацевтической композиции, способ включает в себя добавление к фармацевтической композиции по меньшей мере одной кислотной добавки, выбранной из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты.
11. Применение по меньшей мере одной кислотной добавки, выбранной из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты для стабилизации 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида, его соли или его сольвата, содержащегося в фармацевтической композиции.
12. Применение по меньшей мере одной кислотной добавки, выбранной из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты для улучшения растворимости 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида, его соли или его сольвата, содержащегося в фармацевтической композиции.
13. Применение по меньшей мере одной кислотной добавки, выбранной из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты для улучшения всасываемости 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида, его соли или его сольвата, содержащегося в фармацевтической композиции.
14. Применение по меньшей мере одной кислотной добавки, выбранной из группы, состоящей из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты для приготовления фармацевтической композиции для перорального введения, содержащей 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамид, его соль или его сольват.
ПРИМЕРЫ
Настоящее изобретение подробно описывается со ссылками на примеры, однако настоящее изобретение ими не ограничивается.
В примерах 2-5 могут быть использованы следующие материалы: разбавитель, выбранный из лактозы, сахарозы, сукрозы, маннита, кристаллической целлюлозы, кукурузного крахмала и декстрана; связующее вещество, выбранное из гидроксипропилцеллюлозы, гипромеллозы и поливинилового спирта; дезинтегрант, выбранный из кроскармеллозы натрия, кросповидона и гидроксипропилцеллюлозы с низкой степенью замещения; смазывающее вещество, выбранное из гидрированного масла, стеарата магния, стеарата кальция, талька, сложного эфира сукрозы и жирной кислоты и стеариновой кислоты; покрывающее вещество, выбранное из этилцеллюлозы, гипромеллозы, сложного эфира гипермеллозы и фталевой кислоты, макрогола и Опадрая; и краситель, выбранный из пищевого желтого №5, пищевого голубого №2, пищевого лакового красителя, оксида железа, желтого оксида железа и оксида титана. Отсутствие дезинтегранта, смазывающего вещества, покрывающего вещества или красителя будет существенно влиять на оценку растворимости или всасываемости фармацевтических препаратов.
ПРИМЕР 1
Испытание на совместимость
Моногидрат 4-((1-метилпиррол-2-ил)карбонил)-N-(4-(4-морфолин-1-ил-карбонилпиперидин-1-ил)фенил)-1-пиперазинкарбоксамида (соединения 1) и органические кислоты соответственно взвешивали в количестве 0,5 г. Моногидрат соединения 1 смешивали с каждой органической кислотой в ступке с получением индивидуальных смешанных порошков. Затем моногидрат соединения 1 взвешивали отдельно в количестве 0,5 г с получением порошка моногидрата соединения 1, по тому же самому способу как при приготовлении смешанных порошков с органическими кислотами.
Каждый смешанный с органической кислотой порошок и каждый порошок с моногидратом соединения 1 взвешивали в количествах 0,04 г и 0,02 г соответственно в герметичных и открытых стеклянных сосудах. Эти сосуды оставляли стоять при 60°С и относительной влажности 60% в течение двух недель и затем для оценки стабильности с помощью ВЭЖХ исследовали получение родственной примеси моногидрата соединения 1. Для оценки использовали высокоскоростной жидкостной хроматограф (Shimadzu Corporation). В таблице 2 показаны результаты.
Условия испытания
Детектор: Ультрафиолетовый спектрометр (длина волны измерения: 260 нм).
Колонка: Фенилированный силикагель для жидкостной хроматографии (3,5 мкм) (XBridge Phenyl, Japan Waters, Inc.) помещали в трубу из нержавеющей стали с внутренним диаметром 4,6 мм и длиной 10 см.
Температура колонки: Постоянная температура около 40°С.
Подвижная фаза.
Подвижная фаза А: Фосфатно-буферный раствор (рН 7).
Подвижная фаза В: Ацетонитрил.
Перемещение подвижной фазы: Градиент концентрации регулируется изменением соотношения смешивания подвижных фаз А и В как показано в таблице 1.
| Таблица 1 | ||
| Соотношение смешивания фаз А и В | ||
| Время после введения (мин) | Фаза А (%) | Фаза В (%) |
| 0-2 | 90→80 | 10→20 |
| 2-15 | 80→75 | 20→25 |
| 15-20 | 75→30 | 25→70 |
| 20-22 | 30 | 70 |
| Скорость потока: 1,5 мл/мин. |
Когда в качестве кислотной добавки добавляли безводную лимонную кислоту, L-винную кислоту, DL-винную кислоту или DL-яблочную кислоту, количество родственной примеси значительно увеличилось в открытых условиях, герметичных условиях или и в тех, и в других. В отличие от этого, когда добавляли органическую кислоту, выбранную из адипиновой кислоты, янтарной кислоты, фумаровой кислоты, L-аспарагиновой кислоты и L-глутаминовой кислоты, количество родственной примеси было таким же, как и первоначальное значение, как в открытых условиях, так и в герметичных условиях, которое не влияло на стабильность соединения 1 (таблица 2).
| Таблица 2 | |||
| Герметезированные (условия): родственные примеси (масс. %) | Открытые (условия): родственные примеси (масс. %) | Первоначальное значение родственных примесей (масс. %) | |
| Моногидрат соединения 1 | 0,44 | 0,47 | 0,46 |
| + адипиновая кислота | 0,20 | 0,17 | 0,23 |
| + янтарная кислота | 0,21 | 0,26 | 0,20 |
| + фумаровая кислота | 0,26 | 0,25 | 0,25 |
| + L-аспарагиновая кислота | 0,19 | 0,18 | 0,21 |
| + L-глутаминовая кислота | 0,20 | 0,17 | 0,20 |
| + безводная лимонная кислота | 2,03 | 43,31 | 0,50 |
| + L-винная кислота | 0,69 | 45,62 | 0,38 |
| + DL-винная кислота | 0,73 | 35,39 | 0,76 |
| + DL-яблочная кислота | 29,60 | 60,90 | 0,37 |
ПРИМЕР 2
Оценка растворимости фармацевтического препарата, содержащего органическую кислоту
Получали таблетки рецептурой по примеру 1, рецептурой по примеру 2 и сравнительного примера 1. В таблице 3 указана рецептура каждой таблетки.
Рецептура по примеру 1
Моногидрат соединения 1 (1 г) и фумаровую кислоту (1 г) в качестве кислотной добавки поместили в аппарат для измельчения таблеток (Konishi Seisakusyo Co., Ltd.) и измельчили с получением измельченного продукта, содержащего фумаровую кислоту. Измельченный продукт, содержащий фумаровую кислоту (1,50 г), разбавитель (4,17 г), дезинтегрант (0,30 г) и смазывающее вещество (0,030 г) вносили и смешивали в стеклянном сосуде, и затем смесь сжимали, используя таблетировочную машину с получением таблеток весом каждая 200 мг.
Рецептура по примеру 2
Вместо фумаровой кислоты (1 г) в рецептуру по примеру 1 в качестве кислотной добавки была добавлена янтарная кислота (1 г), с последующим измельчением с получением измельченного продукта, содержащего янтарную кислоту. Таблетки весом каждая 200 мг получали тем же самым способом, как и для рецептуры по примеру 1.
Сравнительный пример 1
В качестве контроля таблетки получали тем же самым способом как для рецептуры по примерам 1 и 2, за исключением того, что кислотную добавку не добавляли.
Испытание на растворимость
Относительно рецептур по примерам 1 и 2 и сравнительного примера 1 испытание на растворимость осуществляли при 50 оборотах в минуту, используя 900 мл раствора 2 для испытания на растворимость (37°С) в качестве испытуемого раствора в соответствии с лопастным способом из способов испытания на растворимость, описанного в японской фармакопее, шестнадцатом издании. В качестве оборудования для измерения использовали устройство для проведения измерения растворимости (Toyama Sangyo Co., Ltd.) и монитор для измерения растворимости (Otsuka Electronics Co., Ltd.).
Результаты показаны на фиг. 1 (n=3 средняя скорость растворимости ± стандартное отклонение). В сравнительном примере 1, который не содержал кислотной добавки скорость растворимости, полученная спустя 15 минут, составляла 65%, тогда как в рецептуре по примеру 1, которая содержала фумаровую кислоту и в рецептуре по примеру 2, которая содержала янтарную кислоту, скорости растворимости, полученные спустя 15 минут, составляли 93% и 76% соответственно. Это подтверждало, что кислотные добавки по настоящему изобретению оказывали улучшенное влияние на растворимость.
| Таблица 3 | |||
| Рецептура по примеру 1 (мг/таблетка) | Рецептура по примеру 2 (мг/таблетка) | Сравнительный пример 1 (мг/таблетка) | |
| Моногидрат соединения 1 | 25 | 25 | 25 |
| Фумаровая кислота | 25 | - | - |
| Янтарная кислота | - | 25 | - |
| Разбавитель | 139 | 139 | 139 |
| Дезинтегрант | 10 | 10 | 10 |
| Смазывающее вещество | 1 | 1 | 1 |
| Общее | 200 | 200 | 175 |
ПРИМЕР 3
Оценка растворимости фармацевтического препарата, содержащего фумаровую кислоту
Получали таблетки рецептурой по примерам 3, 4, 5 и 6 и сравнительного примера 2. В таблице 4 указаны рецептура каждой таблетки.
Рецептура по примеру 3
Моногидрат соединения 1, фумаровую кислоту и разбавитель поместили в гранулятор с псевдоожиженным слоем (Powrex Corp.) и смесь гранулировали напылением раствором связующего вещества с получением гранулированного продукта. К полученному гранулированному продукту добавляли дезинтегрант и смазывающее вещество и смешивали, и затем смесь сжимали, используя таблетировочную машину (Kikusui Seisakusyo Ltd.) с получением таблеток весом каждая 282 мг. Пленко-покрывающую жидкость, содержащую покрывающее вещество, краситель и очищенную воду (примерно 92% относительно покрывающего раствора) распылили на полученные таблетки, используя устройство для нанесения покрытий (Powrex Corp.) с получением таблеток с пленочным покрытием весом каждая 296 мг. В рецептуре по примеру 3 количество фумаровой кислоты составило примерно 0,25 массовые доли на массовую долю моногидрата соединения 1.
Рецептура по примеру 4
Таблетки с пленочным покрытием получали тем же самым способом, как и для рецептуры по примеру 3 за исключением, что количество фумаровой кислоты изменили примерно до 0,5 массовой доли моногидрата соединения 1 и изменили соотношение компонентов смеси фумаровой кислоты и разбавителя.
Рецептура по примеру 5
Таблетки с пленочным покрытием каждая весом 296 мг получали тем же самым способом, как и для рецептуры по примеру 3 за исключением, что количество фумаровой кислоты изменили примерно до 0,8 массовой доли моногидрата соединения 1 и изменили соотношение компонентов смеси фумаровой кислоты и разбавителя.
Рецептура по примеру 6
Таблетки с пленочным покрытием каждая весом 296 мг получали тем же самым способом, как и для рецептуры по примеру 3 за исключением, что количество фумаровой кислоты изменили примерно до 1 массовой доли моногидрата соединения 1 и изменили соотношение компонентов смеси фумаровой кислоты и разбавителя.
Сравнительный пример 2
В качестве контроля, таблетки с пленочным покрытием каждая весом 296 мг получали тем же самым способом, как и для рецептуры по примеру 3 за исключением, того что не добавляли фумаровую кислоту и что изменили соотношение компонентов смеси разбавителя.
Испытание на растворимость
Относительно рецептур по примерам 3, 4, 5 и 6 и сравнительного примера 2 испытание на растворимость осуществляли при 50 оборотах в минуту, используя 900 мл раствора 2 для испытания на растворимость (37°С) в качестве испытуемого раствора в соответствии с лопастным способом из способов испытания на растворимость, описанного в японской фармакопее, шестнадцатом издании. Для оценки использовали высокоскоростной жидкостной хроматограф (Shimadzu Corporation). Результаты показаны на фиг. 2 (n=3 средняя скорость растворимости ± стандартное отклонение). Рецептуры по примерам 3, 4, 5 и 6, которые содержали фумаровую кислоту продемонстрировали улучшение в растворимости по сравнению со сравнительным примером 2, который не содержал фумаровую кислоту.
| Таблица 4 | |||||
| Рецептура по примеру 3 (мг/таблетка) | Рецептура по примеру 4 (мг/таблетка) | Рецептура по примеру 5 (мг/таблетка) | Рецептура по примеру 6 (мг/таблетка) | Сравнит. пример 2 (мг/таблетка) | |
| Моногидрат соединения 1 | 104 | 104 | 104 | 104 | 104 |
| Фумаровая кислота | 25 | 50 | 80 | 100 | 0 |
| Разбавитель | 125 | 100 | 70 | 50 | 150 |
| Связующее вещество | 10 | 10 | 10 | 10 | 10 |
| Дезинтегрант | 15 | 15 | 15 | 15 | 15 |
| Смазывающее вещество | 3 | 3 | 3 | 3 | 3 |
| Покрывающее вещество | 12,6 | 12,6 | 12,6 | 12,6 | 12,6 |
| Краситель | 1,54 | 1,54 | 1,54 | 1,54 | 1,54 |
| Общее | 296 | 296 | 296 | 296 | 296 |
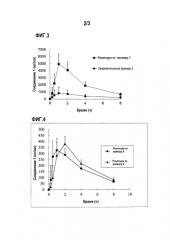
ПРИМЕР 4
Оценка всасываемости фармацевтического препарата, содержащего фумаровую кислоту
Получали таблетки рецептурой по примеру 7 и сравнительного примера 3. В таблице 6 продемонстрирована рецептура каждой таблетки.
Рецептура по примеру 7
Моногидрат соединения 1 (2,4 г) и фумаровую кислоту (2,4 г) и разбавитель (1,2 г) поместили в ступку. К ним добавляли раствор связующего вещества (1,28 г) и смесь гранулировали с получением гранулированного продукта. Гранулированный продукт измеряли и затем оставляли стоять и сушиться при 60°С в течение одного часа с получением сухого гранулированного продукта. К полученному сухому гранулированному продукту (5,08 г) добавляли дезинтегрант (0,26 г) и смазывающее вещество (0,02 г) и перемешивали. Смесь затем сжимали, используя таблетировочную машину (Shimadzu Corporation) с получением таблеток весом каждая 268 мг.
Сравнительный пример 3
В качестве контроля, таблетки с пленочным покрытием каждая весом 268 мг получали тем же самым способом, как и для рецептуры по примеру 7 за исключением, того что гранулированный продукт получали, не добавляя фумаровую кислоту, а увеличивая количество разбавителя до 3,6 г.
Условия эксперимента по всасываемости.
Используемые животные: гончие (Kitayama Labes, самец, n=6)
Условия приема пищи: голодали с предыдущего дня в течение 20 часов.
Доза: 50 мг/тело.
Образец для введения: рецептура по примеру 7 и сравнительный пример 3, одна таблетка на пример.
Способ введения: вводили вместе с 50 мл воды.
Предварительная обработка: внутривенную инъекцию атропинсульфата (10 мкг/0,1 мл/кг) и внутривенную инъекцию омепразола (1 мг/0,25 мл/кг) вводили внутривенно за 30 минут до введения образца. Другую внутривенную инъекцию омепразола (1 мг/0,25 мл/кг) вводили внутривенно через 30 минут после введения образца.
Способ измерения всасываемости
Кровь, выделенную из каждой собаки центрифугировали (12000 оборотов в минуту, 5°С, три минуты) и полученную плазму (20 мкл) выделяли в полипропиленовую пробирку с последующим добавлением очищенной воды (25 мкл). Добавляли ацетонитрил (100 мкл) и внутренний стандартный раствор (50 мкл) и перемешивали в вортекс-миксере. После разделения способом центрифугирования (15000 g, 5°С, две минуты) супернатант (60 мкл) выделяли в полипропиленовый автоматический пробоотборник и к нему добавляли очищенную воду (120 мкл) и перемешивали, используя вортекс-миксер. Полученный образец для измерения определяли количественно, используя высокоскоростной жидкостной хроматограф с масс-спектрометром (Japan Waters, Inc.).
Устройство: высокоскоростной жидкостной хроматограф с масс-спектрометром (Japan Waters, Inc.).
Условия измерения жидкостной хроматографии.
Колонка: ACQUITY UPLC BEH C18 (1,7 мкмоль, внутренний диаметр: 2,1 мм, длина: 50 мм).
Температура колонки: 40°С.
Подвижная фаза.
Подвижная фаза А: Формиат аммония 10 ммоль/л.
Подвижная фаза В: Ацетонитрил.
Перемещение подвижной фазы: Градиент концентрации регулируется изменением соотношения смешивания подвижных фаз А и В, как показано в таблице 5.
| Таблица 5 | ||
| Соотношение смешивания подвижных фаз А и В | ||
| Время после введения (мин) | Фаза А (%) | Фаза В (%) |
| 0,00-2,10 | 80→50 | 20→50 |
| 2,10-2,40 | 50 | 50 |
| 2,40-2,41 | 50→80 | 50→20 |
| 2,41-3,50 | 80 | 20 |
Скорость потока: 0,3 мл/мин.
Условия измерения MS/MS.
Источник ионизации: электрораспылительная ионизация (ESI) с положительным режимом.
Режим сканирования: MRM (мониторинг множественных реакций).
Результаты показаны на фиг. 3 (n=6 средняя концентрация плазмы + стандартное отклонение). AUC (17783±3813) и Cmax (5067±1334) рецептуры по примеру 7, который содержал фумаровую кислоту, соответственно составляли в 5 и 6 раз больше, чем AUC (3518±2932) и Cmax (842±850) сравнительного примера 3, который не содержал фумаровую кислоту. Рецептура по примеру 7, который содержал фумаровую кислоту, продемонстрировал улучшение во всасываемости по сравнению со сравнительным примером 3, который не содержал фумаровую кислоту. Это подтверждало то, что фумаровая кислота улучшила всасываемость.
| Таблица 6 | ||
| Рецептура по примеру 7 (мг/таблетка) | Сравнительный пример 3 (мг/таблетка) | |
| Моногидрат соединения 1 | 100 | 100 |
| Фумаровая кислота | 100 | - |
| Разбавитель |