Производные олигохитозана в качестве адъювантов для вакцин
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к иммунологии, и может быть использовано для применения производного олигохитозана в качестве адъюванта для вакцин. Производное олигохитозана состоит из звеньев глюкозамина 91-98% и (N-ацил)глюкозамина 2-9% с молекулярной массой от 5 до 15 кДа. Использование данного изобретения позволяет применять производное олигохитозана в качестве новых адъювантов, повышающих иммуногенность вакцин и обладающих низкой гемостатической активностью. 2 з.п. ф-лы, 5 пр., 4 табл.
Реферат
Изобретение относится к применению производных природных полисахаридов, а именно к производным олигохитозана, состоящим из звеньев глюкозамина 91-98% и N-ацил)глюкозамина 2-9%, в качестве адъюванта для вакцин, повышающего иммуногенность инактивированных и живых вакцин. Изобретение наиболее успешно может использоваться в медицине и ветеринарии.
Некоторые существующие вакцины обладают относительно низкой иммуногенностью, поэтому для получения относительно высокого иммунитета необходима многократная вакцинация. Альтернативным способом повышения иммуногенности вакцины является использование адъюванта (АД) - специальной добавки, которая усиливает действие вакцины.
Целью вакцинации является создание у человека и животных эффективного иммунитета, обеспечивающего длительную защиту от инфекций. Большинство современных вирусных вакцин разрабатывается на основе определенных антигенов (АГ), в отличие от полностью инактивированных или аттенуированных патогенов. АГ микроорганизмов, опухолевых клеток или аллергенов, вводятся в организм человека в виде очищенных белков. Но в некоторых случаях такие «молекулярные вакцины» могут обладать слабой иммуногенностью, поэтому для усиления иммунного ответа со стороны иммунной системы человека к ним необходимо добавлять адъюванты [V. Schijns, Immunological concepts of vaccine adjuvant activity, Curr. Opin. Immunol., 2000, v. 12, 456-463; Vogel F.R. Improving vaccine performance with adjuvants, Clin. Infect. Dis., 2000, v. 30(3), S 266-S270]. Разработка эффективных АД для вакцин, обеспечивающих формирование выраженного и длительно сохраняющегося иммунитета на системном уровне или только в месте введения АГ (например, слизистых оболочек), остается одной из сложнейших задач в производстве вакцин. Использование АД позволяет значительно снизить дозы антигенов при иммунизации и увеличить тем самым безопасность вакцины.
В настоящее время в качестве АД для вакцин обычно используют различные неорганические (гидроокись алюминия, фосфат алюминия, фосфат кальция), органические вещества (сквален, парафиновые масла) и синтетические (например: полилактид) и природные (декстран, инулин, маннан, хитин и хитозан) полимеры [N. Petrovsky and J. Cesar Aguilar Vaccine adjuvants: Current state and future trends, Immunology and Cell Biology, 2004, v. 82, 488-496; E. Montomoli, S. Piccirella, B. Khadang, Current adjuvants and new perspectives in vaccine formulation, Expert Review of Vaccines, 2011, v. 10(7), 1053-1061].
АД на основе соединений алюминия нашли наиболее широкое применение, однако обладая хорошей способностью индуцировать образование антител (Th2), они плохо стимулируют клеточный иммунный ответ (Th1), который очень важен для защиты организма от многих патогенных микроорганизмов. Другие вышеуказанные адъюванты имеют ряд существенных недостатков: их использование в вакцинах может вызывать серьезные локальные и системные побочные эффекты, такие как аллергия, воспаление, эозинофилия и миофасцит.
Наиболее перспективным АД представляется хитозан. Хитозаном называют продукт частичного или полного деацетилирования хитина (основного компонента клеточных стенок большинства низших грибов, экзоскелета ракообразных и насекомых линейного полисахарида поли(β-1-4-D-N-ацетилглюкозамина) с молекулярной массой более 16 кДа. Олигохитозан - это производное хитина и хитозана, состоящее из звеньев глюкозамина и N-ацетилглюкозамина, с молекулярным весом от 2 кДа до 16 кДа. В зависимости от условий процесса деацетилирования хитина получают хитозан или олигохитозан, которые различаются физико-химическими и биологическими свойствами [Множественность понятия «хитозан» и терминология в области хитина и хитозана, В.Е. Тихонов. «Хитозан», ред. К.Г. Скрябин, С.Н. Михайлов, В.П. Варламов, изд. РАН и РХО, Москва, 2013, 49-60].
Известен олигохитозан, обладающий антибактериальными свойствами, состоящий из звеньев 93-98% глюкозамина и 2-7% N-ацетилглюкозамина, с молекулярным весом от 2 кДа до 16 кДа [Molecular weight and рН aspects of the efficacy of oligochitosan against meticillin-resistant Staphylococcus aureus (MRSA), Sergey Kulikov, Vladimir Tikhonov, Inesa Blagodatskikh, Evgeniya Bezrodnykh, Sergey Lopatin, Ruslan Khairullin, Yulia Philippova, Sergey Abramchuk, Carbohydrate Polymers, 2012, v. 87, 545-550].
Однако в патентной и научно-технической литературе отсутствуют данные по взаимосвязи гемостатической и адъювантной активности олигохитозана и хитозана с их составом и молекулярной массой.
Известна иммуномоделирующая добавка (адъювант) к интраназальной мукозальной вакцине, представляющая собой хитозан деацетилированный на 80-90% (содержание N-ацетилглюкозамина 10-20%) с молекулярным весом от 10 кДа до 100 кДа (патент US 6534065, заявл. 30.05.2000, опубл. 18.03.2003, МКИ7 А61К 39/145). Однако интраназальное введение инактивированной гриппозной вакцины с таким адъювантом приводило к серьезным осложнениям в виде паралича некоторых лицевых мышц, в связи с чем применение такой вакцины было прекращено [Mutsch М., Zhou W., Rhodes P., et al. Use of the inactivated intranasal influenza vaccine and the risk of Bell′s-Palsy in Switzerland. 2004. N. Engl. J. Med. 350: 896-903].
Известна также иммуномоделирующая добавка для вакцин, включающая хитозан с молекулярной массой 70-500 кДа и содержанием N-ацетилглюкозамина 1-34%, которая повышает иммуногенность холодоадаптированной живой гриппозной вакцины (Патент РФ №2465006, заявл. 14.04.2010, опубл. 20.10.2011, МПК А61К 39/00). Однако использование хитозана с указанными характеристиками приводит к серьезным побочным эффектам, которые не позволяют использовать такой хитозан в качестве адъюванта при парентеральном введении противовирусных вакцин, поскольку при этом наблюдается повышенное склеивание эритроцитов, приводящее к тромбозу сосудов в месте введения вакцины, что абсолютно недопустимо при иммунизации лиц, у которых наблюдается повышенная свертываемость крови. Такой гемостатический эффект хитозана заключается в агрегации (агглютинации) эритроцитов и тромбоцитов (К.Е. Скрябин, Е.А. Вихорева, В.П. Варламов. Хитин и хитозан. Получение, свойства и применение, 2002, Наука, Москва). Механизм гемостатического действия хитозана связан со способностью его положительно заряженных молекул соединяться с отрицательно заряженными мембранами клеток крови, вызывая их адгезию, а также активацию плазменного гемостаза. Степень аггрегации (агглютинации) эритроцитов хитозаном (степень ацетилирования - содержание звеньев N-ацетилглюкозамина: 64,4÷92,5%, молекулярная масса: 519÷1860 кДа) зависит от его молекулярного веса и степени ацетилирования. (Jian Yang, Feng Tian, Zheng Wang, Qing Wang, Yan-Jun Zeng, Shi-Qian Chen, Effect of Chitosan Molecular Weight and Deacetylation Degree on Hemostasis, J. Biomedical Materials Research - Part B: Applied Biomaterials, 2008, v. 84(1), 131-137).
Близким аналогом заявляемого изобретения является адъювант, применяемый для повышения иммуногенности инактивированной гриппозной вакцины (патент РФ № RU 2323742, заявл. 15.02.2007, опубл. 10.05.2008, МПК А61К 39/145, А61К 31/722, А61Р 31/12), который представляет собой смесь высокополимерного хитозана и ограниченно деполимеризованного низкополимерного хитозана, молекулы которого содержат на одном из своих концов свободные альдегидные группы, при этом указанные высокополимерный хитозан и ограниченно деполимеризованный низкополимерный хитозан имеют степень деацетилирования в пределах 60-90% (содержание звеньев N-ацетилглюкозамина 10-40%) и молекулярную массу в пределах 100-500 кДа (высокополимерный хитозан) и 0,5-20 кДа (низкополимерный хитозан).
Отличительной особенностью данного адъюванта является наличие в его составе ограниченно деполимеризованного низкополимерного хитозана, молекулы которого включают концевые звенья ангидроманнозы, содержащей свободную альдегидную группу. Наличие таких звеньев связано с методом получения деполимеризованного низкополимерного хитозана путем деполимеризации высокомолекулярного хитозана с помощью азотистой кислоты/нитрита натрия в кислой среде (G.G. Allan, М. Peyron, Molecular weight manipulation of chitosan II: prediction and control of extent of depolymerization by nitrous acid, Carbohydr. Res. 277 (1995) 273-282; K. , K.W. , B.E. Christensen, O. , (2007) Preparation and characterization of oligosaccharides produced by nitrous acid depolymerization of chitosan, Carbohydr. Res. 333 (2007) 137-144).
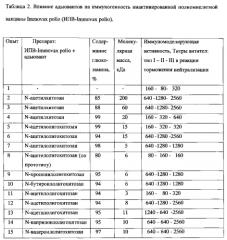
Такой деполимеризованный низкополимерный хитозан, полученный согласно патенту US 5312908 (заявл. 13.07.1992, опубл. 17.05.1994, МКИ С08В 37/08; "Chitin-chitosan oligomer having 2,5-amhydromannitol group or 2,5-anhydromannose group at terminal end and method for preparation thereof"), не обладает адъювантной активностью (Таблица 2), в составе адъюванта его используют в качестве бактериостатического/бактерицидного средства, которое содействует консервации вакцины при хранении (в количестве 10% от массы использованного высокомолекулярного хитозана). Однако ввиду подавляющего количества высокополимерного хитозана в адъюванте, гемостатическая активность указанной смеси высокомолекулярного хитозана и деполимеризованного низкополимерного хитозана крайне высока, что значительно осложняет применение такой смеси в качестве адъюванта для вакцин.
Задачей настоящего изобретения является создание нового адъюванта для вакцин, на основе природных полисахаридов, обладающего высокими адъювантными свойствами и низкой гемостатической активностью, применение которого позволит избежать серьезных осложнений при вакцинации.
Задача решается применением производного олигохитозана, состоящего из звеньев глюкозамина 91-98% и (N-ацил)глюкозамина 2-9% с молекулярной массой от 5 до 15 кДа, в качестве адъюванта для вакцин. N-Ацильная группа применяемого производного хитозана содержит от 2 до 6 атомов углерода и может представлять собой ацетил, пропионил, изопропил, бутироил, изобутироил, валероил, изовалероил, каприлоил или изокаприлоил.
Техническим результатом заявляемого изобретения является новый адъювант, обладающий низкой гемостатической активностью, применение которого обеспечивает повышение иммуногенности вакцин и снижает вероятность возникновения тромбоза сосудов в месте введения вакцины.
При этом (N-ацил)олигохитозан с вышеуказанными характеристиками получают из соответствующего высокомолекулярного (N-ацил)хитозана путем его гидролиза в водном растворе в присутствии кислоты. При таком способе получения молекулы (N-ацил)олигохитозана не содержат концевых звеньев ангидроманнозы со свободными альдегидными группами (K.W. , М.Н. , О, , Acid hydrolysis of chitosan, Carbohydrate Polymers 46 (2001) 89-98; A. Einbu, H. Grasdalen, K.W. , Kinetics of hydrolysis of chitin/chitosan oligomers in concentrated hydrochloric acid, Carbohydr. Res. 342 (2007) 1055-1062; A. Einbu, K.W. , Depolymerization and de-N-acetylation of chitin oligomers in hydrochloric acid, Biomacromolecules 8 (2007) 309-314).
Заявляемое изобретение иллюстрируется следующими ниже примерами.
Пример 1. Получение (N-ацетил)олигохитозана.
Высокомолекулярный (N-ацетил)хитозан с молекулярной массой 200 кг/моль и степенью N-ацетилирования (содержание звеньев N-ацетилглюкозамина) 15% растворяют в разбавленной соляной кислоте и нагревают в течение 2-12 часов. После охлаждения добавляют избыток спирта и отделяют осадок, промывают его спиртом и высушивают в вакууме. Получают (N-ацетил)хитозан в виде гидрохлорида, определяют его молекулярную массу методом высокоэффективной жидкостной хроматографии и анализируют его на содержание ацетильных групп методом УФ-спектроскопии (согласно Европейской фармакопейной статье 5.0 на хитозан гидрохлорид) или методом ядерного магнитного резонанса.
Аналогично получают остальные N-ацильные производные олигохитозана из соответствующих N-ацильных производных высокомолекулярного хитозана.
Пример 2. Измерение гемостатической активности.
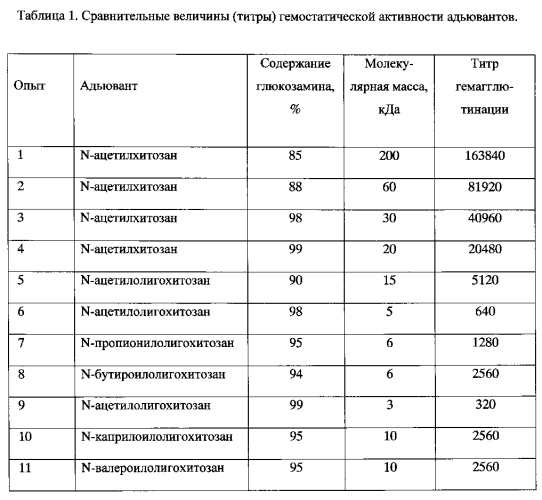
Гемостатическую активность адъювантов оценивают по титру их гемагглютинирующей активности. Определение гемостатической активности по титру гемагглютинации проводят по методике, разработанной в лаборатории генетики РНК-содержащих вирусов ФГБНУ НИИ вакцин и сывороток им. И.И. Мечникова. (Москва). Для постановки реакции готовят серии двукратных разведений исследуемого препарата хитозана в концентрации 1,0% в круглодонных 96-луночных планшетах фирмы Corning. С этой целью в ряд лунок вносят по 50 мкл физиологического раствора с рН 5.5-6.0 и затем готовят двоичные разведения 1.0% раствора адъюванта в 0.15М глютаматном буферном растворе с рН 5.5-6.0. Затем в каждую лунку вносят 50 мкл 0,5% суспензии трижды отмытых физиологическим раствором куриных эритроцитов. Плашки инкубируют при комнатной температуре 20-25 минут. Максимальное разведение адъюванта, при котором в лунке еще наблюдалась агглютинация (аггрегация эритроцитов в виде зонтичного осадка), рассматривают как титр агглютинирующей активности хитозана. Титры агглютинирующей активности приведены в таблице 1.
При определении иммуномоделирующей активности использовали инактивированные и живые вакцины:
а) трехвалентную полиомиелитную вакцину Imovax Polio фирмы Sanofi Pasteur (Франция), содержащую 40 единиц антигена D типа 1, 8 единиц типа 2 и 32 единицы типа 3,
б) инактивированную гриппозную вакцину Ваксигрипп (Sanofi Pasteur, Франция) и
в) живую гриппозную вакцину холодоадаптированный (ХА) штамм-донор аттенуации А/Краснодар/101/35/59 (H2N2).
Пример 3. Влияние адъювантов на иммунологическую активность инактивированной полиомиелитной вакцины Imovax Polio.
Иммунизацию полиомиелитной вакциной проводят следующим образом. Группы мышей (беспородные самки весом по 10-12 г, 4-6 мышей на группу) вакцинируют внутримышечно, по 0,2 мл вакцины, смешанной с равным объемом раствора адъюванта до его конечной концентрации 0,05%. Мышей вакцинируют двукратно или трехкратно с интервалом 21 день между первой и второй иммунизацией. Через 10 дней после второй иммунизации у мышей берут кровь и определяют титр гуморальных антител в реакции торможения нейтрализации. Результаты приведены в таблице 2.
Пример 4. Влияние адъювантов на повышение иммуногенности инактивированных гриппозных вакцин.
В качестве инактивированной гриппозной вакцины применяют инактивированную гриппозную расщепленную вакцину Ваксигрипп (Sanofi Pasteur, Франция), расщепленную вакцину Гриппол (Россия), субъединичную вакцину Инфлювак (Нидерланды).
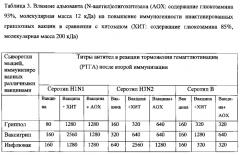
При иммунизации мышей инактивированными гриппозными вакцинами также используют беспородных мышей (самки, вес 10-12 г). Мышей вакцинируют внутримышечно 0,2 мл препарата вакцины, содержащего по 3 мкг каждого компонента вакцины, 0,05% адъюванта или буферного раствора (контроль). Мышей вакцинируют двукратно. Вторую вакцинацию проводят на 21 день после первой и через 10 дней у мышей берут кровь и определяют титр гуморальных антител в реакции торможения агглютинации. Результаты приведены в таблице 3.
Пример 5. Влияние адъюванта на повышение иммуногенности живых гриппозных вакцин.
В качестве живой гриппозной вакцины используют холодоадаптированный (ХА) донор аттенуации А/Краснодар/101/35/59 (H2N2), полученный путем длительных пассажей в 10-дневных развивающихся куриных эмбрионах при субоптимальных условиях (Патент РФ №2354695: Аттенуированный холодоадаптированный штамм вируса гриппа А/Краснодар/101/35/59 (H2N2) для получения штаммов живой интраназальной гриппозной вакцины).
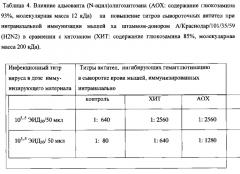
К ХА штамму-донору аттенуации А/Краснодар/101/35/59 (H2N2) в дозах 103,5 и 105,5 ЭИД50/0.05 мл добавляют 1% раствор адъюванта с рН 6,5, чтобы получить конечную концентрацию 0,05%. Конечная смесь содержит также 0.9% хлорид натрия. Мышей весом 10-12 г под легким эфирным наркозом интраназально иммунизируют двукратно различными разведениями ХА штамма с адъювантом или без него, вводят по 25 мкл в каждую ноздрю. Вторую иммунизацию проводят на 21 день после первой иммунизации, и через 10 дней после второй иммунизации у мышей берут кровь. Сыворотки мышей перед постановкой РТГА обрабатывают рецептор-разрушающим ферментом. С этой целью 3 объема рецептор-разрушающего фермента фирмы Denka Seiken CO., Ltd добавляют к 1 объему сыворотки и инкубируют в термостате 16-18 час при 37°С. Затем смесь прогревают при 56°С в течение 30 мин и добавляют 6 объемов фосфатного буфера, после чего анализируют титры антител в реакции торможения гемагглютинации. Результаты приведены в таблице 4.
В Таблице 2 приведены данные по иммуногенности препаратов инактивированной полиомиелитной вакцины Immovax polio (ИПВ-Immovax polio).
Таким образом, известные препараты хитозана обладают высокой гемостатической активностью, что значительно усложняет их применение в качестве адъювантов для вирусных вакцин из-за высокой вероятности возникновения тромбоза сосудов в месте введения вакцины, что абсолютно недопустимо при иммунизации лиц с повышенной свертываемостью крови.
Уровни гемостатической активности у 1.0% растворов препаратов заявляемого адъюванта - (N-ацил)олигохитозана - с заявленными характеристиками и контрольных образцов хитозана приведены в таблице 1. Как видно из таблицы 1, гемостатическая активность образцов заявляемого адъюванта (N-ацил)олигохитозана в 4-1024 раза ниже, чем гемостатическая активность контрольных образцов хитозана с молекулярной массой выше 15 кДа.
С другой стороны, (N-ацил)олигохитозаны с содержанием глюкозамина, выходящим за заявленные пределы (выше 98% и ниже 91%), обладают низкой иммуномоделирующей (адъювантной) активностью.
Как видно из таблицы 2, уровень повышения иммуногенности полиомиелитной вакцины, включающей в качестве адъюванта препараты (N-ацетил)олигохитозана существенно превышает уровень повышения иммуногенности полиовакцины, включающей раствор олигохитозана с молекулярными характеристиками, выходящими за заявленные пределы (а именно 91-98%), и не уступает уровню повышения иммуногенности полиовакцины, включающей в качестве адъюванта раствор хитозония.
Таким образом, применение адъюванта по настоящему изобретению на основе производных (N-ацил)олигохитозана, обладающего низкой гемостатической активностью и высокими адъювантными свойствами, повышает иммуногенность инактивированных гриппозных и полиомиелитных вакцин при парентеральном введении и живых гриппозных вакцин при мукозальном введении. Применение производных (N-ацил)олигохитозана по изобретению в качестве адъюванта снижает вероятность возникновения тромбоза сосудов в месте введения вакцины.
1. Применение производного олигохитозана, состоящего из звеньев глюкозамина 91-98% и (N-ацил)глюкозамина 2-9% с молекулярной массой от 5 до 15 кДа, в качестве адъюванта для вакцин.
2. Применение по п. 1, отличающееся тем, что N-ацильная группа (N-ацил)глюкозамина содержит от 2 до 6 атомов углерода.
3. Применение по п. 1 и 2, отличающееся тем, что N-ацильная группа (N-ацил)глюкозамина представляет собой ацетил, пропионил, изопропил, бутироил, изобутироил, валероил, изовалероил, каприлоил или изокаприлоил.